文献解读|Cell Metab(29.0):转录组学、表观基因组学和空间代谢组学细胞分析重新定义了区域人类肾脏解剖结构
✦ +
+
论文ID
原名:Transcriptomic, epigenomic, and spatial metabolomic cell profiling redefines regional human kidney anatomy
译名:转录组学、表观基因组学和空间代谢组学细胞分析重新定义了区域人类肾脏解剖结构
期刊:Cell Metabolism
影响因子:29.0
发表时间:2024.03.20
DOI号:10.1016/j.cmet.2024.02.015
背 景
人体肾脏维持液体和电解质平衡、清除废物并调节血压。在健康成人肾脏中,每天有 180L血浆过滤到肾单位中,肾单位的肾小管跨越肾皮质、髓质和乳头(肾脏的主要解剖区域)。肾脏疾病影响着全世界超过 10% 的人口,而减缓疾病进展的治疗选择相对较少。人类肾脏的转录、表观遗传和代谢组学景观尚未在所有解剖区域进行研究,这限制了对细胞类型特异性功能的理解以及新治疗靶点的潜在识别。
实验设计
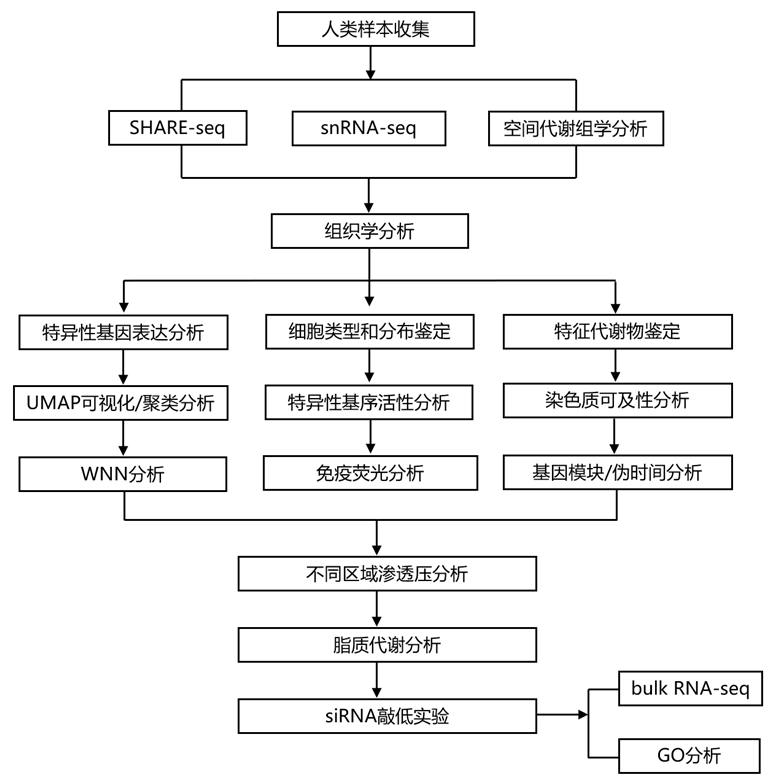
结 果
01
使用 SHARE-seq 进行转录和表观基因组分析
人的肾脏大约有100万个肾元,每个肾单元由一个肾小体组成,肾小体包含肾皮质的肾小球和遍布肾脏所有区域的肾小管。根据亨利环(loop of Henle)在皮层、髓质和乳头中折回的解剖位置,将肾单位分为皮质、短袢和长袢三大类(图1A)。这一特征使肾脏成为一个独特的器官,其中可以定位源自相同发育结构(即集合管的输尿管和其他肾小管细胞的后肾间充质)的相同肾小管上皮细胞 (TEC) 类型在不同的解剖区域内。
肾皮质包括位于肾囊下方的肾脏外部区域。肾髓由肾皮质包围,其由三角形的肾锥体组成。锥形乳头位于肾锥体的顶端并伸入输尿管(图 1 A -B)。研究者团队从多个解剖区域获取了成人肾脏样本,包括皮质、髓质、乳头、肾动脉和输尿管(图 1 B)。为了确认样本解剖的准确性,他们对来自五个解剖区域的相同组织的切片进行了高碘酸希夫(PAS)和三色组织学染色(图1C)。正如预期的那样,仅在肾皮质中观察到肾小球。肾小管跨越多个解剖区域,包括皮质、髓质和乳头,反映了 TEC 的不同亚群。相比之下,在肾动脉和输尿管中都可以识别出平滑肌,这表明组织弹性较高。
为了研究这些解剖区域在多模态和单细胞水平上的潜在差异,他们使用同步高通量单细胞 ATAC/RNA 测序 (SHARE-seq)分析了来自48个肾脏样本(24个皮质、10个髓质、7个乳头、3个肾动脉和4个输尿管)的相同细胞的转录组和染色质可及性谱,并使用基于像质谱 (IMS)的空间分辨代谢组学分析了6个肾脏样本(图1D-H)。
他们们通过单细胞核转录组分析(snRNA-seq)检测了总共获得了446267个单细胞,平均每个细胞有3084个独特分子标识符(UMI)和1051个基因(图1F)。降维和无监督单细胞聚类分析总共确定了 snRNA-seq 模块的 29 个主要细胞聚类和单细胞ATAC测序(snATAC-seq)模块的 21 个细胞聚类(图1F-G)。
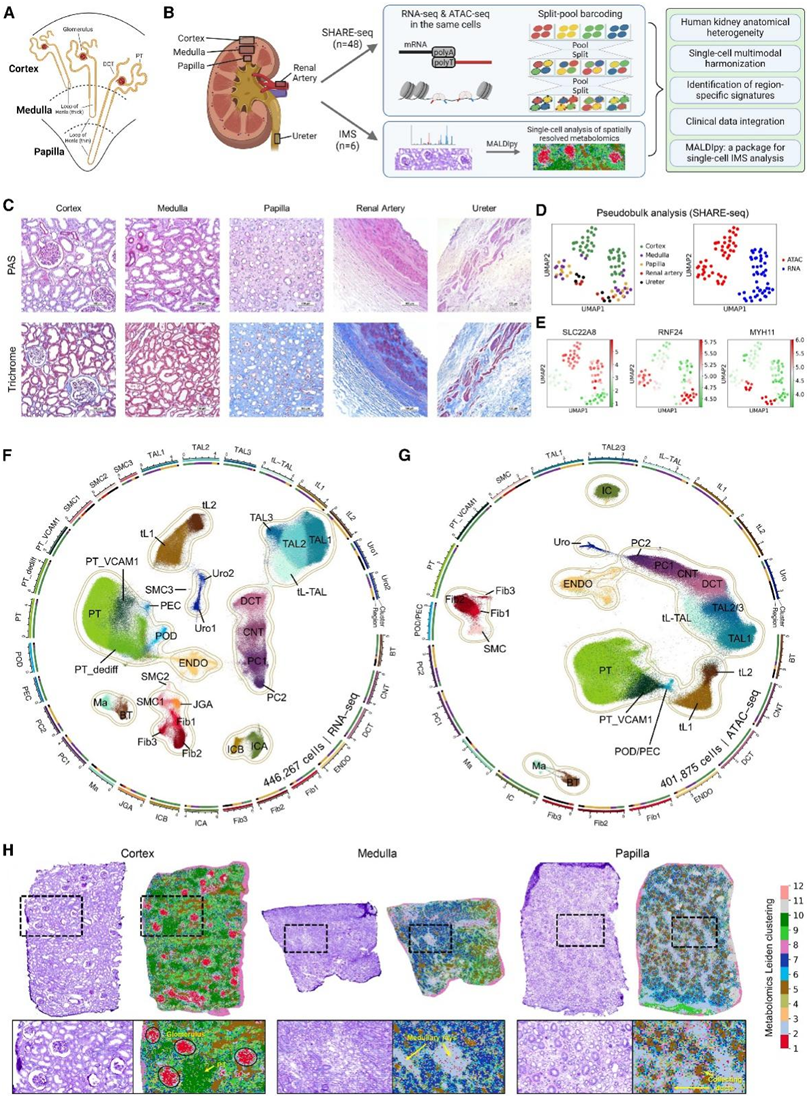
图1. 人类肾脏的多模式和解剖分层单细胞图谱。
(A) 人体肾脏解剖结构。(B) 研究概述。(C) 人肾区域的 PAS 和三色组织学染色。(D) 伪整体分析。(E) 伪批量分析中区域特异性基因表达/活性的可视化。(F-G) UMAP 展示了 446267 个单细胞转录组数据和 401875 个染色质可及性概况。(H) 人类肾脏区域的空间解析代谢组学。
该数据集的庞大规模和来自不同肾脏解剖结构的样本使研究者们不仅能够对先前描述的人类肾脏的细胞类型/状态进行基准分析,例如表现出以VCAM1表达为特征的促纤维化和促炎特征的近端小管(PT)细胞状态(PT_VCAM1),而且还能够识别先前单细胞研究未深入研究的细胞聚类,包括髓袢薄壁段(tL)细胞。髓袢升支粗段(TAL)和主细胞(PC)亚群以及成纤维细胞、平滑肌细胞(SMC)和尿路上皮细胞的多个群体(图1F-G),它们都表现出不同的基因表达和基因活性特征(图2A-B)。基因模块评分分析显示成纤维细胞和 SMC 中细胞外基质 (ECM) 编码基因上调。
他们分析了每个解剖区域的细胞类型组成(图 2C)。正如预期的那样,PT 主要存在于肾皮质中(图 2C),而肾小球、远曲小管(DCT)和连接小管(CNT)B 的细胞主要存在于皮质中(图 2D)。值得注意的是,B 型嵌入细胞 (ICB) 主要存在于皮质中,而 A 型嵌入细胞 (ICA) 可见于所有皮质、髓质和乳头(图 2C-D)。髓袢壁段细胞在髓质和乳头状区域高度富集,SMC 在肾动脉和输尿管中富集,尿路上皮细胞主要在输尿管中(图 2 C-D)。他们发现 Uro1 细胞在输尿管样本中高度富集(图 2 C -D),因此代表输尿管尿路上皮,但 Uro2 细胞在肾髓质和乳头中更为丰富(图 2 D),表明肾盂身份。
snATAC-seq 聚类分析中的细胞注释与 snRNA-seq 数据中的注释高度一致(图 2 E)。对 324701 个细胞的两种模式与加权最近邻 (WNN) 的综合分析揭示了与 snRNA-seq 和 snATAC-seq 分析中确定的相同的细胞聚类模式(图 2 F)。WNN 分析能够推断细胞类型特异性转录因子 (TF) 结合基序活性(图 2 G)。例如,HNF4A和HNF4G显示 PT 细胞特异性基因表达和基序活性,并且在 ICA 和 ICB 中鉴定出FOXP1的表达和基序活性上调(图2G)。
值得注意的是,除了上述明确表征的细胞类型外,snRNA-seq 和 snATAC-seq 聚类分析都识别出了两个新的细胞聚类(tL1 和 tL2)(图 1F-G),这些细胞聚类无法映射回之前发表的研究在人类的肾脏上。对这两个聚类的差异表达基因(DEG)进行富集分析,发现包括肾管发育、肾小管上皮细胞分化调节和上皮细胞增殖等通路富集,表明它们是TEC。此外,这些细胞不表达TAL(例如UMOD)和PC(例如AQP2)的标记基因,并且与皮质相比,在肾髓质和乳头中含量很高(图2C-D),表明它们可能是细胞tL的一部分,在髓质和乳头中形成 U 形环。他们发现水通道蛋白 1 (AQP1) 在 PT 和降支细段DTL 中表达,但在升支细段(ATL) 中不存在。在 tL1 细胞中表现出比 tL2 细胞更高的基因表达,表明 tL1 和 tL2 细胞分别具有 DTL 和 ATL 身份。与其他细胞类型相比,他们观察到 tL 细胞的启动子或基因内区域具有更高的开放染色质可及性(图 2H)。胆碱转运蛋白样蛋白(SLC44 家族)对于磷脂代谢很重要,他们通过免疫荧光证实了 SLC44A5 蛋白表达(图 2 I)。 SLC44A5 与 UMOD 和 AQP2 在肾髓质切片上的共染色显示,SLC44A5+ 肾小管不与肾髓质中的 TAL 和集合管细胞共定位,进一步证实了其 tL 身份。该分析还表明,SLC44A5 转运蛋白主要定位于 tL 细胞的基底外侧膜(图 2 I)。
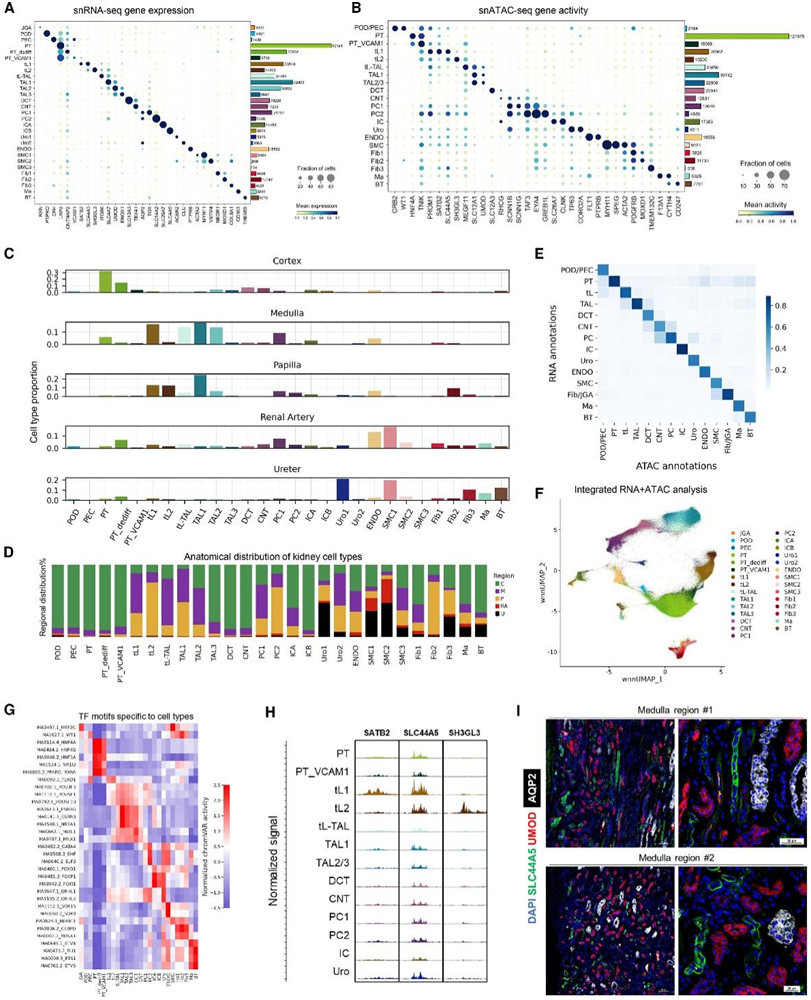
图2. SHARE-seq 多组学分析识别人类肾脏的解剖异质性。
(A) 显示聚类特异性标记基因表达的点图和显示细胞数量的条形图。(B) 显示聚类特异性基因活性的点图和显示细胞数量的条形图。(C) 每个肾脏区域的细胞类型组成。(D) 每种细胞类型的区域分布。(E) 热图显示具有相同聚类注释的 snATAC-seq 细胞的比例。(F) 两种模式与 WNN 分析的综合分析。(G) 热图显示细胞类型特异性基序活性。(H) 三个 tL 标记基因的覆盖图。(I) 肾髓质切片上 SLC44A5、UMOD 和 AQP2 的免疫染色。
02
通过 IMS 分析人体肾脏解剖结构
使用 MALDIpy平台,他们对 408218 个空间分辨代谢物进行降维和聚类分析,并识别出 12 个聚类,每个聚类都表现出独特的代谢组学特征(图 3B-C)。例如,聚类 #1 显示出高丰度的鞘磷脂 SM(d18:1/16:0)(图 3C),该物质是肾小球标记物。聚类#10 显示棕榈酰肉碱和油酰肉碱的特异性积累(图 3 C),它们是脂肪酸 β-氧化的关键中间体,而脂肪酸 β-氧化是肾 PT 细胞的标志。组织切片上代谢组聚类的可视化分析揭示了不同肾脏解剖区域中不同的代谢组特征(图 3D)。
通过与同一切片区域的 PAS 染色进行比较,他们发现聚类#1 清楚地表明位于皮质的肾小球(图 1 H,图 3 D),而聚类#12仅出现在肾盂区域,提示其为尿路上皮(图 1 H,图 3 D)。
他们假设细胞类型特异性的代谢组学特征也应该在转录组水平上得到反映,例如编码与感兴趣的代谢物相关的酶的基因的独特表达。SM(d18:1/16:0) 在肾皮质肾小球区域表现出特异性积累(图3E)。CERS6(神经酰胺合酶 6)可以将棕榈酰(C16:0)-辅酶 A (CoA) 转化为神经酰胺,神经酰胺是 SM(d18:1/16:0) 的前体(图 3 F)。CERS6基因在肾皮质的足细胞中特异性表达(图 3G)。除了SM(d18:1/16:0) 之外,他们还描述了一种磷脂酸 PA(18:1(9Z)/15:0),作为另一个聚类#1 差异代谢物,它仅存在于肾小球中,但在肾髓质和乳头中检测不到(图 3 H)。通过 MALDIpy,他们确定 CDP-二酰基甘油合酶 2 (CDS2) 是负责将磷脂酸催化为 CDP-二酰基甘油 (DAG) 的相关酶(图 3 F)。 CDP-DAG是磷脂酰肌醇代谢的关键中间体,对于正常肾小球形态和功能至关重要。CDS2在肾小球旁装置 (JGA) 中高度丰富,也在足细胞中表达(图 3G),通过对人皮质样本进行免疫荧光验证了其在肾小球中的蛋白表达,特别是在 JGA 中(图 3J)。此外,他们还鉴定出溶血磷脂酰胆碱 LysoPC(22:4(7Z,10Z,13Z,16Z)) 作为聚集在肾盂区域的聚类 #12 标记物(图 3 I)以及相关酶溶血磷脂酶 1/2 (LYPLA1/ 2) 均在尿路上皮细胞中特异性表达(图 3F-K),进一步验证了其聚类身份。
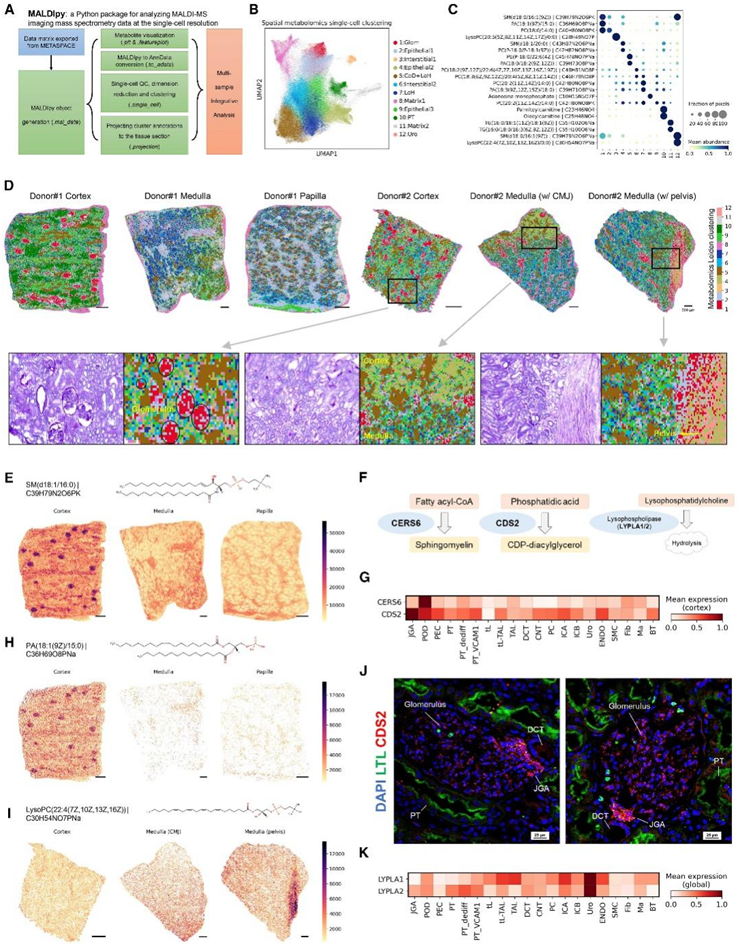
图3. 空间解析代谢组学凸显人类肾脏的解剖异质性。
(A) MALDIpy 分析。(B) 408218 个空间分辨代谢组的 UMAP 呈现。(C) 显示聚类特异性代谢组学的点图。(D) 6 个人类肾脏样本的空间解析代谢组学分析。(E) 代谢物 SM(d18:1/16:0) 的空间特征图。(F) 感兴趣的酶的生物学功能。(G)肾皮质中CERS6和CDS2的基因表达。(H) 代谢物 PA(18:1(9Z)/15:0) 的空间特征图。(I) 代谢物LysoPC(22:4(7Z,10Z,13Z,16Z))的空间特征图。(J) 人肾皮质中 CDS2 和 LTL(Lotus tetragonolobus 凝集素)的免疫染色。(K) snRNA-seq 数据中LYPLA1/2的基因表达。
03
根据区域位置,相同的 TEC 类型可能具有不同的转录组和表观基因组特征
接下来,他们的目标是利用 SHARE-seq 多组学数据和空间代谢组学数据来研究不同的解剖位置是否可能导致不同的分子特征,即使对于相同的终末分化 TEC。在上述 SHARE-seq 分析中,他们发现相同 TEC(tL、PC 和 TAL)的聚类可以根据其区域位置进行分层(图 1 F-G)。例如,TAL3细胞主要存在于皮质中,TAL2细胞主要源自髓质,TAL1细胞在乳头中最为丰富(图2D)。
首先,他们通过对 tL(图 4A)、远端肾单位(图 4B)和 TAL 细胞(图 4C )进行亚聚类分析,确认相同的 TEC 显示出不同的转录组特征,具体取决于解剖区域。他们还确定了髓质中高度丰富的两个 tL 亚聚类 (tL-M1/2) 和肾乳头更特异的两个亚聚类 (tL-P1/2)(图 4 A)。将这些细胞映射回整个 SHARE-seq 数据集表明 tL-M1/2 和 tL-P1 细胞主要代表 tL1 细胞,而 tL-P2 细胞主要源自 tL2 聚类。这些亚聚类显示出独特的基因表达,例如tL-M1/2和tL-P1中的CD200表达高于tL-P2细胞,以及乳头状tL中的CA8(碳酸酐酶8)表达高于髓质tL细胞(图4D)。他们发现 tL 细胞中这些基因的启动子或基因内区域的染色质可及性增加,表明表观基因组特征存在差异(图4E)。
远端肾单位细胞的亚聚类分析显示,PC 细胞在皮质和髓质(髓质 PC,PC-M中更为丰富),另一聚类在乳突(PC-P)中丰富(图4 B),每个显示独特的 DEG 和一致的染色质可及性变化(图 4D)。例如,两个IV型胶原编码基因COL4A3和COL4A4在人类基因组中具有头对头的构象,他们发现这两个基因在启动子区域的染色质可及性增加,并且在PC-P中的基因表达高于PC-M(图4D)。最近的一项snRNA-seq研究报告了PC-P中RALYL (rna结合的RALYL样蛋白)的低表达,他们进一步发现与PC-M相比,PC-P中该基因的染色质可及性降低(图4E)。
使用类似的方法,他们分别定义了肾皮质、髓质和乳突中(TAL-c /M/P)的TAL细胞。与 TAL-M 和 TAL-P 细胞相比,TAL-C 细胞表现出更高的PAPPA2表达,同时其启动子区域的染色质可及性增加(图 4D-E)。他们分析了 TAL 亚聚类之间确定的 DEG 中的离子转运蛋白相关基因。与 TAL-C 细胞相比,TAL-M/P 中锚蛋白 2 ( ANK2 ) 上调(图 4 F),并且还显示髓质和乳头状区域的基因内染色质可及性增加。他们通过将 ANK2 与 UMOD(一种众所周知的 TAL 标记物)共染色来进行免疫荧光分析,并验证 ANK2 在皮质 UMOD+ 细胞中低表达,但大多数髓质 UMOD+ 细胞共表达 ANK2(图 4 G)。
他们分析了tL、PC 和 TAL 细胞亚群的 DEG 和差异可及区域,并发现 RUNX1(Runt 相关 TF 1)沿着皮质乳头轴显示出基因表达增加,无论 TEC 类型如何(即较高的tL-P 与 tL-M、PC-P 与 PC-M 以及 TAL-P 与 TAL-M 与 TAL-C 中的表达)(图4D)。
他们预测基因与顺式调控元件和TF的关联,对TAL-P、TAL-M、TAL-C、tL-P、tL-M、PC-P、PC-M的分析均表明,RUNX1在维持这些tec在不同解剖区域的同一性方面是一个调节性TF(图4H)。
他们在IMS实验中使用的一系列组织切片上分别用免疫荧光法对TAL和PC细胞的两种标记物UMOD和AQP2进行了共染色,研究TAL和PC细胞是否存在区域依赖性代谢组学变化(图4I-J)。在空间分解代谢组学分析中,几乎所有AQP2+细胞都注释为聚类#5(棕色),无论区域位置如何(图4J),表明不同解剖区域的PC细胞具有相对相似的代谢组学特征。另一方面,尽管大多数UMOD+ TAL细胞与肾皮质的聚类#5共定位,但在髓质中,它们主要由聚类#7识别(图4J)。他们计算了聚类#5和聚类#7的差异特征,并确定了C45H78NO7PNa[磷脂酰乙醇胺PE(P-18:0/22:6)]作为聚类#5的特异性标记,C42H80NO8PNa[磷脂酰胆碱PC(20:2/14:0)]作为聚类#7的特异性标记(图4K)。皮层TAL细胞C45H78NO7PNa的丰度显著高于髓质TAL细胞C42H80NO8PNa的丰度(图4K)。
总之,他们将空间分辨代谢组学分析与 TAL 细胞的免疫染色相结合,表明皮质和髓质 TAL 细胞具有不同的代谢组学特征。
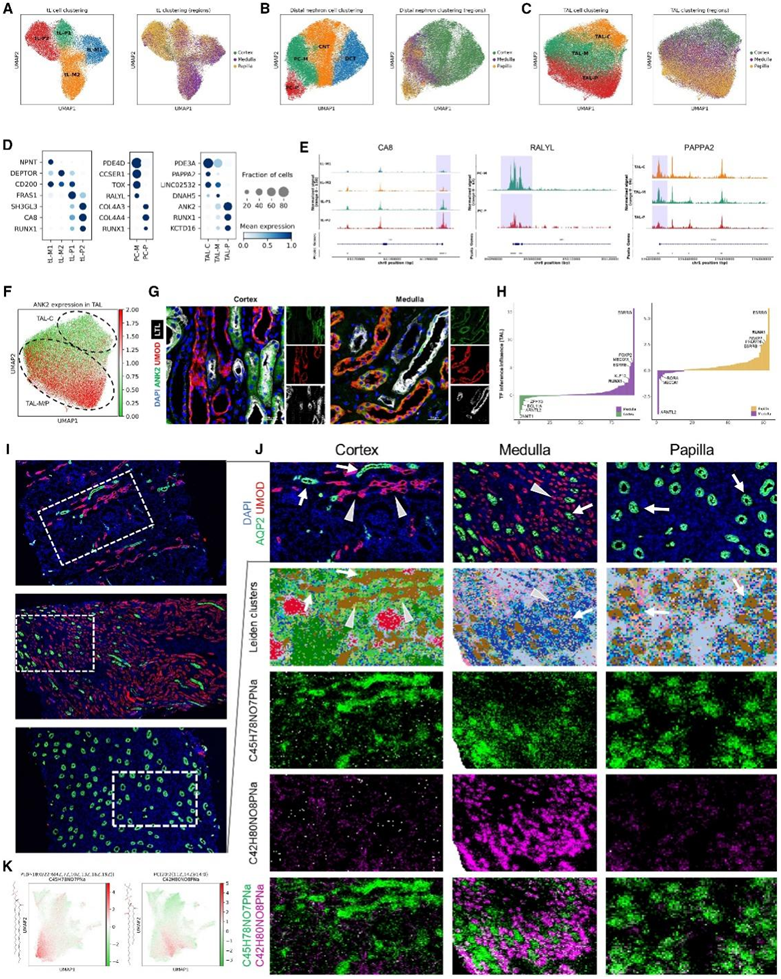
图4. tL、PC 和 TAL 细胞根据区域位置具有不同的特征。
(A–C) tL、远端肾单位和 TAL 细胞的亚聚类分析。(D) 显示聚类特异性基因表达的点图。(E) tL、PC 和 TAL 细胞标记基因的覆盖图。(F) TAL 细胞中的ANK2表达。(G) 肾脏皮质和髓质样本上的 ANK2、UMOD 和 LTL 的免疫染色。(H) 按 TAL-M 与 TAL-C(左)和 TAL-P 与 TAL-M(右)的监管分数排序的 TF。(I) 对皮质(上)、髓质(中)和乳头(下)组织的连续 MALDI 切片进行 AQP2(绿色)和 UMOD(红色)的免疫染色。(J) 免疫染色、代谢组学聚类和特征之间的比较分析。(K) UMAP 展示了两个特征。
04
肾单位片段之间独特的代谢相关基因谱
基于 446267 个单细胞转录组数据,他们处理了总共 2111 个基因,并通过保留总共 88113 个细胞的 150 多个基因进行进一步分析。他们将从 446267 个细胞的分析中获得的注释投影到这 88113 个细胞上(图 5 A)。有趣的是,他们能够利用 2111 个代谢基因的子集对所有主要肾细胞类型进行分层(图 5 A),只有极少数例外,包括 DCT 细胞,与整体细胞相比,与 TAL 细胞表现出更高的相似性。每种肾细胞类型都呈现出不同的代谢相关基因特征,例如脂质代谢相关基因ACSM2A (一种酰基辅酶A合成酶)在PT细胞中的独特表达以及CHST11(一种碳水化合物磺基转移酶)在免疫细胞中的较高表达细胞比其他细胞类型。
他们对每种细胞类型的代谢相关 DEG 进行富集分析,确定了这些细胞中独特且不重叠的代谢通路(图 5 B)。例如,除了脂肪酸氧化(FAO)的高活性外,PT细胞还表现出参与糖异生的基因表达增加,例如编码醛缩酶的ALDOB和编码磷酸烯醇丙酮酸羧激酶的PCK1/2 。tL 细胞表现出与谷氨酰胺代谢和糖酵解相关的基因的较高表达。重要的是,所有这些代谢基因还表现出统计显著的细胞类型特异性基因活性。
对不同解剖区域的代谢评分的调查表明,肾皮质中的FAO和糖异生活性较高,但肾乳头中糖酵解和谷氨酰胺代谢的活性增加(图5D)。在细胞类型水平上,他们鉴定了具有最高FAO和糖异生得分的PT细胞(图5E-F)。另一方面,在肾髓质和乳头中含量丰富的 tL 和 PC 细胞均表现出较低的糖异生评分,但糖酵解和谷氨酰胺代谢活性相对较高(图5G-H)。
在皮质乳头轴上,氧分压和渗透压存在显著梯度,导致渗透性细胞应激增加。因此,他们通过平均渗透细胞应激相关基因的表达来定义渗透应激评分,并验证了tL和PC细胞是两种TEC得分最高的细胞类型(图5I)。对所有肾细胞类型的评分进行调查表明,尿路上皮细胞也表现出高渗透应激活性。PC-P 的渗透应激评分高于皮质和 PC-M,乳头 tL (tL-P1/2) 的渗透应激评分高于髓质 tL (tL-M1/ 2)细胞(图5K)。
他们发现SCCPDH(假定的糖碱脱氢酶)在 tL 和 PC 细胞中特异性表达,并在其他 TEC 中表现出较低的表达(图 5 L)。他们进行了免疫染色,并证实在肾髓质和乳头中,SCCPDH+细胞内颗粒主要位于AQP2+ PC细胞和SLC44A5+ tL细胞(图5 M-N)中,但在其他TEC中很少检测到。
总体而言,这些结果确定了跨肾单位段的独特代谢基因谱,证明了 tL 和 PC 细胞中参与渗透性细胞应激的基因的高表达,并表明渗透性细胞应激可能与这些细胞中的区域特异性转录程序相关。
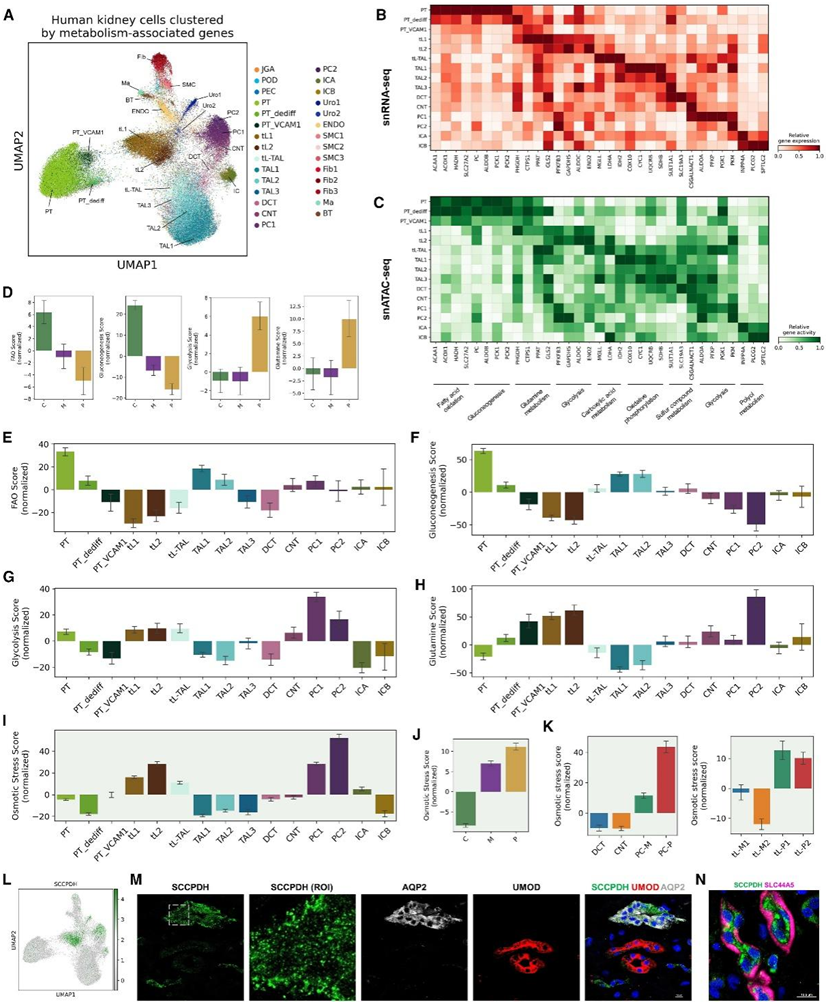
图5. 肾单位段之间独特的代谢相关特征。
(A) 通过代谢基因子集分析的细胞 UMAP 呈现。(B-C) 热图显示每个 TEC 的代谢基因表达和活性概况。(D) 条形图显示肾皮质、髓质和乳头的代谢相关基因模块得分。(E–H) 显示代谢相关基因模块得分的条形图。(I-J) 条形图显示了 TEC和肾脏区域的渗透压分数。(K) 条形图显示子聚类分析中的渗透应力评分。(L) tL 和集合管细胞特异的SCCPDH基因表达。(M) 对人肾髓质切片进行 SCCPDH、AQP2 和 UMOD 的免疫染色。(N) 髓质切片上 SCCPDH 和 SLC44A5 的免疫染色。
05
PT 细胞脂质代谢的多模式表征
PT 细胞中的脂质代谢高度活跃,并且在肾损伤期间可能失调,这与不良的疾病结果相关。他们确定了一个 PT 代谢聚类(聚类 #10),其长链酰基肉碱 (LCAC) 丰度较高,包括棕榈酰肉碱和油酰肉碱(图6A-B)。LCAC在肉碱棕榈酰转移酶I(CPT1)的催化下,作为载体将相应的长链酰基辅酶A从细胞质转运至线粒体外膜,因此是FAO的指标。他们在该数据集中检测到了 23 种 LCAC,发现大多数在 PT 聚类中表现出特异性积累(图 6 C),例如亚油酰肉碱和十四酰肉碱。计算所有 LCAC 物种的平均丰度(即酰基肉碱评分)证实 LCAC 积累是 PT 聚类的独特特征(图6D)。
在 23 个 LCAC 类别中,有 18 个特征显示 PT 聚类中的丰度显著高于其他聚类(图 6 C)。这 18 种 LCAC 类别的碳长度为 19 至 25,可分为三类:饱和、不饱和和羟基化 LCAC(图 6 E)。棕榈酰肉碱(23-C)和油酰肉碱(25-C,有一个双键)分别是最丰富的饱和和不饱和 LCAC 类别,而羟基化 LCAC 的富集程度相对较低(图 6 E)。
他们鉴定了健康状态和患病状态下的 PT 细胞(PT_dediff 和 PT_VCAM1)(图 1 F)。PT_VCAM1 细胞中健康 PT 标记基因(如LRP2)的表达减少,而损伤标记基因(如VCAM1)的表达增加(图 2 A)。在对 2111 个代谢基因子集进行的单细胞分析中,PT、PT_dediff 和 PT_VCAM1 仍然可以在降维空间上清晰地分层(图 5 A),表明不同的代谢相关基因谱。
通过对 2,111 个代谢基因进行轨迹推断分析,验证了健康和患病 PT 细胞之间独特的代谢基因谱,并确定了从 PT 到 PT_VCAM1 细胞的轨迹,PT_dediff 细胞位于其间(图6 F)。与 PT 细胞相比,PT_dediff 和 PT_VCAM1 中参与FAO的基因,包括β-氧化、ω-氧化和FAO活性调节显著下调(图6G)。基因模块评分分析还确定了 PT_VCAM1 中最低的 FAO 活性,而 PT_dediff 细胞显示出中等的 FAO 评分(图 6 H)。此外,在snATAC-seq分析中,这些FAO相关基因在PT_VCAM1细胞中均表现出显著降低的基因活性(图6G),表明染色质可及性变化。例如,催化脂肪酸 ω-氧化的 CYP4A11 在 PT → PT_VCAM1 伪时间内表现出基因表达降低,并且启动子区域的染色质可及性降低(图 6 I)。
肿瘤坏死因子 α (TNF-α) 可通过激活核因子 κB (NF-κB) 信号传导诱导 PT 细胞中 VCAM1 上调。与 PT 细胞相比,PT_VCAM1 细胞显示出 TNF-α/NF-κB 信号复合物相关基因的表达增加,并且 NF-κB 通路活性增加。因此,为了验证VCAM1上调的PT细胞中FAO受损的情况,他们用TNF-α处理hTERT肾PT上皮细胞(RPTEC)。这显著增加了 NF-κB 亚基基因NFKB1和RELB以及损伤标记基因VCAM1和HAVCR1的表达(图 6 J)。TNF-α 处理后,CPT1A、ACOX1和SLC27A2等 FAO 基因的表达显著降低(图 6 J)。他们利用海马代谢试验测量了实时耗氧率(OCR)和细胞外酸化率(ECAR),结果显示,在基线条件下,OCR显著下降,但ECAR没有下降(图6K),证明FAO活性降低。
持续抑制FAO会导致PT细胞中脂质积累增加。在上述富集分析中,他们观察到与 PT 相比,PT_dediff 和 PT_VCAM1 细胞中与脂质积累相关的通路,包括脂质转运、脂滴定位和醚脂生物合成均发生激活,并且相关基因也显著呈现基因活性表明染色质可及性增加(图6G)。以类似的方式,他们定义了脂质积累评分,该评分在健康 PT 细胞中仍然较低,但在 PT_dediff 和 PT_VCAM1 聚类中升高(图 6 L)。他们发现FAAH2(编码脂质水解酶)和ABCC1/3(编码脂质ATP结合盒转运蛋白)的表达增加以及启动子染色质可及性的增加(图6M)。
他们用 BSA 油酸酯/棕榈酸酯脂肪酸处理 RPTEC,导致油红 O (ORO) 染色标记的细胞内脂质显著增加(图 6 N)。在任一脂肪酸种类处理后,FAAH2和ABCC3的表达显著增加(图 6 O),并且在 BSA 油酸酯处理后,ABCC1表达增加。因此,细胞内脂质积累足以诱导其上调。
总之,他们通过空间代谢组学鉴定了 PT 细胞中酰基肉碱的富集。对代谢基因图谱的转录组和表观基因组分析显示,在患病 PT 细胞状态下,脂质代谢失调,包括FAO减少和脂质积累增加。
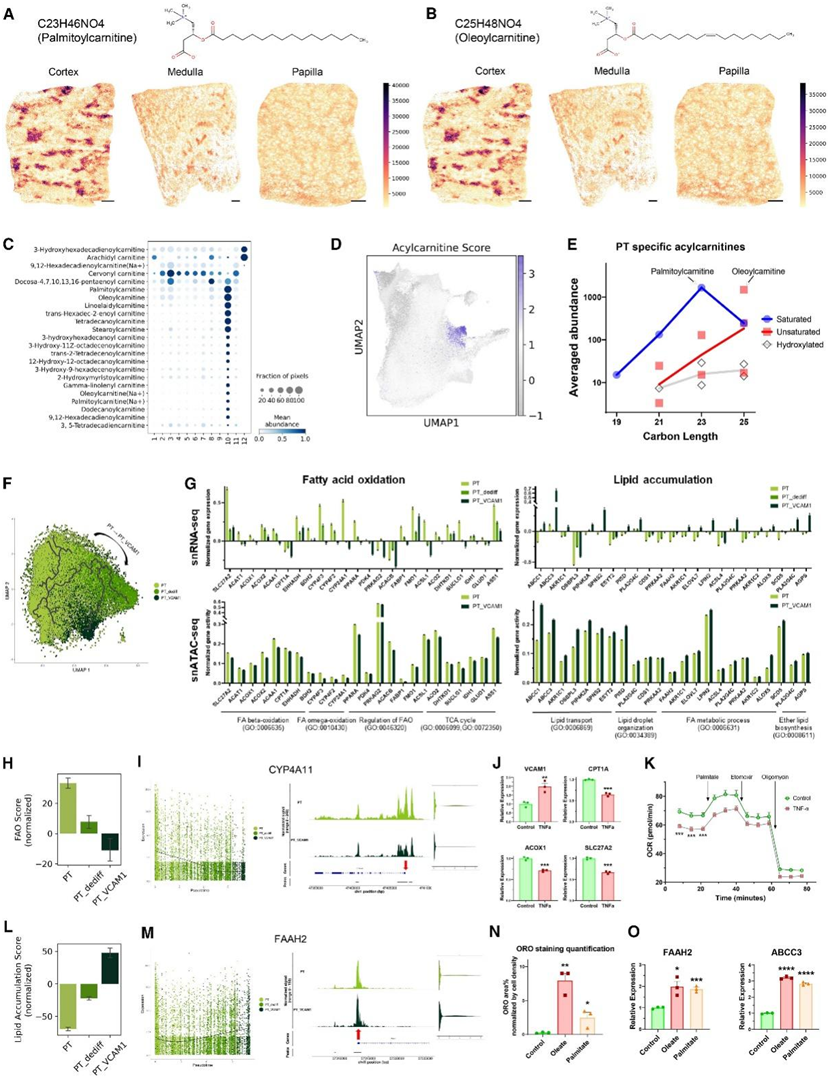
图6. 健康和疾病中近端小管脂质代谢的分析。
(A-B) 代谢物棕榈酰肉碱和油酰肉碱的空间特征图。(C) 点图显示跨聚类酰基肉碱种类的表达。(D) UMAP 演示显示酰基肉碱分数。(E) PT 特异性酰基肉碱种类的组成以及碳链长度和相对丰度。(F) 具有代谢基因子集的 PT 细胞的伪时间排序。(G) 涉及 PT 亚聚类中FAO(左)或脂质积累(右)的基因的相对基因表达(上)或活性(下)。(H) 条形图显示了 PT 亚群群中的 FAO 得分。(J) 用 TNF-α 处理的 RPTEC/TERT1 细胞的 qPCR 分析。(K) 用 TNF-α 处理的 RPTEC/TERT1 细胞的海马分析。(L) 条形图显示 PT 亚群的脂质积累得分。(M) PT 和 PT_VCAM1 细胞中FAAH2在伪时间内的表达(左)、染色质可及性(中)和基因表达(右)。(N) 用油酸酯或棕榈酸酯脂肪酸处理的原代 RPTEC 中 ORO 染色的定量。(O) 对初级 RPTEC 上的脂质积累基因进行 qPCR 分析。
06
临床数据整合识别出新的致病候选基因
接下来,他们的目标是通过整合登记捐献者的临床数据,特别是血清肌酐和血尿素氮(BUN)水平等疾病指标,展示SHARE-seq数据在转化应用中的用途。
他们首先证实了肾脏疾病与众所周知的疾病标志物表达之间的相关性。通过分析每个样本的 PT 细胞亚群,与对照组相比,急性肾损伤(AKI)或慢性肾病(CKD)供体中 PT 损伤标记基因(HAVCR1、VCAM1和TNIK)的表达显著增加,而分化标记物(如HNF4A)的表达降低(图7A-B)。与FAO相关的基因在CKD样本中表现出表达减少,证明了疾病中脂质代谢失调。HAVCR1和VCAM1的表达水平与患者肌酐浓度呈正相关(图7C-D)。胶原蛋白基因的表达随着供体年龄的变化而增加(图 7E),此外,AKI 和 CKD 样本与 ECM 编码基因表达增加相关(图 7F)。
接下来,他们的目标是鉴定对患病 PT 细胞的细胞状态转变可能重要的候选基因。通过交叉基因,(1) 与对照样本相比,在 AKI/CKD 中上调,(2) 与 PT 细胞相比,PT_VCAM1 中上调,(3) 低肌酐样本相比,在高肌酐水平 (≥ 1.3 mg/dL) 的患者中表现出显著更高的表达,(4) 在线性回归模型中显示出作为肌酐水平函数的表达显著增加(图 7G),他们确定了 13 个满足所有标准的候选基因,其中包括 Liprin-β1 (PPFIBP1)和PLEKHA1(图 7 H)。
通过免疫荧光染色,他们验证了 PPFIBP1 表达主要在肾皮质 PT 中鉴定,并且其表达在表达 VCAM1 的 PT 细胞中增加。与对照相比,慢性肾病患者(包括糖尿病肾病、局灶节段性肾小球硬化症和狼疮性肾炎)中PPFIBP1和PLEKHA1上调。
为了进一步研究 PPFIBP1 和 PLEKHA1 在肾脏疾病进展中的潜在作用,他们对原代人 RPTEC 进行了体外基因小干扰 RNA (siRNA) 敲低,并进行了bulk 转录组分析(bulk RNA-seq) (图 7 I-J)。与非靶向对照 (siNT) 相比,PPFIBP1 和 PLEKHA1 siRNA (siPPFIBP1/siPLEKHA1) 处理分别降低PPFIBP1和PLEKHA1表达的 88.0% 和 91.4%,证实基因敲低成功。 siPPFIBP1治疗导致448个基因显著上调和457个基因下调,siPLEKHA1治疗导致更广泛的基因库失调(2062个上调基因和2022个下调基因)。siPPFIBP1对PLEKHA1表达没有显著影响,但siPLEKHA1可以诱导PPFIBP1表达降低26.0%(图7J-K)。
对 siPPFIBP1 处理后 DEG 的富集分析发现,脂质代谢过程[例如PPARA、ACAT2、SPTLC2(丝氨酸棕榈酰转移酶长链碱基亚基 2)]和 ECM 组织中的基因表达增加,以及与细胞凋亡信号相关的基因表达减少以及应激激活信号通路的负调节(图 7 J),表明 PPFIBP1 在脂质代谢和应激反应中的作用。另一方面,siPLEKHA1处理导致与细胞增殖(例如MKI67)、细胞周期调节和细胞分裂相关的基因下调,同时上调分化的PT标志物如HNF4A和SLC6A8以及参与缺氧反应的基因(图7K),表明 PT 细胞中PLEKHA1敲低后具有促分化作用。
RNA-seq 和体外分析表明PLEKHA1可能是一个可能的治疗靶点,因为它的敲低可以增加 PT 分化中的基因表达并减少HAVCR1和VCAM1表达。
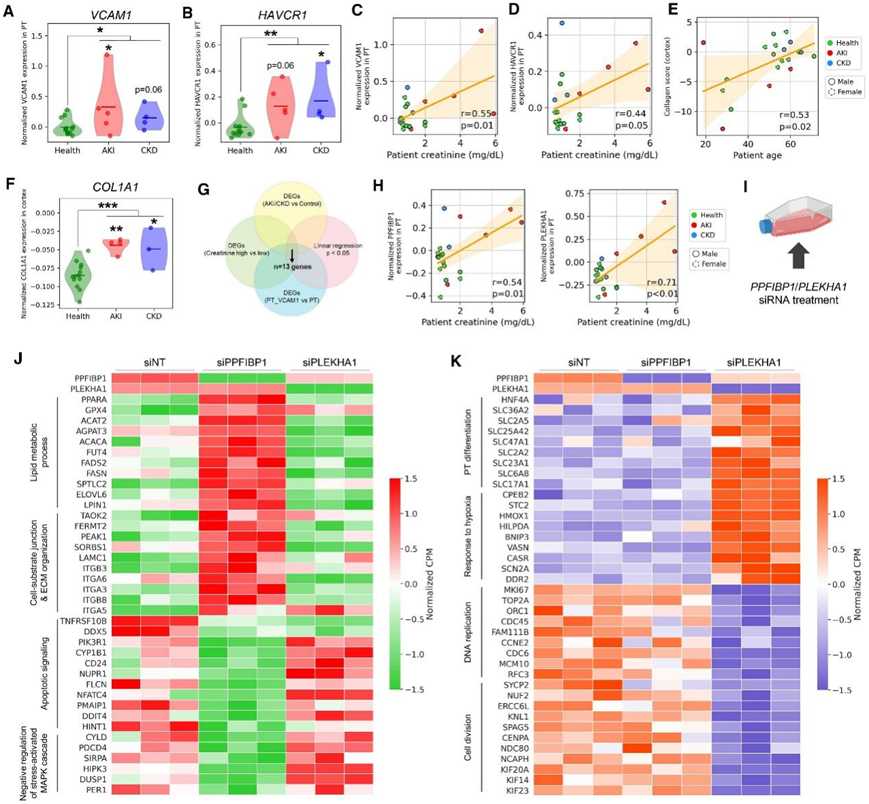
图7. 临床数据整合确定了疾病进展中的靶基因。
(A-B) 小提琴图,显示对照、AKI 和 CKD 供体的所有 PT 细胞中VCAM1 和HAVCR1的表达。(C-D) 患者肌酐水平与 PT 细胞中VCAM1和HAVCR1表达之间的相关性。(E) 患者年龄与肾皮质胶原基因表达之间的相关性。(F) 显示COL1A1表达的小提琴图。(G)基于四个标准选择与具有临床意义的患病PT细胞状态相关的13个基因。(H) 患者肌酐水平与PT 细胞中两个候选基因PPFIBP1(左)和PLEKHA1 (右)表达之间的相关性。(I) PPFIBP1或PLEKHA1在原代 RPTEC 中敲低。(J-K) 热图显示 siPPFIBP1 或 siPLEKHA1 治疗后的失调基因所涉及的通路(GO分析)。
+ + + + + + + + + + +
结 论
本项研究采用SHARE-seq和空间分辨代谢组学分析来自不同肾脏解剖区域的 54 个人类样本。他们生成了 446267 个细胞的转录组和 401875 个细胞的染色质可及性概况,根据解剖位置显示出不同的转录组、染色质可及性和代谢组特征。代谢相关基因谱揭示了肾单位片段之间不重叠的代谢特征以及患病PT细胞中脂质代谢失调。将多模式组学与临床数据相结合,确定PLEKHA1作为一种疾病标志物,其体外敲低增加了 PT 分化中的基因表达,表明可能的致病作用。这项研究强调了先前未得到充分体现的人类肾脏解剖结构的细胞异质性。
+ + + + +



 English
English


