文献解读|Nat Metab(18.9):生酮饮食通过赖氨酸β-羟基丁酰化重塑癌症代谢
✦ +
+
论文ID
原名:Ketogenic diet reshapes cancer metabolism through lysine β-hydroxybutyrylation
译名:生酮饮食通过赖氨酸β-羟基丁酰化重塑癌症代谢
期刊:Nature Metabolism
影响因子:18.9
发表时间:2024.08.12
DOI号:10.1038/s42255-024-01093-w
背 景
赖氨酸β-羟基丁基化(Kbhb)是由生酮饮食(KD)诱导的翻译后修饰(PTM),生酮饮食对多种人类疾病具有治疗作用,目前对Kbhb如何调节细胞过程的机制尚不明确。
实验设计
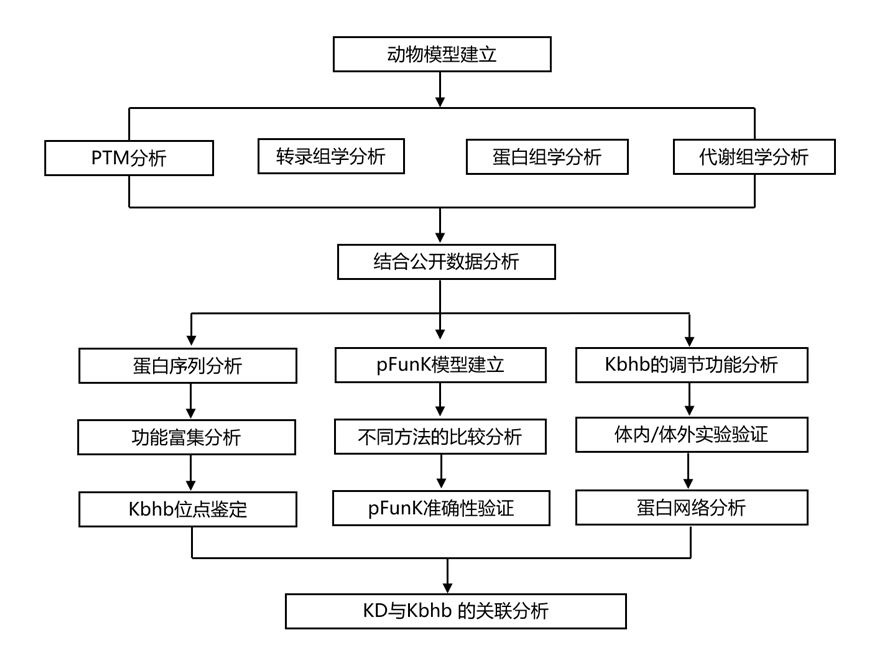
结 果
01
系统分析KD形成的分子景观
研究团队让3个月大的小鼠分别进行KD或对照饮食9周,KD显著降低了小鼠的体重(图1a)。此外,KD消耗显著提高血液中β-OHB水平,降低血糖水平(图1b-c)。他们通过用各种蛋白翻译后修饰(PTM)泛抗体探测小鼠肝组织,分析了KD如何影响蛋白质的PTM。KD显著增加了Kbhb、Kac和O-GlcNAcylation的整体水平,其中Kbhb的水平增加最多(相对于对照组变化了六倍)。相比之下,KD导致Kla和赖氨酸琥珀酰化 (Ksuc) 水平下降,但未改变磷酸化、泛素化和SUMO化的水平(图1d)。
接下来,他们对摄入或未进行KD的小鼠肝脏进行了多组学分析,包括转录组学、蛋白质组学和代谢组学分析(图1e)。由于在所有检测的翻译后修饰中,Kbhb水平的增加最为显著,他们还进行了β-羟基丁酰基组的定量分析(图1e)。
为了预测功能上重要的Kbhb位点,他们开发了pFunK,通过实现分层学习模型,依次进行预训练、迁移学习和少样本微调。使用pFunK,他们在本研究中定量的5304个Kbhb位点中,预测了27个蛋白质中的33个潜在重要的Kbhb位点,其中包括ALDOB的Lys108bhb。后续实验验证了生酮饮食或在癌细胞中添加β-OHB增加了ALDOB的Kbhb修饰,并抑制了其酶活性。此外,他们发现ALDOB Lys108bhb减少了其与底物FBP的结合,下调了mTOR通路和糖酵解,并通过多种实验方法显著抑制了多种癌细胞(包括肝细胞癌、肾癌和胃癌细胞)的增殖。
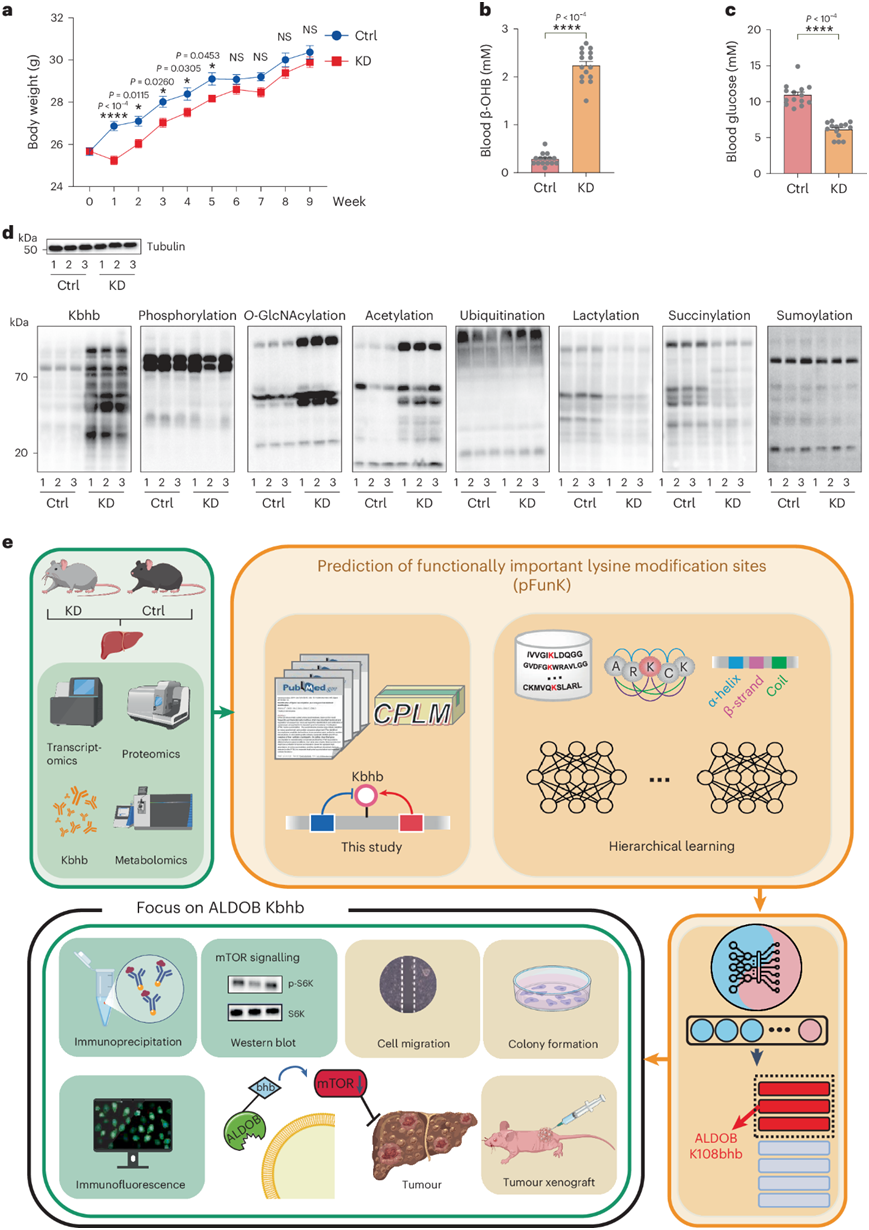
图1. 本研究的实验流程。
(a) 喂食对照 (Ctrl) 饮食或 KD 9 周的小鼠的体重。(b) 饲喂对照 (Ctrl) 和KD 组9 周的小鼠的体重。(c) 小鼠的尾静脉血糖水平。(d)免疫印迹分析。 (e) 实验设计示意图。
02
有无KD小鼠肝脏的多组学分析
通过多组学分析,他们发现37769个(78.07%)未修饰的蛋白质肽段和3492个(62.29%)β-羟基丁酰化的肽段(图2a)。将这些肽段映射到相应的蛋白质序列后,他们获得了2090个蛋白质中的5304个独特的Kbhb位点,其中3946个Kbhb位点此前未曾报道过(图S2a-c)。他们还处理了其他类型的组学数据(图S2e-f),他们通过分析分别在KD小鼠的多组学数据中鉴定出319个差异表达基因 (DEG)、234个差异表达蛋白质(DEP)、235个差异调控Kbhb位点(DRK)和98个差异表达代谢物(DEM)。通过比较这些多组学数据,他们发现只有两个代谢酶,即酮己糖激酶 (KHK)和泛硫乙酰胺酶 (VNN1),在多个层面上都发生了显著变化,这表明生酮饮食可能在不同程度上影响了转录组、蛋白质组和赖氨酸β-羟基丁酰基组(图2b)。
基于GO注释,他们对每个组学层面上差异调控的生物过程进行了功能富集分析(图2c-d)。结果显示,多个脂质生物合成和运输过程,包括胆固醇生物合成过程(GO:0006695)、类异戊二烯生物合成过程(GO:0008299)和长链脂肪酸运输(GO:0015909),在转录组和蛋白质组水平上共同富集(图2c)。这些结果表明,生酮饮食可能调节肝脏中的酮体生成及其非氧化代谢通路。令人惊讶的是,DRK主要富集于与肿瘤发生相关的脂肪酸和能量代谢过程,如脂肪酸β -氧化(GO:0006635)、TCA循环(GO:0006099)、典型糖酵解(GO:0061621)和糖酵解过程。研究表明,在癌症相关的代谢过程中,他们发现这些DRK的Kbhb修饰在KD小鼠中(与对照小鼠相比)普遍上调(图2e)。他们选择含有至少一个DRK的蛋白质,进行功能分析(图S2d),大部分kbhb调节蛋白参与脂肪酸代谢。进一步的分析显示,在TCA循环中,KD小鼠的两种DEM(异柠檬酸和柠檬酸)下调,表明Kbhb修饰与能量代谢存在潜在的相关性(图2f-g)。因此,这些结果表明KD可能通过其Kbhb功能调节各种细胞过程。
他们筛选了26种含有drk的蛋白,包括16种代谢酶,据报道与脂肪酸代谢、糖酵解和TCA循环中的肿瘤发生有关(图2h,图S2g)。与对照组相比,他们发现除了丙酮酸激酶PKLR在mRNA水平上下调外,KD小鼠中大部分酶的mRNA和蛋白表达水平均无明显变化。在β-羟基丁基组修饰水平上,除pklr外,大部分酶均由Kbhb上调。由于酶的数量没有改变,Kbhb修饰可能通过影响它们的催化活性和/或底物结合而起作用。
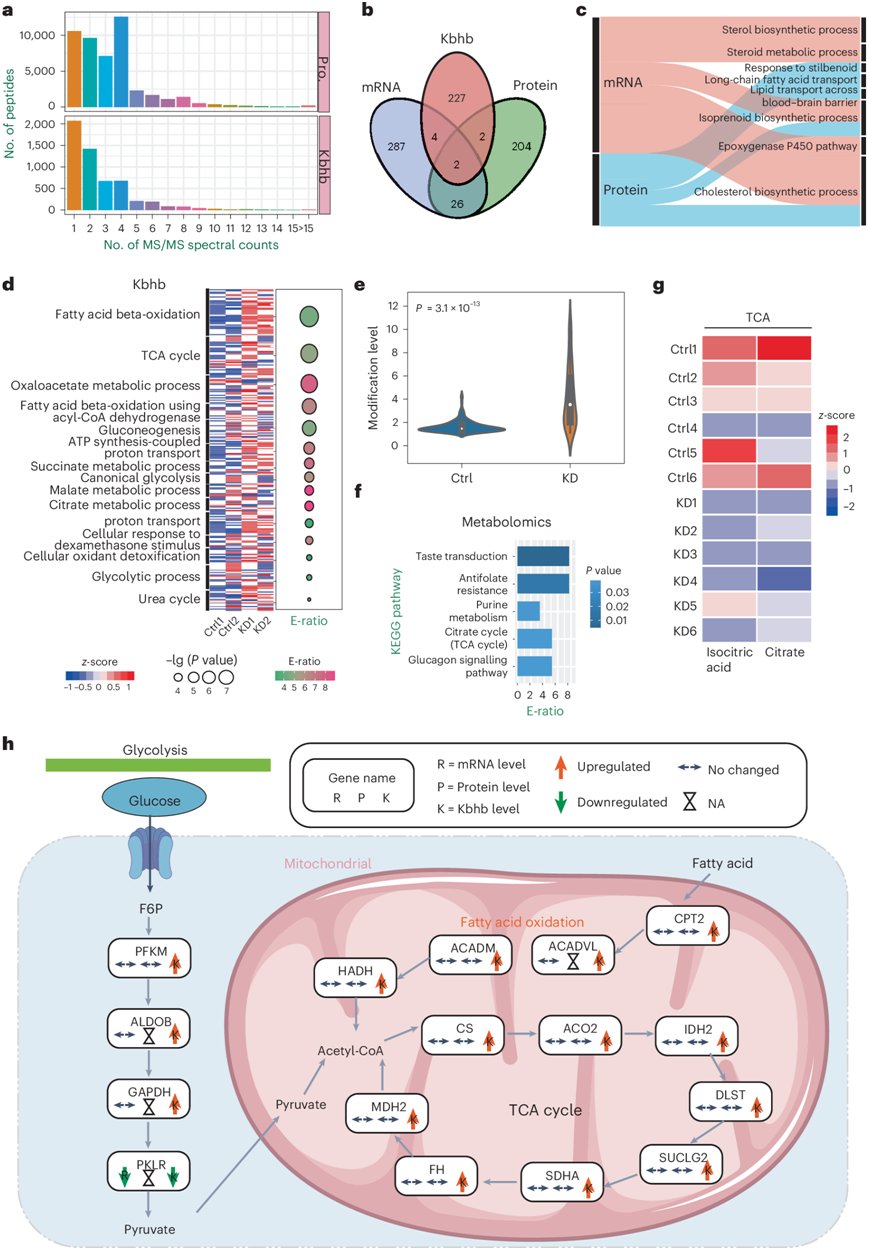
图2. KD 小鼠肝脏转录组、蛋白质组、β-羟基丁酸组学和代谢组的联合分析。
(a) 本研究中定量的蛋白质组肽 (Pro.) 和 Kbhb 肽的 MS/MS 光谱计数分布。(b) DEG(mRNA)、DEP(蛋白质)和含有至少一个 DRK (Kbhb)的 的重叠。(c-d) GO分析。(e) 癌症相关代谢过程中 DRK 的标准化修饰水平比较。(f) DEM 富集分析。(g) TCA 通路中两个 DEM 的热图。(h) 多种癌症相关代谢通路和代谢酶。
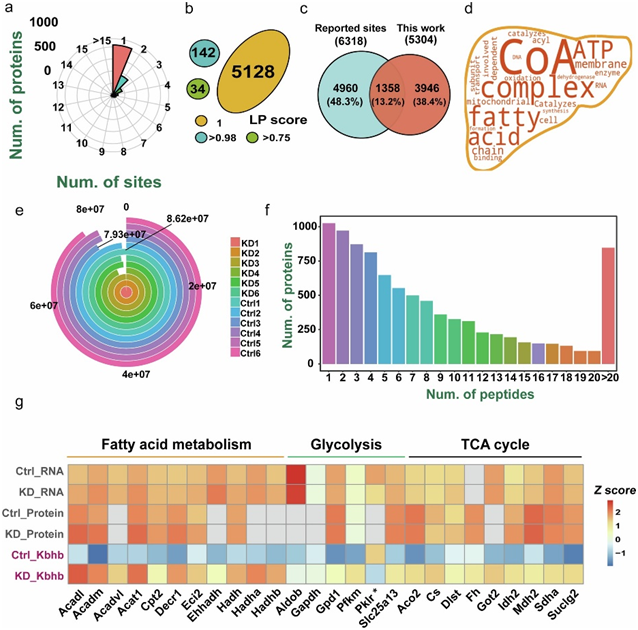
图S2.小鼠肝脏多组学数据分析。
(a) β-羟基丁酸化蛋白上 Kbhb 位点的分布。(b) Kbhb位点的定位概率得分。(c) 已报道的 Kbhb 位点与本研究确定的 Kbhb 位点的比较。(d) 包含至少一个DRK的蛋白质的功能分析。(e) 测序读数。(f) 可映射蛋白质中肽数量的分布。(g) 26种含 DRK 蛋白质在多个癌症相关代谢过程(包括糖酵解、TCA 循环和脂肪酸代谢)中的热图。
03
预测Kbhb位点的功能相关性
虽然在本研究中量化了5304个Kbhb位点,但他们假设这些位点中可能只有一小部分具有重要的功能,与其他PTM类似。从公开数据中,他们筛选了9个具有重要功能的Kbhb位点。显然,直接使用这么小的数据集来训练计算模型会有很大的偏差,容易出现过拟合。为了最小化偏差和过拟合,他们用三个步骤开发了pFunK模型(图3a)。首先,他们建立了一个预训练模型pFunK-P,该模型使用包含29种赖氨酸修饰的145657个非冗余位点的大型训练数据集,以学习赖氨酸修饰位点周围短序列中的“上下文”信息。在pFunK-T的第二步中,首先对基于变压器的模型进行微调,通过迁移学习进一步学习Kbhb特征。在这一步中,他们整合了6318个已报道的和5304个已确定的Kbhb位点,得到了10264个非冗余的已知Kbhb位点。同源消除后,将剩余的6932个Kbhb位点作为迁移学习和MAML微调的基准数据集。最后,采用MAML捕获Kbhb的功能相关性,仅使用9个功能重要的Kbhb位点进行微调。
对于一般赖氨酸修改位点的预测,pFunK-P在十倍交叉验证下获得了0.743[95%置信区间 (CI) = 0.719-0.764]的曲线下面积(AUC)值,比其他方法[包括深度神经网络(dnn)、支持向量机(svm)、随机森林、k近邻(knn)和极端梯度增强(XGBoos)]的准确率提高了>23.63%(图3b)。对于Kbhb位点的预测,在十倍交叉验证下,pFunK-T的AUC值为0.870 (95% CI = 0.859-0.892),比上述其他方法的准确率提高了>33.03%(图3c)。在预测Kbhb位点的功能相关性方面,pFunK在五倍交叉验证下达到了非常高的 AUC值=0.891 (95% CI = 0.828-0.980),远高于其他方法(图3d)。
pFunK能够明确区分功能性Kbhb位点与其他Kbhb位点(图3e)。对于pFunK-T和pFunK,他们选择了严格的阈值[特异性(Sp)= 95.0% 和 Sp = 90.0%]以减少假阳性预测,并生成了混淆矩阵来可视化实际结果与预测结果之间的一致性(图3f-g)。总的来说,pFunK在预测一般赖氨酸修饰位点、Kbhb位点和功能性重要的Kbhb位点上表现出色。
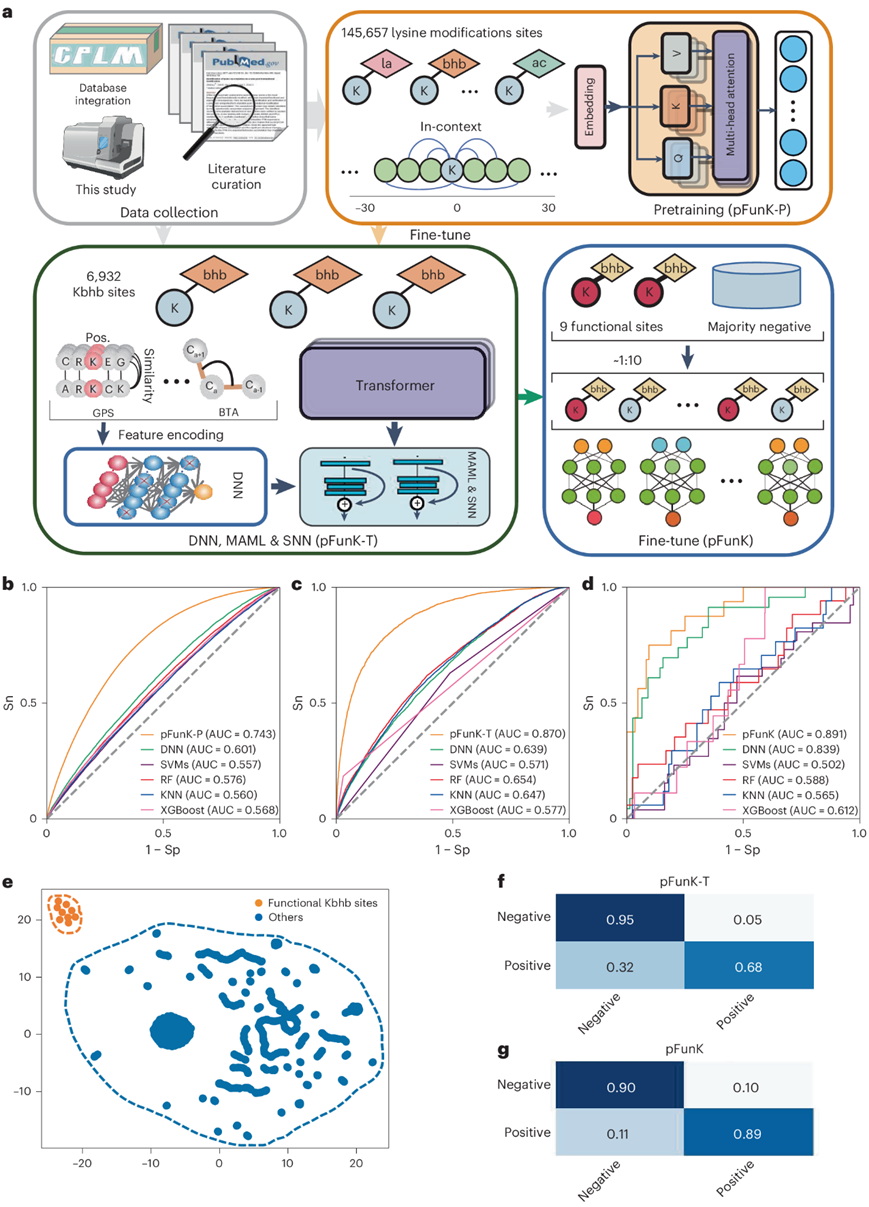
图3. pFunK的层次框架和性能。
(a) pFunK的架构,融合了多种算法。 (b-c) pFunK-P与其他方法的十倍交叉验证的ROC曲线和AUC值。(d) pFunK与其他方法在区分功能重要性Kbhb位点与其他位点的五倍交叉验证的ROC曲线和AUC值。(e) pFunK分离的功能性Kbhb位点与其他Kbhb位点的UMAP分析。(f-g) pFunK-T的混淆矩阵。
04
pFunK的实验验证
使用pFunK,他们对在β-羟基丁酰基组分析中鉴定的5304个Kbhb位点进行了评分和排序。在较低的阈值(特异性Sp = 90%)下,预测有578个Kbhb位点(10.90%)具有重要功能,其真实阳性率通过敏感性(Sn)测量为88.9%。为了缩小候选位点以便进一步实验,他们选择了更高的阈值(Sp = 99.5%,Sn = 77.8%),优先考虑了27个蛋白质中的33个潜在功能性Kbhb位点(图4a)。
接下来,他们重点关注了在列表中排序靠前的六个Kbhb位点,包括ALDOB的Lys108和Lys147、线粒体羟甲基戊二酰辅酶A合成酶2(HMGCS2)的Lys83和Lys310,以及BDH1的Lys91和Lys97(图4a-b)。ALDOB是糖酵解的重要调节因子,含有364个氨基酸,其中Lys108和Lys147位于容纳其底物FBP的口袋处(图4c)。有研究报道,ALDOB在肝脏中高度富集,而ALDOA或ALDOC则不然。与此一致,在蛋白质组和转录组数据中,ALDOB的蛋白质和mRNA表达水平远高于ALDOA或ALDOC。此外,在β-羟基丁酰基组数据中,未检测到ALDOA或ALDOC的Kbhb修饰。为了确定Kbhb对ALDOB活性的影响,他们将ALDOB的Lys108或Lys147位置替换为谷氨酰胺残基,这种替换模拟了β-羟基丁酰化的赖氨酸。他们评估了重组的野生型ALDOB、p.Lys108Gln和p.Lys147Gln蛋白的酶活性。结果显示,p.Lys108Gln和p.Lys147Gln突变体的酶活性相对于野生型显著降低(图4d)。
HMGCS2是酮生成过程中的关键限速酶,Lys83和Lys310位于hmg-CoA结合袋。p.Lys83Gln和p.Lys310Gln突变体都导致HMGCS2酶活性显著降低(图4f)。BDH1是一种在β-OHB代谢中起关键作用的酶,其结构尚未确定。酶活性测定显示,p.Lys91Gln突变显著降低了BDH1的酶活性,而p.Lys97Gln没有显著降低BDH1的酶活性(图4g)。因此,六个选定的Kbhb位点中的五个成功验证表明,pFunK是预测Kbhb位点的强大工具,可以通过Kbhb改变蛋白质的既定功能。
最后,他们检测了6个位点的β-羟基丁基化肽的MS/MS谱,发现每个β-羟基丁基化肽中至少有4对b离子和y离子可以明确识别(图4h-k)。
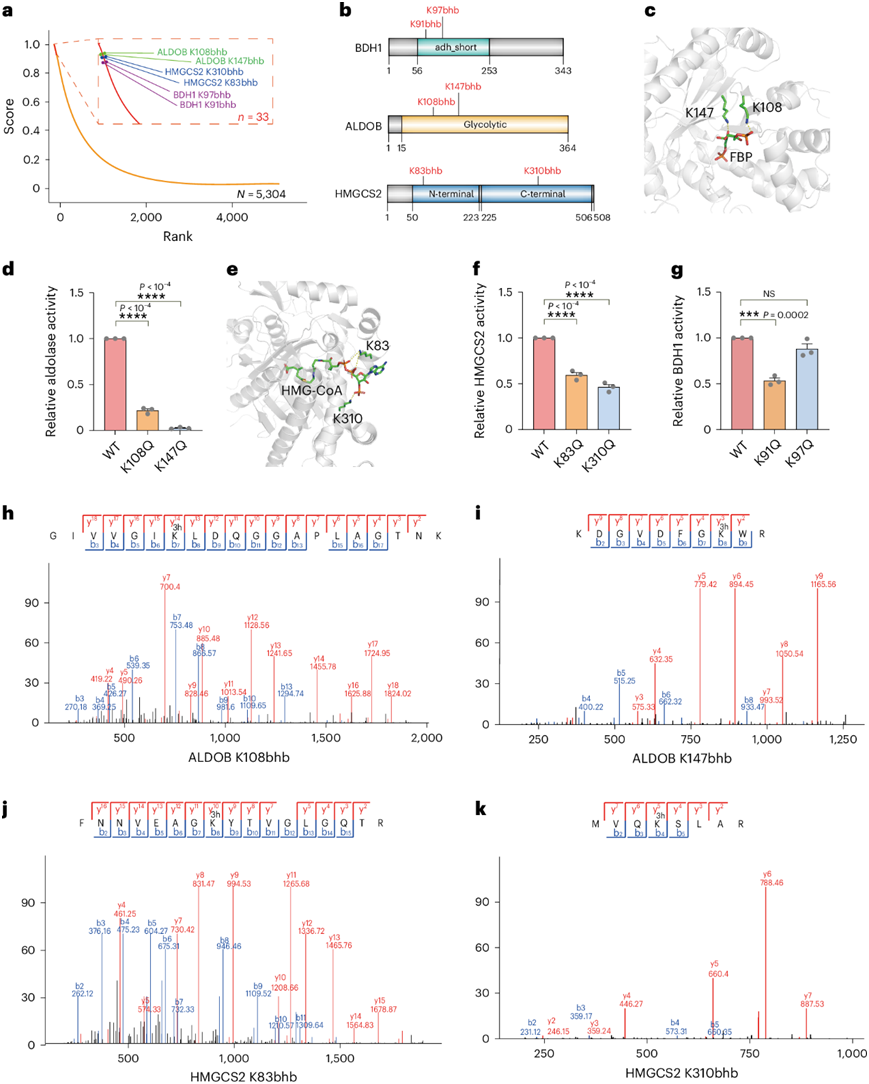
图4. pFunK 预测的 Kbhb 位点的实验验证。
(a) pFunK 对 5304 个 Kbhb 位点进行评分排序。 (b) Pfam 数据库中 BDH1、ALDOB 和 HMGCS2 蛋白的结构域结构。(c) 醛缩酶与FBP的分子对接分析。(d) 重组野生型 (WT) 和突变体 ALDOB 的相对酶活性。(e) 人类 HMGCS2 与 HMG-CoA 的分子对接分析。(f) 重组野生型和突变体 HMGCS2 的相对酶活性。(g) 野生型 BDH1 和 BDH1 突变体 Lys91Gln 和 Lys97Gln 的相对酶活性。(h-i) MS 分析从小鼠肝脏中鉴定出含有 β-羟基丁酰化 Lys108和 Lys147的 ALDOB 衍生肽。
05
KD促进ALDOB的Kbhb,抑制mTOR信号传导
由于ALDOB是糖酵解的关键调节因子,在肝脏中催化FBP转化为磷酸二羟丙酮和甘油醛3-磷酸,他们研究了Kbhb如何调节ALDOB的功能(图5a)。KD肝脏中ALDOB蛋白水平与对照组相当,表明KD对ALDOB蛋白表达没有显著影响。相比之下,与对照组相比,KD显著诱导了ALDOB上的Kbhb,而没有改变Kac的水平(图5b)。此外,与对照相比,KD抑制了ALDOB酶活性约一半(图5c)。这些数据表明,KD可以抑制小鼠肝脏中ALDOB活性,并增加ALDOB Kbhb。
为了验证β-OHB是否抑制人HCC细胞中ALDOB酶活性并增加ALDOB Kbhb水平,他们选择了HCC-lm3和SK-Hep1两种不同的细胞系。10 mM钠-β-羟基丁酸钠(Na-β-OHB)处理24小时显著增加了SK-Hep1细胞中Kbhb的整体水平,但对Kac或其他探针PTM的水平几乎没有影响。此外,Na-β-OHB处理增加了表达GFP-ALDOB的HCC-LM3细胞的ALDOB Kbhb水平,但没有增加ALDOB Kac水平(图5d)。
为了确定β-OHB是否抑制细胞中ALDOB的酶活性,他们在HCC-LM3细胞中短暂表达GFP - ALDOB,使用GFP抗体免疫沉淀GFP - ALDOB,并测量ALDOB的酶活性。不同浓度(2、4和10 mM)的Na-β-OHB处理均导致ALDOB酶活性的抑制(图5e)。同样,10 mM Na-β-OHB处理在多个时间点上减弱了ALDOB活性。总之,这些结果表明,在小鼠肝脏和人类HCC细胞中,生酮抑制ALDOB酶活性并增加ALDOB Kbhb水平。
先前的研究已经通过检测FBP的缺失,确定醛缩酶是mTOR和AMPK通路的关键调节因子。因此,他们决定研究KD如何影响小鼠肝脏中的两条通路。通过检测两个mTORC1下游靶点Ser6激酶(p-S6K)和4EBP1 (p-4EBP1)的磷酸化水平,可以确定KD强烈抑制mTOR通路(图5f)。
为了进一步证实ALDOB Lys108和Lys147发生β-羟基丁基化,他们将它们突变为精氨酸,它与赖氨酸具有相同的电荷,但不能发生β-羟基丁基化。表达野生型GFP-aldob、p.Lys108Arg和p.Lys147Arg的HCC-LM3细胞用10 mM Na-β-OHB处理,然后用GFP抗体进行免疫沉淀。p.Lys108Arg和p.Lys147Arg突变体均显著降低了ALDOB的Kbhb水平,表明这些残基是主要的β-羟基丁基化位点(图5g)。
由于醛缩酶是mTOR信号通路的关键调节因子,他们接下来测试了β-OHB是否通过Kbhb在ALDOB Lys108和/或Lys147位点抑制mTOR通路。他们首先确定了ALDOB和FBP之间的相互作用,因为这种结合是mTOR途径的关键决定因素。他们在p.Asp34Ser的背景下引入了p.Lys108Gln和p.Lys147Gln突变,p.Asp34Ser与FBP结合但不能切割它。有趣的是,ALDOB p.Lys108Gln使FBP的结合降低了约50%,而ALDOB p.Lys147Gln与野生型ALDOB的结合相似(图5h)。
为了评估其对mTOR通路的影响,他们在HCC-LM3细胞中稳定表达野生型ALDOB或突变体p.Lys108Gln或p.Lys147Gln,并监测S6K的磷酸化水平。他们还纳入了另外两个突变体p.a asp34ser和p.Lys230Ala作为对照。p.Asp34Ser和p.Lys230Ala突变体分别通过模拟高糖或低糖状态激活或抑制mTOR通路。他们发现p.Asp34Ser突变体的表达在高糖和低糖条件下都维持或增加了p-S6K水平,而p.Lys230Ala在两种情况下都降低了p-S6K水平(图5i)。与p.Lys230Ala类似,ALDOB p.Lys108Gln在两种情况下也降低了p-S6K水平(图5i)。ALDOB p.Lys147Gln调节p-S6K水平,与野生型ALDOB相似(图5i)。
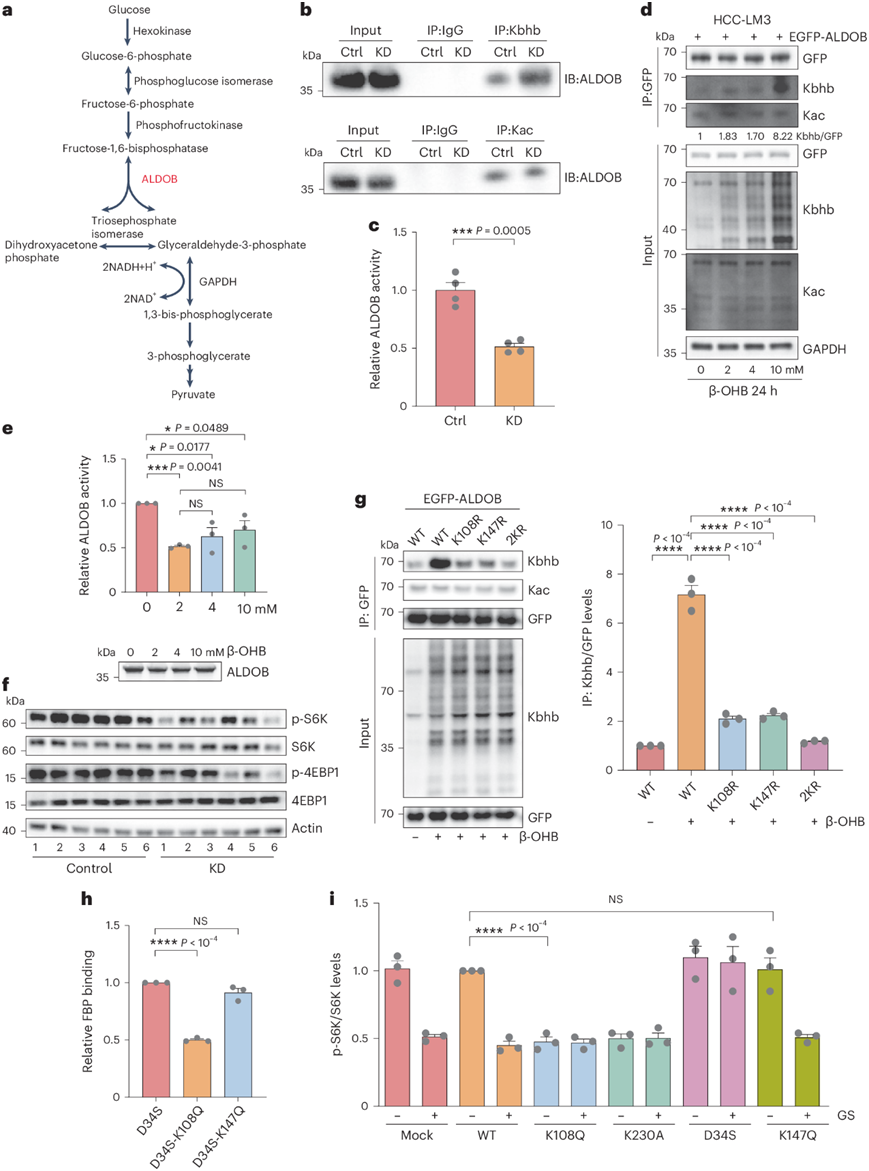
图5. ALDOB Lys108bhb 减弱 mTOR 信号通路。
(a) 糖酵解通路的简化示意图。(b)免疫印迹分析。(c) ALDOB 的酶活性。(d) 免疫沉淀分析。(e) ALDOB 的酶活性。(f)免疫印迹分析。(g) 突变对ALDOB Kbhb 水平的影响。(h) ALDOB 突变体与 FBP 的相对结合率分析。(i) p-S6K 与 S6K 的比率分析。
06
Kbhb在ALDOB Lys108抑制癌细胞增殖
研究表明,KD下调mTOR信号通路,抑制HCC细胞生长。为了进一步探讨ALDOB Lys108bhb是否抑制肝癌细胞mTOR信号传导并阻碍HCC增殖,他们在HCC-lm3和SK-Hep1细胞中稳定表达野生型ALDOB或突变体p.Lys108Gln或p.Lys108Arg。与之前的结果相似,p.Lys108Gln相对于野生型ALDOB显著地减少了mTOR信号通路(图5i和图6a)。
随后,MTT实验显示,与野生型ALDOB相比,p.Lys108Gln突变体显著降低了细胞活力(图6b)。接下来,通过伤口愈合实验,发现表达p.Lys108Gln的细胞迁移速度比野生型或p.Lys108Arg慢得多(图6c)。最后,表达p.Lys108Gln的细胞形成的菌落比野生型或p.Lys108Arg的细胞少得多(图6d)。为了检验ALDOB p.Lys108Gln是否在体内抑制HCC肿瘤生长,他们通过皮下注射向免疫缺陷小鼠注射表达野生型ALDOB或p.Lys108Gln的HCC-LM3细胞,建立肿瘤异种移植模型。与野生型ALDOB相比,p.Lys108Gln突变体在异种移植模型中显著抑制肿瘤大小和肿瘤重量(图6e-g)。与野生型ALDOB相比,p.Lys108Gln显著抑制肿瘤生长。
为了评估ALDOB p.Lys108Gln是否通过抑制与FBP的结合和ALDOB的酶活性来抑制mTOR通路,他们对表达野生型ALDOB和p.Lys108Gln的HCC-LM3细胞进行了靶向代谢组学分析。观察到糖酵解、TCA循环、氧化磷酸化等不同代谢通路的约25种代谢物发生变化。值得注意的是,在表达野生型ALDOB和p.Lys108Gln的HCC-LM3细胞中,ALDOB上游的多种代谢物,包括葡萄糖-6-磷酸、果糖-6-磷酸和FBP没有显著改变(图6h)。另一方面,几种下游代谢物,包括3-磷酸甘油酸和l-苹果酸,在表达ALDOB p.Lys108Gln的细胞中显著减少(图6i-j)。
与先前报道的β-OHB处理抑制多种癌细胞的增殖类似,他们发现10 mM或20 mM Na-β-OHB处理抑制HCC-LM3和SK-Hep1细胞的生长(图6k)。为了进一步证实ALDOB Lys108bhb在调节HCC增殖中的重要性,他们用野生型ALDOB突变体p.Lys108Arg/p稳定表达HCC- lm3和SK-Hep1细胞。Lys147Arg (2KR),然后进行10 mM Na-β-OHB处理。他们选择2KR是因为ALDOB Lys147也是一个主要的Kbhb位点。在Na-β-OHB处理后,表达2KR的细胞比表达野生型ALDOB的细胞迁移更快,形成更多的菌落,表明β-OHB通过ALDOB Lys108和Lys147 Kbhb抑制HCC增殖(图6l-n)。
为了进一步探讨ALDOB Lys108bhb是否抑制其他肿瘤的增殖,他们选择了胃癌细胞系HGC-27和2个肾癌细胞系769-P和786-O。这三种细胞系均稳定表达野生型ALDOB或p.Lys108Gln。随后,MTT实验显示,与野生型ALDOB相比,p.Lys108Gln突变体大大降低了细胞活力(图6o-q)。与在肝癌细胞中观察到的类似,Na-β-OHB处理显著提高了Kbhb的整体水平,但没有改变ALDOB的表达。总的来说,这些结果研究表明,ALDOB Lys108bhb减弱mTOR信号通路,减少糖酵解并抑制癌症增殖。
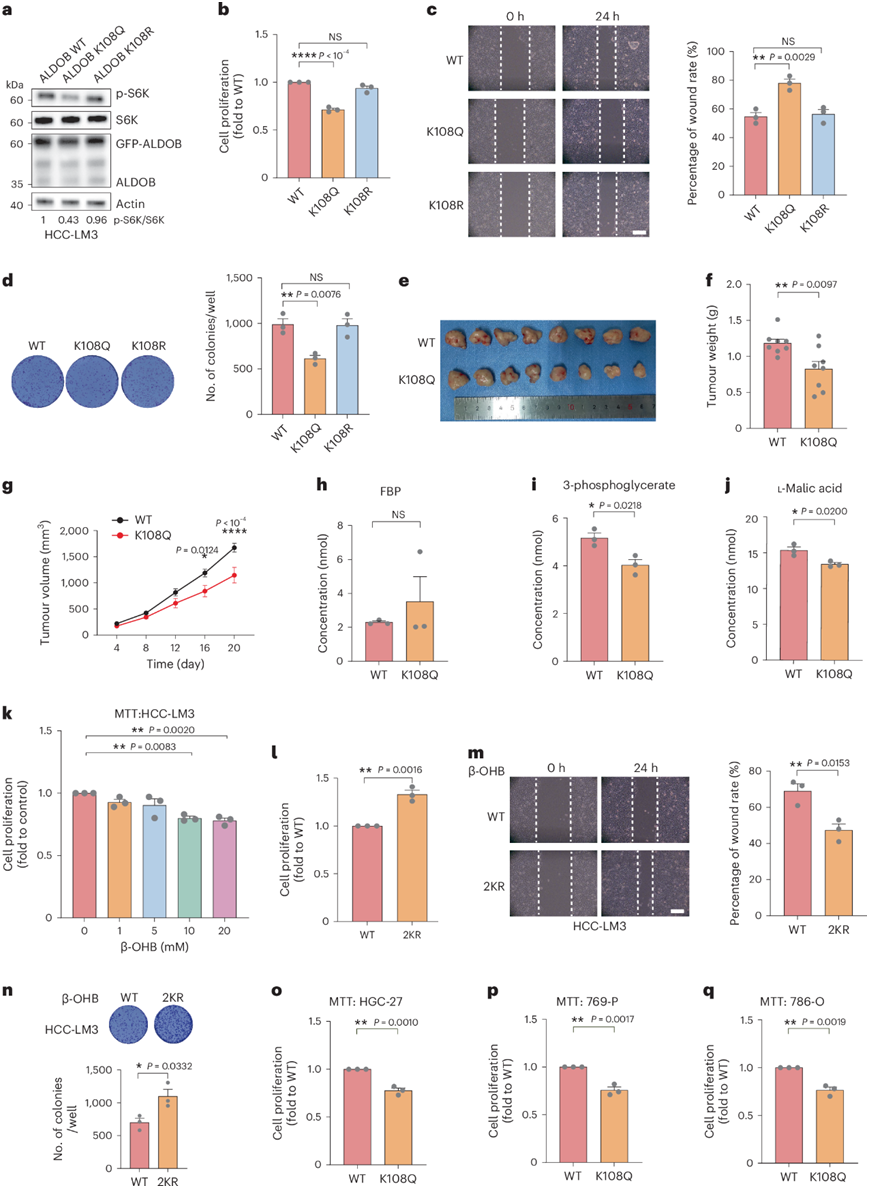
图6. ALDOB Lys108bhb 抑制 HCC 和其他类型癌症的细胞增殖。
(a) 免疫印迹分析。(b) 细胞增殖分析。(c) 细胞迁移分析。(d) 结晶紫染色分析。(e-g)肿瘤体积分析。(h-j) 靶向代谢组学分析FBP、3-磷酸甘油酸和L-苹果酸的浓度。(k) 细胞增殖分析。(l-n) MTT 检测、伤口愈合检测和克隆形成检测。(o-q) 细胞增殖分析。
07
Kbhb重要功能位点的潜在作用
为了进一步验证上述结果,他们采用反转录定量PCR (qRT-PCR)方法,比较了野生型ALDOB和p.Lys108Gln HCC-LM3细胞中mTOR信号通路、糖酵解或细胞增殖/发育等多个关键基因的表达。在与mTOR信号传导相关的组中,他们四个基因,包括AKT1、mTOR、RPTOR和RHEB,在p.Lys108Gln组中表达减少(图7a)。这些基因对肿瘤的生存和生长至关重要,在癌症中经常观察到它们的失调。在糖酵解组中,他们检测到3个基因,包括LDHA、PGAM1和PGAM2,在p.Lys108Gln组中减少,而只有PDK4增加(图7b)。LDHA、PGAM1和PGAM2对于增加癌细胞的糖酵解和致瘤潜能是必需的。PDK4缺失可促进HCC细胞的增殖。在与增殖/发育相关的组中,他们检测到3个基因,包括CCND1, MYC和PAIP1,在p.Lys108Gln组中减少,而FNTB增加(图7c)。下调CCND1、MYC或PAIP1可抑制肿瘤增殖。总的来说,这些数据表明ALDOB Lys108bhb确实抑制mTOR信号通路,阻碍糖酵解并阻碍癌症增殖。
为了更好地理解Kbhb修饰的功能,他们通过整合蛋白-蛋白相互作用和实验验证的结果,建立了一个网络,其中27种蛋白具有潜在功能的Kbhb位点,78种蛋白在前15个富集过程中至少具有一个DRK, 37种蛋白参与mTOR信号通路,糖酵解和癌症增殖(图7d)。
为了测试pFunK的可扩展性,他们进一步研究了其他三种赖氨酸修饰,包括Kla、Kac和Kcr。Kla是一种由细胞代谢物乳酸介导的新兴蛋白PTM,在调控转录和癌细胞代谢等功能中发挥重要作用。对于Kac,最初的pFunK-P首先微调为pFunK-Kac-T。pFunK-Kac模型进一步微调,使用568个带有功能相关性注释的Kac位点。通过10倍和5倍交叉验证,pFunK-Kac-t和pFunK-Kac的AUC值分别为0.925和0.939(图7e-f)。对Kcr进行了类似的分析,使用了15055个已报道的Kcr位点和21个标注了功能相关性的Kcr位点。同样,pFunK-Kcr-T和pFunK-Kcr分别通过10倍和5倍交叉验证获得了0.847和0.901的AUC值。在所有情况下,pFunK都优于其他方法。
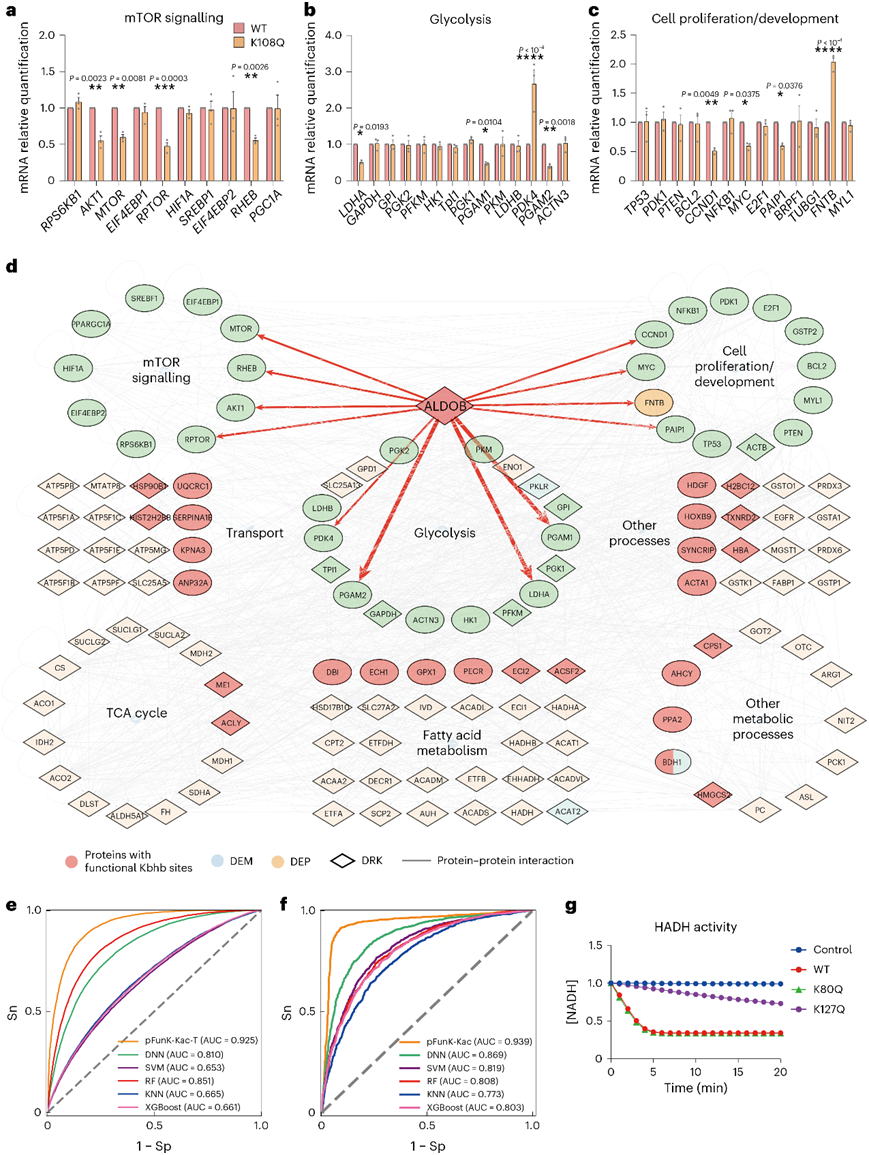
图7. 具有潜在功能性 Kbhb 位点的蛋白质的网络分析。
(a-c) 通过 qRT-PCR 检测涉及 mTOR 信号传导、糖酵解和细胞增殖/发育的多个基因的 mRNA 水平。(d) 具有潜在功能性 Kbhb 位点的蛋白质网络。(e) pFunK-Kac-T 和其他方法的十倍交叉验证的 ROC 曲线和 AUC 值。(f) pFunK-Kac与其他方法的五重交叉验证的ROC曲线和AUC值。(g) 重组野生型HADH和突变体p.Lys80Gln和p.Lys127Gln的酶活性。
+ + + + + + + + + + +
结 论
本项研究通过对小鼠肝脏进行多组学分析,表明蛋白质 Kbhb 受到 KD 的强烈影响。使用具有已知功能的小型训练数据集,本研究开发了一种生物信息学方法来预测功能重要的赖氨酸修饰位点 (pFunK),该方法揭示了各种蛋白质上功能相关的 Kbhb 位点,包括醛缩酶 B (ALDOB) Lys108。肝细胞癌细胞中的 KD 消耗或 β-羟基丁酸补充会增加 ALDOB Lys108bhb 并抑制 ALDOB 的酶活性。 Kbhb 模拟突变 (p.Lys108Gln) 会减弱 ALDOB 活性及其与底物果糖-1,6-二磷酸的结合,抑制mTOR靶标信号传导和糖酵解,并显著抑制癌细胞增殖。本项研究揭示了 Kbhb 在调节癌细胞代谢中的关键作用,并提供了一种预测功能重要的赖氨酸修饰位点的通用算法。
+ + + + +



 English
English


