文献解读|Nat Commun(16.6):甲型流感病毒的蛋白质组学和遗传分析确定了泛病毒宿主靶标
✦ +
+
论文ID
原名:Proteomic and genetic analyses of influenza A viruses identify pan-viral host targets
译名:甲型流感病毒的蛋白质组学和遗传分析确定了泛病毒宿主靶标
期刊:Nature Communications
影响因子:16.6
发表时间:2023.09.27
DOI号:10.1038/s41467-023-41442-z
背 景
甲型流感病毒 (IAV) 是一种反复发作的呼吸道病毒,抗病毒疗法的可用性有限。了解 IAV 感染所必需的宿主蛋白可以确定替代宿主导向疗法 (HDT) 的靶点。
实验设计
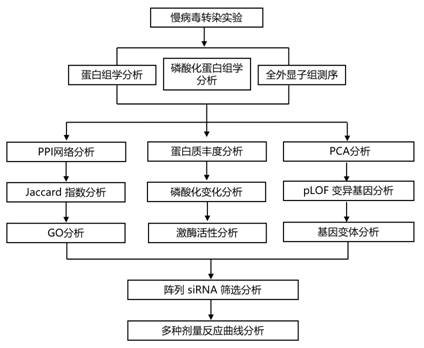
结 果
01
亲和纯化质谱 (AP-MS) 鉴定出 332 种 pH1N1、H3N2 和 H5N1 IAV-人类 PPI
研究者团队采用蛋白质组学方法和全外显子组测序(WES)来表征泛 IAV-human的蛋白-蛋白相互作用 (PPI)。他们对三种 IAV 毒株进行了密码子优化并克隆了 13 个带有 2X-Strep 标签的病毒蛋白(PB2、PB1、N40、PB1-F2、PA、PA-X、HA、NP、NA、M1、M2、NS1、NEP)(pH1N1、H3N2、H5N1)。将三个菌株的所有 PPI 结合起来,他们从 A549 细胞中鉴定出 111 个 PPI,从 NHBE 细胞中鉴定出 89 个 PPI,从分化的 THP-1 细胞中鉴定出 57 个 PPI(图 1B)。
将三种细胞类型中的所有 PPI 结合起来,他们在 8 个 IAV 蛋白中鉴定出 77 个带有 pH1N1 的 PPI,在 10 个 IAV 蛋白中鉴定出 77 个带有 H3N2 的 PPI,在 11 个 IAV 蛋白中鉴定出 142 个带有 H5N1 的 PPI(图 1C)。本项研究与其他使用外源表达的 IAV 蛋白进行 AP-MS 的研究之间有更高的相似性(图1D)。总共,他们发现了 44 种新的 IAV 相互作用因子。本项研究鉴定出的蛋白质序列相似性和 PPI 相似性之间存在正相关性(图 1E),并观察到具有高序列相似性的同源和非同源 IAV 蛋白共有 PPI,强调蛋白质序列是确定这些相互作用的驱动因素。GO分析确定了特定 IAV 蛋白相关的分子功能(图1F)。例如,NS1 相互作用子富含双链 RNA 结合蛋白。GO分析还描述了功能未知的IAV蛋白,如N40的热休克蛋白结合和伴侣蛋白结合,这可能表明N40在蛋白质翻译和/或稳定性中的新作用(图1C)。然而,同样具有少量PPI的M1显示出具有翻译延伸因子活性的PPI的显著富集。M1已知功能包括促进核输出和病毒RNA的转运;目前尚不清楚这些ppi是否参与了这一活动,还是表明M1具有独立的新功能。
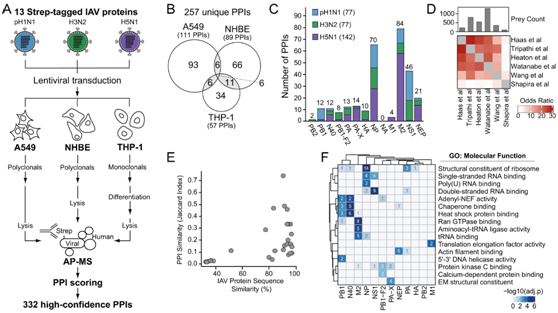
图1. AP-MS 鉴定出 332 种 pH1N1、H3N2 和 H5N1 IAV-人 PPI。
(A) AP -MS 实验设计。 (B) 在每种细胞类型中鉴定出的IAV-human PPI的维恩图。(C) 每个IAV蛋白和菌株的独特IAV-human PPIs柱状图。(D) 比较人类相互作用蛋白的鉴定相关矩阵。 (E) Jaccard指数比较共有蛋白相互作用(PPI相似性)与IAV蛋白序列相似性。(F) GO分析。
02
来自三种细胞类型的 IAV PPI 网络识别毒株特异性和泛 IAV-人类相互作用
他们注意到细胞类型之间的小 PPI 重叠(图 1B),便将三个细胞类型特异性网络中的所有 PPI 结合起来,生成一个统一的相互作用组,以可视化 214 种人类蛋白质和 12 种 IAV 蛋白质之间的泛 IAV 和菌株特异性相互作用(图2)。这三种毒株共有的相互作用采用三色节点表示,包括参与剪接体(NP, 11个相互作用)、CDC5L复合物(M2, 3个相互作用)、线粒体核糖体(NP, 17个相互作用)、60s核糖体(PA, 3个相互作用)、核转运(M2, 10个相互作用)、巨噬(M2和PB1-F2, 2个相互作用)和质子转运(M2, 2个相互作用)的蛋白质。相互作用组还突出了以一种或两种颜色的节点表示的菌株特异性ppi,在主要参与宿主反应的病毒蛋白NS1、PA-X和PB1-F2中最为明显(图2)。这可能代表了每个菌株对宿主蛋白复合物的独特选择。例如,NS1主要与pH1N1和H3N2相互作用,包括四种PI3K信号成分,这与先前的数据一致,表明NS1在感染过程中激活PI3K信号以调节宿主凋亡反应。
除了已知的相互作用之外,他们的 IAV 宿主网络还鉴定了新型 PPI,例如参与细胞骨架调节和 RNA 结合的 NEP 相互作用子,包括结构支架蛋白 AHNAK(图 2)。总的来说,相互作用组凸显了人类蛋白质的丰富生物学特性以及三种 IAV 菌株所针对的途径。
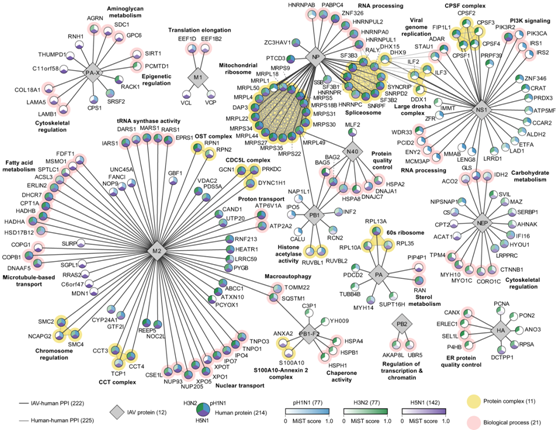
图2. 来自三种细胞类型的 IAV PPI 网络识别菌株特异性和泛 IAV-人类相互作用。
03
整体蛋白质组分析突出了 IAV 感染中的 13 种调节激酶
在正交蛋白质组学方法中,他们在感染后四个时间点对 pH1N1、H3N2 或 H5N1 IAV 感染的原代 NHBE 和分化的 THP-1 细胞进行了整体蛋白质丰度和磷酸化分析,以鉴定 IAV 调节的宿主信号通路(图 3A),确定了每种细胞类型中每种 IAV 毒株在感染时间过程中发生的数百个显著的蛋白质丰度变化和位点特异性磷酸化事件(图 3B-C)。他们检测到在收集的时间点内 IAV NP 丰度不断增加,表明生产性感染,尽管这种增加因菌株而略有不同(图 3D)。
由于蛋白质磷酸化的变化反映了激酶活性的变化,因此他们接下来利用磷酸蛋白质组数据来预测 IAV 感染期间活性改变的激酶,观察到蛋白质和磷酸化位点丰度变化之间的弱相关性,表明观察到的磷酸化变化很大程度上不是由蛋白质丰度变化驱动的(图3E)。他们确定了 13 种在 IAV 感染期间活性发生变化的激酶(图 3F)。在NHBE和THP-1细胞中,5个丝裂原活化蛋白激酶(MAPK)家族成员(MAP2K3、MAP2K6、MAPKAPK2、MAPKAPK3、MAPKAPK5)在pH1N1感染时活性降低或无显著变化,而在H3N2和H5N1感染时活性升高(图 3F)。这可能与不同菌株的NS1激活JNK和PI3K信号的能力不同有直接关系。这种趋势在两个核糖体蛋白S6激酶(RPS6K)家族成员(RPS6KB1, RPS6KB2)中也观察到(图3F)。在THP-1细胞中,磷脂酰肌醇3-激酶相关激酶家族(PRKDC)的一个成员在pH1N1和H3N2感染期间表现出活性增加,而在H5N1感染期间没有明显变化(图3F)。这可能表明通过PRKDC对主要的人感染IAV毒株产生巨噬细胞特异性反应。总的来说,这些预测确定了感染期间不同的激酶活性模式,并可能指示不同的IAV菌株致病性和宿主反应。
叠加 PPI 和磷酸化蛋白质组学结果,鉴定出 45 种人类蛋白质具有 IAV 调节的磷酸化位点,这些位点与至少一种 IAV 蛋白质相互作用(图 3G)。对于某些 PPI,所有三种菌株的磷酸调节模式是一致的,并且可能代表感染和宿主反应中的泛 IAV 功能。例如,THP-1 和 NHBE 细胞中所有三种 IAV 毒株均下调了 H3N2 HA 相互作用因子 CANX 丝氨酸 583 (S583) 的磷酸化。SRSF2 是一种 pH1N1 PA-X 相互作用因子,在所有三种 IAV 菌株普遍上调。而其他 PPI,磷酸化受到 IAV 菌株的差异调节,并且可能代表蛋白质活性或定位的菌株特异性调节。CPSF4 S200磷酸化以菌株特异性的方式调节,在pH1N1和H3N2感染期间磷酸化降低,而在H5N1感染期间磷酸化增加(图3G)。CPSF4-NS1相互作用的功能存在毒株特异性差异,即pH1N1 NS1不能像H5N1亚型病毒那样有效地阻断mRNA输出和刺激mRNA翻译。虽然大多数ppi具有一个或两个iav调节的磷酸化位点,但五个ppi具有四个或更多iav调节的磷酸化位点(图3G)。虽然大多数PPI都具有一或两个IAV调节的磷酸化位点,但五种PPI具有四个或更多IAV调节的磷酸化位点(图 3G)。其中包括DNA损伤感应激酶PRKDC(一种在感染期间活性上调的M2 PPI)(图 3F),并且在pH1N1、H3N2和H5N1感染时具有五个上调的磷酸化位点(图 3G);而AHNAK[一种大的(~700 kDa)支架蛋白和一种 NEP PPI]具有 11 个 IAV 调节的磷酸化位点(图 3G)。IAV 感染期间 IAV-人 PPI(包括 PRKDC 和 AHNAK)的额外磷酸调节模式可能突显感染中相互作用的功能重要性的增加。
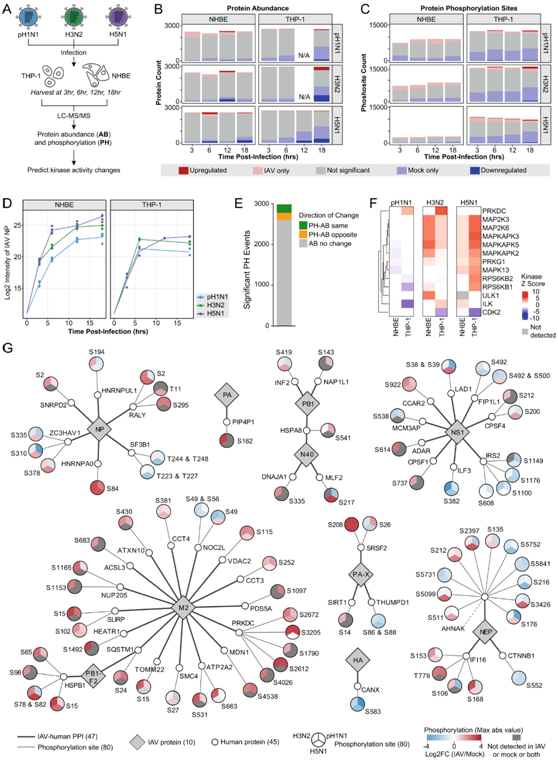
图3. 整体蛋白质组分析突显了 IAV 感染中的 13 种调节激酶。
(A) 实验设计工作流程。 (B)蛋白质丰度。(C) 磷酸化蛋白位点。(D) NHBE和THP-1细胞感染pH1N1、H3N2和H5N1 IAV后,检测IAV NP AB的强度。 (E) 所有肽的 PH 和 AB 数据的相关性。 (F) IAV 感染的 NHBE 和 THP-1 细胞中 FDR < 0.05 的预测激酶活性(激酶 Z 评分)热图。(G) IAV-human-PPI 图。
04
患者外显子组测序鉴定出编码 IAV 感染期间 AB 和 PH 调节蛋白的基因变体
为了研究蛋白质组数据集的临床意义,他们探索了在 IAV 感染细胞模型中受到调节的蛋白质与患者对 IAV 反应之间的相关性。为此,他们在五个 eMERGE 研究地点的个人知情同意后获得了去识别化的人类血液样本,使用主成分分析(PCA)来表征研究人群的遗传血统,并鉴定了 495 名经过基因鉴定的欧洲血统个体,其中 161 人因严重流感感染住院,334 人作为对照(图 4A)。
为了分析本项研究的蛋白质组学研究中的蛋白质是否影响具有与严重流感疾病相关的变异的基因,他们在蛋白质组数据集中探究了预测的功能丧失(pLOF)变异,因为这些变异不仅更容易预测,而且比功能获得突变或同义突变具有更容易理解的分子后果。如果识别为非同义外显子、移码替换或停止增益/丢失(MAF < 1%),则将变体分类为 pLOF,并从六种注释算法中的任何一种预测为有害。总共有 2808 个 AB 基因、3092 个 PH 基因和 177 个 PPI 基因具有 pLOF 变异。他们测试了1082个AB基因、2336个PH基因和118个PPI基因与严重流感疾病的关联(图 4B),并鉴定了 24 个 AB、49 个 PH 和 5 个 PPI 与 pLOF 变异显著的严重疾病相关基因。为了进一步分析具有 pLOF 变异的基因和本项研究的蛋白质组数据集,他们将 95 个 AB、161 个 PH 和 7 个 PPI 基因视为具有与严重疾病相关的 pLOF 变异的中等显著基,以包括更多具有较小影响的基因(图4B-D)。通过观察蛋白质组和患者数据集的重叠,他们发现 23 个 AB 和 52 个带有 pLOF 变异的 PH 基因在 IAV 感染期间受到显著调节(图 4C-F)。在本项研究的蛋白质组学和pLOF分析的交汇处,有44种具有pLOF变异的蛋白质在所有三个蛋白质组学数据集中检测到:AB、PH和PPI(图4D)。重点关注这些蛋白质组学检测到的具有 pLOF 变异的基因,并分析了三个数据集测试中严重流感疾病关联 FDR 的平均值,他们发现其中两个超过了显著性阈值:AHNAK和SEL1L。SEL1L 与 H3N2 HA 相互作用,虽然在 AB 和 PH 数据集中都检测到,但在 IAV 感染过程中,它在蛋白质水平上并未受到显著调节。相反,他们发现NHBE和THP1细胞中的所有三种IAV毒株均显著下调H5N1 NEP相互作用子AHNAK的蛋白AB(图 4E),并且在多个磷酸化位点上的磷酸化有显著变化。至少一种IAV毒株的至少一种细胞类型(图 4F)。他们观察所有 AHNAK 预测的磷酸化位点,以及本项研究数据集中所有显著调节的磷酸化位(图 4 G),他们发现丝氨酸位置 210 包含丝氨酸到脯氨酸或谷氨酰胺的磷酸化破坏突变(S210P/Q)与严重疾病显著相关(图 4H)。总之,本项研究的数据明确了 AHNAK 对感染的分子调节如何反映 AHNAK 的全身效应,因为它与宿主疾病的严重程度有关。
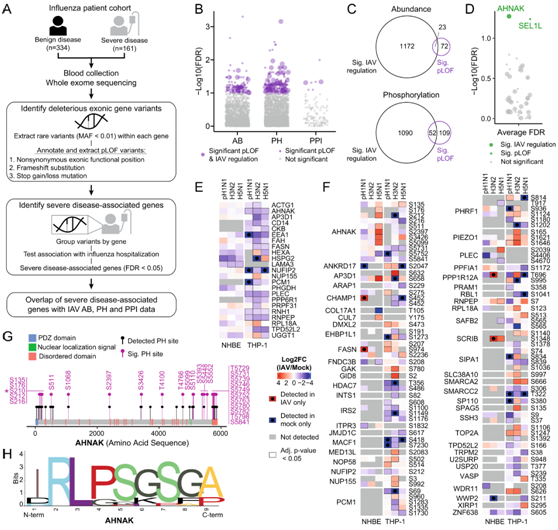
图4. 患者外显子组测序鉴定出编码 IAV 感染期间 AB 和 PH 中受调节蛋白质的基因变体。
(A) 样本收集和数据分析的示意图。(B,D)不同数据集分析。(C) 蛋白质组数据集重叠的维恩图。(E-F)热图分析。(G) 在PH数据中检测到AHNAK磷酸化位点。(H) 使用WebLogo 2.8.2版本创建AHNAK磷酸化中断突变的多序列比对序列LOGO 。
05
siRNA 敲低鉴定出 IAV 和 SARS-CoV-2 感染的 54 种促病毒和抗病毒因子
为了从功能上验证PPI和激酶因子在IAV感染中的作用,他们在A549细胞中采用了一种排列的siRNA筛选方法来鉴定敲除抑制感染(前病毒因子)或增强感染(抗病毒因子)的宿主蛋白(图5A)。共有290个基因在生物重复中敲除,包括:(1)212/214个IAV相互作用蛋白由siRNA靶向;(2) 64个激酶(包括图3F中的12个激酶)和14个磷酸化蛋白。对敲低细胞进行 IAV NP 免疫染色,并通过流式细胞分析对 NP 阳性 (%NP+) 细胞百分比进行定量,作为 IAV 感染百分比的读数。由于单独的 siRNA 敲低不会显著降低细胞活力,因此他们接下来分析 siRNA 敲低和 IAV 感染相结合所产生的细胞活力是否会偏向观察到 IAV 感染的变化。IAV感染的增加或减少与siRNA敲低和IAV感染的细胞活力的增加或减少不相关(图 5B)。正如预期的,非靶向 (NT) 对照siRNA不影响IAV感染(黑点,图 5C),并且IAV NP靶向siRNA抑制IAV感染(绿点,图 5C)。
对于IAV PPI和PH筛选,他们分别使用≤-2或≥2的阈值log2差异倍数对前病毒因子和抗病毒因子进行分类(图5D-E)。使用这一截止点进行PPI筛选,他们将44个基因分类为IAV感染的调节因子,其中37个是前病毒因子,7个是抗病毒因子(图5D)。这44种功能蛋白与12种IAV蛋白相互作用,对应于每个IAV蛋白至少有一个功能相互作用。与之前的全基因组siRNA敲低研究相比,他们鉴定了37种新的人类蛋白,这些蛋白在功能上影响IAV感染。他们计算了实验 siRNA 与复制匹配 NT siRNA 的敲低细胞中 SARS-CoV-2 感染性的 log2 差异倍数,并分别使用 log2 差异倍数 ≤ -2 或 ≥ 2 的阈值对促病毒和抗病毒因子进行分类。这确定了调节 SARS-CoV-2 感染的三个 IAV PPI 因子:COPB1、AHNAK 和 RUVBL2(图 5F)。总的来说,他们对 IAV 感染的 54 个调节因子进行了分类,其中三个充当 IAV 和 SARS-CoV-2 感染的泛呼吸道病毒调节因子(图 5G)。
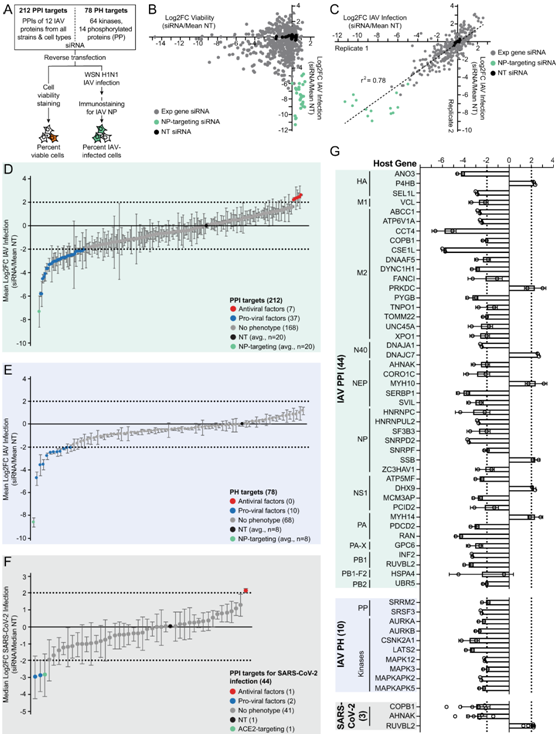
图5. siRNA 敲低识别出 IAV 和 SARS-CoV-2 感染的 54 种促病毒和抗病毒因子。
(A) 在 A549 细胞中采用阵列 siRNA 筛选方法。(B-C) 各生物复制品中各 siRNA 对抗 IAV 感染的细胞活力和IAV 感染的差异。(D-F) 212 个 PPI 目标和78 个 PH 目标的 IAV 感染中 log2FC 的分布。(G) IAV和SARS-CoV-2筛查的前病毒和抗病毒因子柱状图绘制为IAV感染的平均log2FC。
06
针对 IAV 和 SARS-CoV-2 宿主因子的宿主导向化合物可识别 pH1N1、H3N2 和 H5N1 IAV 感染的抑制剂
为了确定针对 IAV 感染的潜在 HDT,他们筛选了针对 44 种 siRNA 验证的促病毒和抗病毒 PPI 因子以及 13 种具有 IAV 调节活性变化的激酶的子集的化合物(图 6A)。20 种宿主蛋白可由至少一种化合物靶向,其中包括 8 种 PPI(总共 16 种化合物靶向)和 12 种激酶(总共 15 种化合物靶向),其中两种宿主蛋白确定为 PPI 和激酶。
他们注意到 11 个共有激酶在 IAV和 SARS-CoV-2 19 感染后具有相似的预测激酶活性谱。例如,MAPK信号传导成员(MAP2K3、MAP2K6、MAPKAPK3、MAPKAPK5、MAPKAPK2、MAPK13)和RPS6K信号传导成员(RPS6KB1和RPS6B2)显示出活性增加,而CDK2显示出活性降低。因此,他们利用已知的激酶靶向 SARS-CoV-2 抗病毒化合物并另外测试了它们针对 IAV 的潜在双重活性(图 6A)。
他们总共鉴定了 16 种对至少一种 IAV 毒株具有抗病毒活性的化合物,其中 7 种化合物显示出泛 IAV 抗病毒活性。四种针对四种 PPI 的化合物显示出针对至少两种 IAV 菌株的抗病毒活性(图 6B-E)。靶向M2 PPI V-ATP酶亚基ATP6V1A的巴弗洛霉素A1、抑制M2 PPI ATP结合盒亚家族成员ABCC1的柔红霉素和靶向HA PPI蛋白二硫键异构酶P4HB的PACMA31显示出有效的泛IAV抗病毒活性(图6B-E)。Bafilomycin A1 还可抑制 A549 细胞中 PR8 H1N1 的 IAV 感染。靶向M2 PPI DNA-PK PRKDC的DNA依赖性蛋白激酶(DNA-PK)抑制剂NU7441抑制pH1N1和H3N2感染,但不抑制H5N1感染(图 6D)。
除了 PRKDC 激酶抑制剂之外,他们还发现另外五种激酶的抑制剂表现出针对 IAV 的抗病毒活性(图 6F-H)。Dinaciclib 是细胞周期蛋白依赖性激酶 CDK2 的抑制剂,对所有三种病毒株均显示出有效的抗病毒活性(图 6F)。MRT68921是自噬激活激酶ULK1的抑制剂,对H3N2和H5N1具有抗病毒活性,并降低pH1N1感染(图 6G)。ULK1与其他蛋白复合物激活mtor依赖性自噬,这是IAV感染所必需的途径。MRT68921是一种新的IAV抗病毒药物,可能通过抑制ULK1来下调自噬和抑制感染。此外,丝裂原活化蛋白激酶(MAPK)途径的四个成员的三种抑制剂显示出抗病毒活性(图6H)。以MAP2K3和MAP2K6为靶点的lestutinib显示出对pH1N1和H5N1的抗病毒活性,并降低H3N2感染(图6H)。有趣的是,虽然MAP2K3和MAP2K6在H3N2和H5N1 IAV感染中显示出预测的激酶活性增加,但在pH1N1 IAV感染中没有(图3F),而lestutinib抑制pH1N1 IAV感染(图6H)。以MAPK13 (p38δ)为靶点的MAPK-13-IN-1表现出广谱活性,在三种IAV毒株之间存在一定的效力差异(图6H)。
八种SARS-CoV−2抗病毒化合物中有三种对至少两种IAV株显示出抗病毒活性(图6I-K)。Gilteritinib靶向p38、MAP2K3和MAP2K6上游的AXL激酶,对三种IAV株显示出抗病毒活性(图6I)。虽然针对MAP2K3和MAP2K6的抑制剂(lestaurtinib)和MAPK13 (p38δ) (MAPK13-in-1)对多种IAV毒株显示抗病毒活性(图6H)。这表明IAV和SARS-CoV-2会聚在MAPK通路的上游激酶上,它们的激酶信号活性对感染至关重要。Pictilisib靶向PIK3CA和PIK3CD也表现出广谱抗病毒活性,但效力存在菌株特异性差异(图6J)。MK-2206以AKT激酶(AKT1、AKT2、AKT3)为靶点,对H5N1表现出强抗病毒活性,对pH1N1表现出中等抗病毒活性(图 6K)。
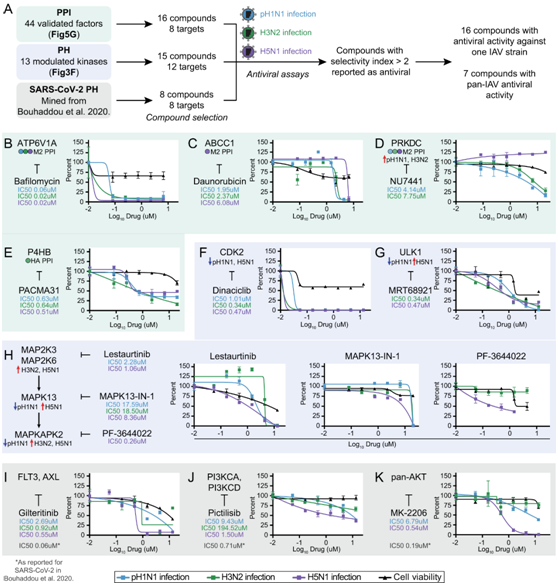
图6. 针对 IAV 和 SARS-CoV-2 宿主因子的宿主导向化合物可识别 pH1N1、H3N2 和 H5N1 IAV 感染的抑制剂。
(A) 针对 8 个 IAV PPI 因子和 12 个 IAV 调节激酶的化合物。 (B-G)靶向化合物的剂量反应曲线。(H) MAPK 途径成员的剂量反应曲线。(I-K) 针对 SARS-CoV-2 的抗病毒化合物的剂量反应曲线。
+ + + + + + + + + + +
结 论
本项研究利用亲和纯化-质谱法以及整体磷酸化蛋白质组学和蛋白质丰度分析,使用三种 IAV 毒株(pH1N1、H3N2、H5N1)在三种人类细胞类型(A549、NHBE、THP-1)中生成了 332 个 IAV-人类蛋白质-蛋白质相互作用图谱,识别 13 种 IAV 调节激酶。对经历过严重流感的患者进行全外显子组测序,揭示了多个基因,包括支架蛋白 AHNAK,在蛋白质组分析中也发现的预测功能丧失变异。在确定的宿主因子中,有 54 个在 siRNA 敲低后显著改变 IAV 感染,并且 AHNAK 和COPB1 这两个因子对于 SARS-CoV-2 的有效感染也至关重要。最后,针对已确定的宿主因子的 16 种化合物可抑制 IAV 复制,其中两种针对 CDK2 和 FLT3 的化合物显示出跨流感和冠状病毒家族的泛抗病毒活性。这项研究提供了人类细胞中 IAV 感染的综合网络模型,确定了泛病毒 HDT 的功能宿主靶点。
+ + + + +



 English
English


