文献解读|Nat Commun(14.7):巨噬细胞 STING 信号通过 IL6-STAT3 通路促进良性气道狭窄的纤维化
✦ +
+
论文ID
原名:Macrophage STING signaling promotes fibrosis in benign airway stenosis via an IL6-STAT3 pathway
译名:巨噬细胞 STING 信号通过 IL6-STAT3 通路促进良性气道狭窄的纤维化
期刊:Nature Communications
影响因子:14.7
发表时间:2025.01.03
DOI号:10.1038/s41467-024-55170-5
背 景
良性气道狭窄(BAS)是一种常见的呼吸系统疾病,以不同程度的呼吸窘迫为特征,严重者可导致窒息,甚至死亡。急性炎症和慢性炎症是良性气道狭窄(BAS)纤维化的重要病理。BAS的主要病因是机械损伤,包括插管后气管狭窄(PITS)、气管切开后气管狭窄(PTTS)和术后气管狭窄。近年来,随着新冠肺炎疫情等公共卫生事件的频发,气管插管是救治重症监护患者肺衰竭的重要手段。但长期气管插管会增加BAS的风险。目前,临床对BAS的干预主要为支气管镜综合处理,如支架植入、球囊扩张等。外科手术虽然具有一定的疗效,但也可能造成继发性损伤,导致肉芽组织过度增生,气管再狭窄。因此,在气道损伤过程中寻找新的治疗靶点,防止BAS的形成至关重要。对于复发性瘢痕增生,可利用一些药物(如丝裂霉素C、紫杉醇或吡非尼酮)抑制纤维化过程,有效抑制瘢痕组织的形成和复发。此外,有报道建议在炎症期使用抗生素、激素等抗炎药物,对气管狭窄的治疗益处。过度的炎症反应往往是气道狭窄发展的重要因素,及时抑制炎症反应可有效减轻狭窄的严重程度。
实验设计
结 果
01
scRNA-seq揭示了 BAS 患者肉芽组织中 cGAS-STING 通路的表达
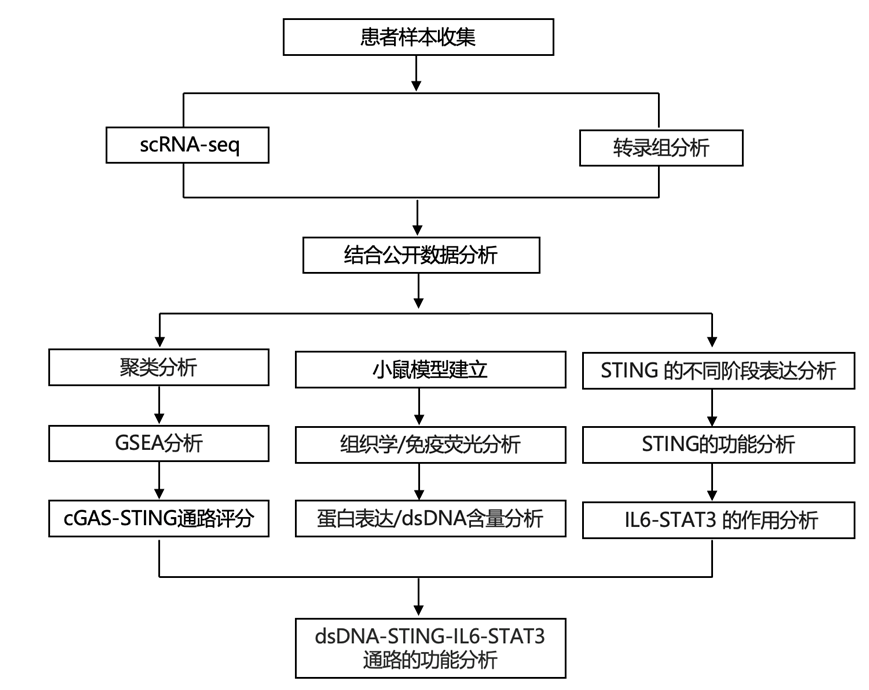
单细胞转录组分析(scRNA-seq)技术广泛用于疾病研究,为了解细胞异质性提供了无与伦比的见解,研究团队进行 scRNA-seq 以检测细胞身份并研究与急性和慢性炎症密切相关的 BAS 中 cGAS-STING 通路的表达异质性。
收集了3个正常气管组织(正常组)和4个肉芽组织(肉芽组)进行scRNA-seq。正常组共捕获31478个细胞,肉芽组共捕获27108个细胞(图 1a)。在均匀流形近似和投影(UMAP)空间中观察到不同的转录组聚类的形成,聚类反映了细胞类型或组(图 1b-c)。根据标记基因将细胞分为以下14个聚类:B细胞、基底细胞、纤毛细胞、内皮细胞、上皮细胞、成纤维细胞、肥大细胞、巨噬细胞、中性粒细胞、浆细胞、增殖细胞、SMC、T细胞和II型肺泡细胞(图 1d)。这14个细胞聚类分为上皮细胞、驻留细胞和免疫细胞三大类,肉芽组织组的免疫细胞比例显著高于正常组(图 1e)。GSEA分析显示,肉芽组织组与正常组相比,炎症反应是富集最显著的通路(图 1f),这与BAS急慢性炎症的病理特点相一致。此外,富集的通路也与免疫反应密切相关(图 1f)。进一步分析发现,与免疫反应密切相关的胞浆DNA传感通路在肉芽组织中高度富集(图1g)。对cGAS和STING基因表达水平分析发现,cGAS和STING在大多数聚类中均有表达(图1h),已证实STING和cGAS在免疫细胞和非免疫细胞中均有表达。与STING和cGAS在大多数细胞聚类中普遍表达相比,cGAS-STING通路的高分主要集中在免疫细胞中,包括巨噬细胞、T细胞和中性粒细胞(图 1i)。肉芽组织组的cGAS-STING通路评分高于正常组(图 1j)。接下来,对肉芽组织组各聚类的cGAS-STING通路评分进行评估,结果发现巨噬细胞聚类的评分最高(图 1k)。综合以上结果,scRNA-seq数据表明,cGAS-STING通路在良性气道狭窄患者的肉芽组织中高表达,巨噬细胞在该通路中起着重要作用(图1l)。
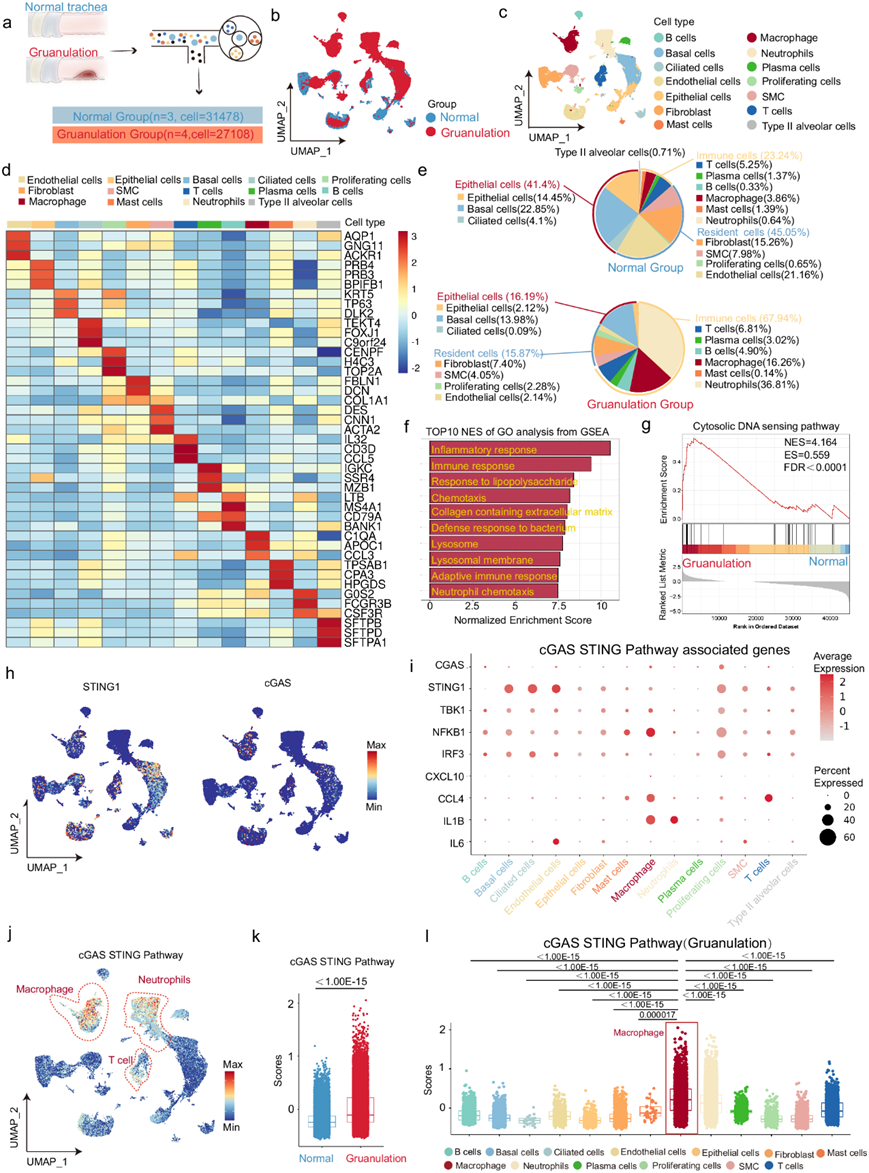
图1. BAS 患者中 cGAS-STING 通路的表达情况。
(a)实验设计的示意图。(b) 正常组和颗粒化组(共 58586 个细胞)的 UMAP 可视化。(c) 14种细胞类型(共 58586 个细胞)的 UMAP 可视化。(d) 每种细胞类型三个代表性标记基因的表达热图。(e) 正常组和颗粒化组中确定的每种细胞类型的总比例饼图。(f) 通路分析。(g) 颗粒化组中与细胞浆 DNA 传感器通路相关的基因集显著富集。(h) UMAP可视化所有聚类中的STING和cGAS表达。(i) 点图显示所有聚类中cGAS-STING 通路 9 相关基因(cGAS、STING、TBK1、NFKB1、IRF3、CXCL10、CCL4、IL1B、IL6)的表达。(j) UMAP 可视化所有聚类中的 cGAS-STING 通路评分。(k) 箱线图显示正常组和肉芽组织组的 cGAS-STING 通路评分。(l) 箱线图显示颗粒组所有聚类中的 cGAS-STING 通路评分。
02
cGAS-STING 信号在 BAS 中发生激活
受损或死亡细胞释放双链 DNA (dsDNA) 是引发炎症反应的关键事件。良性气道狭窄是一种病理状况,以急性和慢性炎症为特征,是由气管插管或置入气管支架造成的中央大气道损伤所致。对良性气道狭窄患者进行支气管镜冲洗后,与对照组相比,良性气道狭窄患者气管灌洗液中的 dsDNA 含量显著升高(图 2a-b)。为了确定 cGAS-STING 通路在 BAS 中的作用,他们用刷子损伤小鼠气管,建立了 BAS 模型(图 2c)。组织学结果显示,对照组小鼠气管通畅,上皮完整,未见炎症细胞浸润或肉芽组织增生(图 2d)。而BAS组机械损伤区域出现不同程度的狭窄,有明显的肉芽肿性增生,气管上皮细胞增生,炎症细胞广泛浸润,成纤维细胞过度增生,成纤维细胞紊乱,新生血管增多,细胞外基质沉积过多,导致固有层(LP)增厚(图 2d)。值得注意的是,BAS组的LP厚度大于对照组(图 2e)。在不同时间点收集小鼠气管组织进行转录组测序。GO分析显示,气管刮除后最初24小时内,主要表现包括损伤引起的炎症反应、免疫系统激活和与DNA相关的各种生物学过程。 然而,在建模后第7天,气管组织已处于修复状态,主要包括气管纤毛上皮的再生、细胞外基质的重塑和成纤维细胞肉芽组织的产生,这表明刮除小鼠的气管经历了与肌节生长一致的生理过程。 此外,在BAS早期,小鼠气管中许多与DNA相关的分子功能发生激活。目前已有多项研究表明DNA可以激活免疫反应。因此,本研究评估了对照组和受伤气管中双链DNA (dsDNA)的存在,结果显示BAS组气管灌洗液中的dsDNA含量明显高于对照组(图2f)。IF分析显示气管刮擦导致气管内胞浆dsDNA明显漏出(图 2g)。KEGG对上调的差异表达基因(DEG)进行通路分析,显示气管损伤24 h后BAS中胞浆DNA传感通路显著激活(图 2h)。关键DEG热图显示,与对照组相比,BAS组气管损伤24 h后胞浆DNA传感通路相关基因表达较高(图 2i)。免疫印迹分析显示,与对照组相比,气管损伤24 h后cGAS、STING表达及STING、P65、TBK1的磷酸化均升高(图 2j)。为了确定游离 dsDNA 受体 cGAS 在 BAS 环境中的功能,给小鼠施用 RU.521 cGAS 抑制剂(图 2k)。施用 RU.521 后,肉芽生长得到有效缓解,气管 LP 层厚度显著降低(图 2l-m)。除 cGAS 之外,AIM2 炎症小体也由dsDNA激活。转录组分析(RNA-seq)数据显示假手术和 BAS 气管组织中 AIM2 的 mRNA 表达较低。免疫印迹还显示假手术和 BAS 气管组织中 AIM2 的蛋白质表达均较低。在 scRNA-seq序中,他们发现 AIM2 在巨噬细胞中也低表达。以上数据表明 AIM2 可能在 BAS 进展中不起作用。总之,这些数据表明 BAS 患者气管和 BAS 小鼠模型中存在游离 dsDNA。此外,小鼠气管损伤后,游离 dsDNA 可激活气管中细胞质 DNA 敏感的 cGAS œ STING 通路。此外,抑制 DNA 受体 cGAS 可有效缓解 BAS 症状。
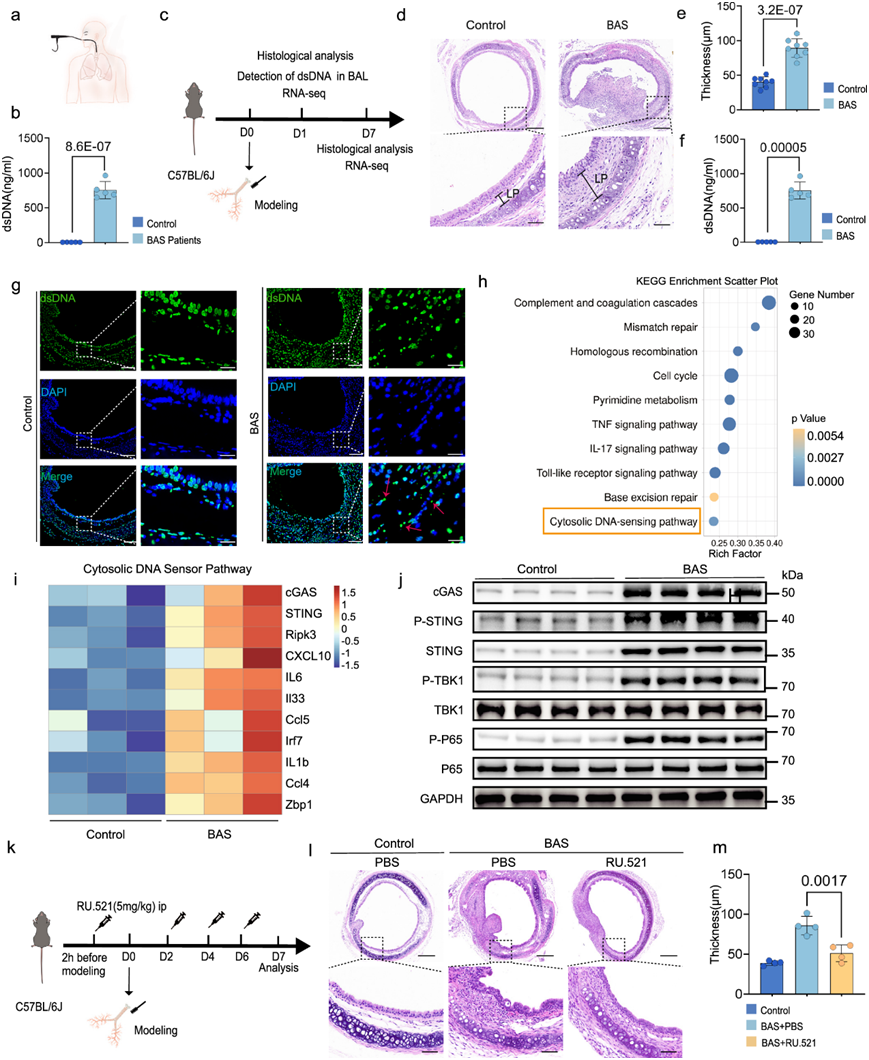
图2. 小鼠气管受伤时,cGAS-STING 信号发生激活。
(a) 患者气管灌洗示意图。(b) 对照组和 BAS 患者组气管灌洗液中 dsDNA 的定量分析。(c) 描述良性气道狭窄小鼠实验策略的示意图。(d) H &E 染色显示第 7 天对照组和 BAS 小鼠气管内和 LP 状况。(e) 对照组和 BAS 组LP 厚度的定量分析。(f) 定量检测对照组和 BAS 组(每组 n = 5 只小鼠)小鼠气管灌洗液中的 dsDNA。(g) BAS组和对照组 dsDNA(绿色)的代表性气管免疫荧光图像。(h)KEGG分析。(i) 热图显示与对照组(每组 3 只小鼠)相比,BAS 组上调了参与细胞浆 DNA 传感器途径的基因。(j)免疫印迹分析。(k) 小鼠服用 Ru.521(5 mg/kg,腹腔注射)的示意图。(l) H & E 染色显示第 7 天对照组和 BAS 小鼠的气管内和 LP 状况。(m) 定量分析表明,与用 PBS 处理的 BAS 组相比,用 Ru.521 处理的 BAS 组的固有层厚度减少。
03
STING 在 BAS 的不同阶段表达
考虑到STING在造血细胞(巨噬细胞、T淋巴细胞和树突状细胞)和非造血细胞(内皮细胞、上皮细胞和成纤维细胞)中广泛表达,分析了STING在BAS不同阶段的表达情况(图S2a-b)。RNA-seq数据显示,cGAS和STING在气管损伤后24 h表达量较高,而在气管损伤后7天表达量呈下降趋势(图S2c)。免疫荧光分析BAS不同时期巨噬细胞和成纤维细胞中STING的磷酸化状态。在BAS炎症早期,巨噬细胞中STING磷酸化水平进一步升高,但随着BAS的进展,成纤维细胞中STING磷酸化水平逐渐升高(图 3a)。炎症期,气管损伤后24 h,气管内大量炎症细胞浸润,如巨噬细胞。分析了CD45 +(白细胞标记物)细胞中STING阳性巨噬细胞的比例,发现与对照组相比,BAS组在气道狭窄炎症期STING阳性巨噬细胞数量增加(图 3b-c)。此外,免疫荧光分析显示BAS组小鼠气管中有大量STING+F4/80 +共表达细胞,而在对照组中很少发现此类细胞(图 3d)。免疫组化结果表明,在第7天的肉芽期,BAS小鼠气管中肉芽组织的上皮细胞和成纤维细胞中均有STING表达(图 3e)。此外,免疫荧光分析显示BAS组小鼠气管内有STING+SMA+和STING+E-cad+共表达细胞,而对照组中此类细胞很少发现(图 3f-g)。STING与纤维化疾病的发展密切相关,STING的激活已证明能促进成纤维细胞的激活
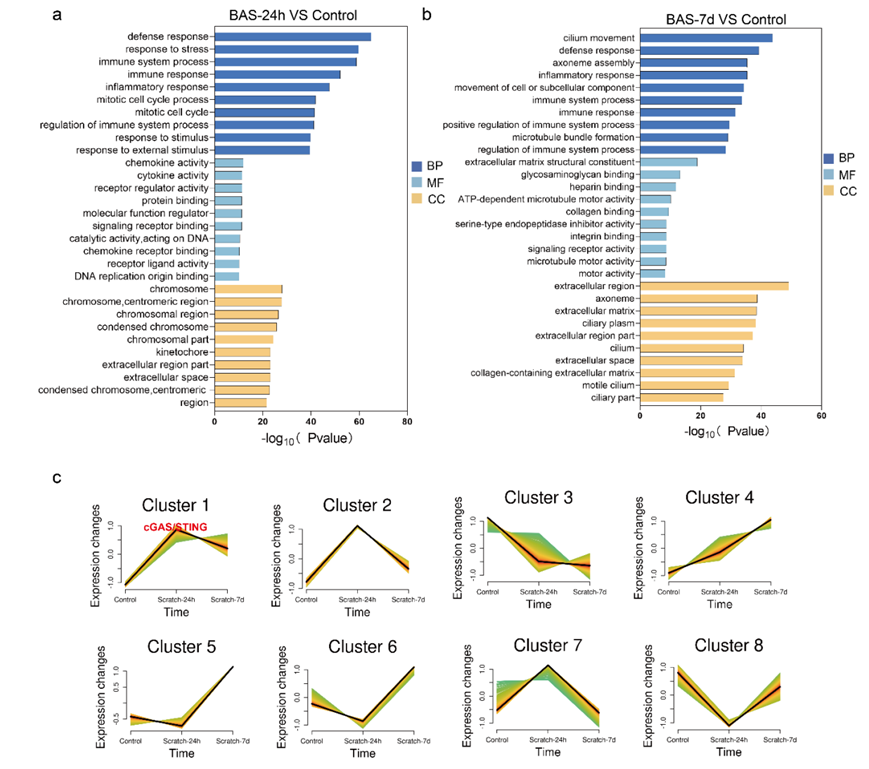
图S2. RNA-seq数据。
(a-b)GO分析。(c) 气管损伤后24h和7d良性气道狭窄小鼠的Mfuzz时间序列分析。
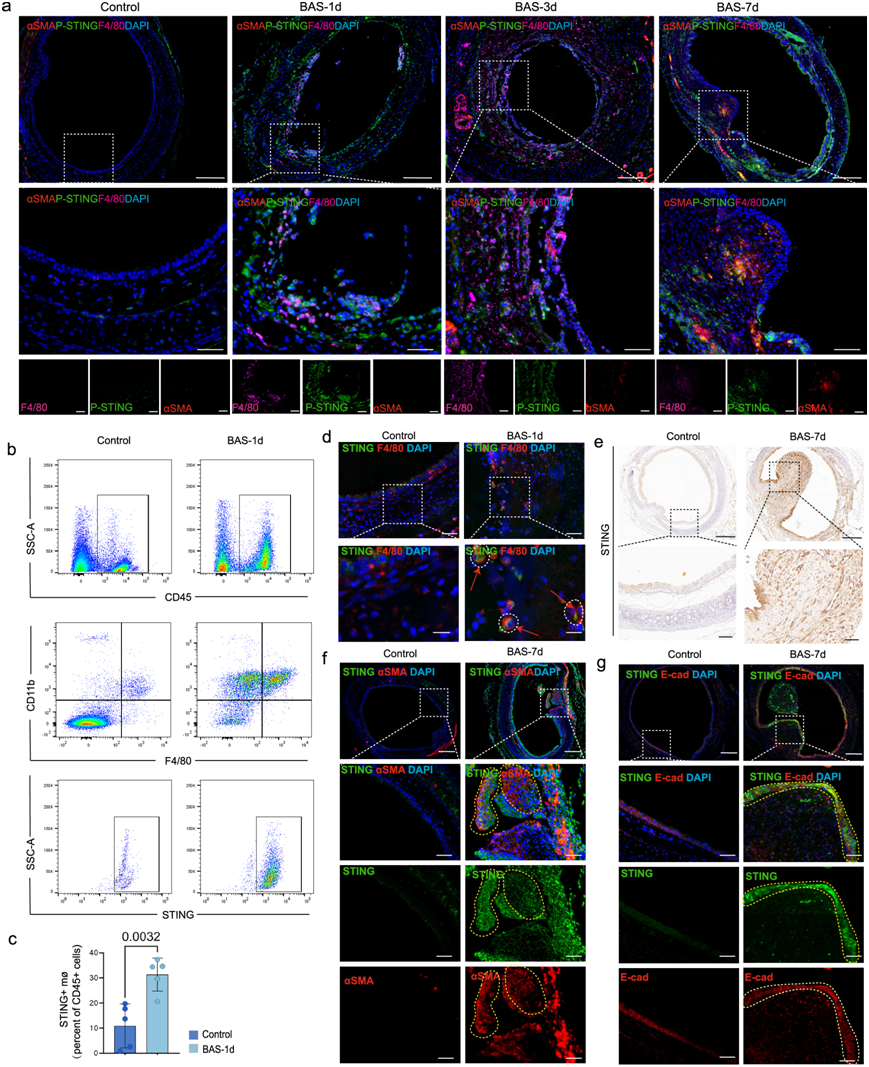
图3. STING 在 BAS 的不同阶段表达。
(a) 代表性免疫荧光图像。(b-c) 流式细胞分析图显示气管白细胞(CD45+细胞)中STING+巨噬细胞的百分比。(d) 代表性免疫荧光图像。(e) 免疫组织化学结果表明第 7 天在肉芽阶段的 BAS 小鼠气管中表达 STING。(f-g) 代表性免疫荧光图像。
04
抑制 STING 可减弱 BAS 的发展
为了证实 cGAS-STING 通路对 BAS 进展的影响,他们用 C176 (STING 抑制剂)处理小鼠(图 4a)。免疫印迹分析显示 C176 能够降低 STING 表达和 STING 磷酸化水平(图 4b)。建模后第 7 天,与用 PBS 处理的 BAS 小鼠相比,用 C176 处理的 BAS 小鼠的肉芽组织发育、气道上皮增生、胶原沉积和纤维化程度明显减少(图 4c)。此外,对 LP 厚度的定量评估显示,C176 处理的 BAS 小鼠的 LP 比 PBS 处理的 BAS 小鼠的 LP 更薄(图 4d)。此外,他们在气管损伤后 24 小时给药,发现相同的保护作用。气管损伤7天后STING 敲除(KO)小鼠亦出现相同现象,BAS组气管内肉芽肿性增生程度显著低于WT组(图 4e)。组织病理学分析显示,造模后第7天 STING KO小鼠的LP厚度较WT小鼠降低(图4f)。Masson三色染色显示,BAS的STING基因敲除小鼠胶原纤维表达量低于野生型小鼠(图 4g-h)。对照组野生型小鼠和STING KO小鼠Micro-CT扫描未发现气管狭窄(图 4j-k)。相反,造模后第7天,野生型小鼠和STING KO小鼠气管管腔内均出现可辨别的突起(图 4j-k)。这种异常表明损伤部位局部变窄,这在成像分析中很容易发现。值得注意的是,微 CT 扫描显示,STING 基因敲除小鼠的管腔收缩严重程度明显低于野生型小鼠(图 4i)。这些结果表明,抑制 STING 可减缓气道狭窄的进展,也可能抑制纤维化的进展。
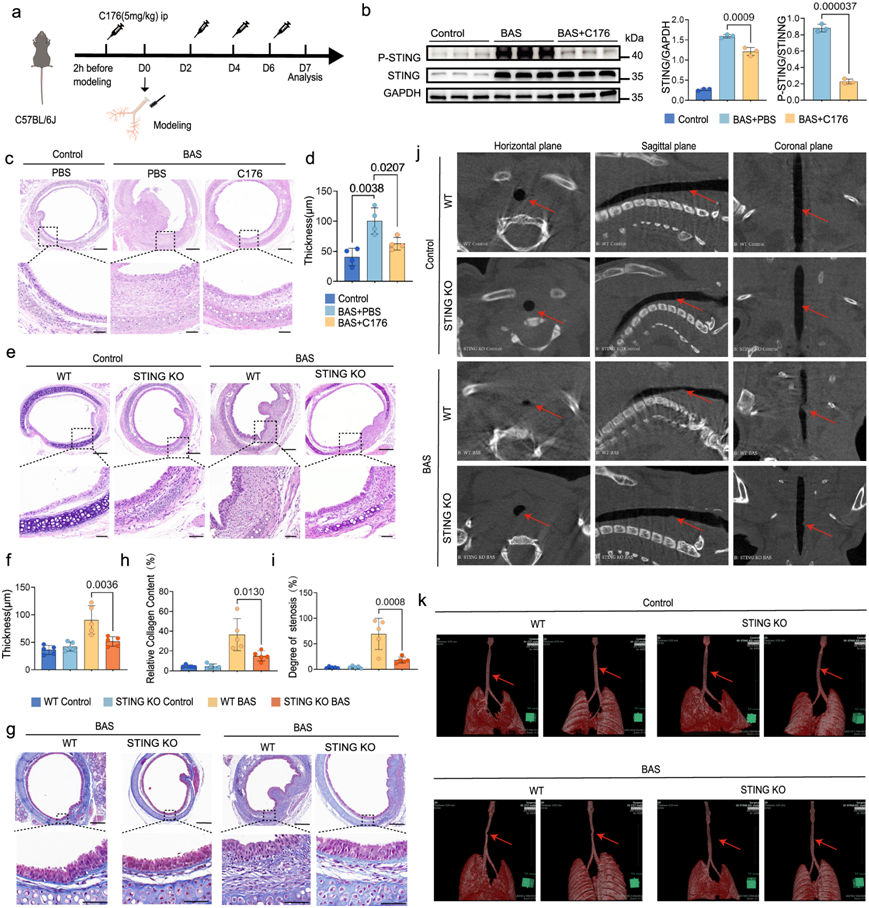
图4. 抑制 STING 可减弱 BAS 的发展。
(a) 小鼠接受 C176 处理的示意图。(b)免疫印迹分析。(c) H &E 染色显示对照组、用 PBS 处理的 BAS 组和用 C176 处理的 BAS 组的气管内和固有层状况 。(d) 定量分析表明,与用 PBS 处理的 BAS 组(每组 n = 4 只小鼠)相比,用 C176 处理的 BAS 组的固有层厚度减少。(e) H & E 染色显示 WT 对照组、STING KO 对照组、WT BAS 组、STING KO BAS 组( 每组n = 5 只小鼠)的气管内和固有层状况。(f) 定量比较STING KO BAS组与WT BAS组( 每组5只小鼠)相比气管LP厚度减少。(g-h) 不同组小鼠气管切片Masson三色染色后,STING KO BAS组与WT BAS组(每组5只小鼠)相比胶原相对含量降低。(i) SYNPASE 3D测量气管狭窄面积CT图,结果显示STING KO BAS组气管狭窄面积明显小于WT BAS组。(j) 不同组别的水平面、冠状面和矢状面微CT扫描,红色箭头表示狭窄部位。(k) SYNPASE 小鼠气管 3D 重建,红色箭头表示狭窄部位。
05
BAS 中的巨噬细胞 STING 表达与炎症有关
目前临床上治疗BAS的主要方法是支气管镜下切除肉芽组织,但可造成继发性狭窄,因此早期干预能有效缓解肉芽组织增生。本研究表明STING在BAS早期急性炎症期及后期慢性炎症期(肉芽增生)均有表达,且已证实STING与炎症密切相关。关键DEG热图显示,与对照小鼠相比,实验小鼠在气管损伤后24h,STING和炎症基因均有高表达(图5a)。为了探讨STING在气道狭窄炎症期的作用,小鼠接受了C176处理(图 5b)。与PBS处理的BAS组相比,C176处理的BAS组的喘息症状在气道狭窄炎症期得到改善,HE染色结果显示C176处理的BAS组气道炎性水肿程度也得到改善(图 5c)。在炎症早期,气道损伤引起气道炎症、水肿,导致气管狭窄,出现喘息。无创肺功能检测显示,C176能有效减少气管损伤后小鼠的吸气时间,从而减轻小鼠的喘息症状(图 5d)。此外,qRT-PCR结果显示,C176处理的BAS组IL6、IL1β、CXCL10的表达量显著低于PBS处理的BAS组(图 5e)。在蛋白质水平上,多因素分析同样表明,注射C176的小鼠气道损伤后炎症因子和炎症相关趋化因子的表达降低(图 5f)。伤口愈合过程中,促炎巨噬细胞起着重要作用,因为它们产生促炎细胞因子,如TNF-a和IL6等促进伤口愈合的介质。对scRNA-seq数据中的巨噬细胞聚类进行单独分析,正常组有1216个细胞,肉芽组织组有4409个细胞(图 5g)。巨噬细胞进一步分为7个功能聚类(Mc1-Mc7)(图 5h)。其中,Mc5、Mc6、Mc7聚类在两组中均有存在。正常组以M2型聚类为主,肉芽组织组以Mc1型聚类为主,有少量Mc3、Mc4型团聚类(图 5i)。Mc1聚类在肉芽组织中的DEG比例最高,其特征基因对应脂质代谢、调节炎症反应和促进组织修复。GO分析排名前5的生物学过程也主要与炎症、免疫和脂质代谢有关(图 5j-k)。正常组大部分的Mc2聚类高表达MRC1,提示其为组织滞留的巨噬细胞,GO分析显示两者主要存在翻译相关性(图 5j-k)。肉芽组织中的Mc3和Mc4聚类呈现促炎特征,标志基因主要为早期炎症基因(IL1B)和警示蛋白(S100a8和S100a9)。Mc3和Mc4聚类的GO分析表明这些聚类主要与炎症和免疫有关。此外,VCAN标记基因表明 Mc3 和 Mc4 聚类主要位于细胞外基质中(图 5j-k)。IRF4是一种巨噬细胞极化基因,是 M5 聚类的标记基因,表明该聚类可能向促修复巨噬细胞极化(图 5j-k)。Mc6聚类显示抗原加工活性并表达与抗原呈递相关的HLA-DQA1、LAMP3和HLA-DOB,且富集的通路包括抗原加工和呈递(图 5j-k)。Mc7 表现出修复和胶原活性,并表达与胶原 ECM(COL1A1和COL4A1)相关的基因以及与组织修复相关的通路(细胞粘附和细胞迁移)富集(图 5j-k)。 Mc7 还表达血管修复相关基因 ( VWF ),表明它也参与肉芽组织中的新血管形成(图 5j)。对各个聚类的 cGAS-STING 通路评分进行评估,结果显示 Mc1、Mc3 和 Mc4 的评分较高(图 5l)。此外,IL6、IL1β和CXCL10等几种炎症因子也主要集中在 Mc1、Mc3 和 Mc4 聚类中(图 5m)。由于 Mc1、Mc3 和 Mc4 巨噬细胞主要与炎症有关(图 5j-k),cGAS-STING 通路评分高的巨噬细胞聚类可能与炎症有关。总体而言,这些发现表明,在气道损伤的早期阶段,气道内巨噬细胞中的 STING 激活会促进炎症因子的表达。
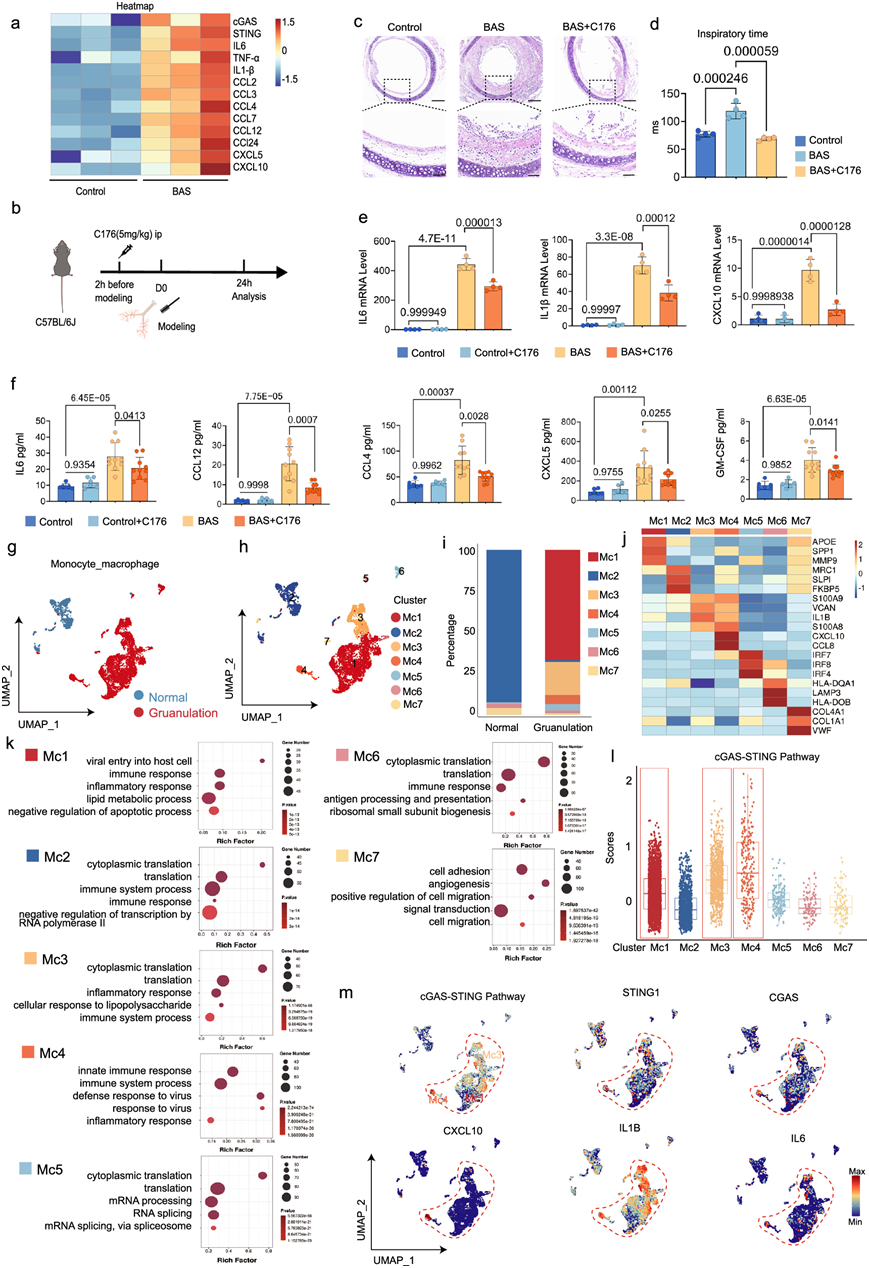
图5. BAS 中巨噬细胞中的 STING 表达与炎症有关。
(a) 热图显示气管损伤24小时后,与对照组相比, BAS组上调了与cGAS、STING 和炎症因子有关的基因。(b) 小鼠接受 C176 处理的示意图。(c) 不同组H& E染色的代表性图像。(d) 不同组(每组n = 4 只小鼠)肺功能指标(吸气时间)的定量比较 。(e) 不同组(每组n = 4 只小鼠)气管中IL6、IL1β和Cxcl10的 mRNA 水平 。(f) 不同组别气管炎症因子(IL6、CCL12、CCL4、CXCL5 和 GM-CSF) 的蛋白质水平。(g-h)UMAP可视化。(i) 正常组和颗粒化组中每种类型百分比的条形图。(j) 每种细胞类型的三个代表性标记基因的表达热图。(k)GO分析。(l) 箱线图显示所有聚类中的 cGAS-STING 通路得分。(m) UMAP可视化 cGAS-STING 通路得分以及所有聚类中STING、cGAS、IL1B、IL6和CXCL10的表达。
06
巨噬细胞通过 IL6-STAT3 轴促进成纤维细胞活化
使用MSigDB标志基因集进行基因集富集分析(GSEA)显示,与正常组相比,肉芽组织组主要富集炎症相关途径、细胞生长相关途径和氧化应激相关通路(图 6a)。在这些通路中,IL6-STAT3通路与肉芽组织有关(图 6b),且已证明与纤维化有关。最近有报道称STAT3在BAS患者气管肉芽组织中高表达。接下来,本研究从scRNA-seq数据中进行分析,发现JAK-STAT通路主要与成纤维细胞有关(图 6c)。免疫组织化学分析表明,与正常气道相比,BAS患者的肉芽组织中STAT3和STING磷酸化水平较高(图 6d)。高 cGAS-STING 通路评分主要集中在免疫细胞上,例如巨噬细胞、T 细胞和中性粒细胞(图 2h)。根据 CellPhoneDB 配体-受体分析,与 T 细胞和中性粒细胞相比,巨噬细胞与成纤维细胞强烈相互作用(图 6e)。通过 scRNA-seq 评估IL6表达水平,结果显示巨噬细胞、SMC、成纤维细胞和内皮细胞中IL6表达增加。在四个聚类中评估了同时表达STING和IL6 的细胞,这表明STING和IL6表达之间最强的相关性是在巨噬细胞聚类中。为了研究巨噬细胞与成纤维细胞的关系,用氯膦酸盐脂质体处理小鼠(图 6f)。流式细胞分析显示,在炎症期,注射PBS的BAS组的巨噬细胞浸润明显多于注射PBS的对照组,但注射氯膦酸盐脂质体后,BAS组的巨噬细胞比例与PBS组相比明显降低。组织学结果显示,注射氯膦酸盐脂质体后,第7天BAS组小鼠气管内肉芽肿性增生较PBS注射组明显受到抑制(图 6g)。且氯膦酸盐脂质体处理的BAS组的LP厚度明显小于PBS处理的BAS组(图 6h),探讨抑制气管损伤后第14天BAS纤维化过程的潜在治疗益处。PBS处理的BAS组出现气管环纤维化瘢痕形成,而氯膦酸盐脂质体处理的BAS组气管损伤部位并未出现过多纤维沉积,而是呈现气管刚受伤的状态(图 6g)。且氯膦酸盐脂质体处理的BAS组的LP厚度仍低于PBS处理的BAS组(图 6h)。Micro-CT数据显示,注射氯膦酸盐后,小鼠气管内增生性肿瘤生物明显变小(图 6i-j)。接下来,分析了水平方向气管狭窄程度,结果显示氯膦酸盐脂质体处理的BAS组的狭窄程度小于PBS处理的BAS组(图 6k)。因此,这些结果表明巨噬细胞耗竭会减缓BAS的进展,这表明巨噬细胞可能在BAS的纤维化中发挥重要作用。为了研究巨噬细胞在BAS纤维化中的作用,对小鼠建模后7天以及氯膦酸盐脂质体注射组小鼠建模后7天进行了RNA-seq分析。GO分析显示,与对照组相比,PBS处理和氯膦酸盐脂质体处理的BAS组中富集的DEG(例如与细胞外基质组织、细胞粘附、胶原三聚体、含胶原的细胞外基质以及赋予拉伸强度的细胞外基质结构成分相关的基因)主要与纤维化相关;然而,氯膦酸盐脂质体注射组的富集程度低于PBS注射组。RNA测序结果的热图显示,与对照组相比,炎症相关基因和纤维化相关基因的表达显显著上调,但氯膦酸盐脂质体处理的BAS组的上调程度低于PBS处理的BAS组。 KEGG 基因集的 GSEA 表明,在施用氯膦酸盐脂质体后,细胞浆 DNA 传感通路、NFkb 通路以及与组织修复相关的通路(如 ECM 受体相互作用和细胞粘附)的富集减少。值得注意的是,Masson 染色结果显示,与用 PBS 处理的 BAS 组相比,用氯膦酸盐脂质体处理的 BAS 组的胶原纤维再沉积水平较低(图 6l-m)。免疫荧光结果显示BAS组SMA和collagen-1表达水平明显升高;然而,氯膦酸盐脂质体处理的BAS组的SMA和collagen-1表达水平低于PBS处理的BAS组(图 6n-o)。这些数据表明STAT3在BAS的进展中起着重要作用。RNA-seq结果显示,与PBS处理的BAS组相比,氯膦酸盐脂质体处理的BAS组中IL6-STAT3通路的富集程度降低(图 6p)。
接下来,他们研究了巨噬细胞对STAT3的作用。巨噬细胞耗竭后,BAS小鼠气管中IL6的表达水平和STAT3磷酸化水平明显低于PBS处理的BAS组(图 6q-r)。这些数据表明巨噬细胞耗竭有利于减轻 BAS 的纤维化过程,并且巨噬细胞和成纤维细胞之间的相互作用是通过 IL6-STAT3 信号通路介导的。
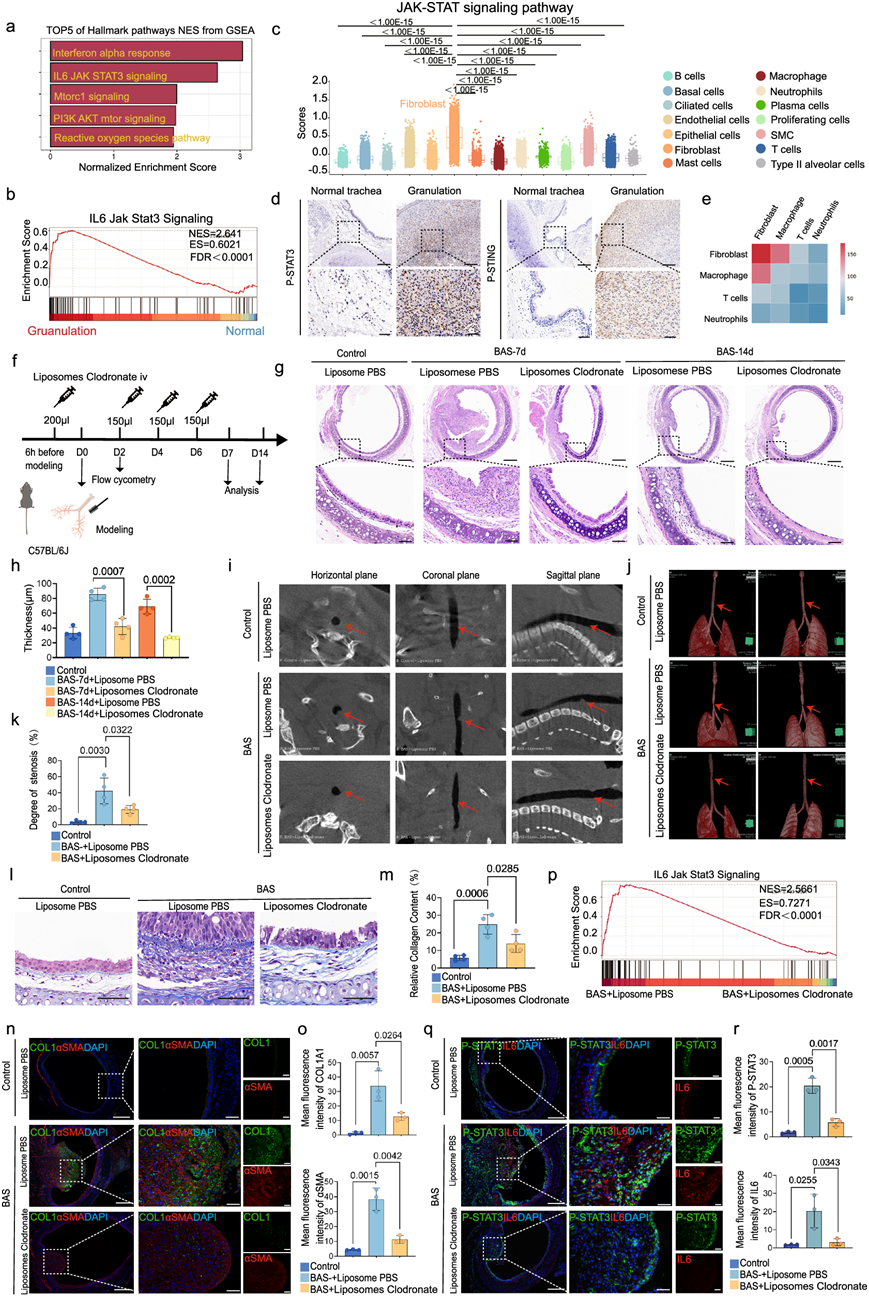
图6. 巨噬细胞通过 IL6-STAT3 轴促进成纤维细胞活化。
(a) GSEA 分析显示与正常组相比,颗粒化组中 TOP5 标志性通路富集。(b) GSEA分析显示,颗粒化组中 IL6 jak STAT3 通路富集。(c) 箱线图显示正常组和肉芽组织组所有聚类中的JAK-STAT 通路评分。(d) P-STAT3 和 P-STING 免疫组织化学染色的代表性图像。(e) 热图显示了巨噬细胞、T 细胞、中性粒细胞和成纤维细胞之间的配体-受体相互作用。(f) 小鼠服用氯膦酸盐脂质体的示意图。(g) 第7 天和第 14 天不同组 H&E 染色的代表性图像。(h) 不同组 LP 厚度的定量分析。(i) 不同组的水平、冠状面和矢状面的微型 CT 扫描。(j) SYNPASE小鼠气管的 3D 重建。(k) 各组(每组4只小鼠)面积定量分析。(l) 各组Masson染色代表性图像。(m) 各组(每组4只小鼠)胶原面积 定量分析。(n-o) 代表性气管免疫荧光图像及αSMA(红色)和COL1(绿色)平均荧光强度 。(p) GSEA分析显示BAS +PBS组IL6 jak STAT3通路富集。(q-r) 不同组的代表性气管免疫荧光图像和 P-STAT3(绿色)和 IL6(红色)的平均荧光强度。
07
气管 DNA 激活巨噬细胞中的 STING 通路
细胞死亡释放的dsDNA可激活巨噬细胞中的STING,促进炎症因子的释放。本研究证实气管损伤后有大量dsDNA释放,且气管损伤24小时后存在多种与DNA损伤修复相关的高表达通路(图 7a)。通常与DNA损伤相关的标记物γH2AX在建模过程后24小时鉴定,其主要在损伤后气管上皮中表达(图 7b)。免疫荧光染色显示,受损气管中巨噬细胞标记物F4/80与游离dsDNA、cGAS以及P-STING共定位(图 7c)。为了研究游离dsDNA是否在气管损伤后起到募集巨噬细胞的作用,用DNase I处理小鼠。使用DNase I后,小鼠气管灌洗液中dsDNA含量明显降低,且小鼠气管损伤后的炎症和水肿程度也得到改善。免疫荧光和流式细胞分析表明,使用DNase I后,小鼠气管内巨噬细胞浸润明显减少。接下来用死亡上皮细胞上清(DECS)培养BMDM(图 7d),紫外线诱导上皮细胞死亡后,DECS中含有大量的dsDNA(图 7e-f)。此外,用DECS培养24小时后,BMDM中STING磷酸化水平明显升高(图 7g-h)。小鼠造模24小时后采集气管DNA,随后激活BMDM(图 7i)。免疫印迹分析显示,转染气管DNA后,BMDM中STING磷酸化水平升高(图 7j-k)。此外,免疫荧光分析显示,转染气管DNA后,BMDM中P-STING表达水平升高,而用DNase I处理后,P-STING表达水平降低(图 7l-m)。ELISA结果显示,转染气管DNA后,BMDM培养上清液中IL6浓度显著升高(图 7o)。qRT-PCR分析表明,转染DNA的BMDM在用STING抑制剂C176处理后,IL6表达水平显著降低(图7p)。总之,这些结果表明抑制STING也能降低STAT3磷酸化水平。免疫荧光分析表明,在BAS的STING KO小鼠的气管中,IL6和STAT3的表达明显低于BAS的野生型气管(图 7q-r)。因此,这些发现表明,抑制巨噬细胞中的STING会导致IL6表达降低,从而通过抑制成纤维细胞中的STAT3活化来抑制纤维化。随后,将BMDM与成纤维细胞共培养,并使用气管DNA激活BMDM中的STING(图 7s)。免疫荧光分析显示,与对照组相比,共培养组成纤维细胞P-STAT3及αSMA表达增多,而DNA转染的BMDM与成纤维细胞共培养中加入C176后,P-STAT3及αSMA表达降低(图 7t-u)。这些结果提示,气管损伤后释放的dsDNA激活巨噬细胞中的STING通路,促进IL-6炎症因子的表达,进一步激活成纤维细胞中的STAT3表达,从而促进成纤维细胞活化,加速良性气道狭窄患者纤维化。
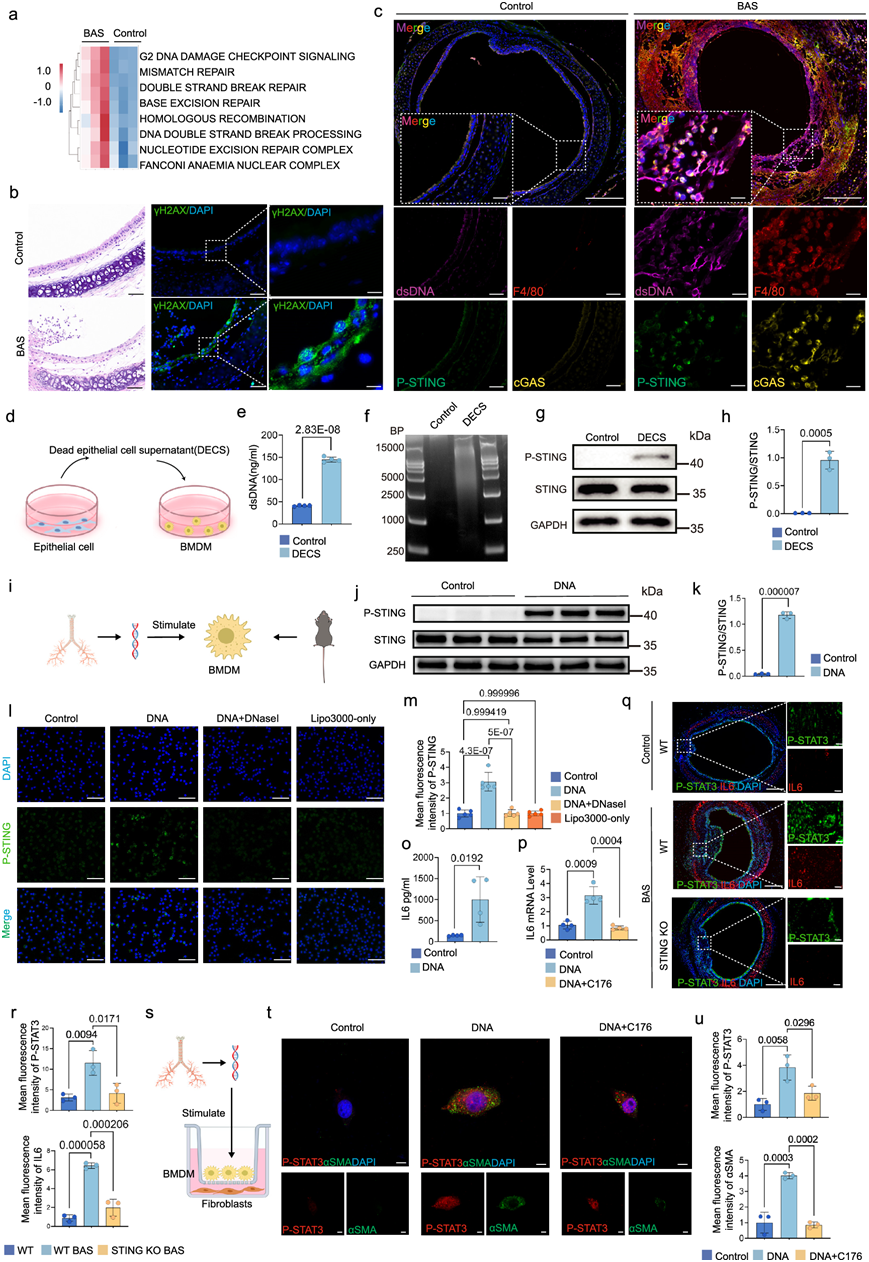
图7. dsDNA 激活巨噬细胞中的 STING 通路,从而通过 IL6-STAT3 轴促进成纤维细胞活化。
(a)GO分析。(b-c) H&E染色和免疫荧光代表性图像 。(d) 使用DECS刺激BMDM的示意图。(e) 对照组和DECS组细胞培养上清液中 dsDNA 的定量分析。(f) 对照组和 DECS 组细胞上清液的 AGAR 凝胶电泳代表性图像。(g-h) 用或不用 DECS 刺激的BMDM组磷酸化 STING 的蛋白质水平。(i) 用 lipo3000 转染小鼠气管 DNA 刺激的 WT 小鼠 BMDM 示意图。(j-k) 用或不用 DNA 刺激的 BMDM 组磷酸化 STING 的蛋白质水平。(l) BMDM中 P-STING(绿色)的代表性免疫荧光图像。(m-n) P -STING 相对平均荧光强度的定量分析。(n) 用或不用 DNA 刺激的 BMDM 组上清液中的 IL6 蛋白水平。(o) 用或不用 DNA 刺激的 BMDM 组上清液中的 IL6 蛋白水平。(p) 对照组、DNA 刺激组和用C176 处理的 DNA 刺激组中IL6的 mRNA 水平。(q-r) 不同组(每组n = 3 只小鼠)的代表性气管免疫荧光图像和 P- STAT3(绿色)和 IL6(红色)平均荧光强度的定量分析。(s) 体外共培养模型的示意图。(t-u) 成 纤维细胞中P -STAT3(红色)和 αSMA(绿色)的代表性免疫荧光图像和平均荧光强度的定量分析。
+ + + + + + + + + + +
结 论
本研究证明 cGAS-STING 信号参与了 BAS,伴随着 dsDNA 的增加、STING 的表达和激活。STING 抑制或缺陷可通过减少急性和慢性炎症有效缓解 BAS 小鼠的气管纤维化。巨噬细胞耗竭也能有效改善 BAS。从机制上讲,受损上皮细胞的 dsDNA 激活巨噬细胞的 cGAS-STING 通路并诱导 IL-6 激活 STAT3 并促进纤维化。总之,目前的结果表明 cGAS-STING 信号诱发急性炎症并增强与良性气道狭窄相关的慢性炎症和气管纤维化,突出了 BAS 的机制和潜在的药物靶点。
+ + + + +



 English
English


