文献解读|Cancer Cell(48.3):组成型干扰素高免疫表型决定了结直肠癌对免疫治疗的反应
✦ +
+
论文ID
原名:A constitutive interferon-high immunophenotype defines response to immunotherapy in colorectal cancer
译名:组成型干扰素高免疫表型决定了结直肠癌对免疫治疗的反应
期刊:Cancer Cell
影响因子:48.3
发表时间:2025.01.16
DOI号:10.1016/j.ccell.2024.12.008
背 景
基于免疫检查点抑制 (ICI) 的癌症治疗彻底改变了晚期或转移性错配修复缺陷 (dMMR) 或微卫星不稳定性高 (MSI-H) 结直肠癌 (CRC) 患者的治疗,显著提高了他们的无进展生存期 (PFS)。dMMR CRC 的高肿瘤突变负担 (TMB) 有利于对 ICI 的反应,因为大量的新抗原有利于免疫浸润。然而,只有不到 50% 的晚期或转移性 dMMR CRC 患者有反应。此外,目前大约 90% 的具有错配修复机制的 CRC (pMMR CRC) 不适合 ICI。因此,迫切需要针对 TMB 并适用于两种 CRC 亚型的免疫治疗反应预测标志物。
实验设计
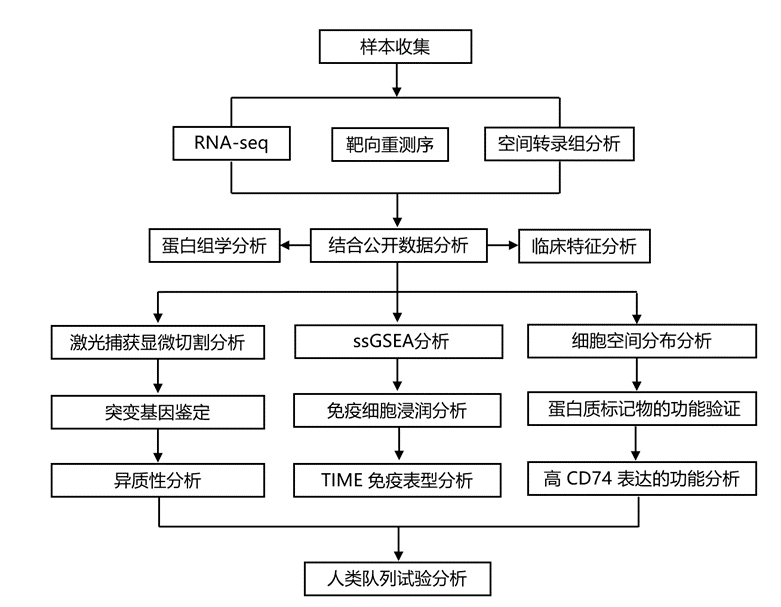
结 果
01
CRC 亚型表现出较高的跨区室转录组异质性
研究团队从 28 名 dMMR 和 30 名 pMMR CRC 患者中收集了 59 个肿瘤块组织(图 1 A),这些患者的年龄和肿瘤分期分布相似(图 S1 A)。正如预期的那样,pMMR CRC 在左侧肿瘤和肝转移的男性患者中普遍存在(图 1 A)。23 名 dMMR CRC 患者(24 个肿瘤)在晚期或转移性环境中接受了抗 PD-1 ICI 治疗,并分为有反应者或无反应者(图 1 A)。
使用 324 个癌症相关基因的共识(图 S1 B),他们检测了 TMB 并确定了每种肿瘤的主要遗传驱动因素。正如预期的那样,dMMR CRC 中的 TMB 总体较高(图 1 A),并且两种亚型中反复改变的基因与之前的研究结果一致(图 1 A)。在通路水平上,KRAS、染色质、干扰素 (IFN) 和缺氧通路在 dMMR CRC 中积累了更多突变(图 S1 C)。染色质相关基因在 dMMR CRC 中普遍发生改变,但在 pMMR CRC 中没有,这与最近的观察结果一致,这证实了这两个队列总体上代表了 dMMR 和 pMMR CRC 遗传学。
接下来,他们分析了通过激光捕获显微切割 (LCM) 在肿瘤核心和侵袭边缘分离的肿瘤上皮 (Te) 、肿瘤相关基质 (Ts) 和相邻正常上皮 (Ne) 的基因表达谱(图 1 B)。为了最大限度地增加从低输入 RNA (< 2 ng) 中检测到的基因数量,他们将每个样本的两个独立文库的转录组分析(RNA-seq)读数连接起来,并在测序批次之间平衡 CRC 亚型和组织区室(图 S1 D)。该优化方案产生的每个样本的基因中位数约为 11500 个(图 1 C),并确认无需进一步进行批次校正(图 S1 E)。
在 Ts 和 Te 中,pMMR CRC 表达的基因数量始终高于 dMMR CRC(图 1 C),这可能是因为它们具有干细胞样表型和发育潜力。Ts和Te 转录组谱之间的差异大于 CRC 亚型之间的异质性(图 1 D),而 dMMR CRC 显示出比 pMMR CRC 更高水平的转录组多样性(图1 E)。有趣的是,核心和侵袭边缘的转录组是混合的(图 1 F)。为了进一步研究这一点,他们对它们的整体基因表达谱进行了层次聚类。大多数样本按患者而不是区域聚类(图 S1 F),证实肿瘤间转录异质性大于区域间差异。
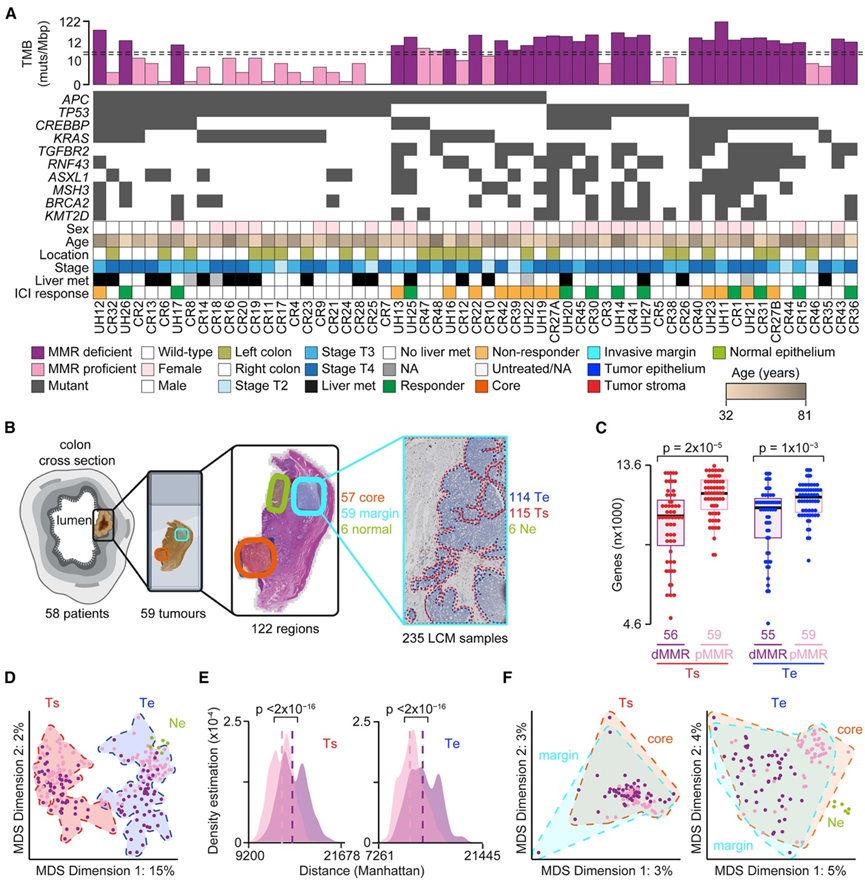
图1. pMMR 和 dMMR CRC 的突变和基因表达谱。
(A) Oncoplot 显示本研究中分析的 CRC 的十个最常突变基因、TMB 分布和基线临床特征。(B) LCM 实验设计。(C) 在 dMMR 和 pMMR CRC 的 Ts 和 Te 中检测到的基因分布。(D) 整体基因表达谱的 MDS。(E) dMMR 和 pMMR CRC 的 Ts 和 Te 样本之间的成对距离密度图。(F)按 CRC 亚型着色的 Ts 和 Te 样本的 MDS。
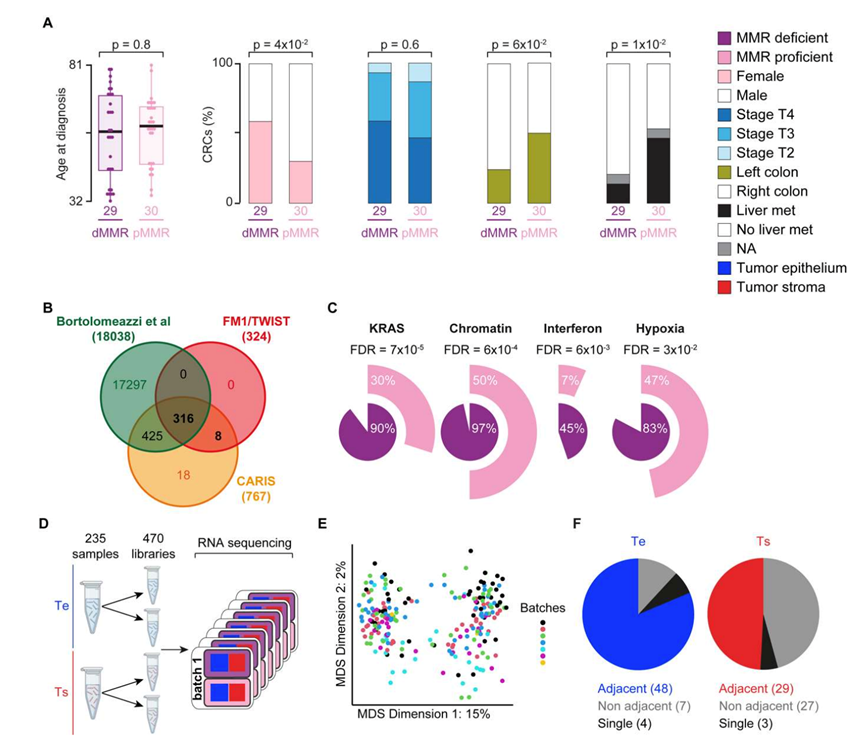
图S1. dMMR和pMMR crc的分子和临床比较。
(A) dMMR和pMMR CRC的临床特征。(B) 用于靶向重测序的基因组合的交集。(C) dMMR和pMMR CRC之间通路的差异改变。(D)RNA-seq方案。(E) 所有235个Ts和Te样品的全局基因表达谱的MDS通过测序批次着色。(F) Te(左)和Ts(右)分层聚类中相邻或不相邻的同一肿瘤的核心和浸润边缘区域样本的比例。
02
CRC 亚型表现出不同的肿瘤-肿瘤免疫微环境 (TIME)相互作用模式
为了比较两种 CRC 亚型中 Te 和 Ts 之间的相互作用,他们应用了单样本基因集富集分析 (ssGSEA) 技术,纳入了 29 个手动整理的基因特征,其中包括 14 个基因列表,捕获了主要的 CRC 内在程序。除 IFNα 反应外,核心和侵袭性边缘区域之间内在特征的归一化富集分数 (NES) 分布没有显著差异,证实了它们的区域间转录异质性较低(图 1 E,图S1 F)。因此,他们将核心和侵袭性边缘 NES 值的平均值视为整个 Te 的代表。 Te 和 Ne 之间有 13 个内在特征显著不同(图 S2 A),这与它们转录组的明显分离相符(图 1 E),而 dMMR 和 pMMR Te 之间有 9 个内在特征显著不同(图 2 A)。dMMR CRC 中的 IFN 反应和 STING 激活更高,反映了它们更丰富的免疫浸润和持续的 DNA 损伤通过 cGAS-STING 促进 IFN 信号传导。虽然dMMR 和 pMMR CRC 之间的突变频率不同,但 KRAS 和转化生长因子 β (TGFβ) 具有相似的 NES 分布,而 BRAF、WNT、缺氧和突变型TP53通路的激活水平反映了它们不同的突变谱(图 2 A)。pMMR CRC 显示出更高的干性特征,与它们的干性表型一致。这些结果证实,即使在转录组水平上,本研究队列也代表了 dMMR 和 pMMR CRC。
接下来,他们使用 15 个来自公开的基因特征分析了免疫细胞浸润和相关功能,例如 IFN 产生,这些基因特征在内部得到了广泛的验证(图 S2 B)。同样,他们发现核心区域和侵袭性边缘区域之间的免疫浸润没有显著差异,并将两个区域的平均 NES 值作为整个 T细胞的代表。与其较高的免疫浸润一致,大多数免疫特征在 dMMR CRC 中显著富集(图 2 B)。免疫 NES 值呈正相关(图 2 C),表明广泛的免疫共浸润。为了研究肿瘤和免疫细胞之间的相互作用,他们检测了内在和外在特征之间的相关性。IFN 反应和 STING 激活与整体(图 2 D)和每个亚型(图 S2 C)的免疫浸润呈正相关,表明肿瘤 IFN 反应由 TIME 诱导。突变型TP53、TGFβ 和 WNT 特征与整体 IFN 产生和免疫浸润呈负相关(图 2 D),而 BRAF 和 TGFβ 程序显示出亚型特异性免疫抑制作用(图 S2 C)。
通过量化 Te 中的免疫特征,Ts 和 Te 分离使得能够比较上皮内 (IE) 免疫浸润水平。为了增加 IE 对 Ts 免疫细胞的贡献,他们将分析限制在肿瘤纯度 < 98% 的 CRC。dMMR CRC Te 中的NK 细胞、细胞毒性淋巴细胞和 CXCL10+ TAM 特征始终较高(图 2E-F)。这些 IE 浸润的富集分数与大多数 Ts 免疫群体的富集分数呈正相关(图 S2 D),表明其来源于基质而非组织驻留。作为进一步支持,他们用 TAM (CD68)、NK (CD57) 和细胞毒性 (GZMB) 细胞标记物对代表性 CRC 载玻片进行染色。在所有情况下,他们都观察到了阳性 IE 染色(图 2 G)。此外,阳性免疫细胞的比例与相应人群的 NES 值呈正相关,证实了根据基因表达特征进行细胞估计的可靠性。
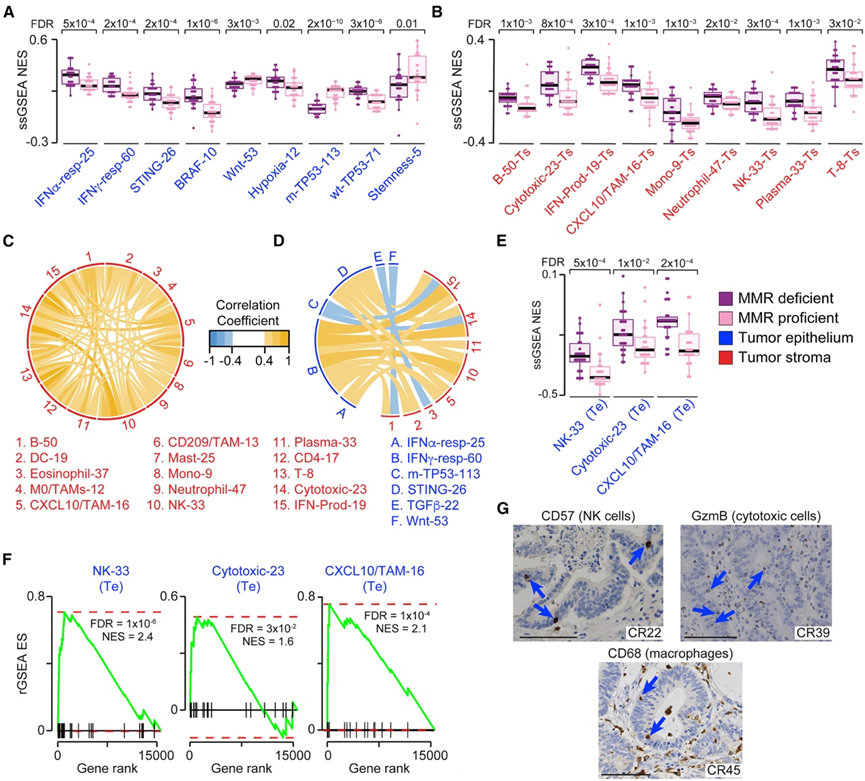
图2. CRC 亚型的肿瘤内在和外在特性。
(A-B) dMMR 和 pMMR CRC 之间内在和外在特征的 NES 分布比较。(C-D) 整个 CRC 队列中,外在-外在和内在-外在成对 NES 相关性显著。(E) dMMR 和 pMMR CRC 中 IE NK 细胞、细胞毒性淋巴细胞和 CXCL10+ TAM 的 NES 分布。(F) Te 中的 NK 细胞、细胞毒性淋巴细胞和 CXCL10+ TAM 特征的 rGSEA 图。(G) CD57、GZMB 和 CD68 免疫染色的代表性阳性细胞。
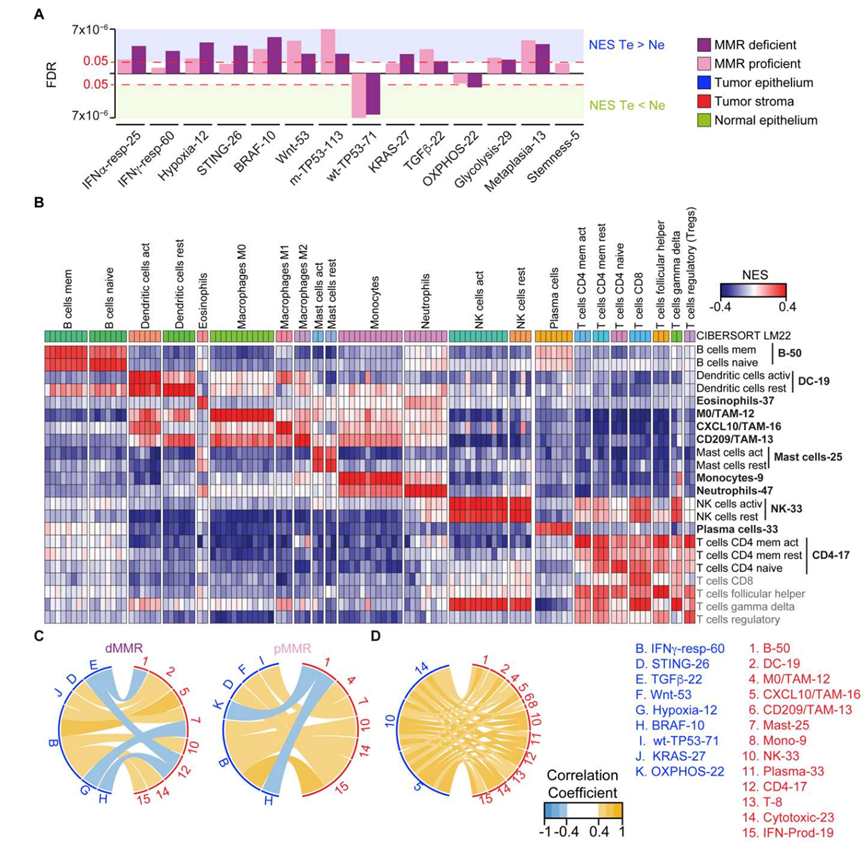
图S2. dMMR和pMMR CRC的内在和外在性质。
(A) dMMR和pMMR CRC中Te和Ne的内在Ne分布比较。(B) 22个CIBERSORT-LM22 [S3]免疫人群的免疫特征NES值热图。(C) 在dMMR(左)和pMMR(右)中,内在(蓝色字母)和免疫(红色数字)信号的NES值显著相关。(D) Te中NK细胞、细胞毒性淋巴细胞和CXCL10+ TAM标签的NES值与整个CRC队列中Ts中所有免疫标签的NES值显著相关。
03
TIME 免疫表型根据 CRC 对抗 PD-1 ICI 的反应进行分层
CRC 亚型之间的 TIME 比较始终表明,基质和 IE NK 细胞、细胞毒性淋巴细胞以及 CXCL10 + TAM 浸润的丰度存在差异,从而触发肿瘤中的 IFN 反应和 STING 激活。使用这七个特征的 NES 值进行层次聚类将整个队列分为四个不同的聚类(图 3 A)。聚类 A 主要由 dMMR CRC 组成,具有最高的免疫浸润和相关肿瘤反应,而聚类 B 具有高基质但较低的 IE 浸润和肿瘤反应,并且是两种亚型的混合。聚类C 和 D 显示出较低水平的免疫浸润和肿瘤反应。与此一致的是,聚类 A 和 B 的IFNG(编码干扰素 γ)表达明显高于聚类 C 和 D(图 3 B)。因此,他们将样本分为 IFN 高和 IFN 低免疫表型 (IP) CRC (图 3 A-C)。IFN-high IP 占 pMMR CRC 的 20% 左右(图 3 A)。他们将 iCMS 分类应用于本研究队列。IFN-high CRC 在 iCMS3_MSI 和 iCMS3_MSS_F 类中显著富集,它们具有最高的 IFN 反应和免疫细胞毒性水平。因此,本研究鉴定的特征可以在独立的 CRC 队列中一致地鉴别相似的 IP,并且这些 IP 与与 IFN 反应相关的外部分类显著重叠。
除了用于聚类的 7 个特征外,IFN-high IP 肿瘤在几乎所有其他免疫群体中都有富集,支持广泛的免疫共浸润。IFN-high和IFN-low IP CRC 之间的 TMB 没有差异(图 3 D),证实免疫浸润不是由肿瘤免疫原性水平触发的。在对抗 PD-1 ICI 有反应的 dMMR CRC 患者中,高 IFN IP 肿瘤明显过多(图 3 E),即使考虑到所有 pMMR CRC 都可能是无反应者,富集仍然很显著(图 3 F)。有趣的是,肝转移患者中的高 IFN IP CRC 减少了(图 3 G),而肝转移是一种新兴的 ICI 耐药标志物。CD274(编码 PD-L1)表达较低,在 IFN 高 IP dMMR 而非 pMMR CRC 中表现出显著过表达。最近有报道称,SOX17 可抑制早期 CRC 细胞对 IFNγ 的反应能力,从而实现免疫逃避。SOX17基因在Te 中几乎没有表达,他们检测到IFN 高和 IFN 低 IP CRC 之间SOX17表达没有显著差异,这可能表明SOX17在早期和晚期 CRC 中发挥不同的作用。分为 IP 并与对免疫疗法的反应相关联反映了特定的 TIME 特性和相关的肿瘤反应,而不是 CRC 亚型之间的整体差异。
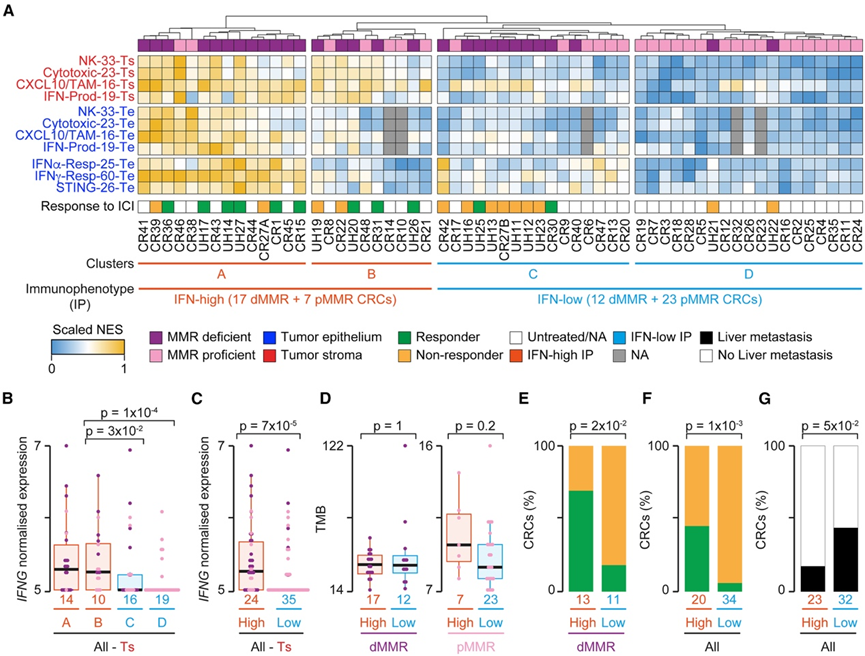
图3. 基于外在属性和内在属性的 CRC 聚类。
(A) 基于 NK 细胞、细胞毒性淋巴细胞、CXCL10+ TAM、IFN 产生和反应以及 STING 激活特征 NES 值对 dMMR 和 pMMR CRC 进行层次聚类。(B-C) 四个 CRC聚类和 IFN-high 和 IFN-low IP CRC之间的基质IFNG表达水平比较。(D) IFN-high和 IFN-low IP CRC 之间的 TMB 比较。(E-F) IFN-high和 IFN-low IP dMMR和所有CRC 之间对 ICI 有反应或无反应的患者比例。(G) IFN-high和 IFN-low IP CRC 中肝转移患者的比例。
04
T 细胞接近性诱导TAM 和肿瘤细胞中CD74上调
为了更好地了解肿瘤细胞与定义IFN-high和IFN-low IP 的三种免疫群(NK 细胞、细胞毒性淋巴细胞和 CXCL10 + TAM) 之间的局部相互作用,他们对两个 ICI 反应性 dMMR (UH20 和 CR36)和两个IFN-high pMMR(CR21 和 CR48)CRC 进行了单细胞空间转录组学分析。为了帮助细胞表型分析和验证基于转录组的细胞聚类,除了核 (DAPI) 和膜标志物(B2M 和 CD298)之外,他们还使用了上皮细胞(泛角蛋白)、TAM (CD68) 和淋巴细胞 (CD45) 的免疫荧光染色。每个样本鉴定出 149645 到 253161 个细胞,将这些细胞分为5-6个聚类(图S4A)。使用基于单细胞 CRC 数据的监督注释,确认髓系和 T/NK 细胞聚类分别主要由 TAM 和 T 细胞组成(图 S4 B)。
根据空间坐标和局部细胞邻域将 T 细胞相邻的 TAM 与其余 TAM 分开后(图 4 A),他们比较了它们的基因表达谱。与 T 细胞相邻的 TAM 显示与抗原加工和呈递 (APP) 和 IFN 应答相关的基因显著上调(图 4 B,图S4 C)。应用类似的方法(图 4 C),他们观察到与基质 T 细胞相比,IE T 细胞中与细胞毒性和耗竭表型相关的基因显著上调(图 4 D)。最后,他们分析了 T 细胞接近性如何改变肿瘤细胞与远离免疫浸润的细胞的基因表达谱(图 4C)。与 TAM 一样,与 T 细胞相邻的肿瘤细胞显著过表达与 APP 和 IFN 应答相关的基因(图 4 E)。为了验证这些发现,他们分析了外部单细胞蛋白质组学 CRC 数据集。同样,HLA-DRA(唯一的 APP 标记)和两种 IFN 刺激蛋白 ICAM1 和 STING 在 TAM 和靠近 T 细胞的肿瘤细胞中更为富集(图 S4 D)。因此,在细胞毒性 T 细胞中局部富集的 TIME 会诱导专业和非专业抗原呈递细胞中 APP 基因的过度表达。。
接下来,他们研究了单一标记物是否可以识别这种指示 IFN-high IP 和对 ICI 的反应的局部 TIME。在 TAM 和 T 细胞相邻的肿瘤细胞中过表达的七个基因中,四个(CD74、CXCL9、CCL5和CXCL10)也在跨组织区室和 CRC 亚型的 IFN-high IP CRC 中持续过表达(图 S4 E),有趣的是,MHC II 类不变链 CD74 是与抗 PD-1 ICI 反应显著相关的 15 个 TAM 蛋白质标记物之一。这15 个基因中有 14 个在至少一个区室或亚型中的 IFN-high IP CRC 中显著过表达(图 S4 F),表明该 TAM 群体可能对应于在 IFN-high IP 中富集的CXCL10 + TAM。具体而言,CD74在 IFN-high IP CRC 的两种亚型和区室中均过度表达(图 4 F),支持基质和上皮表达。与 TAM 相比,肿瘤细胞在空间转录组、LCM和外部单细胞数据中表达的CD74水平明显较低。CD74肿瘤和基质表达呈正相关,表明上皮CD74表达取决于免疫细胞浸润的富集程度。
为了测试 T 细胞接近是否会诱导肿瘤细胞中的CD74,从而支持空间转录组数据,他们比较了其在人类原代活化 CD8 + T 细胞培养的 dMMR(HCT116)和 pMMR(CaCo2)CRC 细胞系中的表达(图 4 G)。与 T 细胞共培养后,CD74表达发生诱导(HCT116 细胞)以及显著增加(CaCo2 细胞)(图 4 H)。肿瘤样本(图 4 E),暴露于活化 CD8 + T 细胞的 HCT116 细胞显示 APP 和 IFN 反应的整体上调(图 4 I)。他们进一步通过用中和抗体阻断 IFNγ来测试CD74表达是否依赖 IFNγ(图4 G),这降低了HCT116 细胞中的CD74表达,但没有降低 CaCo2 细胞中的 CD74。
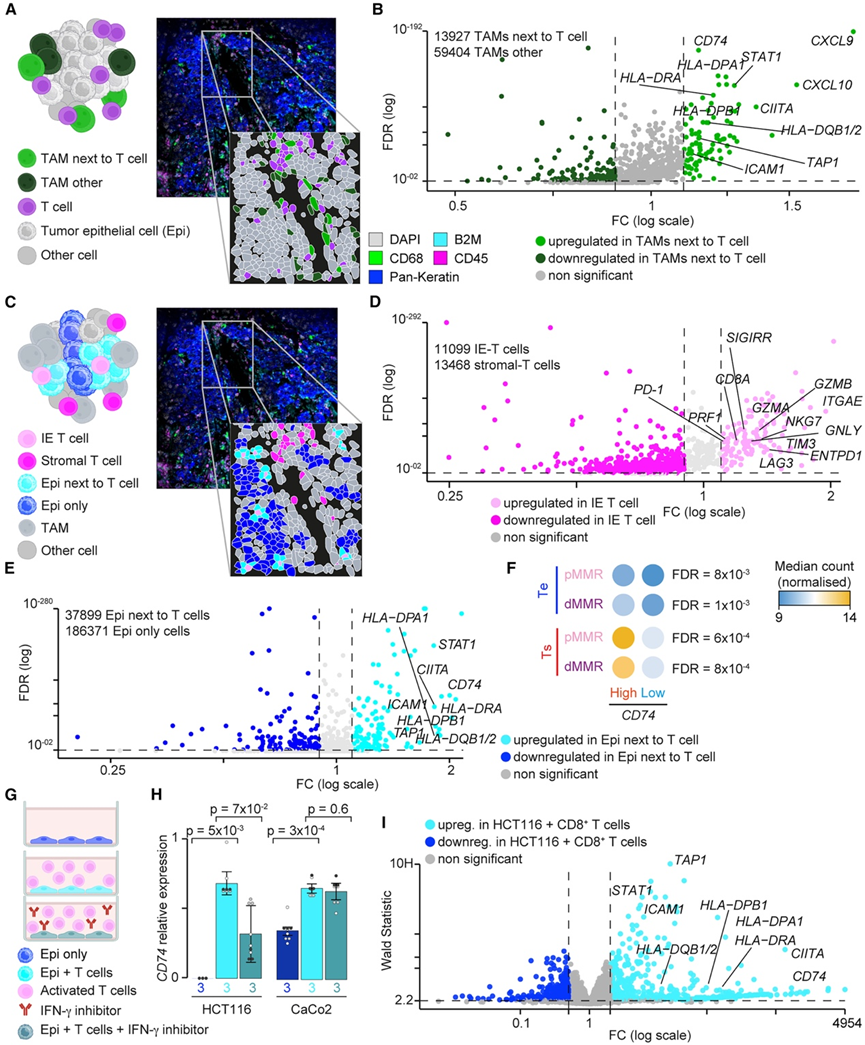
图4. T 细胞诱导的TAM 和 CRC 细胞中CD74过表达。
(A) 按与 T 细胞的接近程度定义的 TAM 表示。(B) T 细胞附近 TAM 中上调和下调的基因。(C) 由局部邻域定义的肿瘤上皮和 T 细胞的表示。(D-E) IE T 细胞和 T 细胞旁上皮细胞中基因上调和下调。(F) IFN-high和 IFN-low IP dMMR 和 pMMR CRC 的 Ts 和 Te 中的CD74中位基因表达水平。(G-H) CRC 细胞系中培养的实验设置和CD74相对表达。(I) 与活化 CD8+ T 细胞一起培养的 HCT116 细胞中基因上调和下调。
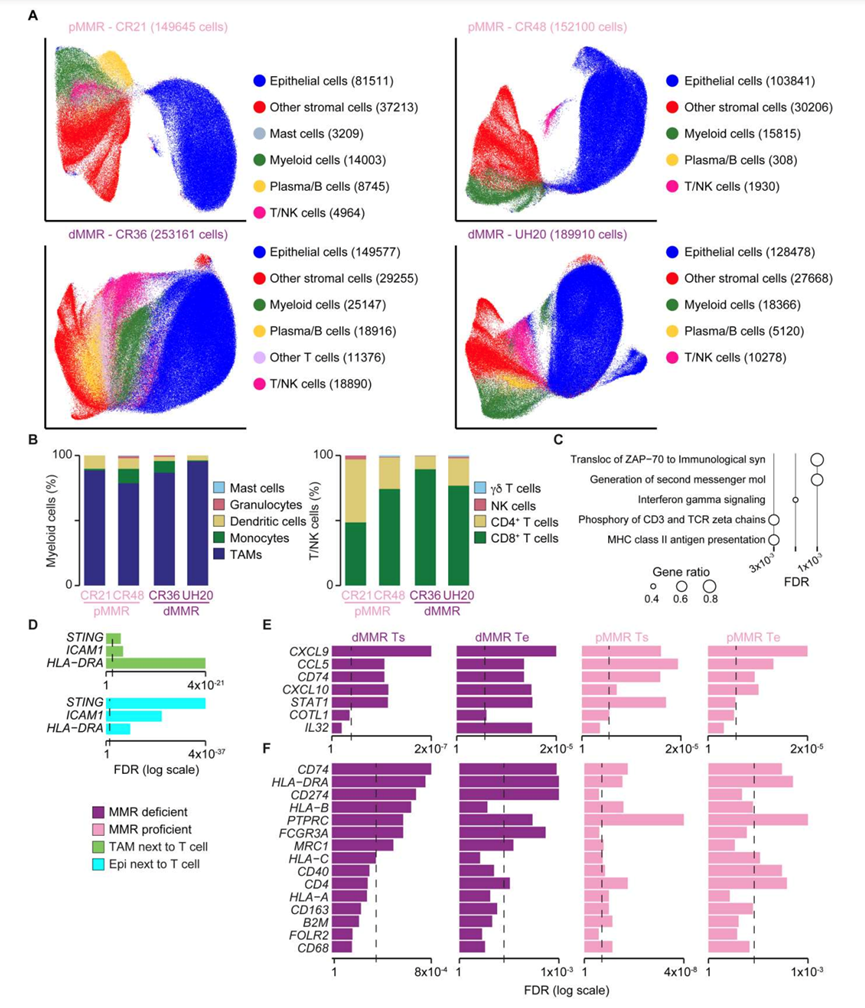
图S4. 单细胞空间转录组聚类和表型。
(A) CosMx样品中单细胞的UMAP图按细胞类型着色。(B) 用单细胞CRC注释的髓系(左)和T/NK细胞(右)亚群的比例数据。(C) 与其他TAM相比,在邻近T细胞的TAM中,94个上调基因显著过表达通路。(D) 从CosMx单细胞蛋白组学CRC数据来看,TAM和T细胞附近上皮细胞中的蛋白显著上调。(E-F) 上皮细胞上调基因和抗pd -1应答相关TAM标志物的基因表达值。
05
高 CD74 表达与 dMMR CRC 中对抗 PD-1 ICI 的反应相关
他们进一步检测了仅通过对肿瘤组织切片进行免疫染色来量化 CD74 蛋白是否能够区分反应者与无反应者。为此,通过四个评分比较了 CD74 +细胞的比例,这四个评分类似于目前在临床病理学中用于量化 PD-L1 +细胞的评分。即他们量化了 CD74 组合阳性评分 (CPS)、基质比例与肿瘤评分 (SPT) 和肿瘤比例评分 (TPS)(图 5 A)。由于 CD74 在 TAM 中高度表达,他们还检测了 CD74 +基质细胞在所有基质细胞中的比例(基质比例评分:SPS)(图 5 A)。
dMMR CRC 应答者的所有 CD74 分数均显著更高,其中 SPS 在两组之间分离效果最佳(图 5 B)。他们使用受试者工作特征 (ROC) 曲线证实了这些结果,并确定 18% SPS 为灵敏度和特异性最好的阈值(图 5 C)。该阈值将 dMMR CRC 应答者与无应答者区分开来(图 5 D),效果甚至比 IP更好(图 3 E)。为他们对另外 43 名接受 ICI 治疗的晚期或转移性 dMMR CRC 患者(GONO 队列)的染色组织切片中的CD74 +细胞进行了分析。与 UCLH 队列一样,GONO 队列中的应答者显示出显著更高的 CD74 SPS 值(图 5 E)。此外,18% CD74 SPS 阈值可以再次显著区分应答者与无应答者(图 5 F)。有趣的是,这些差异甚至在接受抗 PD-1 和抗 CTLA-4 ICI 联合治疗的一组患者中也存在(图 5G-H),这表明,无论药物如何,可能需要高 IFN TIME 才能对免疫疗法产生反应。有或没有肝转移的患者之间的 CD74 SPS 值没有差异(图 5I),这反映了本研究队列和外部dMMR CRC 队列中肝转移的存在与客观反应之间缺乏关联(图 5J)。
虽然病例数少,无法进行适当的统计比较,但在分析转移性而非原发性病变的所有应答者中,CD74 SPS 值均超过 18%。这可能表明,有利于反应的 TIME 特征与部位无关,可能是由原始肿瘤的特性触发的。为了验证这一假设,他们将两种鼠类 CRC 细胞系(CT26 和 MC38)皮下注射到免疫功能正常的同源小鼠体内(图 5 K),然后用抗 PD-1 或 IgG(对照)抗体治疗。虽然TMB(图 5 L)和 MSI 评分(图 5 M)相似,但治疗后他们发现 MC38肿瘤的生长受到显著抑制(图 5 N),但 CT26肿瘤没有(图 5 O)。此外,与 CT26 IgG 治疗的肿瘤相比,MC38 IgG 治疗的肿瘤显示出明显更高的Cd74基因表达(图 5 P)以及明显更高的 CD74 +细胞比例(图 5 Q)。虽然缺少对同一供体内多个部位的比较,但这些数据支持最初的假设,即 CD74 在对抗 PD-1 ICI 有反应的 CRC 中表达更多,与肿瘤部位无关。
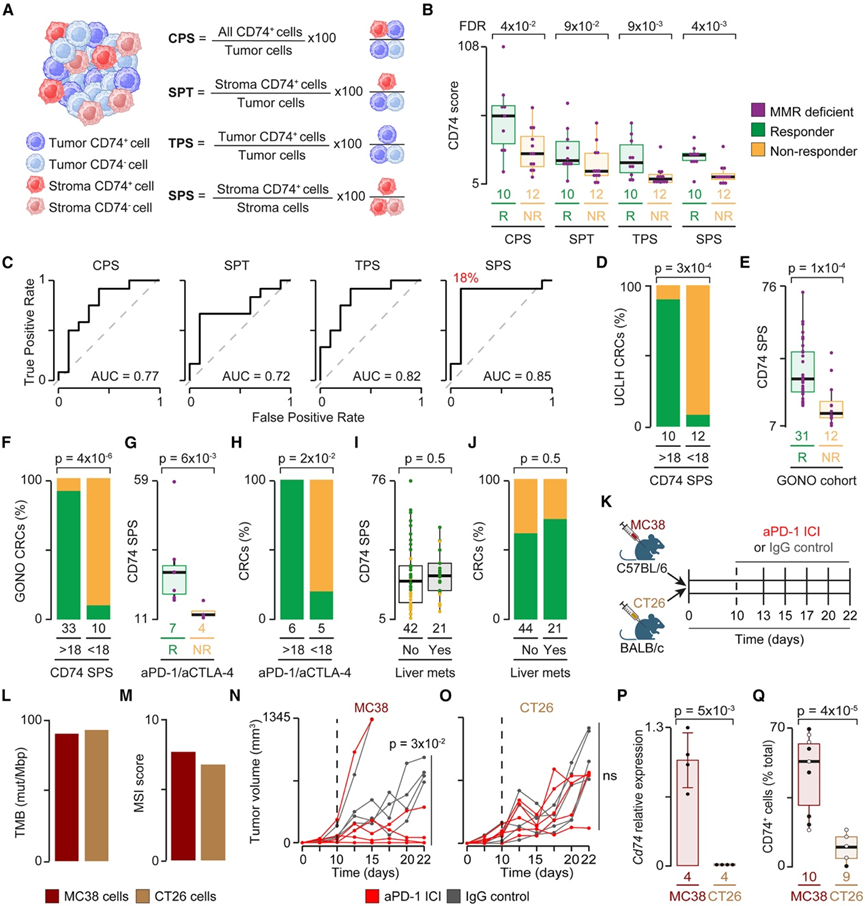
图5. 用抗 PD-1 ICI 治疗的人类和鼠类 CRC 中的 CD74 表达。
(A) 每个组织区室的 CD74 评分示意图。(B) 有反应和无反应 dMMR CRC 中的 CD74 评分分布。(C) ROC 曲线评估 UCLH 队列中四个 CD74 评分的敏感性和特异性。(D) UCLH 队列中 dMMR CRC 应答者和无应答者的比例按 18% SPS 阈值计算。(E) GONO 队列中对 dMMR CRC 有响应和无响应的 CD74 SPS 分布。(F) GONO 队列中 dMMR CRC 应答者和无应答者的比例按 18% SPS 阈值计算。(G) 用抗 PD-1 和抗 CTLA-4 药物联合治疗的应答者和无应答者 dMMR CRC 中的 CD74 SPS 分布。(H) 使用抗 PD-1 和抗 CTLA-4 药物联合治疗的 dMMR CRC 应答者和无应答者的比例。(I) UCLH 和 GONO 队列患者中 CD74 SPS 的分布。(J) UCLH 和 GONO 队列中具有关于存在肝转移信息的患者中反应者和无反应者的比例。(K) 小鼠实验的实验设置。(L-M) MC38 和 CT26 细胞的 TMB和 MSI 得分。(N-O) 肿瘤生长比较。(P) MC38 或 CT26 肿瘤中Cd74 的相对表达。(Q) 用 IgG 抗体处理的 MC38 和 CT26 肿瘤免疫染色中CD74+细胞的比例。
06
高 CD74 SPS 可预测接受 ICI 治疗的 pMMR CRC 患者的临床益处
层次聚类显示,pMMR CRC 子集具有IFN-high IP(图 3 A)。此外,所有这些肿瘤的 CD74 SPS 均高于 18%(图 6 A),且其 CD74 免疫染色与 dMMR CRC 相似(图 6 B),这表明患有 pMMR CRC 和高 CD74 SPS 的患者可能具有对 ICI 起效所需的局部 TIME。目前,抗 PD-1 ICI 单药疗法不用于治疗 pMMR CRC,因为总体反应较低且无法有效地预先识别少数受益患者。为了验证 CD74 丰度是否有助于对 pMMR CRC 患者进行分层,他们分析了两项测试 ICI 与其他疗法联合使用的临床试验的样本。
第一项是 CAMILLA 试验 (NCT03539822),该试验测试了卡博替尼(酪氨酸激酶抑制剂)和度伐单抗(抗 PD-L1 ICI)在化疗难治性胃肠道癌中的应用。他们从 20 名 pMMR CRC 患者的治疗前转移性活检中收集了 GeoMX 空间转录组数据(图 6 C)。经过数据标准化和质量控制后,他们比较了有反应者和无反应者的肿瘤和基质区域中CD74 的表达水平。在两个区域中,有反应者的CD74表达均显著增加(图 6 D),证实了其与反应的相关性。这些样本是接受抗 PD-L1 药物治疗的患者的转移性活检样本,CD74 丰度可能是对 ICI 反应的标志,与药物(图 5 H-I)或肿瘤部位无关(图 5 O-P)。
第二项试验是 AtezoTRIBE 试验 (NCT03721653),旨在评估在 FOLFOXIRI(化疗)和贝伐单抗(抗 VEGF 抗体)中添加阿替利珠单抗(抗 PD-L1 ICI)的临床益处。在研究中,他们对 124 例无法切除的转移性 pMMR CRC 患者的 FFPE 组织切片中的 CD74 SPS 进行了染色和定量,这些患者接受了(实验组)或未接受(对照组)阿替利珠单抗治疗(图 6 E)。97 名患者的一个子集之前已归类为免疫评分-免疫检查点 (IS-IC) 高和低,这是对 PD-L1 +和 CD8 +细胞的空间时间定量,在试验的实验组中显示与 PFS 呈正相关。有趣的是,CD74 SPS 值在高 IS-IC pMMR CRC 中显著较高(图 6 F),表明这两种检测是同一局部 TIME 的标记。
在本试验中, IS-IC(图 S6 A)和 CD74 SPS(图 S6 B 和 S6C)均与客观反应均未显示出显著关联。因此,他们测试了 SPS 是否像 IS-IC 一样可以预测 ICI 治疗后的 PFS。为此,他们使用根据 PFS 中值最能区分 ICI 治疗患者的 SPS 截点将 CD74 SPS 二分为高值和低值。由于切除原发性肿瘤的患者生存期更长,他们将这一组与未切除原发性肿瘤的患者分开分析。虽然统计学上并不显著,但高 CD74 SPS 表明实验组而非对照组中切除患者的进展风险较低(中位 PFS 分别为 26.4 和 15.0 个月)(图 6 G),未切除的患者并非如此(图 6 H)。当分别治疗两个组时,他们证实了实验组(图 6 I)中高 CD74 SPS 对切除患者的预后价值显著(图 6 J)。此外,高 CD74 SPS 组中接受阿替利珠单抗治疗的切除患者的肝转移显著减少,这与报道的肝转移与 pMMR CRC 中的 ICI 耐药性之间的关联一致。总而言之,这些结果支持 CD74 作为实现临床益处所需的局部 IFN 高 TIME 标记物的作用。
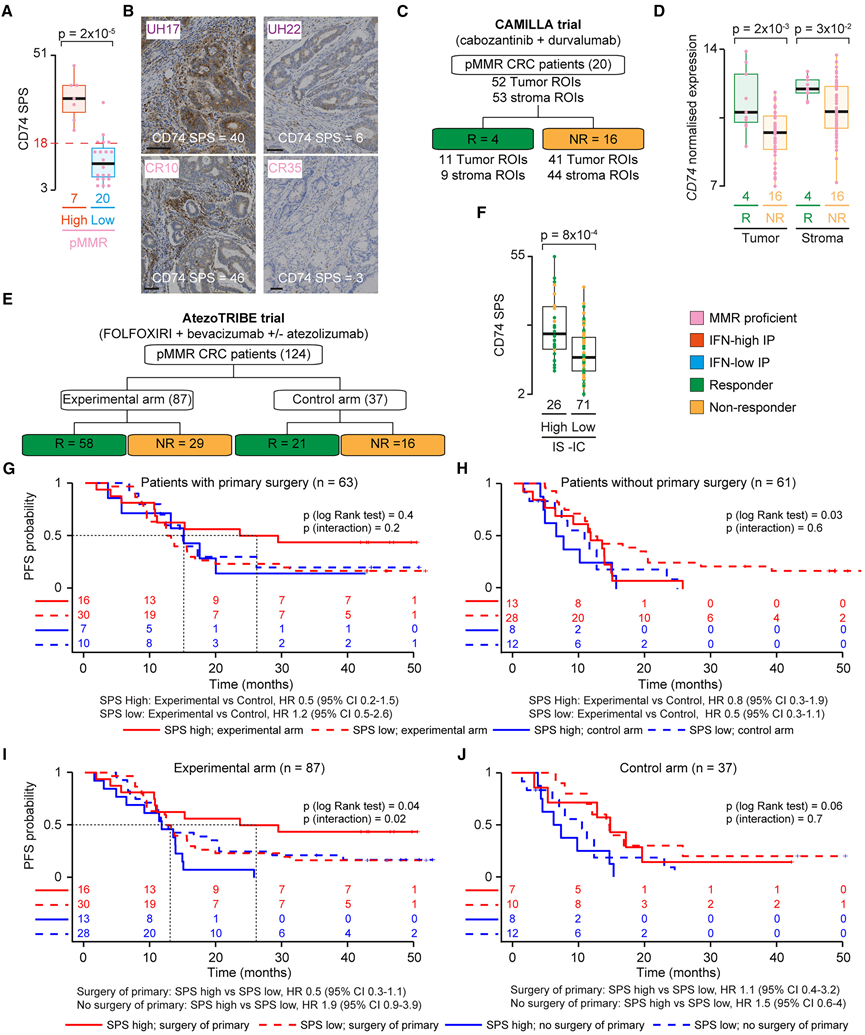
图6. 人类 pMMR CRC 中的 CD74 定量。
(A) IFN-high和 IFN-low IP pMMR CRC 中的 CD74 SPS 分布。(B) 代表性 dMMR(UH17 和 UH22)和 pMMR(CR10 和 CR35)CRC 中的 CD74 染色。(C) CAMILLA 试验样品示意图。(D) CAMILLA 试验中反应者和无反应者的基质和肿瘤区域的CD74基因表达水平。(E) AtezoTRIBE 试验样本示意图。(F) IS-IC -high和 IS-IC-low pMMR CRC 中的 CD74 SPS 分布。(G-J) 接受或未接受原发肿瘤手术的患者以及 AtezoTRIBE 试验实验组和对照组患者的 PFS 的 Kaplan-Meier 估计值。
+ + + + + + + + + + +
结 论
本研究通过多组学数据证明局部富集细胞毒性淋巴细胞和抗原呈递巨噬细胞的高干扰素免疫表型是应答所必需的。这种免疫表型并非 dMMR CRC 所独有,而是包括一部分 pMMR) CRC。单细胞空间分析和体外细胞共培养表明,产生干扰素的细胞毒性 T 细胞会诱导邻近巨噬细胞和肿瘤细胞中抗原呈递的过度表达,包括 MHC II 类不变链CD74。表达高水平 CD74 的 dMMR CRC 对 ICI 有反应,一部分 CD74 高 pMMR CRC 患者在接受 ICI 治疗时表现出更好的无进展生存期。因此,CD74 丰度可以识别决定 CRC 临床益处的组成性干扰素高免疫表型,与肿瘤突变负担或 MMR 状态无关。
+ + + + +



 English
English


