文献解读|J Hepatol(26.8):从乳头状肿瘤到胆道癌的连续致癌基因组和转录组特征
✦ +
+
论文ID
原名:Genomic and transcriptomic signatures of sequential carcinogenesis from papillary neoplasm to biliary tract cancer
译名:从乳头状肿瘤到胆道癌的连续致癌基因组和转录组特征
期刊:Journal of hepatology
影响因子:26.8
发表时间:2025.01.18
DOI号:10.1016/j.jhep.2025.01.007
背 景
目前对肝内和肝外胆管和胆囊乳头状癌前病变进行的研究将这些病变统称为胆管内乳头状肿瘤 (IPN) 和胆囊内胆囊乳头状肿瘤 (ICPN)。IPN/ICPN 的患病率表现出地理差异,东亚的发病率(占所有胆管肿瘤的 10-38%)高于西方国家(7-12%)。根据组织病理学特征,IPN/ICPN 分为四种亚型:胰胆管(胆道)、胃、肠道和嗜酸细胞性,这些癌前病变的致癌的遗传学特征尚不清楚。
实验设计
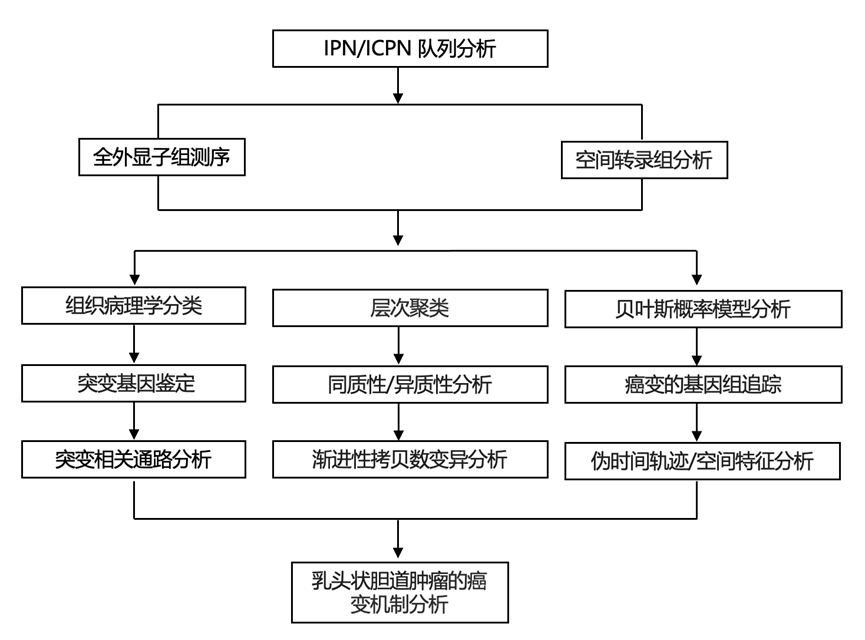
结 果
01
IPN/ICPN 的临床病理特征
研究团队建立了一个由 166 例 IPN/ICPN 组成的队列,包括 33 例肝内 IPN、44 例肝外 IPN 和 89 例胆囊 ICPN(图 1 A)。其中41 例患者伴有浸润性癌,包括 8 例肝内癌、13 例肝外癌和 20 例胆囊癌。所有浸润性癌在手术切除时均为局限性疾病,无远处转移或播散的证据。仅在少数患者中观察到潜在的肝胆疾病,其中 5 例患有慢性病毒性肝炎,3 例患有胆总管囊肿。
166 例 IPN/ICPN 中,60 例 (36.1%) 归类为低级别上皮内瘤变 (LGIN),106 例 (63.9%) 归类为高级别上皮内瘤变 (HGIN)(图 1 B)。大多数癌(n =40/41,97.6%)伴有 HGIN。进一步分层显示 88 例 (53.0%) 为胆道癌,23 例 (13.9%) 为肠道癌,53 例 (31.9%) 为胃癌,以及 2 例 (1.2%) 为嗜酸细胞亚型(图 1 A)。根据日韩研究组分类,70 例 (42.2%) 和 96 例 (57.8%) IPN/ICPN 病例分别归类为 1 型和 2 型(图 1 A)。肝外 IPN(分别为 63.6% 和 11.4%)与肝内 IPN(分别为 36.4% 和 36.4%)之间胆道亚型和胃亚型的比例存在差异(P =0.012)。
与 IPN 患者相比,ICPN 患者年龄更小(平均年龄:61.7 岁 vs. 66.3 岁,P =0.019),肿瘤体积更小(平均大小:2.7 cm vs. 3.7 cm,P =0.005)。ICPN 患者的肠道亚型和 2 型频率低于 IPN 患者(P <0.001)。
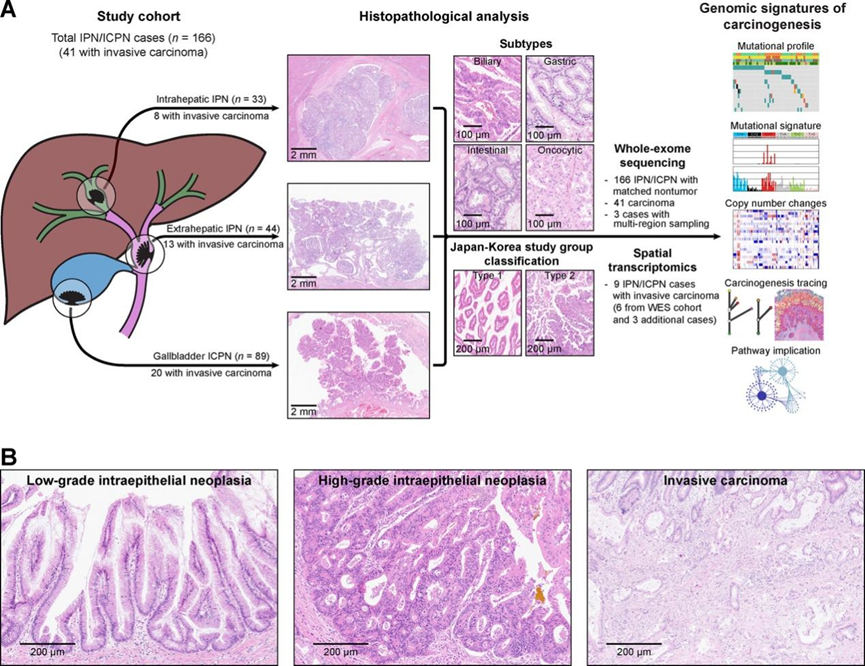
图1. IPN/ICPN 的研究概况和组织病理学特征。
(A) 研究队列和实验工作流程的总结。(B) 低级别(左)、高级别(中)IPN/ICPN 和浸润性癌(右)的代表性显微镜图像。
02
IPN/ICPN 的基因组图谱
研究团队从未染色的 FFPE 组织切片中分别解剖和收获肿瘤区域 (IPN/ICPN)、相关癌和非肿瘤组织并进行外显子测序(图2A-C),他们在 161 例 IPN/ICPN 病例(31 例肝内 IPN、43 例肝外 IPN 和 87 例 ICPN)中鉴定出 10080 个细胞单核苷酸变异(SNV),IPN 中的 SNV 率高于 ICPN。致癌驱动基因中反复突变的体细胞 SNV 包括CTNNB1(17.4%)、TP53(16.8%)、KRAS(13.0%)、APC(7.4%)和SMAD4(6.8%)。TP53 (18.2%)、APC(41.2%)和SMAD4 (15.4%)的无义突变率很高,证实了肿瘤抑制因子的功能中断。此外,还发现了常见的拷贝数变异(CNV),包括CDKN2A缺失(7.4%)、MDM2扩增(6.2%)和ERBB2扩增(6.2%)。IPN/ICPN 中主要驱动突变和 CNV 的总体频率与之前报道的胆道癌19-24的基因组改变谱相当,但不存在IDH1突变,而已知该突变在小管肝内胆管癌中富集。
基因组分析显示,根据 IPN/ICPN 的解剖位置,关键驱动因素的突变频率有所不同(图 2A-C)。与肝外 IPN(16.3%)和 ICPN(1.1%)相比, KRAS突变主要见于肝内 IPN(41.9%)(图 2 A-C)。相反,SMAD4几乎仅在肝外 IPN 中发生突变(21.0%)。在肝外 IPN 中,与远端组相比,肝门部 IPN 表现出更高的KRAS突变频率(30.8% vs. 10.0%)和更低的SMAD4突变频率(0% vs. 30.0%),尽管这些差异在统计学上并不显著。CTNNB1突变常见,但 ICPN(23.0%)突变频率高于肝内(12.9%)或肝外 IPN(9.3%)。在所有解剖位置中,HGIN 的TP53突变频率高于 LGIN(肝内 IPN 0% vs. 12.5%,肝外 IPN 0% vs. 37.1%,ICPN 0% vs. 25.6%)。 2 型(日韩研究组)的TP53突变频率也高于 1 型(28.0% vs. 1.5%,P <0.001)。相反,CTNNB1突变主要见于 LGIN(36.4% vs. 9.3%,P =0.004)。突变频率不因组织病理学亚型(胆道、肠道、胃或嗜酸细胞)的不同而有所差异。
对已识别的 SNV 进行通路水平预测,发现 MAPK 通路 (48%)、基因组完整性维持 (42%) 和 β-catenin 通路 (33%) 分别是肝内 IPN、肝外 IPN 和 ICPN 中受影响最显著的功能(图 2 A-C)。进一步的亚克隆分析发现平均有 2.4 个亚克隆聚类。亚克隆的数量与组织病理学亚型、肿瘤等级或解剖位置无关。

图2. 肝内 IPN、肝外 IPN 和 ICPN 按解剖位置划分的突变谱。
(A-C) 肝内 IPN、肝外 IPN 和ICPN 胆道癌中十大突变基因和五个拷贝数经常改变的基因。每个切片的右侧显示了显著突变的通路和组成基因的频率,分别显示低级别和高级别病变。每个框中的红色强度代表相对突变频率;白色框中的基因没有突变。
03
IPN/ICPN 的突变特征
从头提取突变特征揭示了肝内 IPN、肝外 IPN 和 ICPN 分别有 2、3 和 4 个特征(图 3 A)。将提取的特征分配给先前定义的癌症特征(COSMIC 特征),通常在所有 IPN/ICPN 中识别出时钟状特征(SBS1 和 SBS5);然而,没有发现年龄相关性。在肝外 IPN 和 ICPN 中,两个载脂蛋白 B mRNA 编辑酶催化亚基 (APOBEC) 特征(SBS2 和 SBS13)与 SBS23(病因不明)一同进行额外注释。SBS7b(紫外线暴露)仅在 ICPN 中观察到。这些特征在侵袭性癌中得到了反映,证实了 IPN/ICPN 是癌症前兆的证据。
无监督的层次聚类揭示了样本水平对突变过程的贡献(图 3B)。虽然肝内 IPN 对 SBS1 和 SBS5 表现出明显同质的标记活性,但在肝外 IPN 和 ICPN 中观察到异质性。在 30.2% 和 31.0% 的肝外 IPN 和 ICPN 病例中观察到弱至中等的 APOBEC 活性,表明肿瘤起始期间存在解剖区域特异性病因。ICPN 中的异质性更为明显,另外还存在 SBS7b 标记(29.9%)。基于突变活性的聚类证实了肝内 IPN(图 3C,绿色方块)与肝外 IPN 和 ICPN 相比的病因同质性。
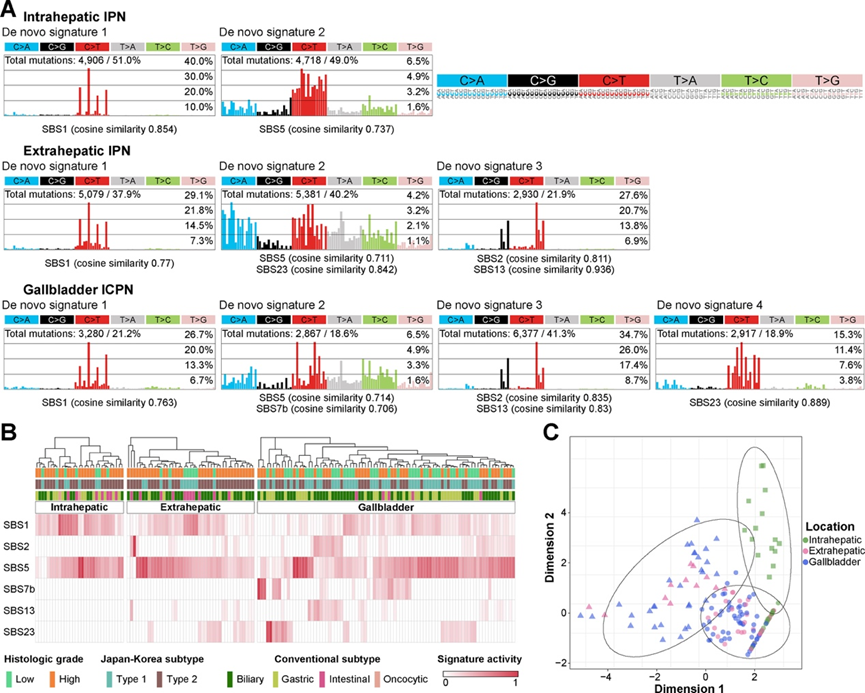
图3. IPN 和 ICPN 的突变特征。
(A) 突变特征结果。右上角显示了具有上下文的特定替换类型。Y 轴表示按序列上下文进行的替换的一部分。每个特征都分配了精选的 SBS 特征。(B) 精选的 SBS 特征热图,每个解剖位置都有单独的层次聚类。(C) 精选的 SBS 特征提取的 K 均值聚类结果。
04
从 IPN/ICPN 到癌症的渐进性拷贝数变异
按发育不良等级(LGIN、HGIN 和癌)分层的总体 CNV 模式突出了 IPN/ICPN 和癌中拷贝数变异事件的程度(图 4 A),观察到从 LGIN 和 HGIN 到癌的 CNV 事件数量显著增加(图 4 B)。此外,在 IPN/ICPN 中,HGIN 中观察到的 CNV 事件数量高于 LGIN。在所有 IPN/ICPN 和癌症中,复发性 CNV 事件定义为常见的基因组区域(图 4 A)。在 1q 和 20q 中经常观察到染色体增益。在 IPN/ICPN 和癌症中均检测到了染色体臂 5q、9p、17p 和 18q 的丢失,这些臂分别包含APC、CDKN2A/B、TP53、SMAD2和SMAD4。改变的拷贝数的定量进一步证明从 LGIN 到 HGIN 和癌症逐渐增加(图 4 C)。这些发现强调了 LGIN 和 HGIN 中主要 CNV 事件的早期发生,并逐步发展为癌症。
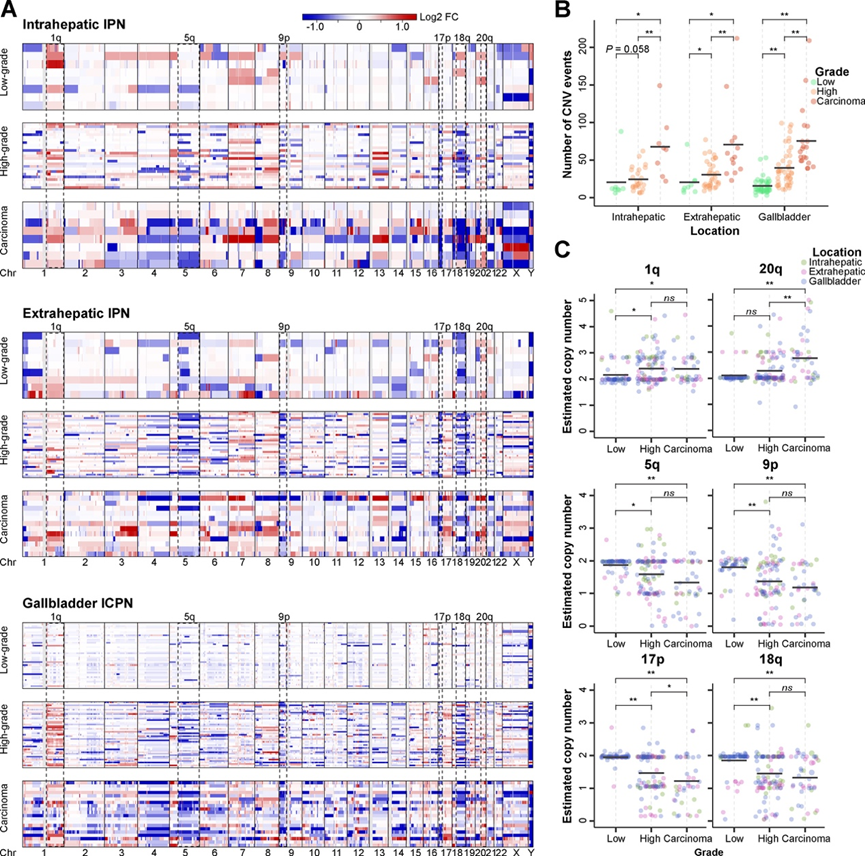
图4. 全基因组 CNV 状态按组织病理学等级和解剖位置比较。
(A) 拷贝数增加和缺失的热图。(B) 散点图显示按组织病理学等级分布的 CNV 事件数。(C) 显著改变的染色体臂的估计拷贝数的散点图。
05
从 IPN/ICPN 到相关浸润性癌的连续致癌作用
通过使用贝叶斯概率模型分析体细胞 SNV 和 CNV 的共有模式,他们阐明了 IPN/ICPN 与其相关侵袭性癌之间的基因组关系(图 5)。在 36 个(共 41 个)可分析病例中,将32 个侵袭性癌(88.9%)确定为直接源自 IPN/ICPN。相反,虽然位置和组织病理学接近,但仍有 4 个病例(11.1%;一个肝内 IPN 和三个 ICPN)是巧合。巧合病例显示,IPN/ICPN 与其相关癌症之间存在不一致的驱动突变(IPN/ICPN 中的PTCH1 p.Q714*、STK11 p.Y49* 和TP53 p.R175H 与癌症中的EGFR p.V441I、TP53 p.A161T 和NOTCH1剪接变体),并且 SNV 的重叠率较低(35/992,3.5%)。
32 例 IPN/ICPN 衍生癌(4 例肝内癌、13 例肝外癌和 15 例胆囊癌)显示较高的平均突变重叠率(22.0%),包括 42 个驱动突变和 4 个 CNV。系统发育分析揭示了基因组修饰从非肿瘤起源到 IPN/ICPN 和癌症的进化轨迹(图 5 A)。大多数驱动突变(n =46/78,59.0%)鉴定为 IPN/ICPN 和癌症的祖先,表明主要的致癌环境是在 IPN/ICPN 中预先建立的。然而,不同病例中癌前阶段的估计持续时间(基于茎长度)和恶性肿瘤发作后的时间(基于分支长度)存在显著差异,反映了基因组进展的随机性(图 5 A)。
3 个符合多区域取样条件的病例(病例 30、31 和 32)为了解进化关系提供了更深入的见解(图 5 B)。在病例 30(肝内 IPN)中,分析了一个 HGIN 区域和两个癌区域(癌中心:紧邻 IPN 和癌边缘:远离 IPN)(图 5 B)。所有三个病变都共有的驱动突变APC p.K1454*;然而,癌中心表现出中度分化并且与 IPN 共有更多的体细胞突变(46.2%),包括KRAS p.G13D 和CREBBP剪接变体。相反,癌边缘表现出较差的分化和较低的突变重叠(7.2%),表明分支较早。值得注意的是,两个癌部位在基因上不同(2.0% 的突变重叠),表明两者都直接来自 IPN,而不是来自彼此。
在病例 31(肝内 IPN)中,对两个 IPN 区域(LGIN 和 HGIN)和两个癌区域(癌中心和癌边缘)的分析揭示了一个共同的驱动事件(CDKN2A缺失);然而,IPN 和癌边缘之间的遗传相似性较低,表明分支较早(图 5B)。癌区域和 HGIN 之间的共有突变率(16.5%)略高于 LGIN(13.5%),这表明 HGIN 是癌的起源。除了CDKN2A缺失之外, KRAS、TSC2和ERBB2中的三个驱动突变仅在 IPN 和癌中心之间共存,这表明致癌作用从 HGIN 发展到癌边缘,癌中心的出现是较晚的事件。
在病例 32(肝外 IPN)中,分析了三个癌区域(癌中心、癌边缘和癌中途)和一个 IPN 区域(HGIN)(图 5 B)。所有区域都共有两个驱动突变(SMAD4 p.R361H 和TP53 p.R241T)。然而,癌中心(47.3%)、癌中区(41.8%)和癌边缘(21.9%)与 IPN 的基因组相似性表明了一种连续分支模式:癌边缘首先进化,然后是癌中途和癌中心。三个癌区域之间缺乏共同突变,进一步支持了 IPN 独立的致癌作用,而不是癌到癌的逐步演变。总之,这些结果强调,IPN/ICPN 的连续致癌作用经常涉及多灶性致癌事件,这些事件导致了癌症内在的基因组异质性。
按进化时间分离的体细胞突变用于鉴定与致癌作用相关的分子通路。在 32 个 IPN/ICPN 衍生病例中,IPN/ICPN 和癌侧分别独立获得 1834 和 1349 个突变,影响 1654 和 1249 个基因。对癌症特异性突变进行GO 分析显示,循环系统发育、解剖结构形态发生的调节、参与分化的细胞形态发生和对生长因子的反应是致癌作用中最受影响的通路(图 5C-D)。这些途径是癌症发展的核心机制,与抗缺氧能力、异常分化和不受调节的生长有关。相反,1834 个 IPN 特异性突变涉及在致癌作用中不太明显的通路,例如神经元的产生、细胞投射组织和神经元分化。
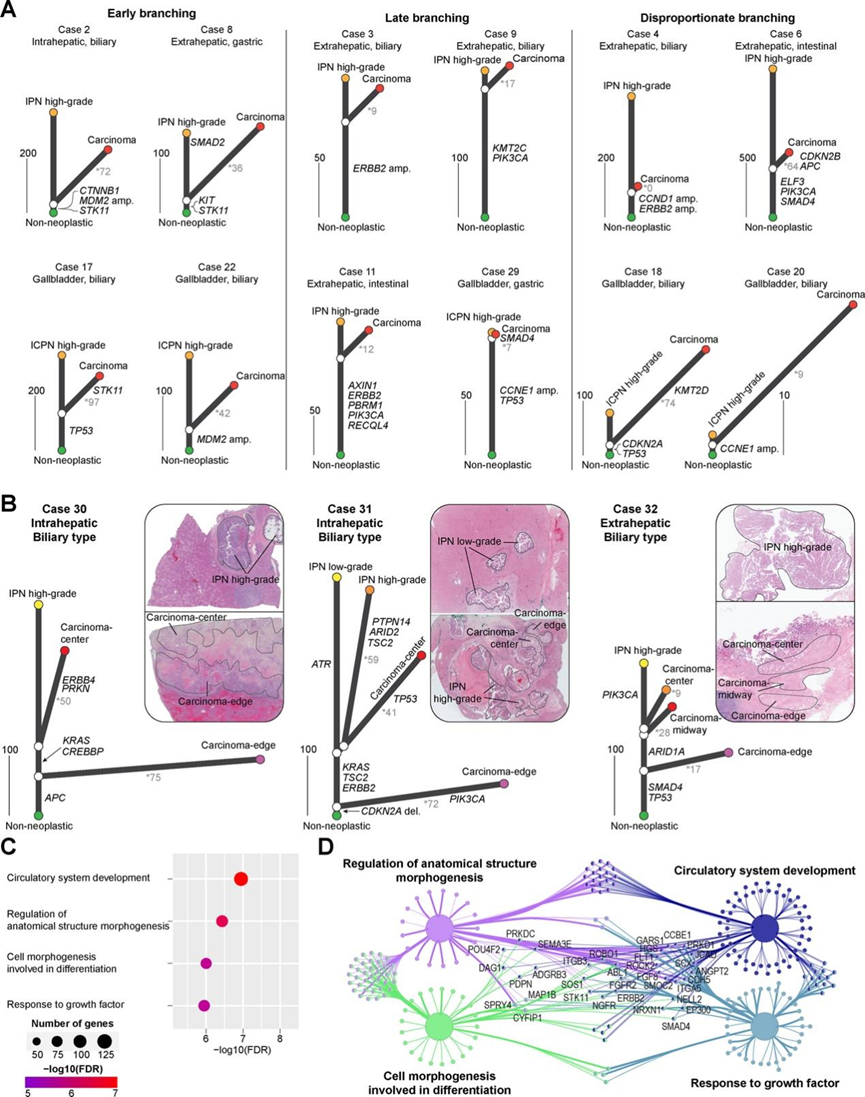
图5. IPN/ICPN 进展为浸润性癌的基因组追踪。
(A) IPN/ICPN 衍生癌病例的系统发育树。(B) 三个多区域测序病例的系统发育树。(C)GO分析。(D) 具有富集突变的通路网络。
06
IPN/ICPN 致癌作用的空间转录组学概况
为了研究 IPN/ICPN 致癌的转录组学特征,他们对 9 例伴有侵袭性癌的 IPN/ICPN 病例(肝内、肝外和胆囊各 3 例)进行了空间转录组学分析(图 6)。其中,6 例(1 例肝内 IPN:病例 2,2 例肝外 IPN:病例 10 和 32,3 例 ICPN:病例 15、18 和 29)具有匹配的 WES 数据并归类为 IPN/ICPN 衍生癌。聚类分析确定了组织病理学保守的 IPN/ICPN 和侵袭性癌区域,以及批次效应最小的基质特征(图 6 A)。
基于均匀流形近似和投影 (UMAP) 表示的聚类的拟时间轨迹分析推断出致癌的关键阶段:开始(称为“根”)、结果(“叶”)和中间分支点(“分支”)(图 6 A)。在 6 个病例(66.7%)中,包括 6 个 IPN/ICPN 衍生癌病例中的 5 个和 1 个额外的肝内 IPN 病例(病例 33),轨迹显示从 IPN/ICPN 到侵袭性癌聚类的线性进展,与 WES 结果一致(图 6 A)。然而,两例(病例 2 和 34)显示部分链接的轨迹。值得注意的是,轨迹分析的稳健性可能会受到致癌过程中径向转录组变化的影响,从而难以准确区分 IPN/ICPN 衍生癌症和巧合癌症。
合并所有九个转录组数据集后,确定了六个组合聚类(五个对应于 IPN/ICPN,一个对应于侵袭性癌)(图 6B)。差异基因表达分析显示,前 50 个基因在侵袭性癌中高表达。GO 分析表明,这些基因在与细胞外基质 (ECM) 组织、外在凋亡途径的调节以及对生长因子刺激的细胞反应的负调节相关的途径中富集,这与基于 WES 的通路大致一致(图 6C)。值得注意的是,一个聚类(聚类 2,标记为橙色)位于 IPN/ICPN 和侵袭性癌区域之间,表现出中间转录组谱,表明在致癌过程中存在过渡状态。TERT表达的空间分布(恶性转化的关键因素)在 IPN/ICPN 和侵袭性癌之间没有显著差异。这意味着具有 HGIN 的 IPN/ICPN 样本已经获得了恶性特征,这与突变数据一致。

图6. 与浸润性癌相关的 IPN/ICPN 的空间转录组学分析。
(A) Visium 空间转录组学结果。 (B) 从组合聚类中确定的每个 IPN/ICPN 或浸润性癌聚类的前 50 个差异表达基因的热图。(C)GO分析。
+ + + + + + + + + + +
结 论
本研究提供了胆管和胆囊乳头状肿瘤的全面突变和空间转录组学图景。MAPK(48%)、基因组完整性维持(42%)和 Wnt/β-catenin(33%)通路突变分别在肝内 IPN、肝外 IPN 和 ICPN 中普遍存在。KRAS突变在肝内 IPN 中富集(42%,P <0.001),而SMAD4突变在肝外 IPN 中富集(21%,P =0.005)。ICPN 经常表现出CTNNB1突变,尤其是在低度病变中。突变特征分析显示,SBS1 和 SBS5 特征在肝内 IPN 中均匀富集,而 SBS1、SBS2、SBS5、SBS13、SBS7b 和 SBS23 在肝外 IPN 和 ICPN 中的分布则不均匀。拷贝数畸变从低度到高度上皮内瘤变逐渐增加,最终增加到癌症。系统发育分析显示,89% 的癌症是通过连续致癌作用从 IPN/ICPN 衍生而来的,大多数 IPN/ICPN 和癌症之间共有众多驱动突变。此外,在 IPN/ICPN 中观察到多灶性、独立的致癌事件,导致突变不同的癌病变。IPN/ICPN 的致癌作用发生在多个亚克隆中,通过突变积累和转录组改变,影响血管发育、细胞形态形成、细胞外基质组织和生长因子反应。本研究的结果为胆管内乳头状肿瘤的致癌机制、病理学-基因组学相关性和潜在治疗靶点提供了见解。
+ + + + +



 English
English


