文献解读|Cell Rep Med(14.3):使用模拟内源细胞转变的代谢物进行干预可加速年轻和老年小鼠的肌肉再生
✦ +
+
论文ID
原名:Intervention with metabolites emulating endogenous cell transitions accelerates muscle regeneration in young and aged mice
译名:使用模拟内源细胞转变的代谢物进行干预可加速年轻和老年小鼠的肌肉再生
期刊:Cell Reports Medicine
影响因子:14.3
发表时间:2024.03.19
DOI号:10.1016/j.xcrm.2024.101449
背 景
损伤后的组织再生需要动态的细胞状态转变,从而建立恢复组织稳态和功能所需的细胞特性。骨骼肌组织分化是研究最充分的细胞命运转变模型之一。在生理分化过程中,干细胞可产生肌肉祖细胞[或成肌细胞(MB)],并分化为肌纤维。肌纤维的从头形成发生在损伤后的再生过程中,并且也是由肌肉祖细胞介导的。因此,连同其体内可及性,肌肉代表了一个极好的实验环境,可以揭示生理和损伤后环境中细胞身份变化的潜在因素。
实验设计
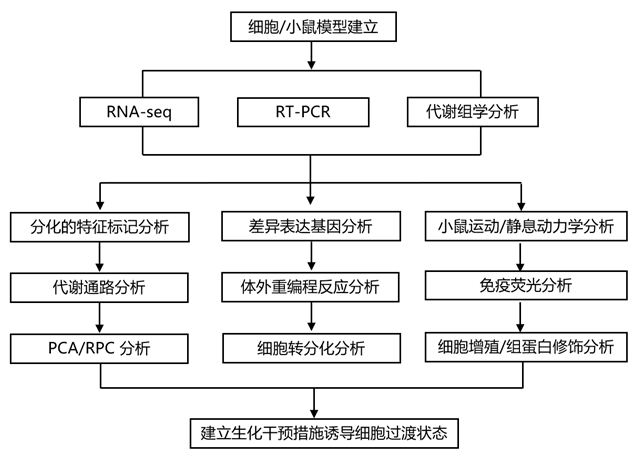
结 果
01
MB 分化的早期瞬时状态揭示了特定生化生态位的激增
本项研究在体外描述了从 MB 到肌纤维的早期转录组转变,以检测允许在两种细胞身份之间转换的分子线索(图 1 A)。MBs 早在分化诱导后 1-3 小时就表现出基因表达的变化,并在 6-12 小时后检测到分化的特征标记。基于该基因表达轨迹,研究者团队选择了适当的时间点来进行转录组学分析(RNA-seq),发现分化诱导 3 小时后整体基因表达存在显著差异(图 1 B)。在分化诱导后的早期,即 3 至 6 小时之间,检测到与代谢过程相关的途径显著富集,包括生物合成和调节途径(图 1 C)。这一观察结果表明,代谢线索(clue)可能在维持细胞内生态位以实现细胞类型变化方面发挥着至关重要的作用。因此,他们在相同时间范围内进行了非靶向代谢组学分析。主成分分析(PCA)显示MB 的代谢组与其早期分化对应物的代谢组完全分离(图 1 D)。
接下来,为了鉴定中间转变中必需的生化物质,他们应用了循环模式分类(RPC)方法,跟踪化合物随时间的相对平均丰度变化(图1E)。RPC能够可视化和识别代谢物丰度的重复模式,甚至是那些在特定窗口中表现出微妙增加的模式,可以将它们分类为累积波、还原波、U 形波或钟形波,并将它们从不随时间变化的模式中排除。值得注意的是,钟形波模式与初始转录组学分析的框架一致(图 1 A-C)。钟形图的富集分析显示了Warburg效应、糖酵解和糖异生、一碳(1C)代谢相关途径和脂质代谢途径等途径富集(图1F)。
他们通过逆转录聚合酶链反应 (RT-PCR)筛选了神经干细胞(NSC)和间充质干细胞(MSC)分别分化为星形胶质细胞和软骨细胞的一些标记。然后他们在适当的时间分析代谢组学并应用 RPC 策略。三种多能模型(MB/肌纤维、NSC/星形胶质细胞和 MSC/软骨细胞)的瞬态交叉点(钟形模式)比其他交叉点有更多共性(图1G)。
比较代谢组转变后,他们发现蛋氨酸代谢和亚精胺/精胺生物合成是维恩图钟形交叉点共有的途径(图 1 G)。值得注意的是,这些途径在 1C 代谢网络中是相互关联的。
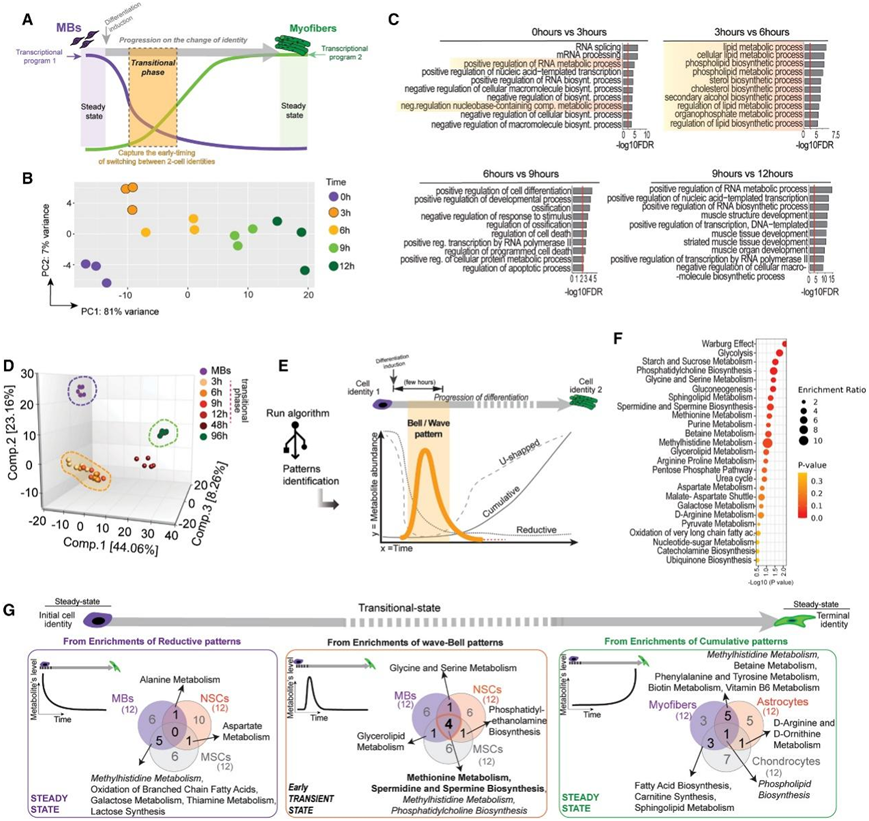
图1. 肌细胞(MB)和肌纤维之间生化过渡态的鉴定。
(A-C)体外MB 和肌纤维之间早期过渡状态的转录组分析。(D–F)体外MB 和肌纤维之间的代谢组转变。(G) 三种祖细胞类型的初始、过渡和终末状态普遍存在的代谢途径的交叉点。
02
合成 1C 生态位在肌纤维中诱导离散的祖细胞样轮廓
过渡性1C状态可能反映了任何其他身份变化的细胞的代谢组学需求。因此,他们使用优先选择的与1C网络相关的生化物质处理分化的肌纤维,包括蛋氨酸、苏氨酸、甘氨酸、腐胺、SAM和半胱氨酸。他们将这些分子指定为在上述几种细胞类型的过渡状态中的1C网络的代表(图2A)。由于涉及的代谢物类型,他们将混合物命名为 1C-代谢物诱导培养基 (1C-MIM)。
接下来,他们探讨了 1C-MIM 创建的生态位是否可以驱动分化肌纤维中的重编程。他们发现MB 到肌纤维之间的中间过渡具有一个由 1C 相关代谢物短暂填充的细胞内生态位(图 2 A)。暴露于 1C-MIM 的肌纤维表现出成熟细胞标记Myh11和Mef2c基因表达的下调,并恢复了与祖细胞状态相关的Pax7蛋白表达(图2B-D)。他们观察到形态学的变化,并验证了所有用于下游分析的细胞培养物在收集时至少具有85%的细胞活力,从而消除了仅因死亡而导致表达降低的可能性(图2E)。MB/肌纤维分化取决于血清水平,因此,他们在2%和20%两种不同的血清浓度下检测了1C-MIM(图2C-D)。
为了探索 1C-MIM 对肌纤维的作用,他们使用了C2C12 的体外模型。简而言之,通过血清还原来区分 C2C12,然后暴露于 1C-MIM 或混合代谢物组合(与 1C 代谢非直接相关的六种代谢物的混合物)3 天,然后进行RNA-seq。混合代谢物组合呈现出与未处理的肌纤维对照相似的基因表达谱(图2F-G)。1C-MIM 处理的肌纤维与其余肌纤维的差异基因表达(DEG)富集于细胞周期相关途径和细胞骨架途径(图 2 H)。1C-MIM 处理的肌纤维与其亲本(未处理的对照)相比,表现出 822 个DEG(图 2 I)。1C-MIM 上调最多的基因是Mmp13,它是骨骼肌再生的贡献者,对 MB 迁移、胎儿肌肉发育中的几种金属蛋白酶、激酶和基因(例如Stc110)至关重要(图 2-J)。
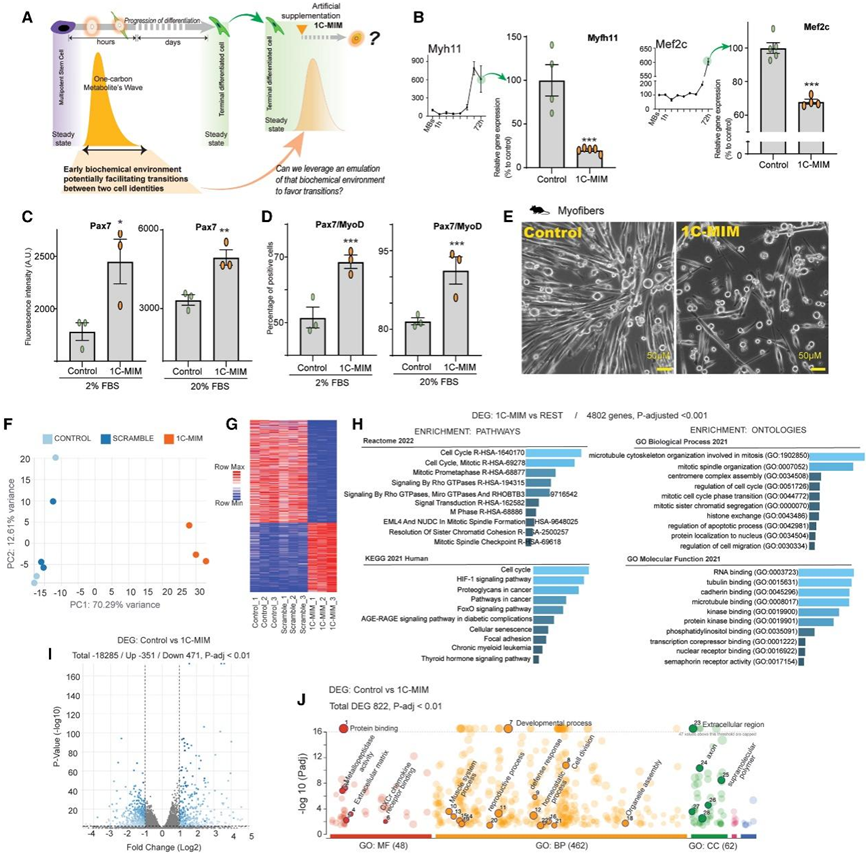
图2.模拟生化过渡生态位引起成熟细胞分化标记的减少。
(A) 在终末分化稳态下补充代谢物以用 1C-MIM(代谢物诱导培养基)部分模拟 1C(一碳)波的示意图。(B) 补充 1C-MIM 对肌纤维Myfh11(左)和Mef2c(右)分化标记物的影响。(C-D) 补充 1C-MIM 对肌纤维 Pax7 和 MyoD 祖细胞标记物的影响。(E)体外对照肌纤维和 1C-MIM 治疗后 3 天的代表性图像。(F–J) 补充 1C-MIM 后肌纤维获得的身份的转录特征。
03
生化过渡生态位简化了细胞类型之间的转分化事件
从1c-MIM处理的星形胶质细胞的转录组学中也得出了类似的推论,其中的特征更接近于祖细胞NSC,并且表现出细胞周期的调节,星形胶质细胞和MIM星形胶质细胞之间的细胞迁移相关过程受到不同的调节(图3A-C)。值得注意的是,他们验证了在1c - mim处理的星形胶质细胞中获得中间样状态。
为了探讨 1C-MIM 诱导的状态是否可能增加对特定分化因子的反应性,他们用MyoD(一种充分表征的肌源性转录因子)感染小鼠 MSC,并评估与 1C-MIM 结合时向肌纤维的转化效率(图 3 D)。在此模型中,MyoD 表达与连接的 GPF+ 信号成正比,而成功的转分化则通过 MF20 进行检测,MF20 对分化的肌纤维进行染色。1C-MIM 不仅将转化效率提高了 5 倍,而且还加速了细胞转化,正如在第 4 天早期检测到 MF20+ 细胞所观察到的那样,当时仅感染仍然没有显示任何转化的细胞(图 3D-G)。有趣的是,在感染后第8天,在相同数量的细胞中观察到更多的GFP+细胞,这可能反映了混合代谢物在病毒转导中的额外影响,独立于转分化的效率。值得注意的是,在补充4天后,对照组和补充的细胞之间没有观察到显著差异(图3E),特别是在4种代谢物的组合中,检测到对转分化的影响更大(图3F-G)。

图3. 生化过渡生态位简化了细胞类型之间的转分化事件。
(A–C) 补充 1C-MIM 后星形胶质细胞获得的身份的转录特征。(D–G) 1C-MIM 加速 MSC 转化为 MB 的功能测定。
04
体内1C 代谢物干预可加速年轻和年老小鼠受伤后的肌肉恢复
接下来,为了验证 1C-MIM 的潜在可翻译性,他们进行了体内干预,选择了心脏毒素(CTX)引起的肌肉退化模型,它会损伤肌肉纤维,随后激活涉及连续转化细胞事件的修复机制。作为体内验证的一部分,他们比较了接受干预的年轻和年老小鼠的运动能力。作为第一步,将小鼠预先适应旷场测试(在诱导损伤前至少 1 周将小鼠放置在该区域 1 小时并 2-3 次)(图4A)。接下来,他们证实CTX损伤损害了小鼠的运动,观察到运动反应在速度和跳跃方面的减少,以及休息时间的增加。有趣的是,仅在损伤后24小时,他们观察到补充1C-MIM的小鼠的行走距离增加,因此休息时间减少(图4B-C)。只检测到跳跃次数和移动时间等其他参数的改善趋势:跳跃次数和移动时间的相对变化占再生进程的59%和61%,而速度变化不占恢复的比例(图4D)。值得注意的是,休息时间是显示 CTX 损伤后各组之间最相关差异的参数(即小鼠休息时间更长)。总之,与其他对照补充剂相比,补充 1C-MIM 的小鼠运动恢复更快;位居第二的是补充甘氨酸的组;最后是未经处理的对照小鼠和(图 4 C)。总体而言,随着肌肉再生(恢复)的进展,小鼠减少了休息时间(同样增加了行走距离)。
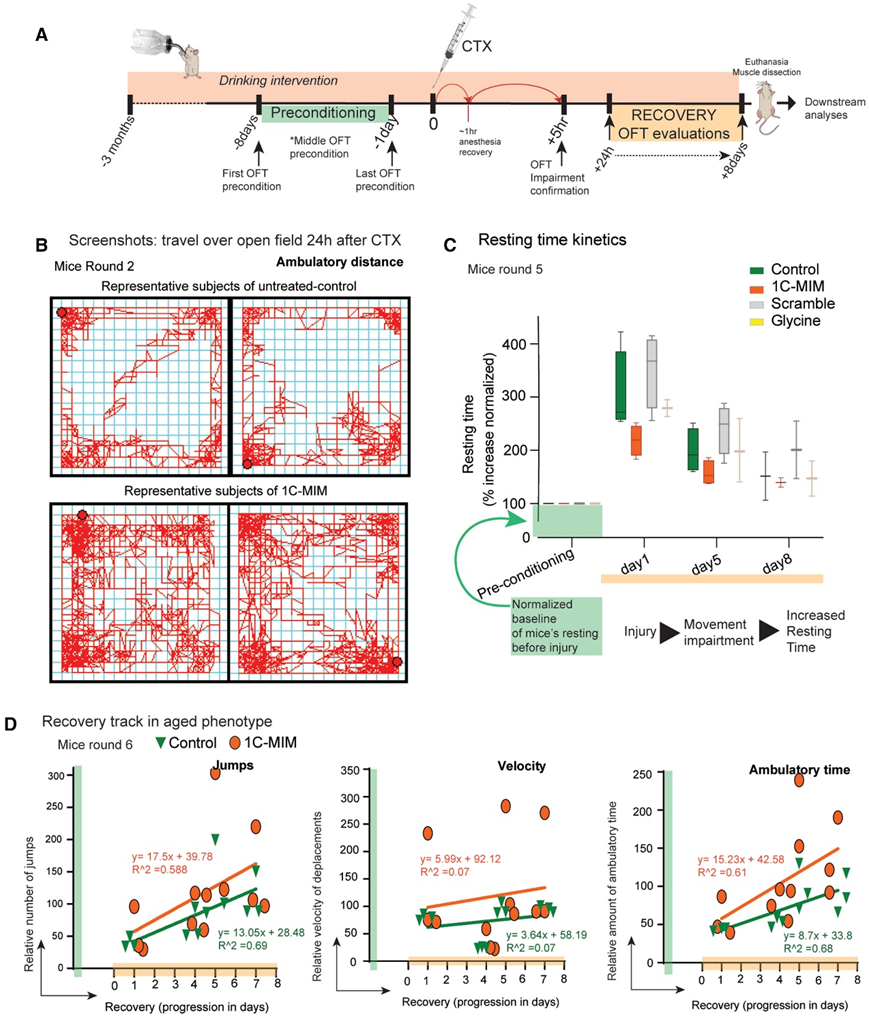
图4. 体内1C-MIM干预加速CTX损伤的运动恢复。(A) 实验设计。
(B) CTX 损伤后 24 小时在对照小鼠和补充 1C-MIM 的小鼠中进行的行为运动测试的代表性轨迹。(C) 通过 OFT 在 CTX 损伤小鼠中评估静息动力学。(D) 在 CTX 损伤小鼠中评估跳跃、速度和行走时间的动力学。
接下来,他们分析了组织水平上发生的情况,证实了补充 1C-MIM 的小鼠中所见的改善。受伤后,肌肉结构的恢复与中央有核再生纤维的出现同时发生。在补充 1C-MIM 的小鼠中观察到,第 2 天中央有核纤维增加了 2.4 倍(在第 7 天后,与对照组中通常观察到的许多中央有核纤维),表明 1C-MIM 动物中修复发生得更快(图5A-B)。
激活的卫星细胞(SC)在CTX损伤后的第7天非常突出,超过11天就会减少。他们观察到,1C-MIM确实增强了这种激活过程,且Pax7+细胞水平的显著增加(图5C-D)。此外,在再生过程中,与未治疗的小鼠相比,补充1c - mim的小鼠肌纤维的横截面积增加,表明这种干预加速了恢复(图5E-G)。在没有损伤的对照动物中,1C-MIM干预对肌纤维大小没有影响。值得注意的是,3个月的干预并没有影响肌纤维的大小(图5H),而3个月的甘氨酸补充有影响,如其他人报道的那样增加了肌纤维的大小,但补充1C-MIM的效果仍然更好(图5H)。

图5. 体内1C代谢物干预后肌肉修复加速。
(A) 对照小鼠和补充 1C-MIM 的小鼠第 2 天时对照小鼠和注射心脏毒素的肌肉中以“纤维数量/视野”表示的中央有核细胞数量进行分析。(B) 对照小鼠和 1C-MIM 治疗小鼠注射心脏毒素 7 天后胫骨前肌 (TA) 的代表性 H&E 染色。(C) 对照小鼠和 1C-MIM 处理小鼠心脏毒素注射后 7 天,TA 中 Pax7+ 细胞的代表性免疫染色。(D) 在所示组比较中每个视野的 Pax7+ 细胞的定量。(E-H) 注射心脏毒素 7 天后 TA 肌肉中纤维的大小分布。
05
乙酰化修饰和细胞周期调节分析
因为在早期的体外模型分析中(包括肌纤维和星形胶质细胞),细胞周期的调节发生在添加1C-MIM后,因此,他们检测了不同补充物下小鼠肌肉中的Ki67+细胞,只有补充1C-MIM组的 Ki67+细胞显著增加(图6A)。为了区分1C-MIM是否影响增殖的MB或静止的SC,他们使用MyoD和Pax7对分离的单个肌纤维进行了共免疫染色,发现1C-MIM使增殖SC(Pax7+MyoD+)和静止SC (Pax7+MyoD−)的数量分别增加了1.96倍和1.7倍(图6B)。
接下来,他们进行了RNA-seq,PCA显示对照组与补充1c-mim组发生明显分离(图6C)。DEG分析显示789个基因,其中67%下调,与免疫反应和胶原形成相关(图6D-F)。
基因集富集分析显示,1C-MIM干预与基因表达的表观遗传调控、染色质修饰酶和组蛋白乙酰化呈正相关。上调的 DEG 通过乙酰化富集转录活性的调节,表明这是调节细胞周期的途径(图 6 F)。在用 1C-MIM 处理的星形胶质细胞中获得的正交读数证实了这种调节,他们检测了 1C-MIM 诱导的组蛋白修饰的相对丰度的变化(包括乙酰化、甲基化和未标记的组蛋白),没有观察到甲基化标记的相关变化,但 1C-MIM 增加了整体乙酰化标记,这一事件证明了发生染色质可塑性(图6 G)。
总的来说,这些结果表明,1C-MIM体内干预加速了小鼠肌肉的再生,模拟了在分化 MB 的过渡状态,因此不会影响谱系特性。此外,这种干预有利于重编程转变,从而增强损伤事件后的生肌潜力,从而加速受损肌肉恢复健康状态。
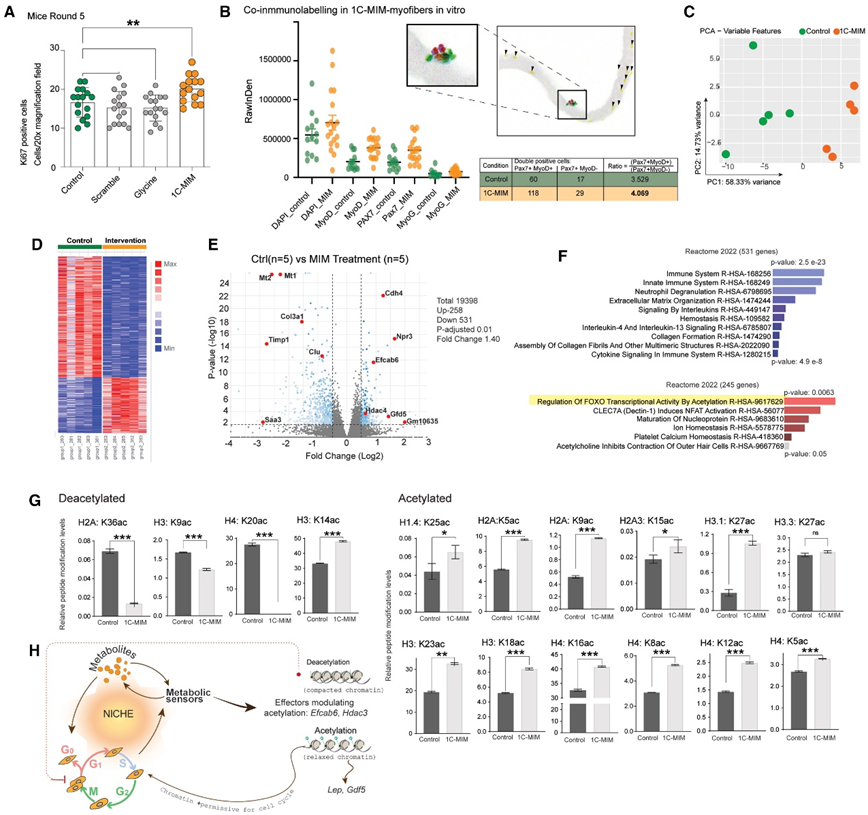
图6. 乙酰化修饰和细胞周期调节驱动 1C-MIM 体内肌肉再生加速。
(A) 通过免疫荧光和 Ki67 检测定量增殖。(B) 将初级肌纤维置于体外并用或不用 1C-MIM 处理,以精确评估细胞核中的双标记。(C-F) 补充 3 个月后从老年小鼠中提取的 1C-MIM 股四头肌的转录组分析。(G) 对对照星形胶质细胞和补充 1C-MIM 的星形胶质细胞检测到的组蛋白修饰的正交读数。(H) 1C-MIM 引发加速细胞再生转变的机制。
+ + + + + + + + + + +
结 论
本项研究提出了一种生化干预措施,可诱导中间细胞状态,反映成肌细胞和其他专能和多能细胞正常分化为成熟细胞期间确定的转变。当应用于体细胞分化细胞时,由一碳代谢物组成的干预措施可以减少一些去分化标记物,而不会失去谱系特性,从而诱导有限的重编程为更灵活的细胞状态。此外,这种干预可以加速年轻和老年小鼠肌肉损伤后的修复。总体而言,本项研究揭示了一个保守的生化过渡态,可以增强体内细胞的可塑性,并暗示在再生医学和复兴干预中使用潜在的、可扩展的生化干预措施,这些干预措施可能比遗传干预措施更容易处理。
+ + + + +



 English
English


