文献解读|Sci Transl Med(17.1):血管周围三级淋巴结构中的干细胞样 CD4+ T 细胞维持自身免疫性血管炎
✦ +
+
论文ID
原名:Stem-like CD4+ T cells in perivascular tertiary lymphoid structures sustain autoimmune vasculitis
译名:血管周围三级淋巴结构中的干细胞样 CD4+ T 细胞维持自身免疫性血管炎
期刊:Science Translational Medicine
影响因子:17.1
发表时间:2023.09.06
DOI号:10.1126/scitranslmed.adh0380
背 景
巨细胞动脉炎 (GCA) 是一种中动脉和大动脉的自身免疫性疾病,影响老年人,并且通常对标准免疫抑制无效。尽管 T 细胞浸润占据 GCA 患者的血管壁,但这些细胞的来源及其在驱动疾病中的重要性尚不清楚。
实验设计
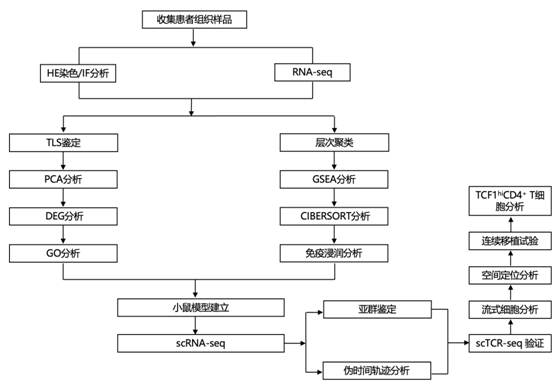
结 果
01
从主动脉炎患者切除的主动脉瘤含有血管外周三级淋巴结构(TLS)
在GCA的全动脉炎性病变中,T细胞和巨噬细胞呈典型的肉芽肿样浸润,多核巨细胞沿破碎的内弹力层聚集于中膜边缘。为了检测疾病诱导T细胞的多样性和动态变化,研究者团队对42例升主动脉壁样本进行了全面的空间分析,这些样本来自22例主动脉炎和20例非炎症性升主动脉瘤(遗传性主动脉病和轻度动脉粥样硬化)。所有主动脉炎样本均显示致密的单核细胞聚集在血管外膜微血管周围(图1A),这一表型仅限于患血管炎的主动脉,仅在疾病对照组和正常主动脉中极少出现(图1B)。单细胞核聚集物的免疫荧光(IF)成像鉴定了T细胞和B细胞(图1C)以及Ki67+增殖细胞,表明外膜中高度有序的淋巴结构在慢性炎症条件下发挥TLS的功能(可诱导异位淋巴组织)。主动脉TLS由三个不同的区组成:T细胞区、B细胞区和T/B混合区。B细胞区是通过CD21滤泡树突状细胞 (DC) 网络确定的,其中一些含有生发中心。一半的主动脉TLS主要由T细胞和B细胞组成,但约25%的TLS主要由T细胞组成(图1D-F)。大多数TLS处于晚期成熟阶段,具有明显的T细胞或B细胞特征(图1E),类似于淋巴结的结构。TLS主要在外膜形成,很少在中膜形成,主要包含CD4+ T细胞(图1F)。主动脉TLS富含CD11c+ DC,通常排列在相互连接的网络中(图1G)。T细胞与抗原呈递HLA-DR细胞密切接触(图1H)。对TLS驻留细胞的分析显示了podoplanin+ 淋巴管,这些淋巴管通过产生IL-7促进T细胞存活(图1I)。
主动脉TLS的一个显著特征是微血管密度高(图1J),在T细胞区明显可见(图1K)。出乎意料的是,微动脉和微静脉都可以作为TLS导向血管,并且它们中的许多都表达外周淋巴结地址素(PNAd)(图1L),这是高内皮小静脉(HEV)的标志。PNAd+内皮细胞包裹着大量外渗的T细胞,紧邻着排列在血管壁平滑肌细胞层之间的T细胞下方(图1M-P)。
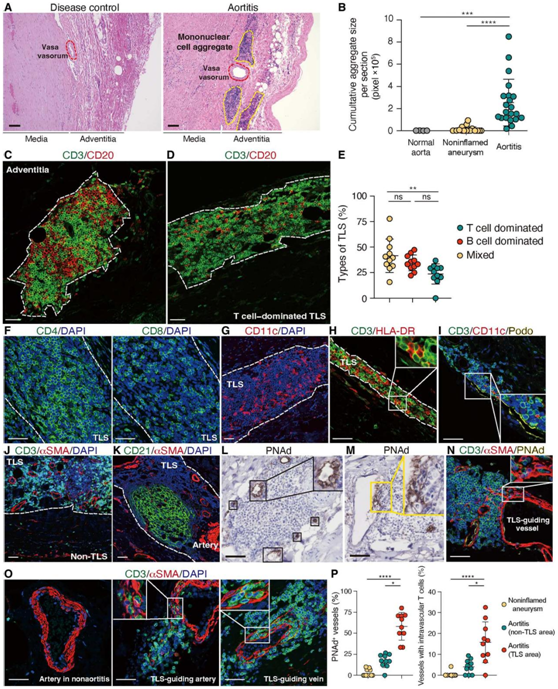
图1. TLS形成于大血管血管炎。
(A) H&E染色。(B) 每个组织切片的单个核细胞聚集体的累积大小。(C-D) 对组织进行CD3和CD20染色。 (E) 根据显性细胞类型,TLS可分为T细胞显性、B细胞显性或混合型。图中显示了11例主动脉炎的比例。 (F-K) 组织染色。 (L-M) 免疫组织化学分析。(N-O) 分别对组织进行CD3、αSMA、PNAd和CD3、αSMA染色。 (P) 比较主动脉炎和非炎症性动脉瘤中PNAd+血管和血管内T细胞血管的频率。
02
TLS基因标记将主动脉炎与非炎症性动脉瘤区分开来
接下来,它们对42个主动脉瘤样本进行了整体组织转录组分析(RNA-seq)。无监督主成分分析(PCA)显示,主动脉炎组与疾病对照组明显分离(图2A)。两组间共有1070个基因差异表达(图2B)。对1070个差异表达基因(DEG)进行的GO分析表明,主动脉炎中适应性免疫激活通路富集(图2C)。在主动脉炎组织中高度富集的DEG包括持续的T细胞和B细胞依赖性免疫应答:T细胞(CD3E、CD4、CD8A、GZMB和LTB)、B细胞(CD19、CD38、SDC1、FCRL3、FCRL5、CR2、LTB、JCHAIN、IGLL5和CD79B)、抗原呈递(HLA-DRA、HLA-DMA和CD86)和稳态趋化因子(CXCL13、CCL19)、增殖和激活(MKI67和BTLA)(图2B)。这些基因的层次聚类提供了主动脉炎组与疾病对照组和正常主动脉组织的明确分离(图2D)。将主动脉组织分为主动脉炎和非炎症性动脉瘤的22个基因转录本与非淋系组织部位TLS的形成相关。主动脉炎病例包括局限型和广泛型GCA患者,对照组动脉瘤由动脉粥样硬化或遗传性主动脉疾病引起。基础疾病过程不影响22个TLS相关基因转录本的表达模式(图2E)。在主动脉炎中,CXCL13和CCL19的表达上调,而CCL21的表达上调,且与单核细胞聚集物的大小密切相关(图2F-G)。与对照组织相比,在主动脉炎组织中,淋巴细胞生存因子,如IL7、IL15和B细胞活化因子编码基因(TNFSF13B)的转录本表达均显著较高(图2G)。基因集富集分析(GSEA)证实了人体组织常驻记忆T细胞(Trm)特征的富集。促进TLS内TFH样T细胞和年龄相关B细胞之间相互作用的TNFSF8和TNFRSF8在主动脉炎组织中也高度升高(图2G)。
组织浸润的CD45+免疫细胞在主动脉炎中高度富集。为了捕获与结构化淋巴滤泡形成相关的细胞元件,他们对bulk RNA-seq数据进行了CIBERSORT分析(图2H)。两种组织来源均表达基因模式,表明静息CD4+记忆T细胞和单核细胞。然而,某些细胞类型的基因表达谱在血管炎组织中富集甚至特化。活化的CD4+记忆T细胞和记忆B细胞仅存在于主动脉炎中(图2H)。大多数组织浸润T细胞在主动脉炎中处于静息状态(图2I)。总之,组织转录组学证实了自身免疫性疾病影响的TLS进入主动脉壁的组织形态学数据,并为组织驻留T细胞的小亚群原位活化提供了证据。

图2. 炎症的主动脉壁表现出TLS转录组特征。
(A-B) 主成分分析(PCA)和火山图显示了主动脉炎和非发炎动脉瘤之间的DEG。(C) 图中显示了GCA主动脉炎的前10条富集通路。(D) 层次聚类热图显示了22个与主动脉炎和非炎症性动脉瘤中TLS形成(TLS基因标记)相关的转录本。(E) 亚组分析比较TLS基因标记在指定的临床亚型。(F) CXCL13、CCL19和CCL21的TLS大小和每百万转录本(TPM)值是相关的。(G) 比较主动脉炎和疾病对照中TLS相关基因。(H) 对RNA-seq数据进行CIBERSORT分析,定量评估主炎患者和疾病对照组的免疫细胞浸润情况。(I) 显示了动脉炎中静止和激活的CD4+记忆T细胞的估计比例。
03
血管炎组织内的CD4+ T细胞是异质的
为了揭示CD4+ T细胞参与自身免疫性血管炎的异质性,他们试图从未接受免疫抑制治疗的动脉中分离组织CD4+ T细胞。他们用来自活动期GCA患者的外周血单个核细胞(PBMC)重建了免疫缺陷非肥胖糖尿病小鼠(NOD)严重联合免疫缺陷(scid) γ (NSG)小鼠的动脉,并诱导其血管炎。在炎症动脉中,浸润组织的T细胞在血管外膜中形成致密聚集物。从切除的动脉中分离出CD4+ T细胞用于单细胞转录组分析 (scRNA-seq)。保留了680个CD4+ T细胞,每个细胞中位数为2122个基因。为了直接比较来自诱导性血管炎的scRNA-seq数据和来自主动脉样本的bulk RNA-seq数据,他们将scRNA-seq数据合并成一个伪批量数据集。85%的基因在两个数据集中重叠,表明实验性血管炎和自发性人类血管炎的T细胞群高度相似。对scRNA-seq转录本的聚类分析得到5个聚类,5个聚类之间的DEG分析显示其转录组谱存在显著差异(图3A-C)。
聚类0的特征是转录因子(TF) TCF7(编码TCF1)、LEF1和FOXO1的表达,存活相关基因(IL7R)和共刺激分子(CD28、CD27、FAS和CD226)的表达较高,但CD38的表达不高。聚类0还表达与淋巴组织归巢相关的主要趋化因子受体(CCR7、CXCR3和CXCR5)以及参与DC募集的GPR183基因(图3D-E)。聚类2的不同基因转录包括TF BCL6、MAF和TOX2,以及与B细胞辅助功能相关的基因(如IL21、CXCL13和TNFSF8),将它们确定为TFH样细胞(图3D-E)。区分聚类2和聚类4的基因图谱包含细胞周期基因ME2F8、MKI67、PCNA和MCM2。区分基因聚类2和4的基因图谱包含细胞周期基因ME2F8, MKI67, PCNA和MCM2。区分基因聚类3的基因包括EOMES和SLAMF7,以及参与细胞毒性的基因如PRF1, NKG7, GZMB和GZMK。聚类3表达趋化因子CCL4和CCL5的转录本(图3D)。
根据这些发现,他们将这些聚类分别注释为TCF1hi CD4+ T细胞(聚类0)、TFH样T细胞(聚类1)、循环(聚类2和聚类4)和细胞毒性CD4+ T细胞(聚类3)。TCF1hi CD4+ T细胞缺乏TOX驱动的耗竭和EOMES驱动的细胞毒性程序的转录证据(图3E)。PRDM1[编码B淋巴细胞诱导成熟蛋白1 (BLIMP-1)]和TCF7的表达是相互排斥的(图3E),这与BLIMP-1抑制TCF1和IL7R一致(图3E)。尽管抑制性标志物(如TOX、PDCD1和TIGIT)高表达(图3E-F),但细胞毒性CD4+ T细胞表达了较高数量的TBX21和IFNG,使其能够发挥致病效应功能(图3E-F)。表达FOXP3的CD4+调节性T细胞非常罕见(图3E)。TCF1hi CD4+ T细胞表达TGFB1和SMAD3转录本(图3G),同时它还表达LTB,这对TLS的发展至关重要(图3H)。
从炎症动脉分离出的TFH样细胞高表达CSF2, CSF2编码粒细胞-巨噬细胞集落刺激因子(GM-CSF),而GM-CSF是一种专门参与单核细胞活化的促炎细胞因子(图3H),提示它们可能通过原位GM-CSF供应促进大动脉炎。基因特征分析显示聚类2表现出更强的T细胞受体(TCR)信号特征(图3I),表明聚类1和2的激活状态不同。
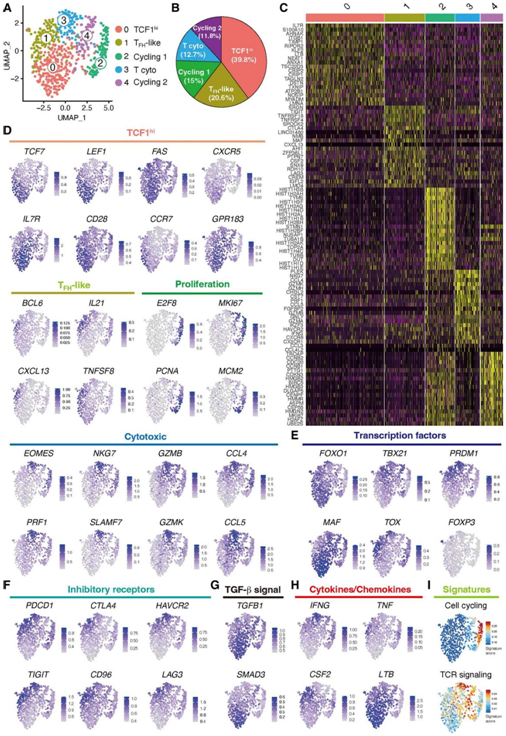
图3. scRNA-seq定义了血管源性CD4+ T细胞的多个亚群。
(A)UMAP可视化。 (B) 每个CD4+ T细胞子集的相对频率的圆形图显示。 (C) 图中显示了前20 DEG驱动血管壁浸润CD4+ T细胞异质性的热图。(D-H) UMAP可视化。
04
TCF1hi CD4+ T细胞产生TCF1lo效应细胞和循环CD4+ T细胞
为了探索上述CD4+ T细胞亚群之间潜在的谱系关系,他们使用Monocle3进行了伪时间分析。细胞轨迹从TCF1hiCD4+ T细胞开始,随后分为三个分支,其中两个分支发展为两种不同的效应细胞群,TFH样细胞和细胞毒性CD4+ T细胞。第三个分支产生循环CD4+ T细胞(图4A)。沿着预测的伪时间过程,TCF7表达逐渐减少(图3D),验证了TCF1hiCD4+ T细胞分化为TCF1lo效应性CD4+ T细胞并作为原位增殖CD4+ T细胞的来源。
为了验证这些结果,他们接下来单细胞TCR序列(scTCR-seq)分析,并检测了TCR克隆型是否在五个不同的T细胞群体之间共享。他们从70.7%的CD4+ T细胞中恢复了TRA和TRB的互补决定区3 (CDR3)序列,仅从10.2%的TRA和13.8%的TRB中恢复了CDR3序列(图4B-C)。它们将克隆定义为两个或多个具有相同的α或β TCR链CDR3序列的T细胞。TRA和TRB均有超过40%的克隆扩增,扩增的克隆类型存在于所有5个T细胞聚类中(图4D-E)。扩增的克隆型在不同的CD4 +T细胞亚群之间是共享的(图4F)。TCF1hi CD4+ T细胞与所有其他CD4+ T细胞聚类共享TCR克隆型(图4G-H)。
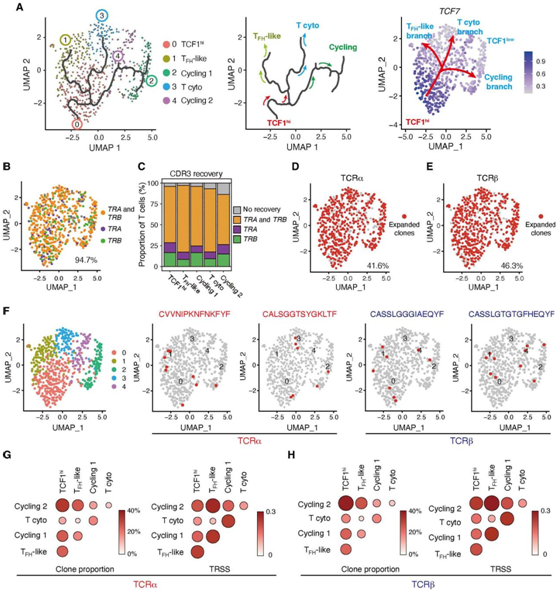
图4. 不同的血管源性CD4+T细胞亚群共享TCR克隆。
(A) 用Monocle3伪时间分析生成血管源性CD4+ T细胞的单细胞轨迹。(B-H) 通过单细胞TCR测序(scTCR-seq)分析组织源性CD4+ T细胞。(G-H)组织浸润性CD4+ T细胞亚群中TCRα和TCRβ的克隆重叠比例和TCR库相似性评分(TRSS)。
接下来,他们探讨了TCF7表达T细胞和效应分子表达T细胞在组织病变中是否保持了差异。TCF7在组织来源的CD4+ T细胞中的表达与若干效应分子(包括TBX21、EOMES、IFNG和GZMB)的表达呈负相关(图5A)。在PBMC中,T-box转录因子(TBX21)的表达,也称为T-bet,通常与效应分化相关,在主动脉炎患者和对照组的CD4+和CD8 +T细胞中与TCF1蛋白表达呈负相关(图5B-C)。为了从功能上表征TCF1hi和TCF1lo CD4+T细胞在自身免疫性疾病过程中的特征,它们检测了老年健康成人(64至83岁)T细胞亚群中TCF1的表达。在CD4+和CD8+ T细胞中,幼稚细胞和中央记忆T细胞(TCM)通常比效应记忆T细胞(TEM)和效应记忆CD45RA+ T细胞(TEMRA)表达更高浓度的TCF1蛋白(图5D),这表明TCF1表达是分化程度较低的T细胞的一个特征。他们分离出老年人的幼稚和记忆CD4+ T细胞,用CellTrace Violet标记,刺激其增殖。幼稚 CD4+ T细胞的子代在分裂早期增殖细胞中TCF1保持高表达。最终,TCF1lo种群出现(图5E-F)。相比之下,TCF1hiCD4+ T细胞在刺激前在记忆细胞群体中的比例低于50%,并且随着每次分裂逐渐降低(图5E-F)。患者来源的T细胞偏向于非效应T细胞。与健康对照相比,患者的非效应性CD4+ T细胞(幼稚 TCM细胞)比例较高,TEM和TEMRA频率较低(图5G)。在CD8 T细胞中观察到类似的偏态(图5H)。
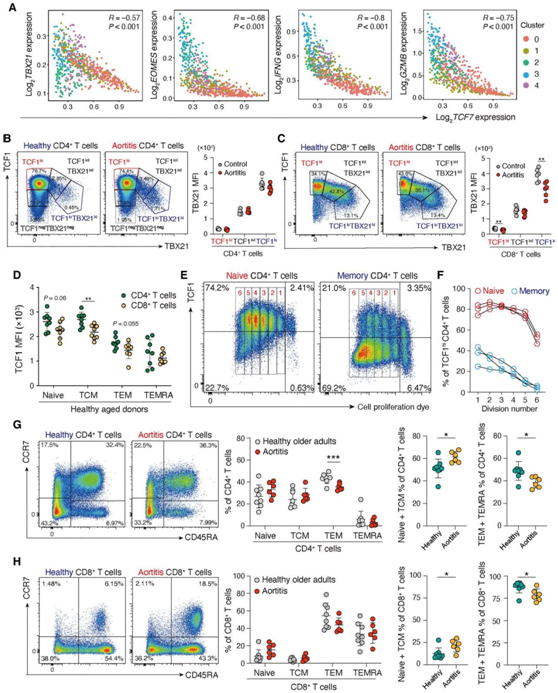
图5. TCF1表达与T细胞分化状态相关。
(A) 在血管病变个体CD4 T细胞scRNA-seq数据中,TCF7基因表达与TF TBX21和EOMES以及效应分子IFNG和GZMB相关。 (B-H) 从GCA主动脉炎患者和年龄匹配的对照组中收集PBMC,并通过流式细胞进行分析。
05
TCF1hiCD4+ T细胞优先驻留在TLS内,可能作为TEM细胞的储存库
为了验证组织来源的CD4+ T细胞的scRNA-seq的结果,他们鉴定了的功能性T细胞亚群。IF分析发现TCF1hi T细胞位于TLS内(图6A)。为了明确T细胞定位与TCF1表达的关系,他们确定了TCF1hi和TCF1lo T细胞在三个解剖位置的比例:外膜TLS区,外膜非TLS区和内侧室。超过50%的TLS- T细胞TCF1强阳性(图6A-C),其他部位超过80%的T细胞是TCF1lo。一致地,TCF1表达与TLS的大小相关(图6D)。
增殖标志物Ki67的IF将增殖的CD4+和CD8+ T细胞定位于外膜层(图6E-H),特别是定位于TLS(图6I-J)。细胞毒性CD4 +T细胞,定义为EOMES CD4 T细胞,存在于TLS内部和外部(图6K)。IF鉴定出在胚胎中心的TFH样细胞(图6L)。IFNG、IFNGR1和IFNGR2转录本在主动脉炎病例中有差异表达,GSEA提供了疾病病灶中持续存II型干扰素(IFN)信号传导的进一步证据(图6M-N),所有证据均支持产生IFN的细胞毒性CD4+ T细胞的存在。GSEA证实了在主动脉组织中TFH基因标记的富集和IL21基因转录的升高,支持TFH样细胞的存在(图6M-N)。
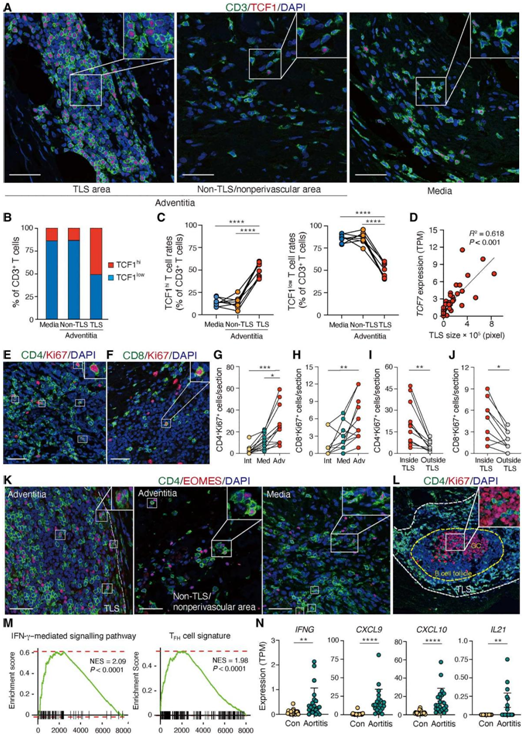
图6. TCF1hi CD4+ T细胞优先定位于TLS。
(A) IF染色显示GCA主动脉组织中TCF1hi T细胞的空间定位。 (B) 确定TCF1hi和TCF1lo T细胞在培养基、TLS区域内和非TLS区域内的比例。 (C) 显示了TCF1hi和TCF1lo T细胞在GCA主动脉炎个体中的分布。 (D) 结果显示22例GCA型主动脉炎和20例疾病对照的TCF7 TPM值与TLS大小的相关性。(E-F) 通过Ki67表达检测循环T细胞。 (G-H) 11例GCA主动脉炎的内膜、中膜和通气膜中CD4+ Ki67+和CD8+ Ki67+ T细胞的分布。 (I-J) 显示CD4+ Ki67+和CD8+ Ki67+ T细胞在TLS内外的位置。 (K-L) 双色IF分析。(M) 显示了IFN-γ介导的信号通路和TFH细胞特征在主炎和非炎症动脉瘤中的GSEA。(N) IFNG、CXCL9、CXCL10和IL21在主动脉炎和非炎症性动脉瘤进行比较。
他们确定了TCF1hi CD4+ T细胞在TLS中的分布。TCF1hi CD4+ T细胞归巢于T细胞区和T/B混合区(图7A-D)。在淋巴结中,DC网络在T细胞- B细胞区边界特别密集,CD11c+ DC映射到T细胞区,通常靠近B细胞区(图7E-G)。驻留在TLS中的CD11c+ DC形成了广泛的网络,为T细胞生存创造了专门的环境(图7E-H)。最后,CD11c+ DC通常包裹在HEV周围,在两种细胞类型之间建立间层细胞网络(图7I-J)。

图7. TCF1hi T细胞在特定的细胞邻域中存活。
(A-D) 图中显示了T/B细胞区、B细胞区、T细胞区的图谱以及不同区域TCF1hi T细胞的定量。 (E-F) CD11c+树突状细胞(DC)在T和B细胞区和混合区的组织分布。(G) 比较不同区CD11c+ DC的数量。 (H) Ki67染色鉴定增殖的CD11c+DC。(I) 显示直流微血管接触点。 (J) 定量测定与DC直接接触的TLS内αSMA+ 微血管的比例。
06
TCF1hiCD4+ T细胞具有疾病干细胞的功能
他们假设TCF1hi T细胞具有独特的致病作用,因为它们能够通过原位增殖补充T细胞浸润,产生效应T细胞,并以器官自主的方式维持自身免疫性血管炎,独立于循环免疫细胞。为了验证这一假设,他们设计了一系列移植实验,探索TCF1hi CD4+ T细胞的疾病维持能力。首先确定了IL-7受体(IL-7R)是与TCF7高表达相关的可分类表面标志物(图8A)。IL-7R的表达仅限于T细胞(图8B),高TCF1表达可区分IL-7R+ T细胞和IL-7R−T细胞(图8C)。使用IL-7R作为TCF1hi CD4+ T细胞的替代标志物,他们通过去除IL-7R+细胞来生成表达TCF1lo的GCA PBMC。然后,通过连续移植含IL-7R (IL-7R+)和去除IL-7R (IL-7R−)的PBMC,在人源化NSG小鼠中诱导血管炎(图8D)。为了将驻留在炎症动脉内的T细胞与驻留在血管外淋巴组织(主要是NSG小鼠的脾脏)内的T细胞分离,他们将炎症动脉连续移植到除移植物驻留细胞外无人类细胞的“空”小鼠中(图8D)。他们检测了主要和次要接受者血液和脾脏中的人类T细胞数量(图8E)。炎症的人动脉植入第二受体后,血管移植物中组织浸润的T细胞完全包围。在循环中未检测到人类细胞。通过组织学评分量化血管炎的强度,评估炎症的严重程度和扩散以及血管损伤的程度。缺乏IL-7R+细胞的PBMC诱发的血管炎的严重程度显著较轻(图8F-G),表明TCF1hi T细胞的致病相关性。
他们评估了IL- 7R+TCF1hi T细胞对血管重构的影响。去除血管炎诱导免疫细胞群中的IL-7R+细胞显著降低了VEGFA转录,并使移植物的新生血管生成减少(图8H-J)。他们比较了含有IL-7R和去除IL-7R的嵌合体重建的动脉中Ki67+ T细胞的比例。IL-7R+ T细胞群诱导的动脉炎症富含T细胞,包括高增殖率(Ki67+) T细胞(图8K-L)。去除IL-7R+细胞导致低级别炎症,缺乏两个主要效应分子IFNG和GZMB的转录物(图8M)。
总之,这些数据表明TCF1hiCD4+ T细胞是诱导可转移性和持续性血管炎所必需的,将它们定义为疾病干细胞。

图8. TCF1hiCD4+ T细胞具有疾病干细胞的功能。
(A) 从血管炎病灶分离的单个CD4+ T细胞中TCF7和IL-7R基因表达是相关的。(B) 流式分析。(C) 比较了IL-7R阳性(IL-7R+)和IL-7R阴性(IL-7R−)T细胞中的TCF1表达。(D) 连续移植实验的方案。 (E) 定量了血液(100 μl)和用IL-7R+或IL-7R- PBMC重建的NSG小鼠脾脏中的人T细胞数量。(F-M) 从切除的动脉中制备组织切片,评估血管炎的强度。
+ + + + + + + + + + +
结 论
本项研究对血管炎动脉中的免疫细胞群进行的单细胞和全组织转录组学研究,发现了具有干细胞样特征的CD4+ T细胞群。组织浸润和组织损伤效应T细胞的CD4+ T细胞在血管外膜周围的三级淋巴结构中存活,表达转录因子T细胞因子1 (TCF1),具有高增殖潜能,并产生两种效应细胞群: EOMES+细胞毒性T细胞和B细胞淋巴瘤6 (BCL6)+滤泡辅助性T细胞。在一系列移植实验中,表达白细胞介素7受体(IL-7R)的TCF1hiCD4+ T细胞持续发生血管炎。因此,TCF1hiCD4+ T细胞具有疾病干细胞的功能,并促进自身免疫组织炎症的慢性化和自主性。本项研究证明诱导缓解的疗法将需要靶向干细胞样CD4+ T细胞,而不仅仅是效应T细胞。
+ + + + +



 English
English


