自噬(13.391):甲状腺激素通过MTOR信号通路介导线粒体自噬并促进线粒体生成以增强棕色脂肪活性
✦ +
+
论文ID
原名:Thyroid hormone (T3) stimulates brown adipose tissue activation via mitochondrial biogenesis and MTOR mediated mitophagy
论文ID译名:甲状腺激素通过MTOR信号通路介导线粒体自噬并促进线粒体生成以增强棕色脂肪活性
发表期刊:Autophagy
影响因子:13.391
发表时间:2019.1
DOI号:10.1080/15548627.2018.1511263
背 景
甲状腺激素可分为thyroxine (T4)和3,5,3ʹ-triiodothyronine (T3)两类,后者是主要的活性形式。T3在机体内作用极为广泛,对维持机体代谢稳态至关重要。棕色脂肪组织BAT(Brown adipose tissue)由含有大量线粒体和小脂滴的脂肪细胞构成,能特异性表达解耦联蛋白1(Uncoupling protein 1, UCP1),对于非战栗性产热十分重要,调控BAT的发育和功能被认为是治疗代谢性疾病如肥胖的重要手段。研究表明,小鼠胚胎BAT中表达DIO2基因,该基因可以将外周组织T4转化为T3,靶向干扰DIO2的表达会抑制小鼠的脂肪沉积以及小鼠的适应性产热,这些现象在小鼠成年后由于DIO2缺失导致T3不足而仍然存在,这表明,T3可能影响小鼠BAT的早期发育过程。与正常小鼠相比,在甲亢小鼠中存在更多的BAT,更高水平的脂肪酸氧化以及葡萄糖摄取量,但相关机制尚未明晰。此外,T3既能通过刺激神经系统诱导DIO2的表达,从而促进T4向T3的转变,又能直接刺激胚胎小鼠棕色脂肪细胞UCP1的表达,因此,T3和BAT之间的关系有待于进一步阐明。自噬是真核细胞内高度保守的溶酶体介导的降解机制,主要负责清除错误折叠的蛋白质、受损的细胞器等,根据底物靶向运输至溶酶体方式的不同,自噬可分为巨自噬(Macroautophagy)、微自噬(Microautophagy)和分子伴侣介导自噬(Chaperonemediated autophagy)。近年来,越来越多的研究聚焦于自噬在BAT中发挥的作用。
实验设计

结 果
01

T3能诱导小鼠BAT和棕色脂肪细胞产生自噬
首先,作者作出初步假设,T3能促进小鼠脂肪组织产生自噬,并通过检测甲亢小鼠棕色脂肪组织中自噬发生的标志性蛋白SQSTM1/p62以及MAP1LC3B-II的表达水平(图1 A),以及自噬小泡数量的增加来说明T3确实促进了自噬的发生(图1 B),并且这种促进作用与T3作用时间和剂量呈依赖关系(图1 C),为了增强说服力,排除事件发生的或然性,作者进一步结合体外实验,利用T3处理小鼠原代棕色脂肪细胞后检测自噬小泡数量以及自噬流,发现T3在体外试验中同样能促进自噬的产生(图1 D-G)。
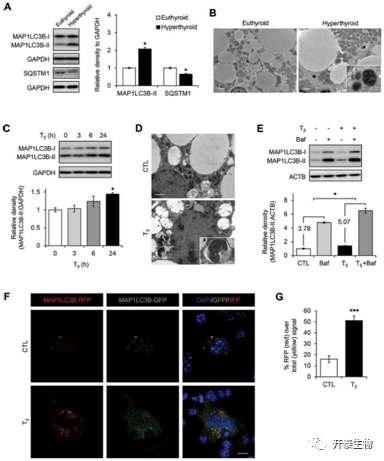
图1 T3诱导BAT和原代棕色脂肪细胞中的自噬通量增加
02

T3能诱导小鼠棕色脂肪组织中线粒体自噬
接着,因为作者此前研究发现T3能在骨骼肌和肝脏中诱导线粒体自噬,由于棕色脂肪组织(BAT)同样含有大量线粒体,于是便通过类比推测T3在BAT中同样能诱导线粒体自噬以维持线粒体的动态平衡,为了验证这一设想,作者利用自噬专一性抑制剂Chloroquine (CQ)处理甲亢小鼠BAT后,检测线粒体标志蛋白COX411以及TOMM20蛋白表达水平发现(图2 A),与未处理的甲亢小鼠相比,CQ处理组的这两个蛋白表达水平增加,也就是说T3促进线粒体自噬的效果被CQ抑制,联合其他实验结果(图2 B-E),说明T3确实能促进线粒体自噬。
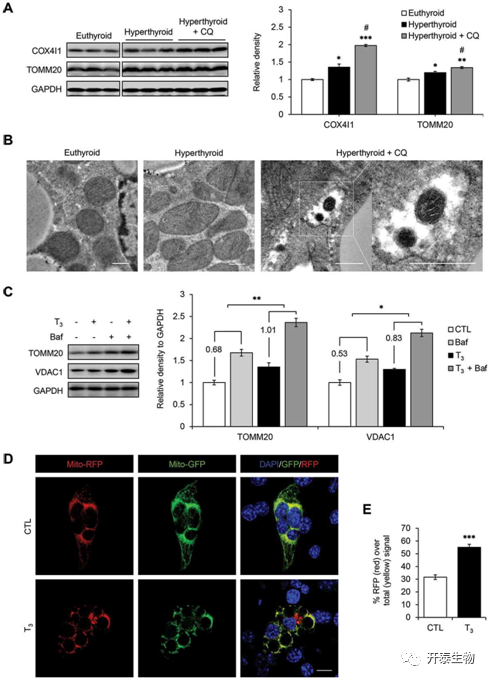
图2 T3增加了BAT和原代棕色脂肪细胞的线粒体自噬水平
03

T3能诱导小鼠棕色脂肪中线粒体的合成
然而,由于甲亢小鼠的一个重要表型是产热量较正常小鼠高,而线粒体是产热的重要来源,T3处理后,线粒体因自噬而导致数量减少,逻辑上的结果是使得甲亢小鼠产热减少,与实际观察到的事实不符,那么是否就说明作者原本的假设被证伪了呢?于是作者进一步设想T3是通过同时促进棕色脂肪中新的线粒体的产生以及衰老、损伤线粒体的清除以起到促进产热的作用。实验结果也表明,T3确实能促进线粒体的合成(图3),在甲亢小鼠BAT中,产热基因UCP1、Prdm16、Ppargc1a、脂肪酸氧化及脂解相关基因Cpt1b、Acsl1 线粒体蛋白Lipe、Pnpla2表达增加(图3 A-C),同样,在体外,T3作用下,原代棕色脂肪细胞中产热以及线粒体相关基因与蛋白表达增加(图3 D-E)。那么,如何才能说明T3促进线粒体生成的能力强于促进线粒体分解的能力呢?作者采用了一种能特异性报告线粒体的荧光质粒(pMitoTimer plasmid),这种质粒能使得新生线粒体发出绿色荧光,成熟线粒体发出红色荧光,结果发现T3处理棕色脂肪细胞后,随时间推移,绿色荧光数量逐渐增加,而红色荧光数量逐渐减少,即新生线粒体逐渐变多,成熟线粒体逐渐减少,说明T3促进线粒体生成作用占主体地位(图3 F)。
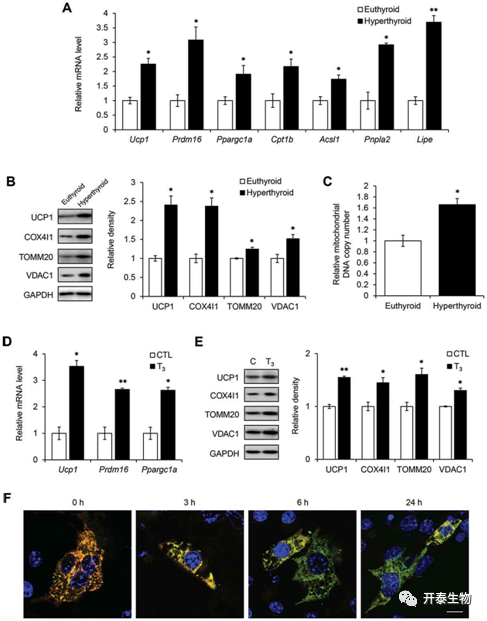
图3 T3促进BAT和原代棕色脂肪细胞中的线粒体生物发生和线粒体周转
04

T3能增强小鼠棕色脂肪中线粒体活性
接着作者想探究T3对棕色脂肪线粒体自身存在何种影响(图4),发现甲亢小鼠BAT中,长链和短链酰基肉碱的含量以及Cpt1b的表达显著增加(图4 A、B)。检测T3作用24h后检测OCR发现(图4 C),原代棕色脂肪细胞基础耗氧率和最高耗氧率均显著增加,并且短时间内(30min),T3就能增强原代棕色脂肪细胞的线粒体呼吸(图4 C-F)。
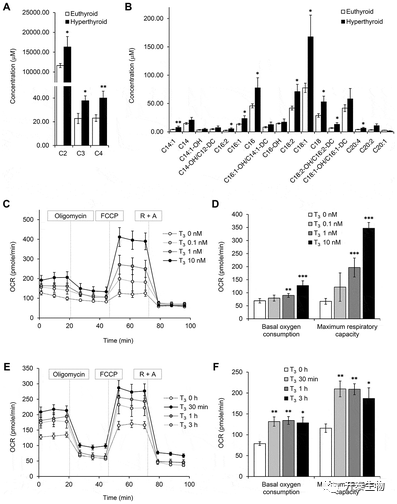
图4 T3增加了BAT和原代棕色脂肪细胞中的脂肪酸氧化和线粒体呼吸
05

T3诱导自噬,促进线粒体周转保护其免受氧化应激
进而产生的一个问题是,既然T3能同时促进线粒体自噬和线粒体生成,那么线粒体自噬对维持线粒体正常功能又什么作用呢?
于是,作者在T3处理后,沉默自噬关键基因ATG5以及采用另一种自噬专一性抑制剂Bafilomycin A1(Baf)后发现,两种处理均能阻碍原代脂肪细胞基础和最高耗氧率的增加,并使得原代棕色脂肪细胞中羰基蛋白质含量增加。(图5 E)。线粒体是细胞中生产ATP,也是发生氧化磷酸化(OXPHOS)的主要场所,线粒体有氧呼吸过程中,会产生大量的氧自由基(ROS),ROS反应活性高,能迅速与细胞内各种生物大分子反应引起细胞水平上的损伤,其中包括 DNA、脂质和蛋白质的氧化损伤。蛋白质羰基化是蛋白质氧化损伤中的一种,其本身是氧化应激中的一种不可逆的化学修饰,指的是氨基酸残基侧链受到氧自由基攻击最后转变成羰基产物。并且T3处理后,棕色脂肪细胞中抗氧化酶mRNA表达水平无明显变化,只有当自噬被抑制后,抗氧化酶的表达水平才有所增加,这些发现表明,线粒体自噬在维持线粒体的质量控制中起重要作用,这种作用是通过阻止T3处理过的棕色脂肪细胞中ROS的积聚来实现的,进而说明线粒体自噬对于线粒体正常功能起重要作用。
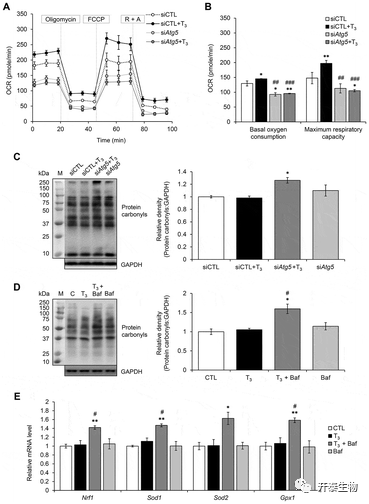
图5 抑制自噬导致氧化应激增加,并降低原代棕色脂肪细胞的线粒体活性。
06

T3诱导线粒体自噬从而促进线粒体周转保护免受氧化应激
那么自噬对于甲亢小鼠机体产热的影响是什么呢?又是如何影响的呢?将甲亢小鼠BAT的Atg5特异性敲除后,发现与对照组相比,敲除组的体温相对降低(图6 B),且BAT特异性敲除Atg5 的甲亢小鼠中羰基蛋白质和变形线粒体的含量增加(图6 C-D)。实验结果表明,T3诱导自噬,促进线粒体周转保护其免受氧化应激。
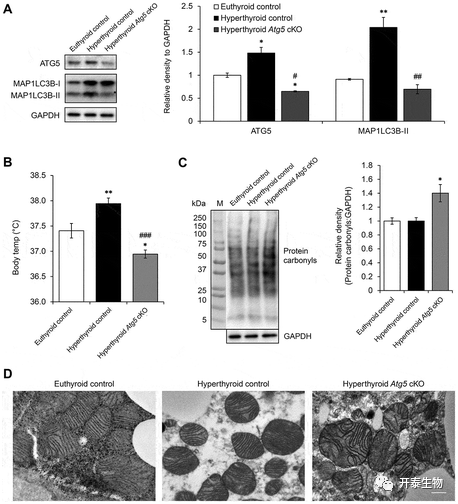
图6 特异性抑制BAT中的自噬可消除T3介导的产热作用。
07

T3能通过MTOR信号通路调控自噬,SIRT1则调节mTOR活性和T3介导的自噬
作者随机进一步展开T3与自噬的机制研究,由于MTOR信号通路是一条经典的自噬相关通路,并且前人研究表明T3与MTOR信号通路有关,作者首先检测了甲亢小鼠BAT以及棕色脂肪细胞中MTOR相关蛋白的表达水平,结果发现,甲亢小鼠BAT和棕色脂肪细胞中磷酸化的MTOR 、EIF4EBP1、RPS6KB含量减少,且BAT中多种氨基酸的含量减少(图7)。
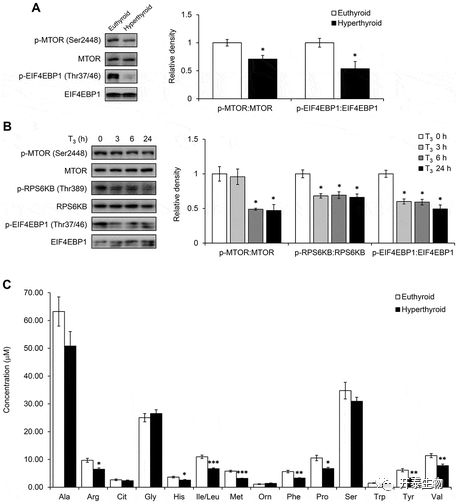
图7 T3抑制了BAT和原代脂肪细胞中的MTOR表达
文章最后发现甲亢小鼠BAT中,FOXO1乙酰化水平下降,其靶基因表达增加,表明T3处理激活脱乙酰基酶SIRT1,并最终证实SIRT1活性和自噬诱导对线粒体功能很重要。
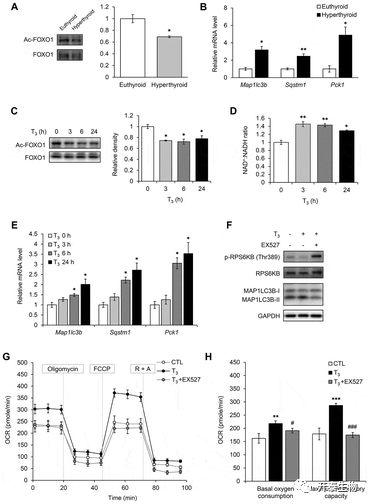
图8 T3激活了BAT和原代脂肪细胞中的SIRT1
+ + + + + + + + + + +
结 论
T3对BAT的线粒体自噬、活性和周转有直接影响,而BAT是产热所必需的,通过甲状腺激素或其类似物来刺激BAT活性可能是肥胖和代谢性疾病的潜在治疗策略。
+ + + + +



 English
English

