文献解读|Nat Commun(14.7):FH缺陷型肾细胞癌的全面分子分析可确定分子亚型和潜在治疗靶点
✦ +
+
论文ID
原名:Comprehensive molecular profiling of FH-deficient renal cell carcinoma identifies molecular subtypes and potential therapeutic targets
译名:FH缺陷型肾细胞癌的全面分子分析可确定分子亚型和潜在治疗靶点
期刊:Nature Communications
影响因子:14.7
发表时间:2025.05.12
DOI号:10.1038/s41467-025-59513-8
背 景
富马酸水合酶缺陷型肾细胞癌(FH 缺陷型 RCC)是一种罕见的肾细胞癌(RCC)疾病,由FH基因的双等位基因失活引起。虽然FH 缺陷型 RCC 罕见,但它几乎普遍致命,即使肿瘤很小也表现出明显的侵袭和转移趋势,这对治疗提出了重大挑战。FH 基因的缺失导致富马酸在细胞内积累,富马酸(又称为延胡索酸)是一种公认的致癌代谢物,可显著影响致癌信号传导、抗氧化反应和表型变化。这些影响包括:1) 抑制 αKG 依赖性双加氧酶,导致整体 DNA 和组蛋白高甲基化,以及 HIF1α2的稳定;2) 蛋白质琥珀化,激活抗氧化途径;3)诱导假缺氧状态,驱动代谢重组和细胞增殖;4)促进高甲基化表型,导致上皮-间质转化(EMT)和同源重组DNA修复缺陷;5)诱导线粒体DNA和RNA释放,驱动先天免疫和干扰素产生。然而,将这些见解转化为有效的靶向疗法仍然具有挑战性。
实验设计
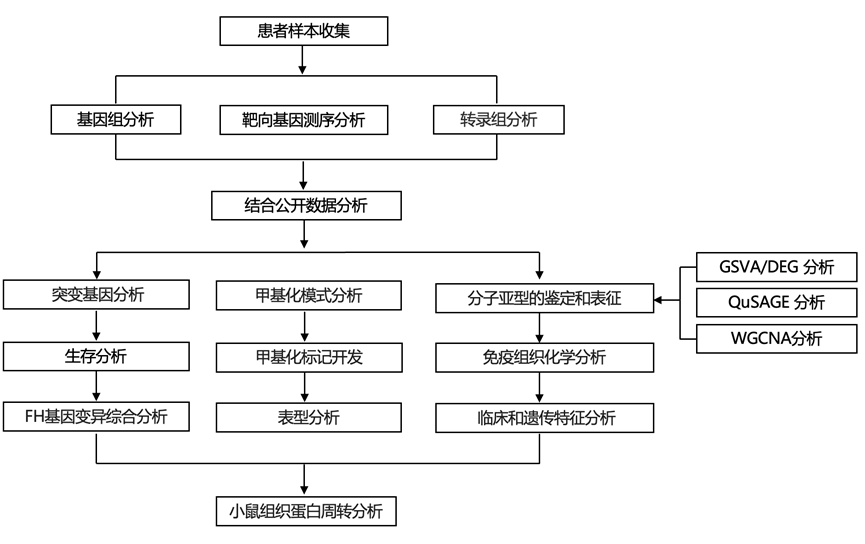
结 果
01
FH缺陷型RCC的体细胞突变和拷贝数变异概况
从 2014 年到 2023 年,研究团队从多中心数据库中共提取了 126 名未经治疗的 FH 缺陷型 RCC 患者,并进行了基因组和转录组分析(图 S1a-b)。所有 126 名患者均获取了福尔马林固定石蜡包埋 (FFPE) 样本,其中 116 名患者接受了肾切除术,10 名患者接受了肾活检。
对 71 个样本进行了全外显子组测序 (WES) 以检测基因变异,同时对另外 9 个样本进行了靶向基因测序(panel sequence)(图 S1b)。除了FH变异外,FH 缺陷型 RCC 中最常见的突变基因是TTN (20%,16/80)、NF2 (15%,12/80)、FAT1 (9%,7/80)、KMT2D (9%,7/80) 和MUC16 (9%,7/80)。虽然TTN和MUC16也是当前队列中最常见的突变基因(图 1a),但它们大多为乘客基因(passenger gene)。跨RCC类型的分析显示,在TCGA队列中,FH缺陷型RCC的突变谱与KIRC、KIPP或KICH(肾嫌色细胞癌)存在显著差异(图 1a)。
先前的研究表明NF2的体细胞突变促进肿瘤转移。在本研究的队列中,相关性分析显示,与不携带NF2突变的患者相比,携带NF2突变的肿瘤ISUP/WHO分级更高,Ki-67指数更高,同步转移发生率更高,尤其是骨转移。生存分析显示,同时存在的NF2突变可能会阻碍TKI单药治疗的有效性,而对免疫检查点阻断剂(ICB)加酪氨酸激酶抑制剂(TKI)联合治疗FH缺陷型RCC的疗效没有明显影响(图1b-c)。但由于样本量有限,且接受 ICB 加 TKI 治疗的NF2野生型患者的中位生存期未达到,这些差异需要进一步验证。
他们在FH缺陷型肾细胞癌中鉴定出三个显著的突变标记(M1、M2和M3)(图1d)。标记M1和M3分别对应COSMIC(癌症体细胞突变目录)标记SBS6(DNA错配修复)和SBS40(未知)。标记M2与COSMIC标记SBS22高度相似,后者与马兜铃酸暴露有关,马兜铃酸是一种中草药成分,与肾损伤和肾细胞癌致癌作用相关。相比之下,先前的研究报告称,SBS5和 SBS124在 ccRCC 和乳头状 RCC (pRCC)中更主要,而 SBS17在 chRCC中主要主要,表明与其他 RCC 亚型相比,FH 缺陷型 RCC 具有不同的突变谱。与具有种系FH突变的患者相比,具有体细胞FH改变的患者显示 SBS22 的贡献更高,证实马兜铃酸暴露可能是中国队列中体细胞 FH 缺陷型 RCC 的致癌因素。此外,他们发现与具有标记 M1 和 M3 的患者相比,具有标记 M2 的患者具有更高的 TMB 和截短突变负担(图1e)。生存分析进一步表明,具有 M2 标记的患者比具有其他标记的患者具有更高的复发风险(图1f)。
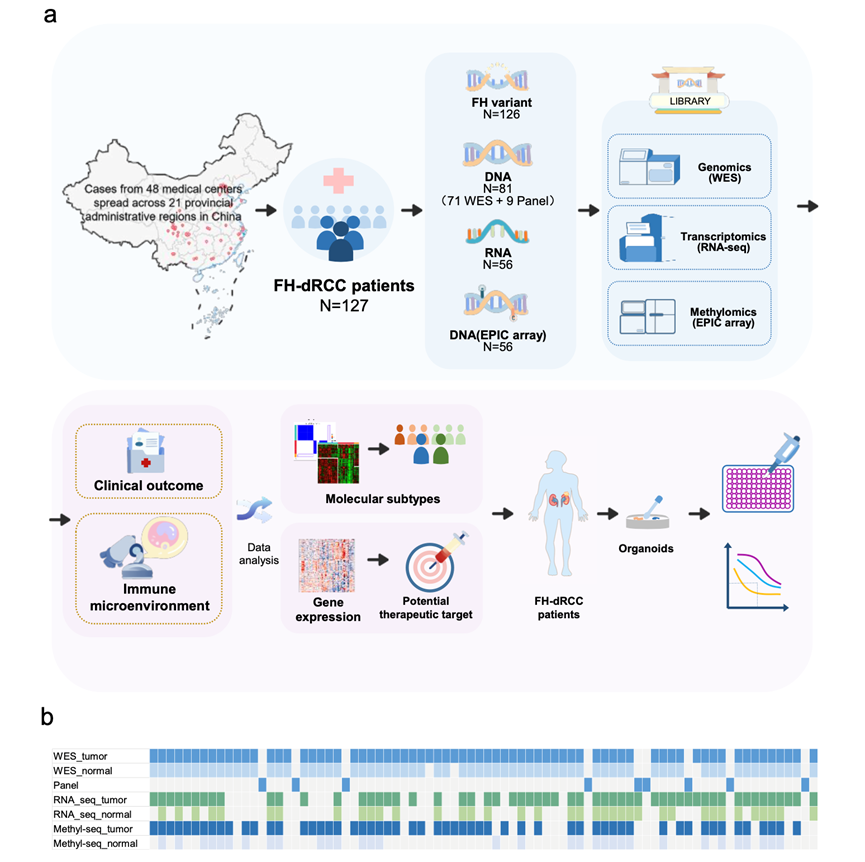
图S1. 研究设计概述。
(a)实验流程图。(b) 显示每个样本测序细节的热图。
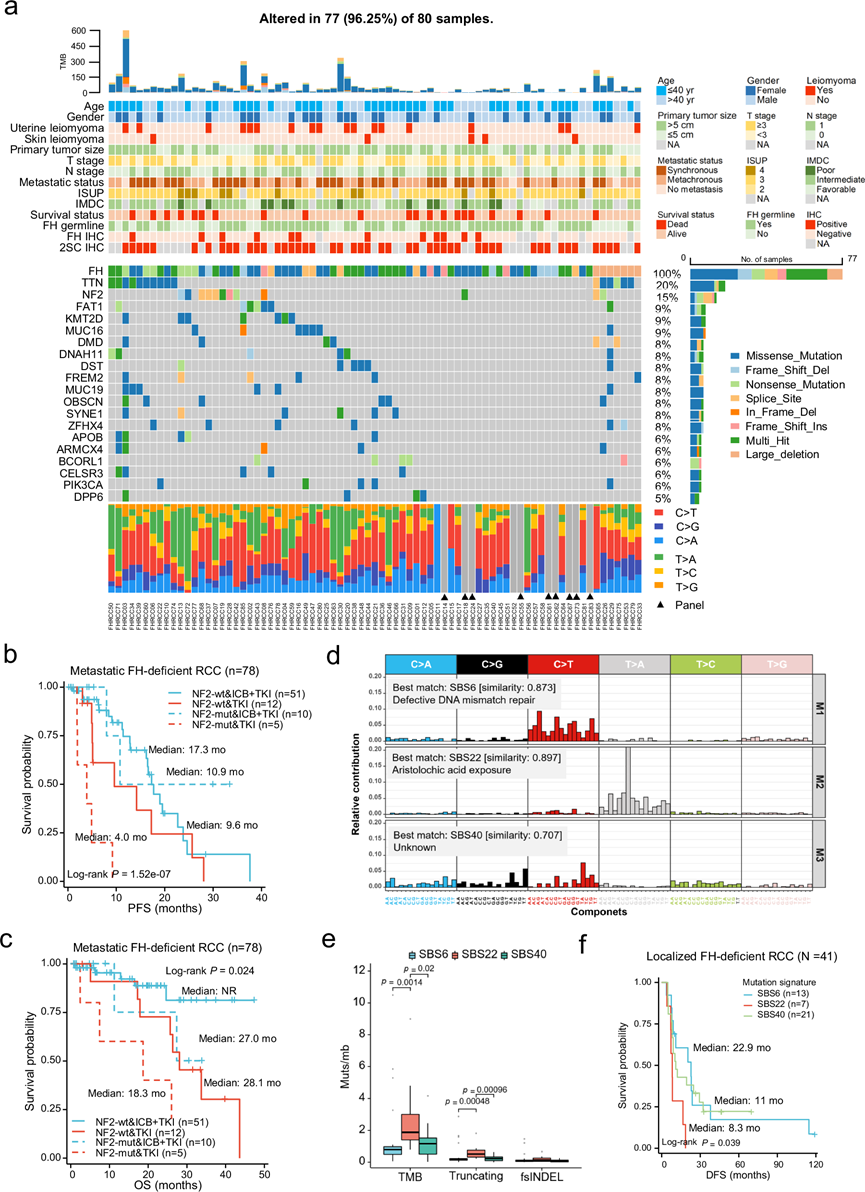
图1. FH 缺陷型 RCC 的突变图谱。
(a) 热图显示 77 例 FH 缺陷型 RCC 病例的临床病理特征(上)。Oncoplot 显示了 77 例 FH 缺陷型 RCC 病例的体细胞变异的整体情况(下)。(b) Kaplan-Meier 曲线显示接受一线 ICB+TKI 或 TKI 单药治疗时有和无NF2体细胞突变的患者的 PFS。(c) Kaplan -Meier 曲线显示接受一线 ICB+TKI 或 TKI 单药治疗时有和无NF2体细胞突变的患者的OS。 (d) 在进行 WES 的 71 例 FH 缺陷型 RCC 病例中检测到三种主要突变特征,即 SBS6、SBS22、SBS40。(e) 箱线图使用 Kruskal-Wallis 检验展示了具有不同突变特征且贡献。(f) Kaplan-Meier 曲线显示具有不同突变特征的局部患者的 DFS。
02
FH 缺陷型 RCC 中FH变异的综合分析
最近的研究表明,FH的不同变异导致不同程度和机制的催化活性降低,这可能与 FH 缺陷型肾癌的肿瘤行为有关。因此,他们对本组 FH 缺陷型肾癌的FH变异模式进行了全面评估。在本研究的 126 例病例中共检测到159 种FH变异,包括 72例(45.3%)体细胞FH变异和 87 例(54.7%)种系FH变异(图 2a)。值得注意的是,他们观察到FH体细胞突变患者和种系突变患者的FH变异谱不同。与体细胞FH变异相比,错义突变对种系FH变异的贡献最大,而无义突变和大片段缺失在体细胞FH变异中比种系FH变异更常见(图2b)。共计66例FH基因存在2个突变,其中8例(12.1%)存在1个以上的FH突变,37例(56.1%)同时存在FH突变和杂合性缺失(LOH),7例(10.6%)同时存在FH突变和FH基因启动子高甲基化,1例(1.5%)同时存在FH突变和1q缺失,11例(16.7%)同时存在大片段缺失和LOH,1例(1.5%)同时存在FH突变、大片段缺失和LOH,1例(1.5%)同时存在FH突变、大片段缺失和FH基因启动子高甲基化。
总共有 55 名(43.7%)患者表现出FH截短突变,52 名(41.3%)患者表现出FH非截短突变,其余 19 名(15.1%)患者含有FH大缺失(图 2c)。与含有 FH 非截短突变的肿瘤相比,在含有 FH 截短突变和大缺失的肿瘤中观察到 FH 的 mRNA 表达水平较低(图2d)。无义突变介导的衰变预计会降解截短突变的 mRNA,他们确实注意到一小部分病例在肿瘤细胞中通过免疫组织化学分析(IHC)显示保留的 FH 蛋白表达,并且几乎所有通过 IHC FH 蛋白表达较弱的病例都含有FH非截短突变(图 2e)。值得注意的是,与FH非截短突变和FH缺失的患者相比,FH截断突变的肿瘤更具侵袭性,具有更大的肿瘤大小和更高的 T 分期(图 2f)。此外,他们还发现了FH突变模式与 ICB + TKI 联合治疗的临床结果之间的关联(图 2g-h)。具体而言,与截短突变患者相比,非截短突变患者的 PFS 更长。而在接受 TKI 单药治疗的患者中,不同突变模式患者的 PFS 和 OS 无统计学意义。
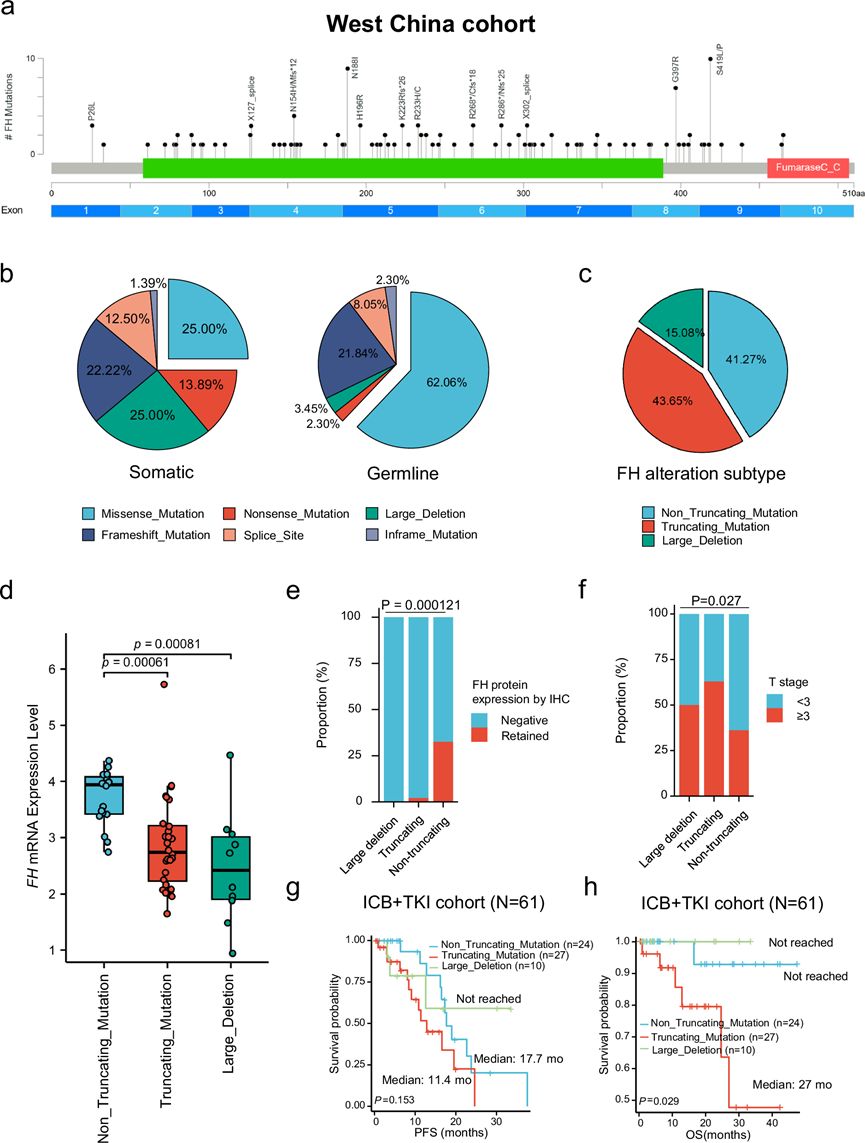
图2. FH基因变异的综合分析。
(a) 棒棒糖图显示FH种系和体细胞变异的类型和位置。(b) 饼图显示体细胞(上)和种系(下) FH变异的变异类型分布。(c) 饼图显示三种 FH 变异亚型(非截短突变、截短突变、大片段缺失)的比例。(d) 箱线图显示不同FH变异亚型患者的FH mRNA 表达水平。(e) 条形图显示不同FH变异亚型患者IHC表达FH蛋白的比例。(f) 条形图显示不同FH变异类型患者T分期<3和≥3的比例。(g) Kaplan-Meier曲线显示接受一线ICB+TKI治疗的不同FH变异类型患者的PFS。(h) Kaplan-Meier曲线显示接受一线ICB+TKI治疗的不同FH变异类型患者的OS。
03
FH 缺陷型 RCC 中的甲基化模式以及 FH 缺陷型 RCC 甲基化特征的鉴定
合并FH缺陷型RCC和TCGA KIRP队列数据后,他们发现大多数FH缺陷型RCC病例属于CpG岛甲基化表型(CIMP)聚类,其余10例属于非CIMP聚类(图 3a)。与非CIMP肿瘤相比,CIMP表型的肿瘤具有更高的TMB负担、截断负担(图 3b)和22q中的缺失频率。转录组分析表明,与非 CIMP 肿瘤相比,CIMP 肿瘤中参与细胞周期和 EMT 通路的上调基因更丰富,提示 CIMP 表型肿瘤具有侵袭性。与这些结果一致,与非 CIMP 表型肿瘤相比,CIMP 肿瘤具有更高的复发倾向和同步转移倾向(图3c-d)。此外,有证据表明,与非 CIMP 肿瘤相比,CIMP 肿瘤的 DNA 甲基化特征明显更高。他们注意到CIMP肿瘤的PD-L1阳性率高于非CIMP肿瘤(图 3e)。
利用FH缺陷型RCC甲基化标记,KIRP队列中的5例病例归类为FH缺陷型RCC,并命名为“KIRP_suspicious_FH”(图 3f-g)。“KIRP_suspicious_FH”病例中的FH mRNA表达显著低于KIRP,但与TCGA队列中已知的HLRCC相当(图 3h)。值得注意的是,所有5例肿瘤均表现出FH缺陷型RCC的典型形态学特征,包括嗜酸性的胞浆、增厚的核膜、嗜酸性大的核仁、嗜酸性的大核以及核周晕(图 3i)。此外,他们还发现了两例 FH 缺陷型 RCC 病例,其FH基因拷贝数缺失(图 3i),强调了在诊断 FH 缺陷型 RCC 时额外进行 FH IHC 染色的必要性。
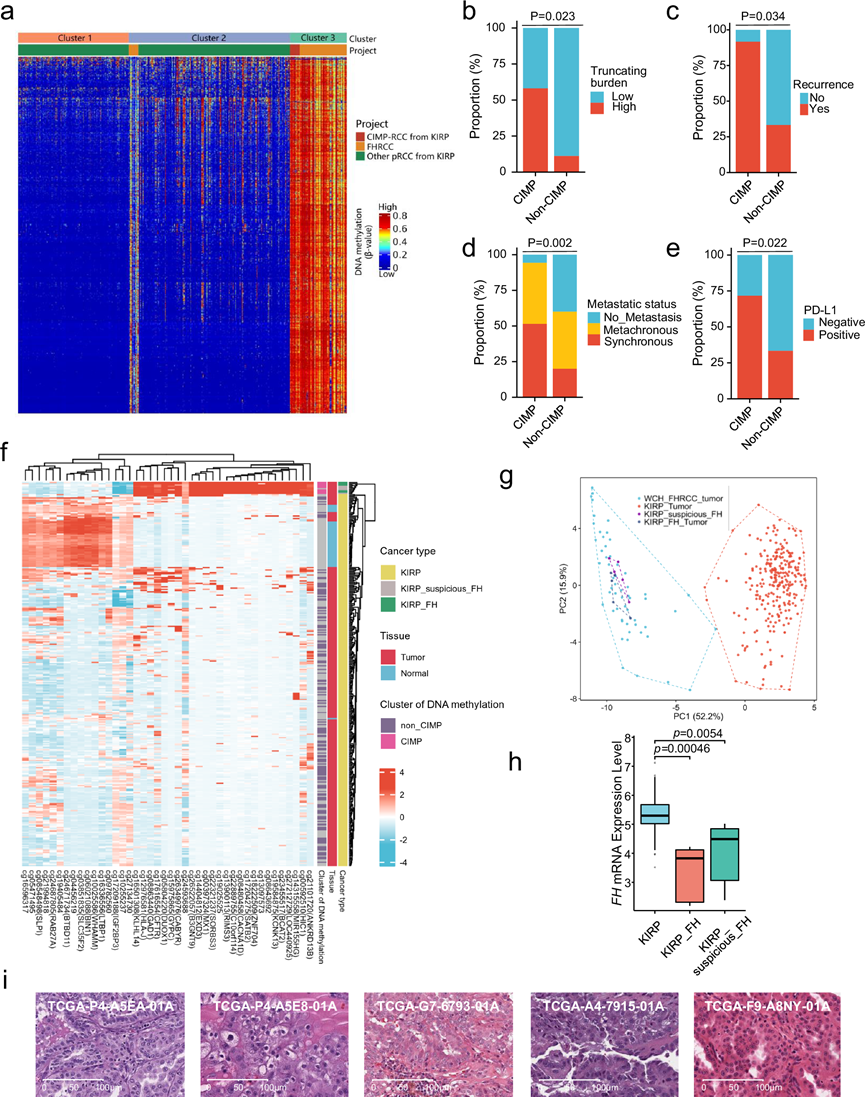
图3. FH 缺陷型 RCC 中的甲基化模式。
(a) 对 2000 个变异最大的 DNA 甲基化探针进行一维层次聚类。(b) 条形图显示了 CIMP和非 CIMP组中的患病率截短突变负担。(c) 条形图显示了 CIMP和非 CIMP组中的复发状态的患病率。(d) 条形图显示了 CIMP和非 CIMP组中的转移状态的患病率。(e) 条形图显示了 CIMP和非 CIMP组中通过免疫组织化学显示的 PD-L1 表达的患病率。(f) 对 42 个 CpG 位点进行一维层次聚类,使用FH 缺陷型 RCC 甲基化特征中的 42 个 CpG 位点,将 TCGA KIRP 队列中的样本分为三个聚类。(g) 主成分分析,分析基于源自 FH-deficient RCC 甲基化特征的 42 个 CpG 位点。(h) 箱线图描绘了FHTCGA数据库中KIRP、KIRP_FH、KIRP_suspicious_FH的mRNA表达水平。(i) 代表性H &E染色显示5个“KIRP可疑FH”样本的形态模式。
04
FH缺陷型RCC三种分子亚型的鉴定和表征
为了深入了解 FH 缺陷型 RCC 的生物学特征,他们采用了无监督共识分割方法40 来识别和细化基于转录的 FH 缺陷型 RCC 患者亚组。因此,使用来自基因集变异分析 (GSVA) 的 110 个特征识别出三个不同的聚类。为了阐明这些亚型的转录特征,他们通过将每个亚型与其他亚型进行比较,整合了差异表达基因(DEG)分析、基因表达定量集合分析 (QuSAGE) 和加权基因共表达网络分析 (WGCNA)。通过结合这些分析的结果,他们总结并细化了与 T 细胞炎症、血管生成、基质、MAPK/ERK、NOTCH、Wnt/β-catenin 和增殖相关的七个代表性基因特征(图 4 a-b)。
近一半的肿瘤归类为聚类1 (C1),其特点是免疫原性和血管生成活性高,在 T 细胞炎症基因(如CD8A、IFNG、GZMB和CXCL13)和血管生成相关基因(如PECAM1和CXCL8)中表现出高度富集(图 4b)。这些肿瘤显示出最高的适应性和先天免疫细胞特征表达,包括 CD8+、CD4+、调节性 T 细胞、B 细胞、巨噬细胞和树突状细胞,以及最高的血管生成评分(图 4c)。IHC结果显示这些肿瘤中 CD8+ T 细胞浸润增加(图 4d)、PD-L1 表达增加(图 4e)、核 HIF1A 染色最强以及血管密度增加。与其他两个聚类不同,聚类1 中的肿瘤表现出耗竭相关基因(CD274、TIGIT、HAVCR2、BTLA和PDCD1LG2)和耗竭评分高表达。多重免疫荧光进一步证实这些肿瘤基质中耗竭(PD-1+和 TIGIT+)和肿瘤反应性(CXCL13+)CD8+ 和 CD4+ T 细胞浸润增加(图 4f-g)。此外,聚类1中的肿瘤表现出更高的基质特异性基因表达,例如胶原蛋白的激活和基质相关基因的激活(例如FN1、COL8A1和MMP1)。因此,他们将该聚类标记为T效应/血管生成/基质。
约五分之二的肿瘤(C2)归类为第 2 类,其特征是血管生成和免疫基因均中度表达,而基质和细胞周期基因表达较低(图4b-c)。这些肿瘤显示 MAPK/ERK(例如MAPK3、MAPK7和MAPK12)、Notch(例如NOTCH1和NOTCH3)和 Wnt/β-catenin(例如WNT5B和DDK4)相关基因表达增加,这与透明细胞 RCC 的侵袭性特征相关(图 4b-c)。他们将此类肿瘤标记为 WNT/MAPK/Notch 类。
一小部分肿瘤归类为聚类3 (C3),其特征是血管生成、基质和免疫基因表达低,但参与增殖转录途径的基因(E2F靶点和G2M检查点、MYC靶点和p53)富集。与其他两聚类肿瘤相比,聚类3中的肿瘤具有更高的细胞周期进展(CCP)评分和干性评分(图4b-h)。因此,他们将该聚类标记为增殖/干性。
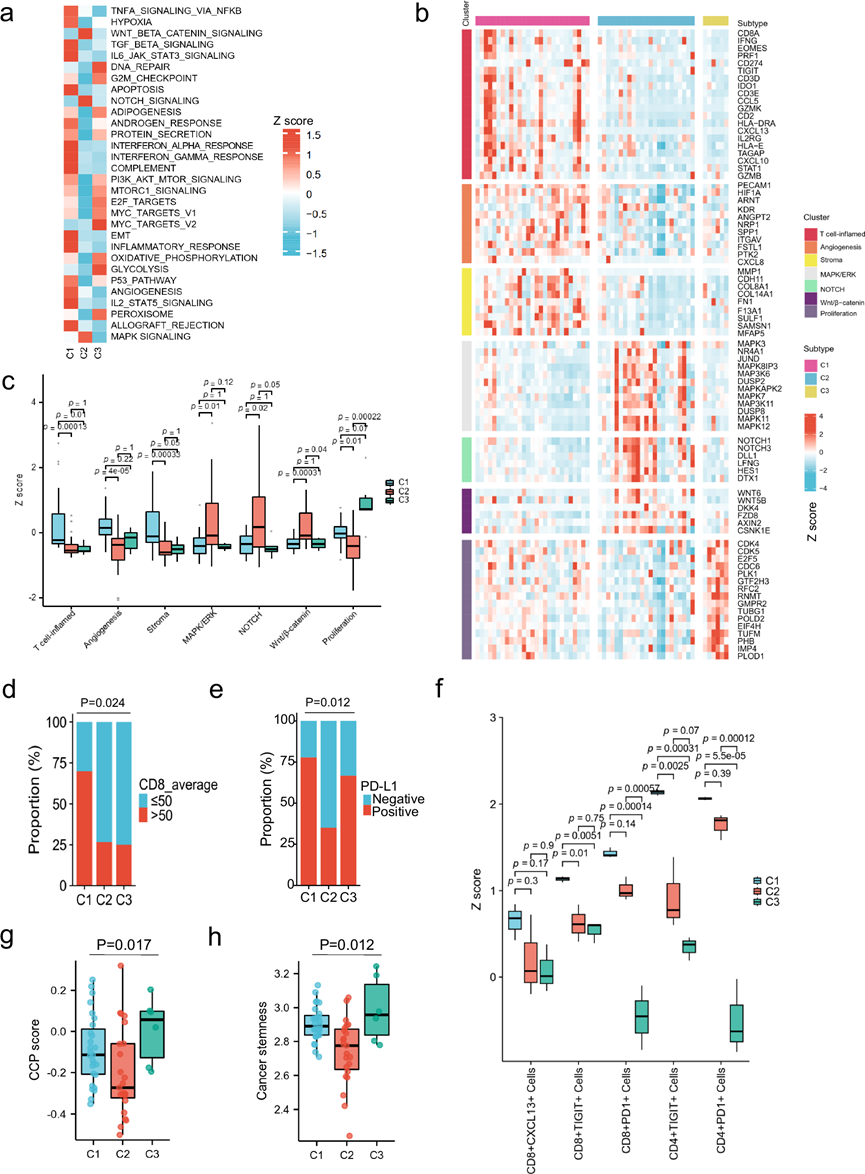
图4. 转录分层识别具有不同生物学特征的 FH 缺陷型 RCC 肿瘤亚群。
(a) 热图表示每个聚类的 MSigDb 标志性基因集的 ssGSEA 得分。(b) 每个聚类的转录特征中包含的基因表达水平热图。(c) 箱线图描绘了不同聚类(C1-C3)的 T 效应子、血管生成、基质、MAPK/ERK、NOTCH、Wnt/β-catenin 和增殖特征的 Z 得分。(d) 条形图显示了不同分子亚型的 FH 缺陷型 RCC 中平均 CD8 IHC 表达 ≤50 个细胞/mm2和 >50 个细胞/mm2的肿瘤比例。(e) 条形图显示了不同分子亚型的 FH 缺陷型 RCC 中 IHC 表达阴性(TPS < 1%)或阳性(TPS ≥ 1%)PD-L1 的患者比例。(f) 箱线图显示了FH缺陷型RCC不同分子亚型中CD8+CXCL13+、CD8+ TIGIT+、CD8+PD1+、CD4+TIGIT+和CD4+PD1+细胞/mm2的数量。(g-h) 箱线图描绘了不同分子亚型 FH 缺陷型 RCC 中 CCP 评分和癌症干细胞评分的 ssGSEA 评分。
05
FH 缺陷型 RCC 分子亚型与 PD-1 抑制剂和 TKI 的分子特征和临床结果相关
接下来,他们探讨了临床和遗传特征与不同分子亚型之间的关联(图 5a)。值得注意的是,与其他聚类相比,增殖/干性 (C3) 聚类中的肿瘤具有高度侵袭性,其特征是肿瘤较大和淋巴结转移频率较高。形态学上, 呈现低度嗜酸性模式的肿瘤与良好的预后相关。有趣的是,所有具有低度嗜酸性模式的肿瘤均在 T 效应/血管生成/基质 (C1) 和 WNT/MAPK/Notch (C2)聚类中。与其他聚类相比,增殖/干性 (C3) 聚类中的肿瘤在 17q、16p和 16q以及FH截短突变中显示出更高的拷贝数增益频率。
他们继续评估每个组中 ICB 加 TKI 和 TKI 单药治疗的临床益处。关于联合治疗的疗效,C1 组患者的客观缓解率 (ORR) 有所提高且 PFS 延长,而 C3 组患者的 ORR 最差且 PFS 最短。C2 组的患者的临床益处介于 C1 和 C3 组之间(图 5b-c)。相反,无论分子分型如何,FH 缺陷型 RCC 患者均无法从 TKI 单药治疗中获得可接受的生存益处(图 5d)。
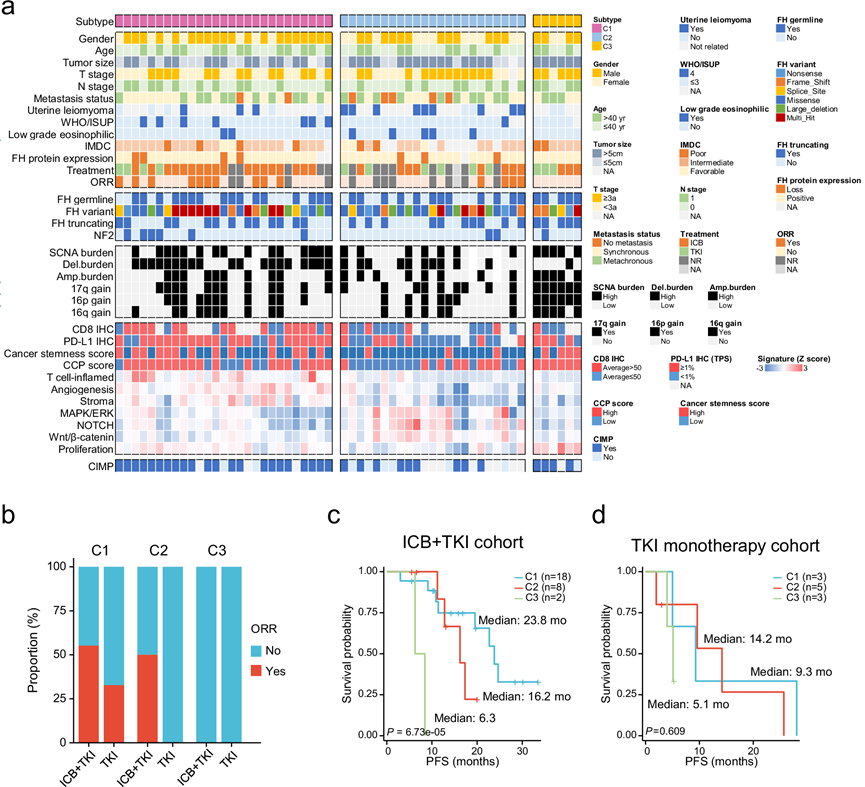
图5. FH 缺陷型 RCC 的分子亚型表现出不同的基因组、转录组和临床特征。
(a) 热图显示每个分亚聚类(C1,n = 27;C2,n = 23;C3,n = 6)的基因组、转录组和临床病理学特征。(b) 条形图描述了每个分亚聚类中接受一线 ICB + TKI 联合治疗或 TKI 单药治疗时实现 ORR 的患者比例。(c) Kaplan -Meier 曲线显示不同聚类中患者接受一线 ICB + TKI 时的 PFS。(d) Kaplan-Meier 曲线显示不同组别患者接受一线 TKI 单药治疗时的 PFS。
+ + + + + + + + + + +
结 论
本研究分析了FH变异模式与肿瘤异质性的关联,并开发了CpG位点特异性甲基化标记,以精确识别FH缺陷型RCC。转录组学分析揭示了三种独特的分子亚型,分别以免疫/血管生成/基质(C1)、WNT/Notch/MAPK(C2)和增殖/干性(C3)通路的富集为特征。C1型肿瘤从ICB和抗血管生成疗法的联合治疗中获得最显著的生存获益。C2型肿瘤对该疗法的反应中等。相比之下,C3型肿瘤对抗血管生成单药治疗及其与ICB的联合治疗反应不佳。这些发现有助于深入了解 FH 缺陷型 RCC 的侵袭性,为疾病管理的潜在精准医疗方法提供了见解。
+ + + + +



 English
English


