文献解读|Cell(64.5):微生物代谢物通过调节泛癌中的 T 细胞干性来增强免疫治疗效果
✦ +
+
论文ID
原名:Microbial metabolite enhances immunotherapy efficacy by modulating T cell stemness in pan-cancer
译名:微生物代谢物通过调节泛癌中的 T 细胞干性来增强免疫治疗效果
期刊:Cell
影响因子:64.5
发表时间:2024.03.14
DOI号:10.1016/j.cell.2024.02.022
背 景
肠道菌群是影响免疫检查点阻断(ICB)功效的主要环境因素之一。癌症患者的肠道微生物群组成有所不同,粪便微生物群移植 (FMT)可以改善 ICB 反应性。然而,具体的细菌成分和详细的潜在机制仍然难以捉摸。
实验设计
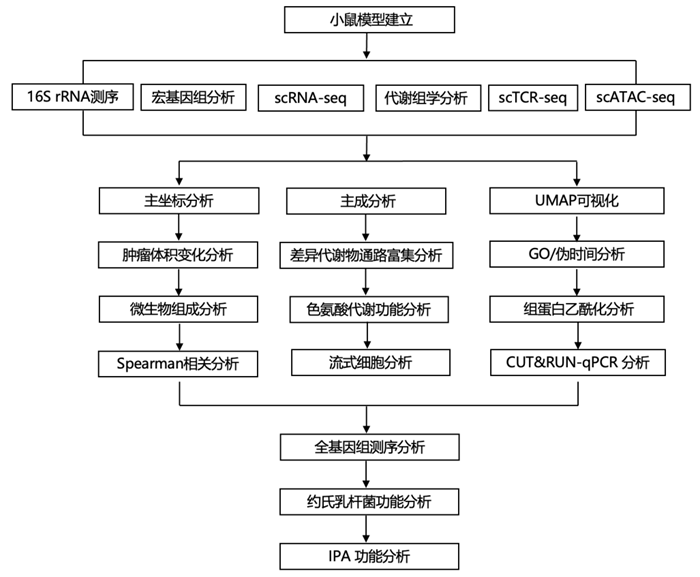
结 果
01
约氏乳杆菌通过激活肿瘤浸润 CD8+ T 细胞使 αPD-1 免疫疗法敏感
当小鼠接受相同剂量的抗程序性细胞死亡蛋白1抗体(αPD-1)免疫治疗时,它们的肿瘤生长可能表现出良好或较差的反应,与临床实践中观察到的情况类似。使用 Mc38 细胞系(高微卫星不稳定性,MSI-H),研究者团队模拟了结直肠癌 (CRC) 的 αPD-1 疗法,并将小鼠分为两组,根据肿瘤体积分为“即“反应不佳组”和“应答组”(图1A-B)。然后,他们将每组的粪便分别移植到经抗生素预处理的受体小鼠中(Abx)(图1C)。用低反应性粪便(PR受体)移植的小鼠对αPD-1治疗的反应性低于用反应性粪便(R受体)移植的小鼠 (图1D),这表明肠道微生物群对ICB治疗的反应性有直接影响。
然后,他们对反应不良小鼠和反应小鼠的粪便进行宏基因组学和16S核糖体RNA (rRNA)测序,以比较微生物群落。通过主坐标分析(PCoA)观察到β多样性存在差异(图1E,图S1A)。在属水平上的菌落组成分析显示,反应不良组的乳酸杆菌丰度下降(图1F,图S1B-C)。在种水平上,约氏乳杆菌最为普遍(图1G)。在不良反应组中,较低丰度的约氏乳杆菌与肿瘤发生负相关(图S1D-E)。Apcmin/+或氧化偶氮甲烷(AOM)/葡聚糖硫酸钠(DSS)诱导的结直肠癌小鼠也显示出约氏乳杆菌定植减少(图S1F-G)。同样,与邻近的正常组织相比,约氏乳杆菌在人CRC组织中的丰度显著降低(图S1H),并且与人CRC的晚期呈负相关(图S1I)。
他们分离了一株约氏乳杆菌,并对其功能作用进行了探究。口服约氏乳杆菌可增强Mc38肿瘤对αPD-1治疗的反应(图1H)。CD8+ T细胞是抗肿瘤反应的主要免疫效应细胞,经口服约氏乳杆菌后,CD8+ T细胞的频率增加(图1I-J)。这种增加伴随着Teff细胞因子的释放,如干扰素(IFN)-γ和肿瘤坏死因子α (TNF-α)(图S1J-K)。
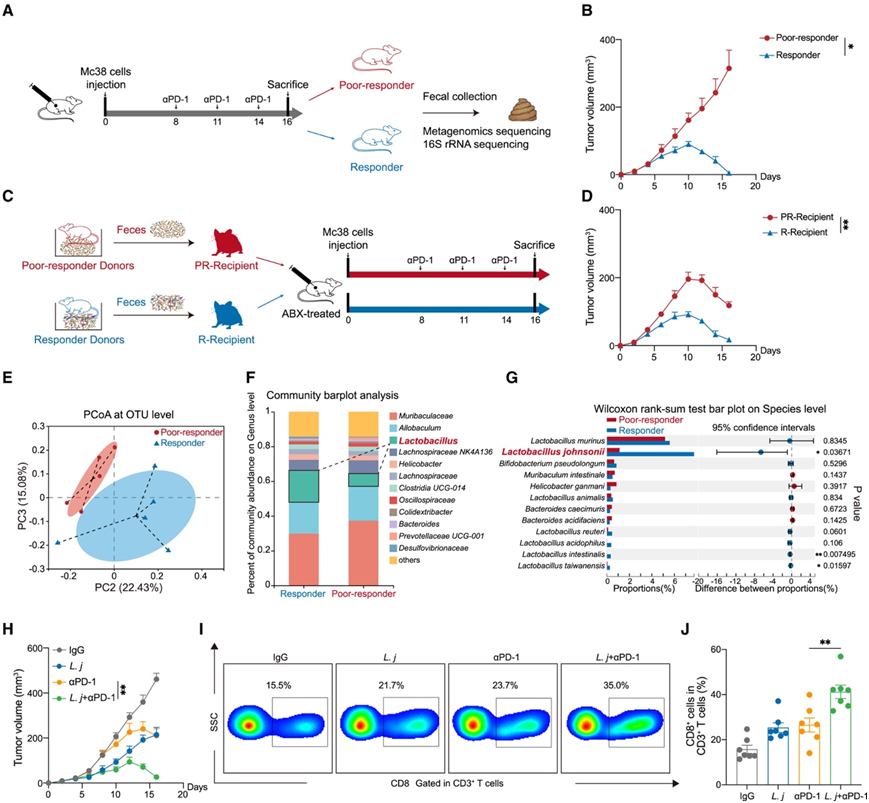
图1. 约氏乳杆菌通过激活肿瘤浸润 CD8+ T 细胞使 αPD-1 免疫疗法敏感。
(A) 皮下Mc38异种移植肿瘤模型中αPD-1免疫治疗过程示意图。 (B)对 αPD-1 免疫疗法有反应(反应者)或反应不良(反应不良)的小鼠中皮下 Mc38 肿瘤体积变化 (mm3)。(C) 粪便微生物移植过程示意图。(D)用抗生素 (Abx) 治疗并移植有反应微生物群 (R-受体) 或反应差微生物群 (PR-受体) 的小鼠的皮下Mc38 肿瘤体积变化 (mm3)。(E) 在操作分类单位 (OTU) 水平上对响应小鼠和响应差小鼠的粪便样本进行 16S rRNA 测序的主坐标分析 (PCoA)。(F) 在属水平上对响应小鼠和响应差小鼠的粪便样本进行 16S rRNA 测序的群落条形图分析。(G) 对物种水平上响应小鼠和差响应小鼠的粪便样本进行 16S rRNA 测序的 Wilcoxon 秩和检验条形图。(H)用IgG同种型对照抗体、αPD-1抗体、约氏乳杆菌或约氏乳杆菌联合αPD-1抗体处理的小鼠中的皮下Mc38肿瘤体积变化(mm3)。(I-J)皮下 Mc38 肿瘤中CD8+ T 细胞的频率。
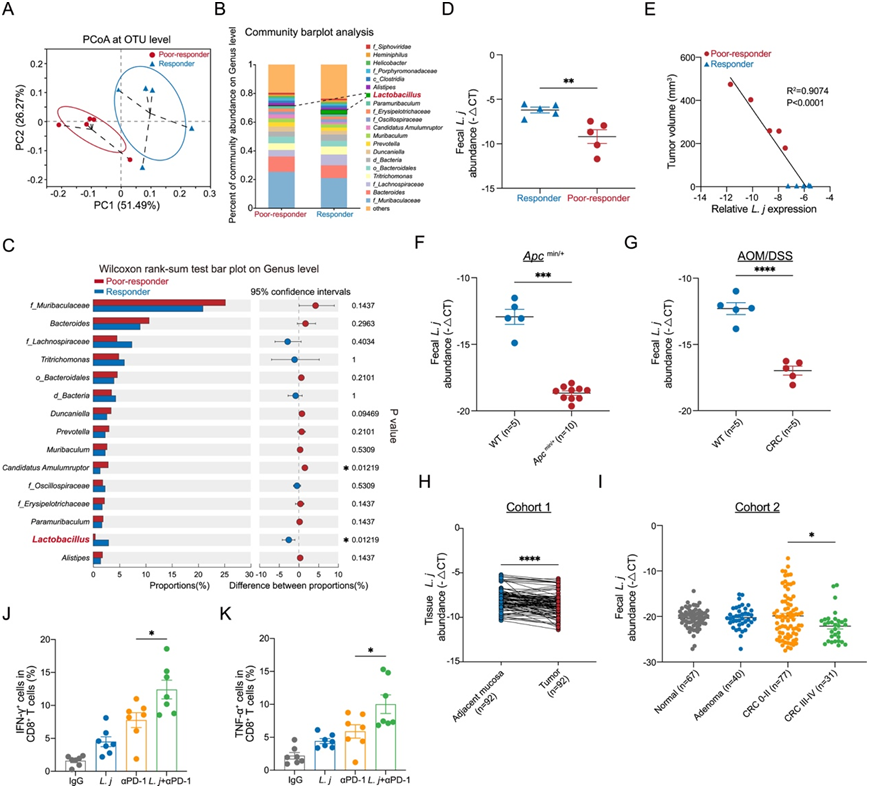
图S1. 大肠杆菌在结直肠癌中的表达减少,并通过激活IFN-γ和TNF-α CD8 T细胞与ICB反应性相关。
(A)粪便宏基因组测序的主坐标分析(PCoA)。(B)在属水平上应答小鼠和反应不良小鼠粪便样本宏基因组测序的群落柱状图分析。(C)在物种水平上应答小鼠和反应不良小鼠粪便宏基因组测序的Wilcoxon秩和检验条形图。(D)反应小鼠和反应不良小鼠粪便中约氏乳杆菌的丰度。(E)分析反应小鼠与不良反应小鼠肿瘤体积与约氏乳杆菌丰度的相关性。(F-I) 约氏乳杆菌丰度。(J-K)四组Mc38肿瘤中IFN-γ+ CD8+ T细胞和TNF-α+ CD8+ T细胞的频率。
02
约氏乳杆菌通过色氨酸代谢促进ICB反应性
为了探讨这种功能是否归因于约氏乳杆菌本身或其分泌产物,他们给小鼠注射经过高温灭活(加热组)、超声破碎(超声组)、原始培养基(MRS组)以及条件培养基(Lj.CM组)处理的约氏乳杆菌以及活的约氏乳杆菌。有趣的是,只有Lj.CM组(Lj.CM +αPD-1)与活约氏乳杆菌组(L.j +αPD-1) 具有相当的免疫治疗效果 ,表明约氏乳杆菌的抗肿瘤作用主要是通过细菌分泌的分子来发挥作用。
血浆液相色谱-串联质谱(LC-MS/MS)分析显示,αPD-1单独处理组与活的约氏乳杆菌组(L. j +αPD-1)代谢物组成存在显著差异(图2C)。活的约氏乳杆菌组组显示出“色氨酸代谢”通路的显著富集(图2D)。然后,他们通过给小鼠喂食色氨酸缺乏饮食(Trpneg饮食),证实了色氨酸在约氏乳杆菌促进的ICB反应中的必要性。正如预期的那样,当色氨酸底物缺失时,约氏乳杆菌并没有增强αPD-1治疗的有效性,也没有增加CD8+ T细胞的频率(图2E-G)。
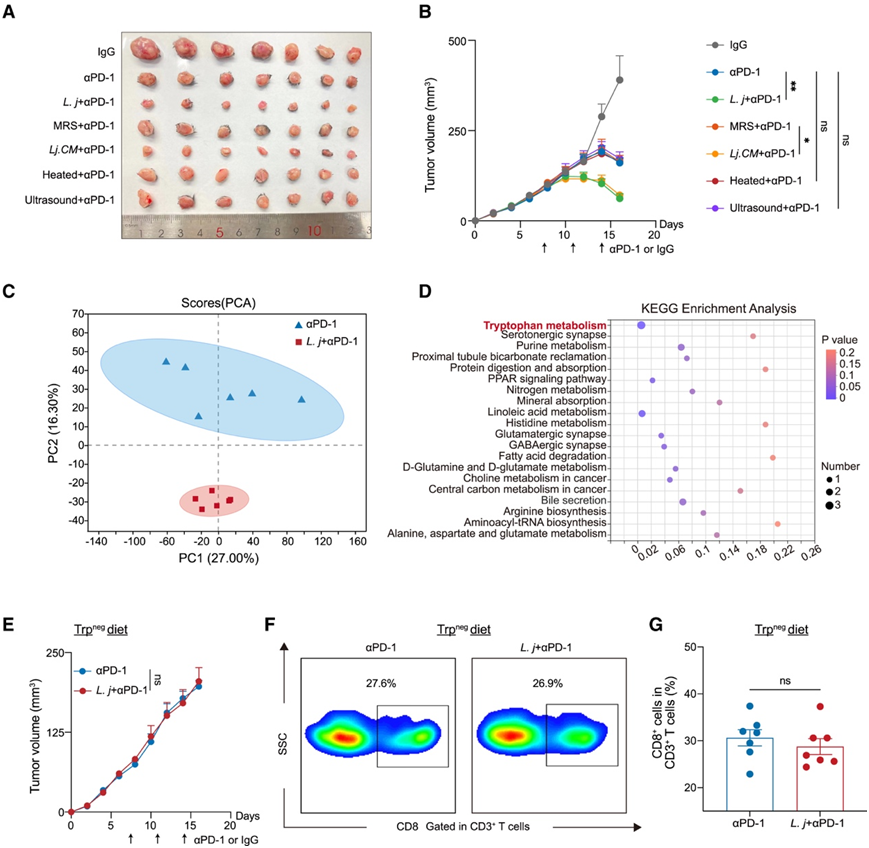
图2. 约氏乳杆菌通过色氨酸代谢促进 ICB 反应。
(A-B)用 IgG 对照抗体、αPD-1 抗体(αPD-1)、αPD-1 抗体联合活的约氏乳杆菌治疗的小鼠皮下 Mc38 肿瘤的代表性图像和体积变化(mm3) 。(C) 在用 αPD-1 治疗的小鼠和用约氏乳杆菌和 αPD-1治疗的小鼠中,通过 LC-MS/MS 鉴定的血浆代谢物的主成分分析 (PCA) 。(D)血浆代谢物差异富集的通路分析。(E)饲喂色氨酸缺乏 (Trpneg) 饮食并用 αPD-1 抗体或 αPD-1 与约氏乳杆菌联合治疗的小鼠的皮下 Mc38 肿瘤体积变化 (mm3) 。(F-G)皮下Mc38肿瘤中CD8+ T细胞频率。
03
约氏乳杆菌衍生的代谢物吲哚-3-丙酸 (IPA)通过CD8+ T细胞促进ICB反应性
他们检测了血浆色氨酸相关代谢物,这些代谢物由约氏乳杆菌上调,发现IPA表现出最明显的增加(图3A)。IPA是一种由肠道菌群特异性产生的吲哚类似物,已证明可以促进轴突再生和保护辐射毒性。与约氏乳杆菌处理一致,用反应组粪便移植的小鼠显示出更高的血浆IPA水平(图3B)。然而,补充约氏乳杆菌并没有增加Trpneg饮食小鼠的血浆IPA水平(图3C)。
然后他们探讨了IPA对肿瘤免疫治疗的潜在影响。灌胃IPA 60 mg/kg/d可增强αPD-1的有效性,提高血浆或肿瘤内IPA水平(图3D)。补充IPA增加了肿瘤中CD8+ T细胞浸润的频率及其效应细胞因子的产生(图3E-G)。然而,自然杀伤细胞(NK)、B细胞、树突状细胞和巨噬细胞没有明显的变化。
为了确定免疫治疗效果是否依赖于T细胞反应,他们给Rag1−/−小鼠注射了约氏乳杆菌或IPA。值得注意的是,两种治疗方法都未能减少肿瘤的生长(图3H-I)。此外,用CD8中和抗体处理小鼠可消除约氏乳杆菌和异丙酸的抗肿瘤作用(图3J)。他们推测经IPA处理的CD8+ T细胞可以维持在激活状态,并通过过继性地将预处理的CD8+ T细胞或B细胞转移到Rag1−/−小鼠中证实了这一点(图3K)。与未接受IPA预处理的CD8+ T细胞(WT)相比,接受IPA预处理的小鼠表现出更好的αPD-1反应性。然而,同时接受经IPA预处理的B细胞和CD8+ T细胞(IPA B+ T)的小鼠,与IPA T组相比,没有更好的肿瘤抑制效果(图3L)。
总之,这些发现表明,约氏乳杆菌衍生的代谢物IPA依赖CD8+ T细胞来促进对ICB治疗的反应性。
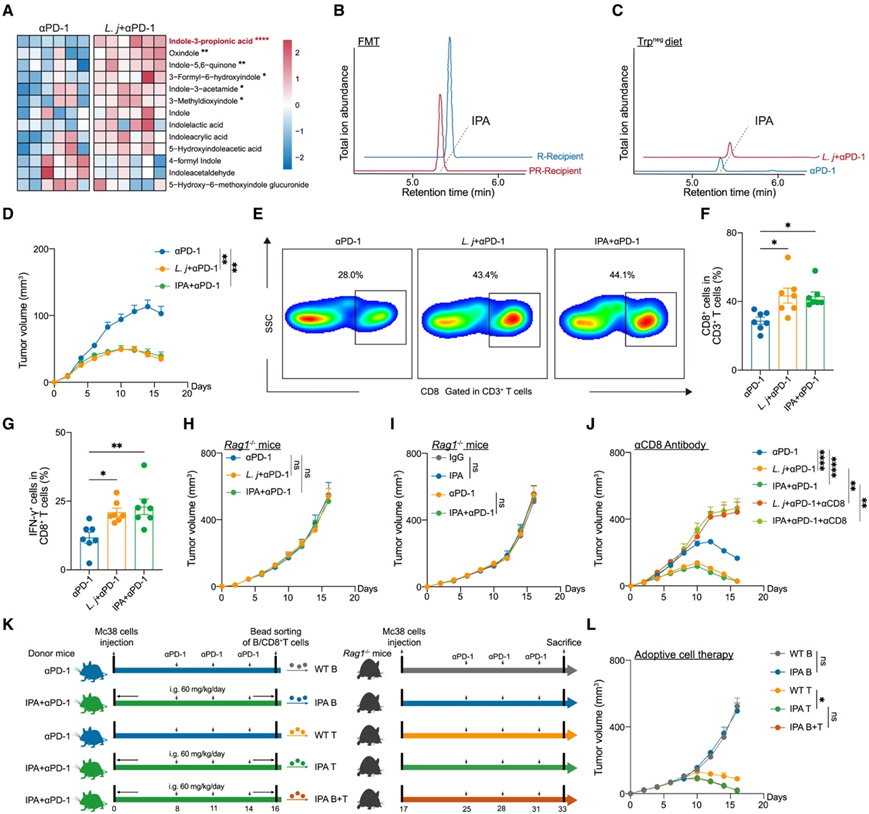
图3. 约氏乳杆菌衍生的IPA通过CD8 T细胞促进ICB反应性。
(A) 热图显示用 αPD-1 或αPD-1 与约氏乳杆菌联合治疗的小鼠中色氨酸相关血浆代谢物的富集。(B-C)血浆 IPA 丰度。(D小鼠中皮下Mc38肿瘤体积变化。(E-F)皮下 Mc38 肿瘤中的CD8+ T 细胞频率。(G)皮下 Mc38 肿瘤中的IFN-γ+ CD8 + T 细胞频率。(H-J)小鼠中皮下Mc38肿瘤体积变化。(K) 过继细胞转移 (ACT) 过程的示意图。(L)受体小鼠皮下 Mc38 肿瘤体积变化.
04
IPA通过促进Tpex细胞来维持CD8+ T细胞的反应
CD8+ T细胞由不同的细胞亚群组成,它们具有不同的功能,并协同调节肿瘤的免疫微环境。为了进一步揭示IPA对CD8+ T细胞亚群的作用,他们对单独αPD-1 (WT组)或联合IPA(IPA组)治疗的小鼠肿瘤中分离的CD8+ T细胞进行了单细胞RNA测序(scRNA-seq)、单细胞T细胞受体测序(scTCR-seq)和靶向可及染色质高通量测序(scATAC-seq)(图4A)。
他们确定了13个细胞聚类和10个CD8+ T细胞亚群:幼稚(Lef1hi、Sellhi和Ccr7hi)、祖细胞耗竭的CD8+ T细胞(Tpex、Tcf7hi和Pdcd1hi)、活化的(Cd69hi和Isg15hi)、Teff (Prf1hi、Gzmbhi和Klrd1hi)、自然杀伤T细胞(NKT、Cd160hi和Xcl1hi)、Trbv3hi、Cotl1hi、Bcl2hi、Mki67hi和Mcm3hi(图4B)。
IPA治疗减少了肿瘤中的幼稚CD8@ T细胞,但增加了肿瘤中的Tpex细胞和Teff细胞(图4C)。为了全面映射免疫细胞功能,他们使用VISION分析预测基因本体(GO)生物过程基因集的总分,并计算每个聚类的平均特征得分(图4D)。IPA处理后, “GO_ALPHA_BETA_T_CELL_DIFFERENTIATION” 在9个细胞聚类富集,特别是在Tpex细胞中(图4E-G)。此外,IPA处理可以增加体外培养中TCF-1干细胞样CD8+ T细胞的比例(图4H-I)。由于Tcf7的表达标志着Tpex细胞的激活,他们在小鼠中敲除了Tcf7 (Tcf7−/−),发现IPA只增强了WT小鼠的免疫治疗效果,而在Tcf7−/−小鼠中没有(图4J)。
为了进一步研究IPA治疗后CD8+ T细胞的分化途径,他们对CD8+ T细胞的四个经典亚群进行了轨迹分析。幼稚CD8+ T细胞发育为Tpex细胞,并逐步激活CD8+ T细胞和Teff细胞(图4K)。CD8+ T细胞亚群共有TCR谱,并相互进行克隆扩增。Teff细胞中主要的TCR克隆型主要来源于Tpex细胞,IPA处理增加了保守传播的比例(图4L-M)。总之,IPA增加了肿瘤微环境中Tpex细胞的频率,促进其向Teff细胞分化,从而增强ICB的应答性。
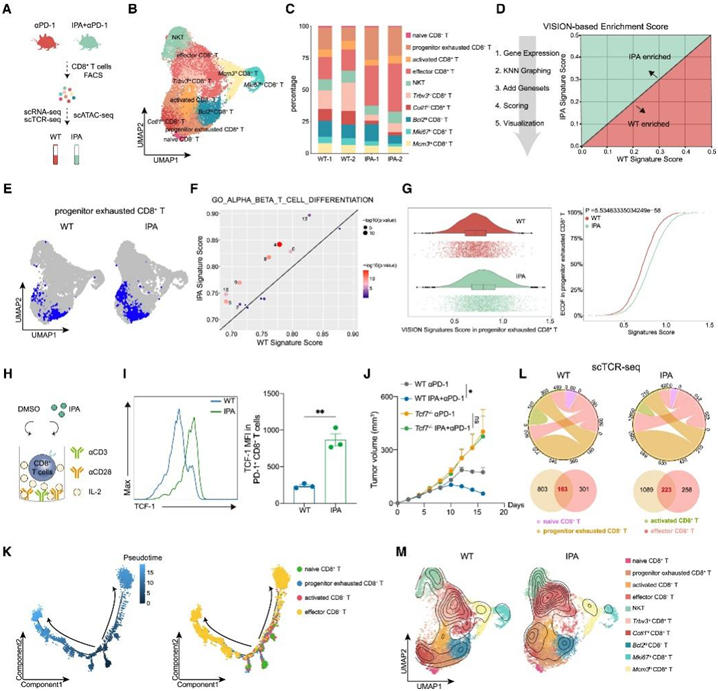
图4. IPA通过促进 T pex细胞维持 CD8 + T 细胞反应。
(A) 示意图显示单细胞 RNA 测序 (scRNA-seq)、单细胞 TCR 测序 (scTCR-seq) 和通过高通量测序靶向可及染色质的单细胞测定 (scATAC-seq) 的过程。 (B) UMAP可视化。(C)每种已识别细胞类型的百分比。(D) 基于 VISION 的分析过程示意图。(E) 代表性 UMAP 图显示 WT 和 IPA 小鼠中祖细胞耗尽的 CD8 + T 细胞(以蓝色突出显示)的分布。(F) 散点图显示 WT 和 IPA小鼠中每个细胞聚类的 GO_ALPHA_BETA_T_CELL_DIFFERENTIATION 基因集的平均特征得分。(G) GO_ALPHA_BETA_T_CELL_DIFFERENTIATION 基因集的 VISION 富集分数的小提琴图(左)和 ECDF 图(右)。(H) CD8 + T细胞离体培养过程示意图。(I) 通过流式细胞分析经 DMSO 或 IPA 处理的 PD-1 + CD8 + T 细胞的 TCF-1 表达的代表性直方图(左)和组合平均荧光强度 (MFI)(右)。(J) Tcf7 −/−小鼠和 WT 同窝对照小鼠的肿瘤体积变化 (mm 3) 。(K)伪时间轨迹分析。(L) WT和IPA处理样品中CD8+ T细胞亚群共有的常见TCR的互联性弦图(上)和WT和IPA处理样品中祖耗尽CD8+ T细胞亚群和效应CD8+ T细胞亚群共有相同CDR3(配对TCRα和TCRβ链)氨基酸序列的Venn图(下)。(M) WT 和 IPA 处理样品中 CD8+ T 细胞亚群的克隆密度图。
05
IPA通过修饰Tcf7基因SE区域的H3K27乙酰化来激活Tpex细胞
Tpex细胞主要受组蛋白修饰调控,他们试图探索IPA是否通过Tcf7基因的组蛋白重塑激活Tpex细胞。他们将scRNA-seq结果映射到scATAC-seq,并鉴定出10种常见的CD8+ T细胞亚群(图5A)。与scRNA-seq结果一致,IPA处理增加了Tpex细胞和Teff细胞的比例(图5B)。进一步的差异峰分析显示,Tpex细胞的开放染色质区域主要富集在启动子和远端基因间区域,IPA处理增加了Tcf7基因超级增强子(SE)区域的染色质开放(图5C-J)。此外,他们注意到IPA处理主要增强Tpex细胞中的组蛋白乙酰化,而不是组蛋白甲基化,表明IPA可能通过乙酰化修饰Tcf7基因SE的组蛋白,从而激活Tpex细胞。
核小体是染色质的基本单位,是由四个核心组蛋白(H2A、H2B、H3和H4)组成的八聚体。scRNA-seq分析显示,IPA处理后,组蛋白H3乙酰化在Tpex细胞中最显著富集(图5E)。他们使用针对常见组蛋白修饰(包括H2AK5ac, H2BK5ac, H3K27ac和H4K20me1)的特异性抗体进行了western blot分析,以验证这一结果。只有H3K27ac在对IPA的反应中表现出剂量依赖性增加,同时TCF-1表达增加(图5F)。此外,他们在分选的CD8+ T细胞中对H3K27ac进行了染色质免疫沉淀(ChIP)、靶标下切割和核酸酶释放(CUT&RUN)和靶标下切割和标记(CUT&Tag)。结果证实,IPA处理增加了Tcf7基因SE的H3K27乙酰化(图5G-J)。综上所述,上述结果证明IPA通过修饰Tcf7基因SE区H3K27乙酰化,促进CD8+ T细胞的干性程序。
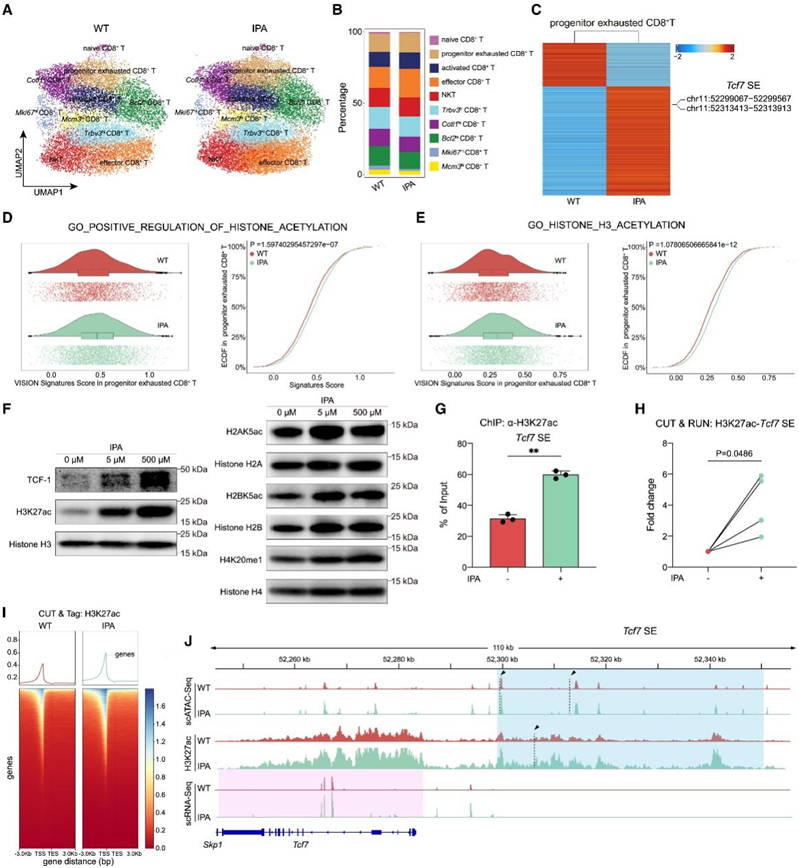
图5. IPA通过修饰Tcf7基因 SE 区域的H3K27 乙酰化来激活 Tpex细胞。
(A) UMAP 可视化。(B)每种已识别细胞类型的百分比。(C) 热图显示来自 WT和 IPA小鼠的祖细胞耗尽的 CD8+ T 细胞聚类之间具有差异染色质可及性的峰值位置。(D) GO_POSITIVE_REGULATION_OF_HISTONE_ACETYLATION”基因集的 VISION 富集评分的小提琴图(左)和 ECDF 图(右) 。(E) GO_HISTONE_H3_ACETYLATION”基因集的 VISION 富集评分的小提琴图(左)和 ECDF 图(右)。(F)免疫印迹分析。(G) ChIP-qPCR 检测H3K27 乙酰化。(H) H3K27 乙酰化的 CUT&RUN-qPCR 检测。(I)使用或不使用 IPA 培养的CD8+ T 细胞中Tcf7超级增强子基因座上 H3K27 乙酰化的 CUT&RUN-qPCR 检测。(J)Tcf7基因组位点上分析的基因组结合模式的代表性插图。
06
约氏乳杆菌与产孢梭菌协同生产异丙醇
色氨酸可以在肠道菌群中代谢成吲哚-3-丙酮酸(IPYA)、吲哚-3-乳酸(ILA)、吲哚-3-丙烯酸(IA)和IPA,但约氏乳杆菌如何代谢色氨酸产生IPA尚不清楚。令人惊讶的是,他们无法在培养约氏乳杆菌后的CM上清液中检测到IPA或IA。而在CM中检测到ILA。这表明约氏乳杆菌只能将色氨酸代谢为ILA,而不能进一步代谢为IA或IPA(图6A-B)。他们将ILA或IPA分别注射给Mc38荷瘤小鼠。正如预期的那样,当给予接受Abx预处理的小鼠ILA时,与IPA给药组相比,它没有改善αPD-1治疗的疗效,也不再提高血浆IPA水平(图6C-D)。同样,腹腔注射ILA避免了肠道菌群的进一步分解代谢,但并没有改善αPD-1的有效性或增加血浆IPA(图6E-F)。
于是,他们提出一种假设:约氏乳杆菌需要与其他共生微生物合作才能产生IPA。由于已知产孢梭菌可将ILA转化为IPA,并且约氏乳杆菌经口灌胃增加了粪便中产孢梭菌的丰度,因此他们选择了它作为代表细菌,并在无菌小鼠中验证了该假设(图6G)。与单菌(约氏乳杆菌或产孢梭菌)给药相比,约氏乳杆菌和产孢梭菌混合给药可进一步增强αPD-1的药效(图6H)。LC-MS/MS分析证实,单独使用约氏乳杆菌不能增加血浆IPA,但可以产生大量的ILA。相反,约氏乳杆菌和产孢梭菌混合物显著增加血浆IPA(图6I)。这些结果证实,约氏乳杆菌产生的ILA需要进一步由产孢梭菌代谢为IPA,以提高免疫治疗的效果。
然后,他们继续探索约氏乳杆菌如何产生 ILA。他们对分离的约氏乳杆菌进行了全基因组测序,并使用蛋白质基本局部比对搜索工具 (BLAST) 来搜索与fldH相似的序列,fldH 是来自产孢梭菌的基因,编码将色氨酸转化为 ILA 的关键酶。ldhA (存在于约氏乳杆菌基因组中的一个基因,编码 337 个氨基酸的 D-2-羟基酸脱氢酶)可能是约氏乳杆菌产生 ILA 所必需的。将ldhA表达载体转化为大肠杆菌(E. c-ldhA)给药可增加Mc38荷瘤小鼠血浆IPA水平并改善αPD-1反应性,证实约氏乳杆菌依赖ldhA编码ILA产生的酶(图6K-L)。
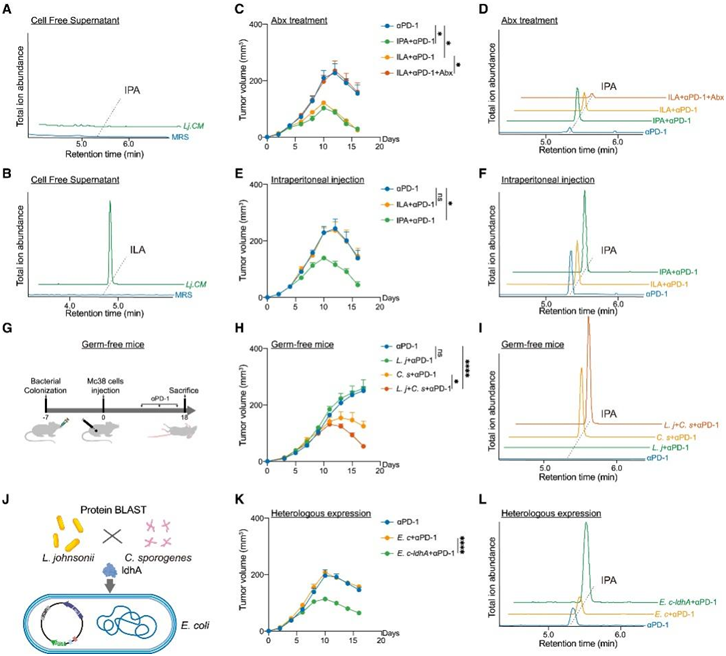
图6. .约氏乳杆菌与产孢梭菌合作生产IPA 。
(A) MRS 培养基和约氏乳杆菌条件培养基 (Lj.CM) 上清液中 IPA 的 LC-MS/MS 鉴定。(B) MRS 培养基和Lj.CM上清液之间 ILA 的 LC-MS/MS 鉴定。(C)用αPD-1、αPD-1联合IPA或ILA、或αPD-1联合ILA和抗生素(Abx)治疗的小鼠中皮下Mc38肿瘤体积变化(mm3)。 (D) 按所示处理的小鼠血浆 IPA 的 LC-MS/MS 鉴定。(E)通过腹膜内注射用αPD-1或αPD-1联合ILA或IPA治疗的小鼠中的皮下Mc38肿瘤体积变化(mm 3)。(F) 按所示处理的小鼠血浆 IPA 的 LC-MS/MS 鉴定。(G)无菌小鼠αPD-1免疫治疗过程示意图。(H)用约氏乳杆菌和产孢梭菌单定殖并用αPD-1治疗的无菌小鼠中的皮下Mc38肿瘤体积变化(mm 3) 。(I) 按所示处理的无菌小鼠血浆 IPA 的 LC-MS/MS 鉴定。(J)大肠杆菌中蛋白质BLAST及ldhA过表达过程示意图。(K)用αPD-1或αPD-1与大肠杆菌或大肠杆菌联合治疗的小鼠中皮下Mc38肿瘤体积变化(mm3)。(L) 按所示处理的小鼠血浆 IPA 的 LC-MS/MS 鉴定。
07
IPA 促进泛癌和 CRC 衍生类器官中的 ICB 反应性
然后,他们在泛癌症水平测试了微生物群来源的IPA是否改善了ICB治疗的反应性。在乳腺癌和黑素瘤移植瘤模型中,IPA能有效促进αPD-1免疫治疗的疗效,增加CD8+ T细胞的浸润频率和TCF-1的表达(图7A-D)。在脂肪垫原位植入模型/小鼠乳腺肿瘤病毒-多瘤病毒中间T抗原(MMTV-PyMT)自发性乳腺癌模型、盲肠原位种植模型中验证IPA对免疫治疗的增敏作用(图7E-I)。免疫荧光染色证实IPA治疗增加了乳腺癌、黑色素瘤和结直肠癌肿瘤微环境中Tpex细胞的浸润(图7J-K)。
鉴于使用传统的患者来源的类器官(PDO)在肿瘤微环境中保存免疫细胞的局限性,他们建立了气液界面(ALI)-PDO系统。该系统包含更完整的免疫微环境和额外的基质成分,允许更准确地表示免疫疗法(图7L)。IPA处理和模拟处理的PDO都成功地保留了CRC结构(图7M)。IPA处理的PDO增加了CD8+ T细胞的浸润,并提高了Teff细胞效应蛋白的表达(图7N)。
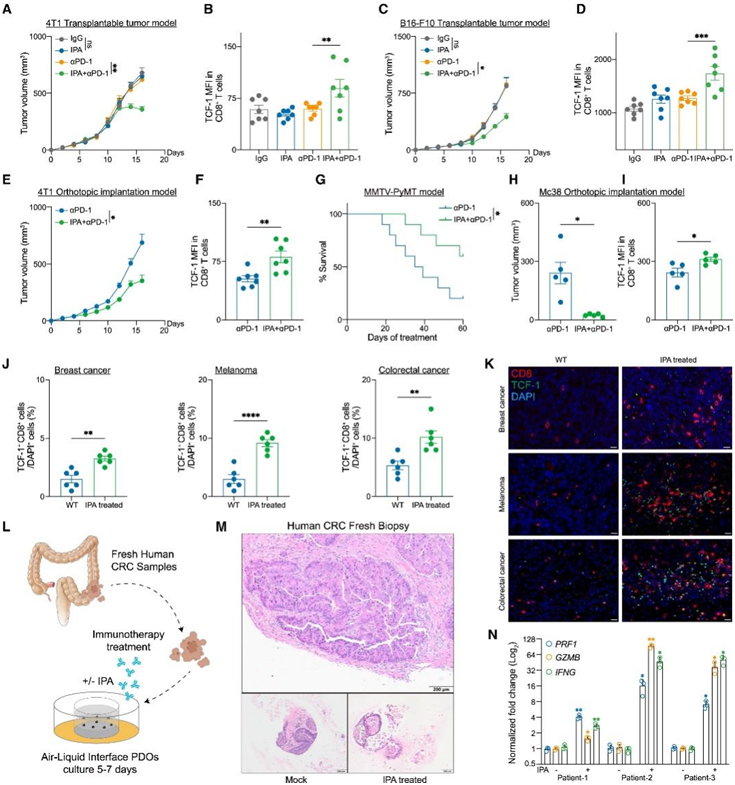
图7. IPA 促进泛癌和 CRC 衍生类器官中的 ICB 反应性。
(A)用 IgG 同种型对照、IPA、αPD-1 或IPA 和 αPD-1 治疗的小鼠中可移植 4T1 乳腺肿瘤的肿瘤体积 (mm3) 变化。(B) 对从 4T1 乳腺肿瘤分离的 CD8+ T 细胞中 TCF-1 的平均荧光强度 (MFI) 进行流式细胞分析。(C)用 IgG 同种型对照、IPA、αPD-1 或IPA 和 αPD-1 治疗的小鼠中可移植 B16-F10 黑色素瘤的肿瘤体积 (mm3) 变化。(D) 对从 B16-F10 黑色素瘤分离的 CD8+ T 细胞中 TCF-1 的MFI进行流式细胞分析。(E)用αPD-1或αPD-1联合IPA治疗的小鼠中4T1原位乳腺肿瘤的肿瘤体积(mm3)变化。(F)对从 4T1 原位乳腺肿瘤分离的CD8+ T 细胞中 TCF-1 的平均荧光强度 (MFI) 进行流式细胞分析。(G) 用 αPD-1 或αPD-1 与 IPA 组合治疗的 MMTV-PyMT 小鼠的存活曲线。(H)用αPD-1或αPD-1与IPA组合治疗的小鼠中Mc38原位肿瘤的肿瘤体积(mm3)。(I)对从 Mc38 原位肿瘤分离的CD8 + T 细胞中 TCF-1 的MFI进行流式细胞分析。(J)两组中乳腺癌、黑色素瘤和结直肠癌TCF-1+ CD8 +细胞相对于DAPI+细胞的频率。(K)免疫荧光染色分析。(L)气液界面CRC PDO过程示意图。(M) 新鲜人 CRC 活检组织和治疗后 PDO。(N)用或不用IPA处理的ALI-PDO中PRF1、GZMB和IFNG表达的qPCR分析。
+ + + + + + + + + + +
结 论
本项研究发现共生约氏乳杆菌的丰度与 ICB 的反应性呈正相关。补充约氏乳杆菌或色氨酸衍生的IPA可增强 CD8 + T 细胞介导的 αPD-1 免疫疗法的疗效。从机制上讲,约氏乳杆菌与产孢梭菌合作生产 IPA。IPA 调节 CD8 + T 细胞的干细胞程序,并通过增加Tcf7超级增强子区域的 H3K27 乙酰化促进Tpex的产生。IPA 改善了泛癌症水平的 ICB 反应性,包括黑色素瘤、乳腺癌和结直肠癌。总的来说,本项研究结果确定了微生物代谢物免疫调节途径,并提出了一种潜在的基于微生物的辅助方法来提高免疫疗法的反应性。
+ + + + +



 English
English


