文献解读|Signal Transduct Target Ther(40.8):单细胞转录组分析揭示肠道菌群通过调节肿瘤微环境发挥免疫治疗协同作用
✦ +
+
论文ID
原名:Single-cell transcriptomic analysis reveals gut microbiota-immunotherapy synergy through modulating tumor microenvironment
译名:单细胞转录组分析揭示肠道菌群通过调节肿瘤微环境发挥免疫治疗协同作用
期刊:Signal Transduction and Targeted Therapy
影响因子:40.8
发表时间:2025.05.02
DOI号:10.1038/s41392-025-02226-7
背 景
针对 PD-1/PD-L1 或 CTLA-4 的免疫检查点抑制剂 (lCl) 从根本上改变了癌症治疗模式,在多种恶性肿瘤中实现了持久的临床反应,包括黑色素瘤、非小细胞肺癌和错配修复缺陷型结直肠癌。然而,只有 15% 至 40% 的患者从 ICI 单药治疗中获得长期获益,患者之间的治疗结果存在很大的异质性,这一点仍知之甚少。肠道菌群对ICI的免疫疗法疗效起着至关重要的调节作用,但其潜在机制在单细胞分辨率下仍不清楚。
实验设计
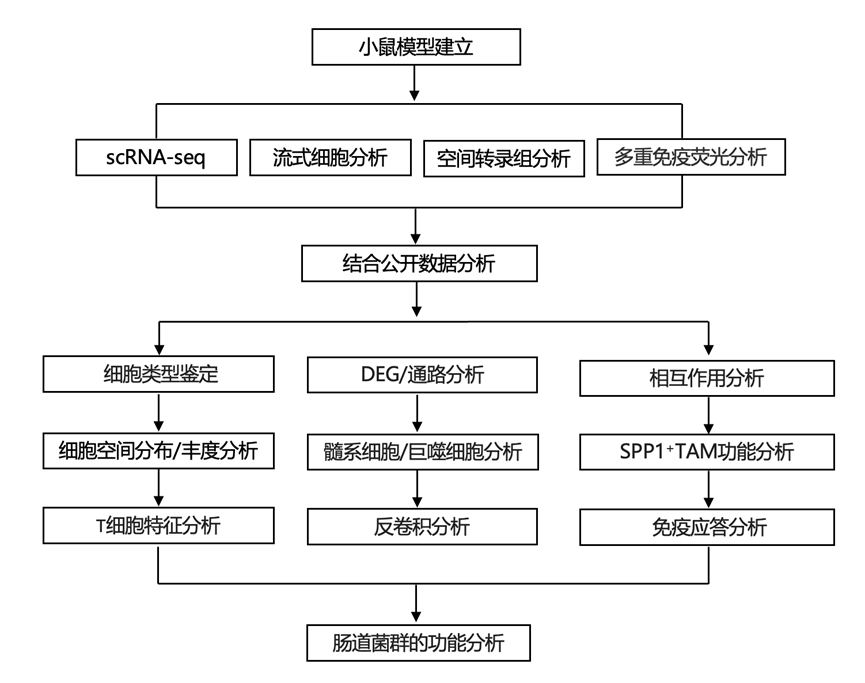
结 果
01
PD-1抑制剂和肠道菌群调节的单细胞肿瘤微环境 (TME)分析
为了探究肠道菌群与抗PD-1疗法之间的相互作用,研究团队皮下植入MC38细胞建立肿瘤模型,并研究肠道菌群与广谱抗生素(ATB)和PD-1抑制剂免疫疗法的协同作用。在无特定病原体(SPF)条件下将饲养的小鼠分为四组:IA组(IgG + ATB)、IW组(IgG +水)、PA组(PD-1抑制剂 + ATB)和PW组(PD-1抑制剂 + 水)。他们进行了单细胞转录组分析(scRNA-seq)、流式细胞分析和多重免疫荧光(Mif)分析,以评估不同疗法对TME的影响(图1a)。 ATB治疗抑制了肠道菌群,PW 组的肿瘤体积受 PD-1 抑制剂治疗的显著控制,但与 IA 和 IW 组相比,PA 组的肿瘤体积仅略有减少(图1b),支持肠道菌群在基于 ICI 的免疫治疗中的关键作用。作为验证,CT26细胞在肿瘤体积较小时也表现出对 PD-1 抑制剂治疗的敏感性,而在肠道菌群耗尽后疗效显著降低。此外, PD-1 抑制剂治疗似乎改变了某些肠道菌群物种(例如Akkermansiaceae )的比例,但不会对 α 和 β 多样性产生显著影响。
使用 scRNA-seq 对各组治疗后合并的肿瘤样本和本研究建立的分析流程进行测序,共27289 个细胞通过质量控制,并通过无监督聚类分为 9 种主要细胞类型。根据典型标记和基于 inferCNV 的拷贝数分析,将这些细胞类型注释为免疫细胞、基质细胞和肿瘤细胞(图1c-g)。不同 TME 细胞成分的比例在四组中有所不同,无论肠道菌群是否耗竭,用 PD-1 抑制剂治疗的小鼠的 T 细胞均有所增加(图1e)。亚型分析显示CD8 + T 细胞与总 T 细胞呈相同的趋势,而CD4 + T 细胞仅在 PW 组中显著增加,该组对 PD-1 抑制剂反应良好(图1f)。这些结果通过 mIF、流式细胞实验和免疫组织化学实验在独立批次的小鼠中以及在 CT26 衍生的肿瘤中得到验证(图1g-i)。
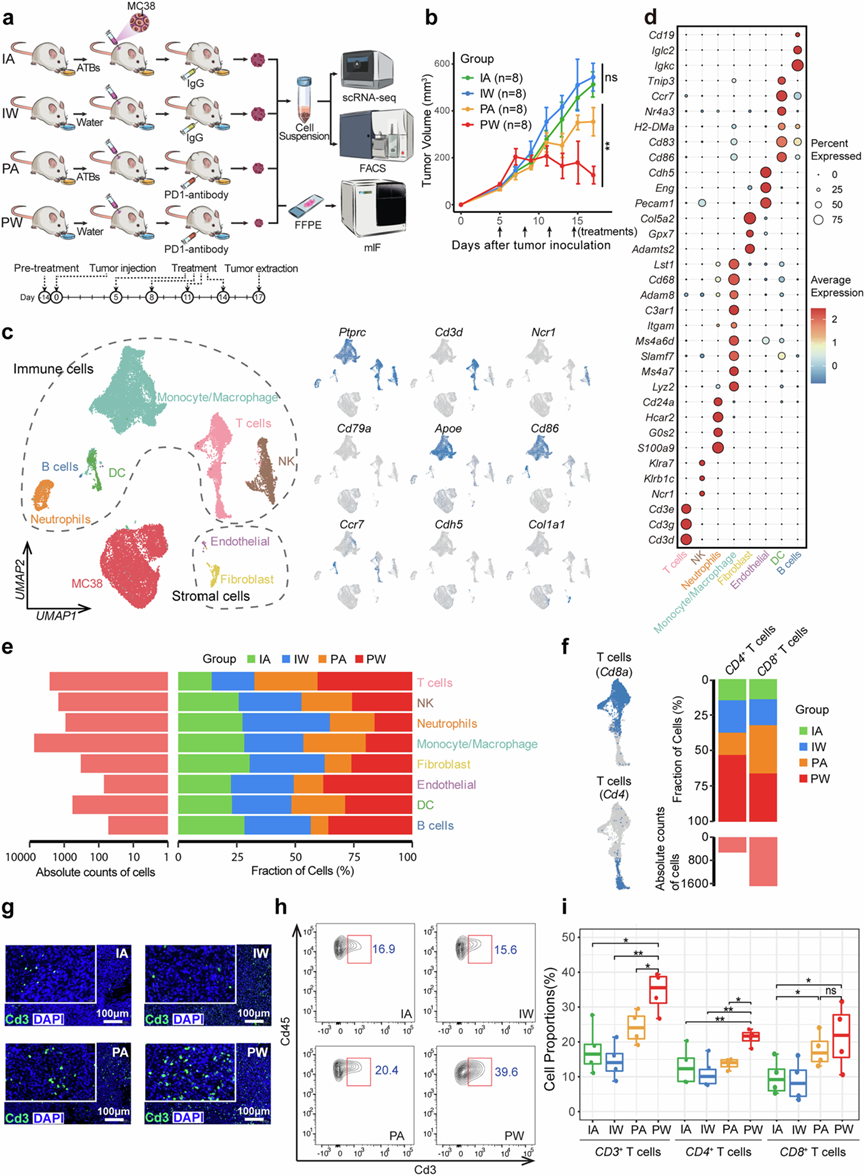
图1. 由肠道菌群和免疫检查点抑制剂 (ICI) 治疗塑造的肿瘤微环境 (TME) 单细胞图谱。
(a) scRNA-seq 实验设计示意图及采用不同治疗策略的四组实验验证。(b) 折线图描绘了四个治疗组中皮下肿瘤的体积进展。(c) 左侧的 UMAP 投影显示了细胞亚群,虚线划分了免疫细胞和基质细胞。右侧的 UMAP 突出显示了已识别聚类的典型基因的表达。(d) 气泡图显示了细胞聚类的典型标记基因的表达模式。(e) 条形图显示了四个组中细胞类型的比例表示。(f) 左侧的 UMAP 突出显示了 T 细胞聚类中 Cd4 和 Cd8a 的表达。右侧的条形图显示了四个组中CD4 +和CD8 + T 细胞的比例分布。(g) 多重免疫荧光 (mIF) 成像揭示了四组小鼠中 Cd3 标记 T 细胞的空间分布和丰度。(h) 流式细胞分析显示四组小鼠中 T 细胞的相对丰度。(i) 箱线图比较了四组小鼠中通过流式细胞测定的CD3+ T 细胞、CD4 + T 细胞和CD8 + T 细胞的比例。
02
PD-1抑制剂和肠道菌群对T细胞亚型的影响
鉴于肿瘤浸润 T 细胞亚型在免疫治疗中的关键和多样化作用,他们根据典型标记将 T 细胞分为 10 个亚群,包括七种CD8 +、两种CD4 +和一种双阴性(CD4 − CD8 −)T 细胞亚型(图2a)。在CD8 + T 细胞中,鉴定出一个中枢记忆/幼稚细胞亚群(CD8-C1-Tcm/naïve)、一个效应记忆细胞亚群(CD8-C2-Tem)和五个耗竭 T 细胞亚群,其特征是表达 T 细胞共抑制受体(例如Pdcd1、Ctla4、Lag3和Havcr2)和细胞毒性相关基因(例如Ifn-γ 和 Nkg7)(图2a-b)。有趣的是,CD8 + -C1-Tcm/naïve、CD8 + -C2-Tem、CD8 + -C3-pre-Tex(前体耗竭 T 细胞)和CD4 +记忆 T 细胞在应答者(即 PW 组)中显著富集,而用 PD-1 抑制剂治疗的肿瘤(即 PA 组和 PW 组)中耗竭 T 细胞亚型的比例更高(图2c-d)。这些发现强调了细胞毒性和预耗竭CD8+细胞与免疫疗法的抗肿瘤作用之间的潜在相关性。此外,与 PA 组相比,PW 组的 Ifn-γ+细胞比例增加(图2e)。所有CD8 + T 细胞的轨迹推断分析揭示了三个状态下的两个主要进化分支(图2f),其中 PA 组在终末衰竭状态(状态 3)中显示更多的 T 细胞,富含CD8 + -C7-Tex(图2f-g)。此外,通过基于 CIBERSORT 的反卷积,使用来自三个免疫治疗队列[包括膀胱癌(BLCA)、黑色素瘤和胃癌(STAD)]的公共批量转录组数据,CD8 +效应/记忆 T 细胞和CD4 +记忆 T 细胞的比例与良好的预后相关,并在应答者中富集。这些发现表明动态CD8 +ICI 治疗期间 T 细胞耗竭,肠道菌群可能会影响效应/记忆 T 细胞和耗竭 T 细胞之间的平衡。
另一方面,他们比较了四个治疗组的CD8 + T 细胞转录谱,发现 40 个差异表达基因(DEG)受 PD-1 抑制剂和肠道菌群联合使用的影响(图2h)。这些 DEG 在多种途径中富集,包括 ATP 合成和糖酵解(图2i)。PW 组的糖酵解水平明显低于其他三组(图2j),这与支持线粒体功能的 Gabpa 和 Bhlhe40 表达较高相一致。在PW组的所有TME细胞成分中都观察到了这种较低的糖酵解评分,这与公共黑色素瘤队列数据一致(图2k)。40此外,在两个有随访信息的免疫治疗队列中(即BLCA和黑色素瘤),反卷积的糖酵解评分较高的患者预后较差(图2l)。这些发现表明,PD-1抑制剂和肠道菌群的联合应用可能协同影响肿瘤糖酵解相关的能量代谢,从而影响基于ICI的免疫治疗的疗效。
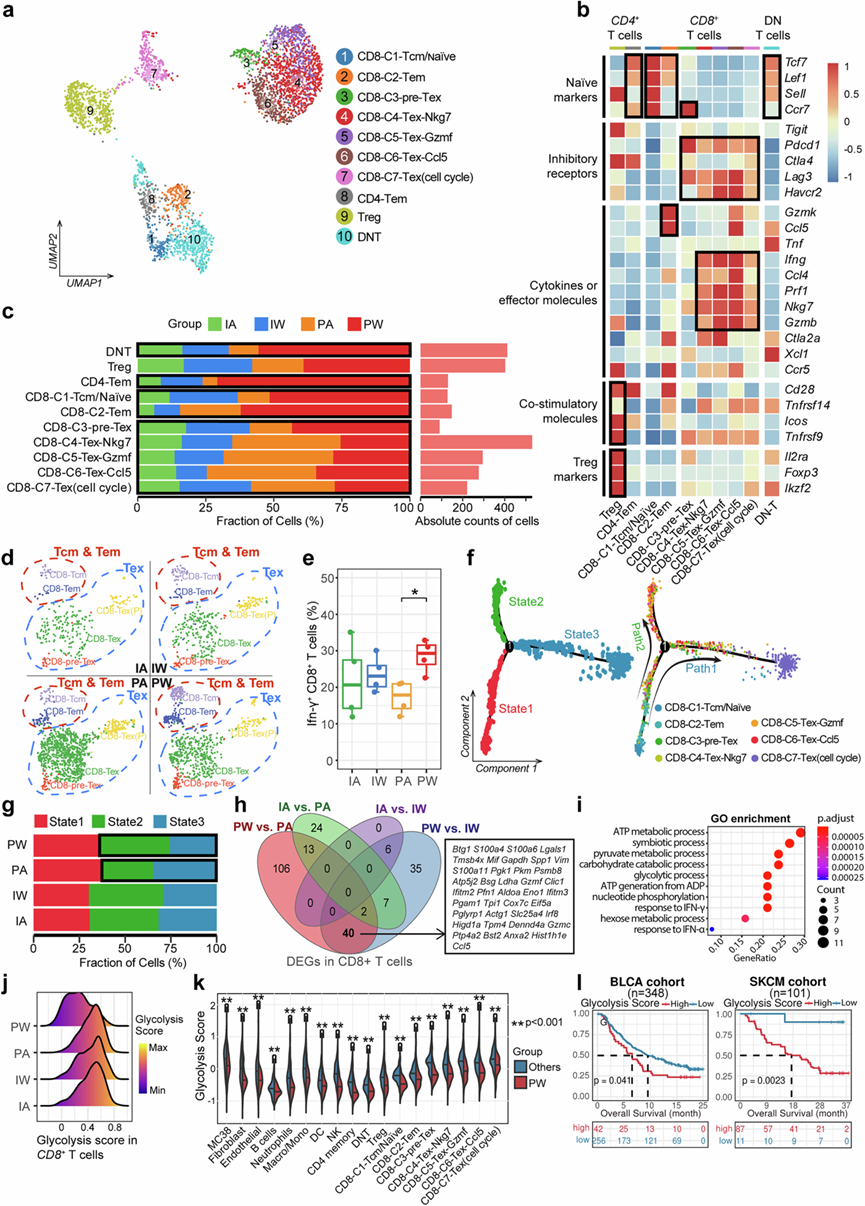
图2. 不同治疗组间肿瘤浸润 T 细胞亚群的特征。
(a) UMAP可视化描绘了四组中 T 细胞的聚类和亚型。(b) 热图说明了与 T 细胞亚型和功能相关的特征基因的表达模式。(c) 条形图显示了四组中 T 细胞亚型的比例分布。(d) UMAP图揭示了四组中CD8+ Tcm 和CD8+ Tex 细胞的分布和比例。(e) 箱线图表示基于流式细胞的四个治疗组中 IFN-γ+ T 细胞的比例。(f) 轨迹图揭示了CD8+ T 细胞的进化路径和不同状态。(g) 条形图表示四组中每种状态下CD8+ T 细胞的比例。(h) 维恩图显示了来自四组的CD8+ T 细胞的交叉差异表达基因 (DEG)。(i) 气泡图显示了 40 个 DEG 中显著富集的功能通路。(j) 脊图描绘了四组中CD8+ T 细胞的糖酵解水平。(k) 小提琴图比较了 PW 组细胞与其他组细胞的糖酵解水平。(l) Kaplan -Meier 生存曲线显示了两个免疫治疗组中细胞糖酵解水平与治疗结果之间的关系。
03
肿瘤浸润双阴性T细胞(DNT)概况
除了CD4 +和CD8 + T 细胞外,PW 组的 DNT 比例也高于其他组(图2c),这可以通过 mIF 进行验证(图3a-b)。使用公共小鼠模型数据,他们观察到常温小鼠中肿瘤浸润性 DNT 数量高于无菌小鼠,支持肠道菌群在增加 DNT 数量方面的作用(图3c)。他们根据特定标记进一步将 DNT 分为两个亚群:Ly6c2-DNT(Ly6c2、Ccl5和Gramd3)和γδT 细胞(Trdc、Tcrg-C1、Trdv4和Cd163l1)(图3d)。PW 组富含 γδ T 细胞,表明免疫疗法和肠道微生物群对 γδ T 细胞诱导具有潜在的协同作用(图3e)。功能上,γδ T 细胞连接先天性和适应性免疫系统,主要位于组织和外部环境(例如肠道)之间的界面。因此,它们可能持续与共生菌和致病菌相互作用,可能影响基于 ICB 的免疫疗法结果。在三个免疫疗法组中,基于 CIBERSORT 的肿瘤浸润 γδ T 细胞比例较高的患者始终与更好的 ICI 反应和预后相关(图3f),这与最近强调 γδ T 细胞在调节免疫疗法结果中的关键作用的证据一致。除了增加的γδT细胞比例外,PW组的DEG还在多种基于GSEA的通路中富集,包括显著激活的MHC-I抗原呈递和抗原加工复合物结合通路(图3g)。PW组中涉及MHC-I成分的多个基因的表达以及γδT细胞中的MHC-I评分明显高于其他组(图3h)。实验表明,使用TCRγδ抗体消耗γδT细胞会显著损害PD-1抑制剂的疗效,同时浸润性T细胞也会显著减少(图3i-j)。这些发现表明γδT细胞可能在功能上受肠道菌群调控,并参与肿瘤抗原的交叉呈递,这可能在免疫治疗中发挥关键作用。

图3. 肠道菌群和 ICI 治疗对双阴性 T 细胞 (DNT) 的协同作用。
(a) 代表性mIF 图像显示了四组皮下肿瘤内DNT 细胞 ( CD3+/CD4−/CD8− T 细胞)的丰度。(b) 箱线图描绘了四组皮下肿瘤中肿瘤浸润性 DNT 细胞的分布和中位数。(c) 基于 GSE181745 数据集,常温小鼠与无菌小鼠中肿瘤浸润性 DNT 细胞的比较。(d) UMAP可视化描绘了 DNT 细胞的聚类和亚型。(e) 条形图描述了四组中 DNT 细胞亚型的比例分布。(f) Kaplan-Meier 生存曲线将肿瘤浸润性 γδ T 细胞丰度与免疫治疗反应相关联。(g) 气泡图展示了PW组与其他组相比,皮下肿瘤来源的γδT细胞中基因集的功能富集分析。(h) 四组肿瘤浸润性γδT细胞中MHC-I相关基因表达的热图。(i) 折线图展示了八组皮下肿瘤的体积进展。(j) 箱线图表示通过多重免疫荧光定量的每组小鼠皮下肿瘤中T细胞亚型的比例。
04
肠道菌群和ICI治疗对髓系细胞的影响
鉴于巨噬细胞 M1/M2 极化在肿瘤中的作用已得到充分证实,他们发现 PW 组的巨噬细胞和单核细胞均表现出 M1 极化,而 PA 组中则表现出 M2 极化,此外,PW 和 PA 组之间的 DEG 在与巨噬细胞极化相关的通路(例如 IL1、IL10、IFN-γ 信号传导和 NF-κB 活化)和“对细菌相关分子的反应”通路中富集。通过对两个免疫治疗队列中的 M1 和 M2 基因集与可用的后续信息进行反卷积,他们观察到 M1/M2 比率与免疫治疗预后显著关联(图4a),这些发现支持了肠道菌群在维持促炎性肿瘤浸润巨噬细胞中的关键作用。他们接下来研究了四组之间肿瘤浸润性髓系细胞的异质性,根据特定标记物鉴定了七种亚型(图4b-c)。PW 组的 cDC 和Cd74 +巨噬细胞[通过高表达Cd74充当抗原呈递细胞(APC)]的比例较高,而Spp1+巨噬细胞的比例降低(图4d)。在常菌小鼠和无菌小鼠中也观察到了类似的趋势(图4e),这表明肠道菌群对巨噬细胞重编程的贡献。为了进一步探索这一点,他们进行了轨迹推断分析,并确定了从伪时间开始时间点沿进化路径的七种状态(图4f)。值得注意的是,Spp1+ TAM和Cd74+ TAM 在不同的轨迹路径(即 T1 和 T2)和状态(即状态 4 中的Spp1+ TAM和状态 7 中的Cd74+ TAM)中富集(图4f-g)。由于Spp1+ TAM和Cd74+ TAM分别表现出最高的 M2 和 M1 分数, Cd74和 MHC-II 组成基因(例如H2-Dma)的表达在进化过程中沿 T1 轨迹路径增加,但沿 T2 路径减少。相反,Spp1和 M2 极化相关趋化因子(例如Cxcl3)的表达显示出相反的方向(图4h)。
结合结直肠癌患者粪便菌群移植(FMT)的公共 scRNA-seq 数据,他们观察到SPP1+ TAM 和CD74 + TAM的比例之间存在显著的负相关(图4i),进一步支持炎症(即SPP1+)和抗原呈递(即CD74+)TAM 的不同进化路径。他们使用结直肠癌患者原发性肿瘤样本的空间转录组谱进一步验证了这种潜在的重编程,一致观察到免疫细胞富集区域(例如三级淋巴结构)内SPP1和CD74表达之间存在显著的负相关(图4j-k)。通过基于 CIBERSORT 对来自两个免疫治疗队列的公共转录组数据进行反卷积分析,反卷积的SPP1+ TAM 比例与不良预后显著相关,而反卷积的CD74 + TAM 和CD74 + / SPP1 + TAM的比例与良好预后显著相关(图4l)。此外,他们使用来自临床试验的公共数据估计了这两种 TAM 亚型的变化,其中 PD-1 抑制剂单药治疗后达到完全缓解的 FMT 供体的粪便样本转移到十名难治性患者。通过比较三名应答者和七名无应答者,与无应答者相比,应答者在 FMT 后反卷积的SPP1+ TAM 比例降低而CD74 + TAM 比例增加,导致SPP1+ TAM显著转向CD74+ TAM(图4m)。他们通过实验诱导小鼠骨髓来源的巨噬细胞极化为M1和M2表型。在添加已知可增强ICI疗效的特定菌种(例如Akkermansia muciniphila,简称Akk)的条件培养基后,M1标记基因(例如Inos和Il6)和Cd74的表达显著增加,而M2标记基因(Cd163和Cd206)和 Spp1表达显著降低(图4n)。这些结果表明,微生物群可能诱导潜在的微噬细胞从 M2 极化相关的 TAM(例如Spp1 + TAM)重编程为 APC(例如Cd74+ TAM),从而可能增强免疫治疗效果。
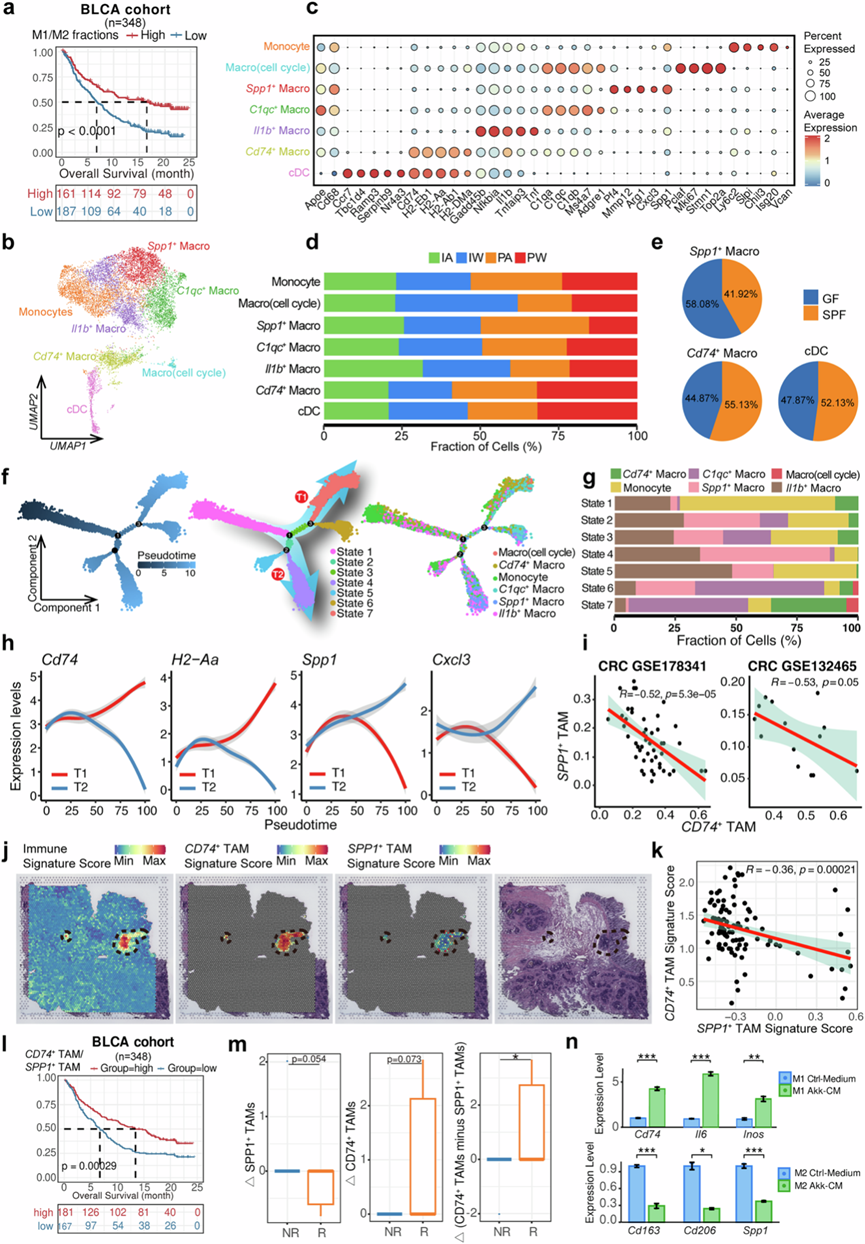
图4. ICI 治疗后髓系细胞和巨噬细胞重编程的特征。
(a) Kaplan-Meier 生存曲线显示 M1/M2 比例与膀胱癌 (BLCA) 队列中免疫疗法治疗结果的相关性。(b) UMAP分析描绘了髓系细胞的聚集和亚型。(c) 气泡图揭示了不同髓系细胞亚型中标记基因的表达谱。(d) 条形图显示了四组中髓系亚型的比例分布。(e) 饼图显示了基于 GSE181745 数据集的常菌小鼠及其无菌小鼠中Spp1+肿瘤相关巨噬细胞 (TAM)、Cd74 + TAM 和 cDC的比例。(f) 轨迹图揭示了巨噬细胞/单核细胞的进化路径和不同状态。(g) 条形图显示了7 种进化状态下单核细胞/巨噬细胞亚型的比例。(h) 折线图显示了抗原呈递基因(即Cd74和H2-Aa)和 M2 相关基因(即Spp1和Cxcl3)随伪时间变化的 loess 回归平滑表达。(i) 散点图显示了两个 CRC 队列中SPP1 + TAM 和CD74 + TAM比例与公开 scRNA-seq 数据的相关性。(j) 代表性空间特征图显示了 CRC 患者样本肿瘤切片中免疫细胞、CD74+ TAM 和SPP1+ TAM的特征得分。(k) 散点图揭示了中 CRC 肿瘤样本中免疫细胞富集区域中CD74+ TAM 和SPP1+ TAM 的特征评分之间的相关性。(l) Kaplan-Meier 生存曲线显示肿瘤浸润CD74+TAM/ SPP1+ TAM 比例与两个免疫治疗队列中 ICI 治疗结果的相关性。(m) 箱线图显示 FMT 队列治疗前后特定 TAM 亚型比例的变化。(n) M1 和 M2 巨噬细胞中巨噬细胞相关基因的表达水平。
05
SPP1对ICI治疗疗效的影响
除了Spp1+ TAM比例的变化外,Spp1 的表达在不同细胞类型中以不同的水平普遍存在,并在 PW 组中持续降低(图5a),这表明Spp1表达在肠道菌群和 ICI 治疗之间的协同作用中具有潜在作用。有趣的是,较高的SPP1表达与来自癌症基因组图谱 (TCGA) 项目的多种癌症类型(图5b)以及两个免疫治疗队列(图5c)的不良预后一致相关。此外,在具有完整肠道菌群的小鼠血清中观察到较低水平的 ELISA 估计骨桥蛋白(一种由Spp1编码的分泌性磷蛋白),特别是在 PW 组中与 ICI 治疗相结合时(图5d)。他们进一步比较了四个治疗组中癌细胞(即MC38)与所有TME细胞类型之间Spp1相关相互作用强度的差异,发现PW组的下降幅度最大,尤其是在TAM,尤其是Spp1 + TAM(图5e-g)。事实上,与其他髓系亚型相比,只有Spp1+ TAM亚型与MC38的相互作用降低(图5h)。这些发现表明,肠道菌群可能通过下调Spp1表达来抑制肿瘤进展并增强免疫治疗效果,而骨桥蛋白可能作为肿瘤进展和治疗结果的预后标志物。
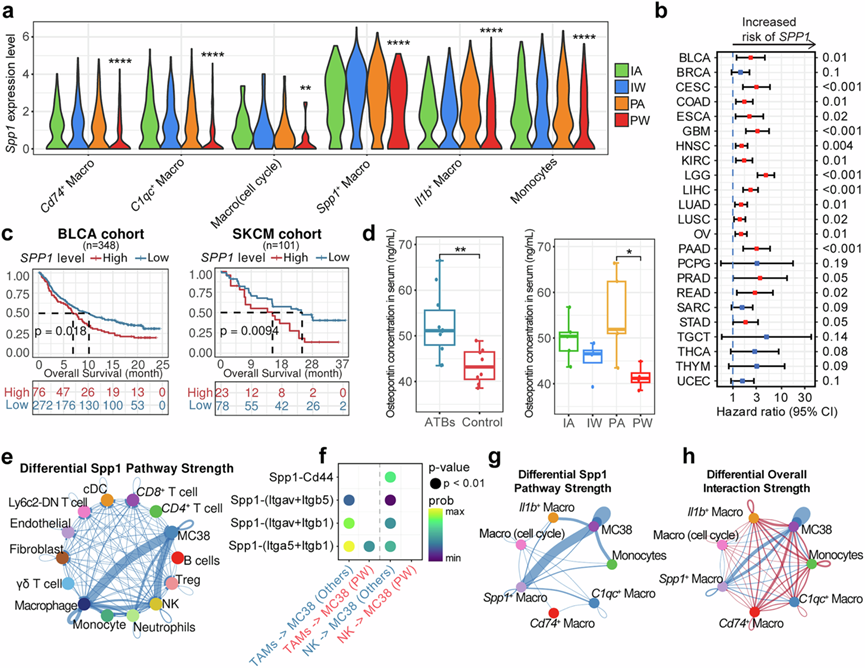
图5. 肠道菌群与ICI治疗对SPP1的协同作用。
(a) 小提琴图显示四组髓系亚型中Spp1的表达水平。(b) 森林图显示TCGA数据集中SPP1基因表达水平与主要癌症类型预后的关系。(c) Kaplan-Meier生存曲线显示两组免疫治疗中SPP1表达水平与预后的相关性。(d) 箱线图显示四组小鼠血清中ELISA测得的骨桥蛋白水平。(e) 网络图显示PW组与其他组相比两种细胞类型之间Spp1相关通路相互作用强度的差异。(f) 气泡图显示PW组与其他组相比肿瘤相关巨噬细胞(TAM)/NK细胞与MC38肿瘤细胞之间Spp1相关通路相互作用强度的差异。(g) 网络图显示 PW 组中髓系亚型与 MC38 细胞之间 Spp1 相关通路相互作用强度与其他组相比存在差异。(h) 网络图显示PW组中髓系亚型与 MC38 细胞之间整体信号传导相互作用强度与其他组相比存在差异。
06
巨噬细胞中 Spp1 耗竭对小鼠模型中 ICI 治疗的影响
鉴于先前研究中强调的SPP1+ TAM 在肿瘤恶性程度、进展和预后中的作用,他们探索了它们在肠道菌群背景下的 ICI 治疗中的作用,使用 Spp1flox/flox Lyz2-Cre+条件性敲除小鼠(称为 Spp1-cKO),其中Spp1在髓系细胞(例如巨噬细胞)中发生特异性敲除。将 MC38 细胞皮下植入 Spp1-cKO 和 Spp1flox/flox Lyz2-Cre −(称为 Spp1-WT)中,然后进行 ICI 治疗,随后进行免疫细胞分选以进行共培养测定(图6a)。皮下植入 MC38 细胞后延迟一天的 ICI 治疗导致初始肿瘤体积增大、生长速度减慢,但并未减少肿瘤体积(图1b,图6b)。更重要的是,Spp1-cKO 小鼠表现出显著的肿瘤生长减少和基于肿瘤体积的更好的 ICI 治疗效果(图6b),同时肿瘤浸润CD4+/CD8 + T 细胞和 DNT 细胞增加(图6c-d)。一致地,与接受 ICI 处理的 Spp1-cKO 小鼠的脾淋巴细胞共培养可诱导显著更高的 GFP 标记的 MC38 细胞凋亡率,通过流式细胞测量(图6e),这表明无Spp1+巨噬细胞的 TME 可能通过刺激更多的细胞毒性 T 细胞来增强抗 PD-1 治疗的杀肿瘤活性。
由于在 PA 组小鼠中,肠道菌群清除后 ICI 介导的免疫疗法的疗效降低,这种效果可以通过口服补充特定的功能性细菌种类(即Akk)和重新建立的肠道菌群来恢复(图6f),他们接下来研究了Spp1+ TAM 耗竭对 ATB 治疗小鼠中 ICI 疗效的影响。值得注意的是,Spp1-cKO 小鼠在肠道菌群清除后仍然对抗 PD-1 治疗有反应,而 Spp1-WT 小鼠则失去了疗效(图6f)。因此,Spp1-cKO 小鼠的治疗后肿瘤表现出各种类型的浸润性 T 细胞比例明显更高(图6g-h)。作为验证,在接受ATB治疗的小鼠中,口服补充Faecalibacterium prausnitzii (FP)(另一种最近报道的可增强ICI敏感性的细菌),也增加了浸润性T细胞并恢复了PD-1抑制剂的疗效。这些发现表明,TME中的Spp1+ TAM可能在肠道菌群调节的基于ICI的免疫治疗中发挥重要作用。
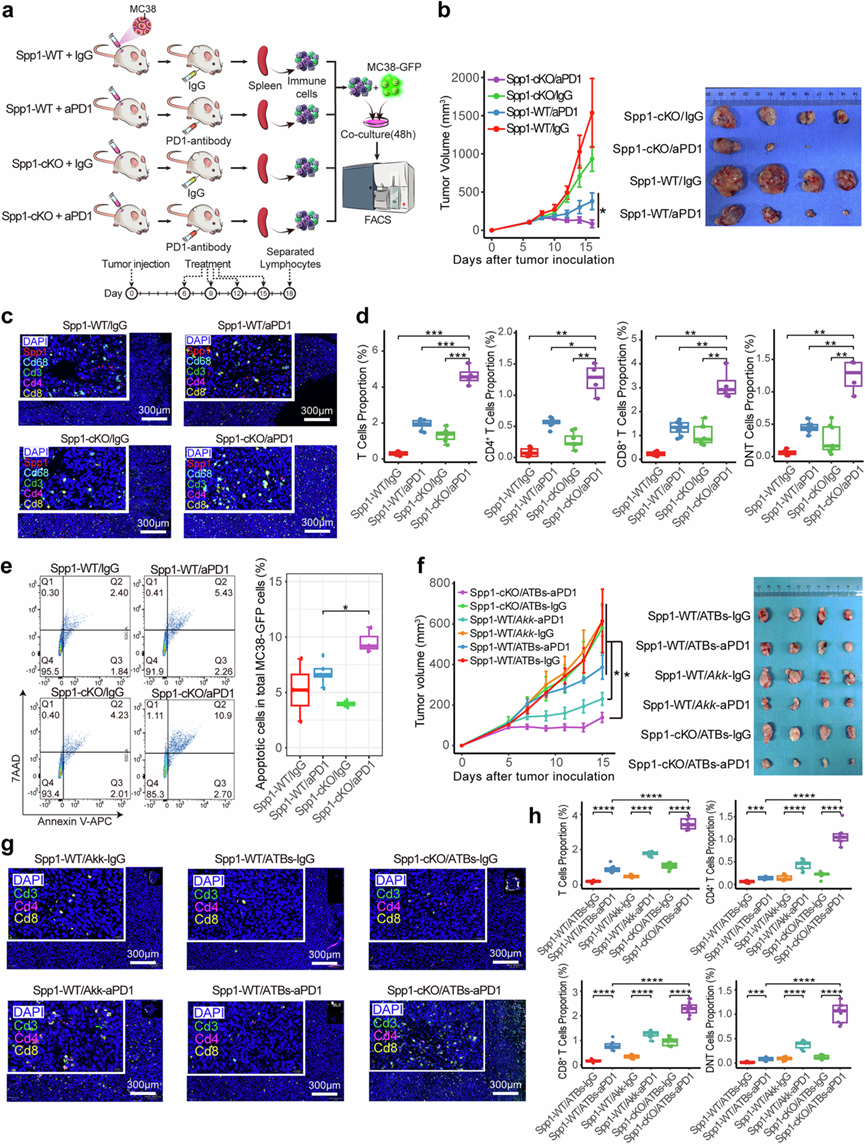
图6. 巨噬细胞中 Spp1 耗竭对小鼠模型中 ICI 治疗的影响。
(a) 与Spp1 -WT 小鼠相比,Spp1 -cKO 小鼠的 ICI/IgG 治疗实验设计示意图。(b) 折线图(左)描述了中所示研究中四组小鼠皮下肿瘤的体积进展。进行了两批实验,每组四只小鼠。图像(右)显示了一个批次的四组切除肿瘤的比较。(c) 多重免疫荧光(mIF)图像显示了四组皮下肿瘤内 T 细胞和Spp1+巨噬细胞的染色。(d) 条形图量化了四组小鼠皮下肿瘤内基于 mIF 的 T 细胞亚型比例。(e) 配对细胞流式细胞面板(左)和箱线图(右)展示了 4 个组中与脾脏来源的 T 细胞共培养的 MC38 细胞凋亡百分比。(f) 折线图(左)展示了Spp1 -cKO 小鼠与Spp1 -WT小鼠相比,6 个 ATB 治疗小鼠组中皮下肿瘤体积的进展情况。图像(右)显示了 6 个组中切除的肿瘤的比较。(g) mIF图像表示揭示了 6 个组中皮下肿瘤内 T 细胞的空间分布。(h) 条形图显示了六组小鼠皮下肿瘤中 T 细胞亚型的比例。
07
γδT细胞-APC- CD8+ T细胞轴通过NF-κB通路介导CD8+ T刺激
与树突状细胞 (DC) 类似,特定的巨噬细胞亚型也可充当 APC,通过促进细胞毒性 T 淋巴细胞分化并通过特定的相互作用防止其功能障碍来影响免疫治疗效果。通过scRNA -seq 分析,他们发现 PW 组的巨噬细胞/单核细胞和树突状细胞中 Cd40 和几种 MHC-II 成分(例如 H2-Ab1 和 Cd74)均上调(图7a)。PW 组中的 DEG 始终在多种抗原呈递相关途径中富集,包括“通过 MHC-II 的外源抗原”(图7b),这些通路的成分在 PW 组的 APC 中显著上调,尤其是在Cd74+ TAM 中(图7c)。这些发现表明肠道细菌和基于 PD-1 的免疫疗法可能协同增强 APC 的抗原呈递能力,进而诱导PW 组中CD4 + -Tem 细胞的特定激活。
另一方面,PW 组 APC 中的 I-κB/NF-κB 调控信号也丰富(图7b),关键基因特别上调,包括Cd40、Birc3(Ciap2)、Nfkb2(p100)、Relb和Icam1(图7d)。这一发现与之前的报道一致,表明细菌(包括肠道微生物群)的存在可诱导 Cd40 上调,从而通过 NF-κB 通路激活 APC 细胞。此外,由非经典 NF-κB 通路激活的 DC 产生的 Il12b 表达可增强抗 PD-1 治疗,该表达在 APC 中也上调。鉴于 CD40 与 CD40L(由CD40LG编码)之间的相互作用对 APC 调节和基于 NF-κB 通路的激活至关重要,他们接下来估计了不同细胞类型中Cd40lg 的表达。与 APC 和肿瘤浸润CD4+ T 细胞和 B 细胞之间的相互作用一致,Cd40lg在这两个 TME 成分中表现出高表达(图7e)。有趣的是,在 γδ T 细胞中观察到Cd40lg的最高表达(图7e),而 IA 组在 γδ T 细胞中显示出的Cd40lg表达明显低于其他组,但在 B 细胞或CD4+ T 细胞中没有这种表达,这表明完整的肠道菌群和 ICI 均可特异性增强γδ T 细胞中的Cd40lg表达。基于Cellchat的细胞间通讯分析显示,Cd40l-Cd40相互作用信号在γδT细胞和APC之间一致富集(图7f),并且Cd40lg-Cd40配体/受体对在PW组中表现出最高的相互作用强度,尤其是在γδT细胞和Cd74+ TAM之间(图7g)。
通过使用 mIF 进行实验验证,在 MC38 和 CT26 衍生的肿瘤中,PW 组中相互作用的 Cd40L+ γδ T 细胞和 Cd40+ APC 对的数量明显高于其他三组(图7h),而相互作用的 Cd40l + Cd4 + T 细胞和 Cd40 + APC 对在所有组中几乎不存在。鉴于 APC 可以通过 CD86-CD28 相互作用激活CD8+ T 细胞,这种相互作用在 PW 组中表现出最强的强度(图7i),他们进一步研究了激活 Cd40 是否可以增强适应性免疫。在用 CD40 激动剂实验性地激活 CD40 后,观察到APC(尤其是巨噬细胞)通过增加 Cd86-Cd28 共刺激受体对的相互作用强度来激活CD8+ T 细胞,类似于肠道细菌的作用(图7i-j)。通过 mIF 测定,在 MC38 和 CT26 衍生肿瘤的 PW 组中均观察到 Cd28+Cd8+ T 细胞与 Cd86+ APC 之间的相互作用明显增多(图7k)。随后,CD40 激动剂治疗后,肿瘤浸润CD8+中枢/效应记忆 T 细胞与耗竭的CD8+ T 细胞的比例显著增加(图7l),与 PW 组的观察结果一致(图7m)。此外,在三个免疫治疗队列中, CD8+效应记忆T细胞和γδT细胞特征的反卷积得分之间存在显著相关性,应答者的两个特征得分均高于无应答者(图7n),从而有助于预测免疫治疗的预后价值(图3f)。使用上述临床FMT试验的数据也观察到了同样的趋势,表明动态浸润γδT细胞比例与FMT治疗后CD8 + Tem比例呈显著正相关,应答者中CD8 + Tem显著富集(图7o)。本研究结果表明,肠道细菌可能通过潜在的 Cd40l-Cd40 介导的 γδ T 细胞-APC- CD8+ T 细胞轴协同提高免疫治疗的疗效。
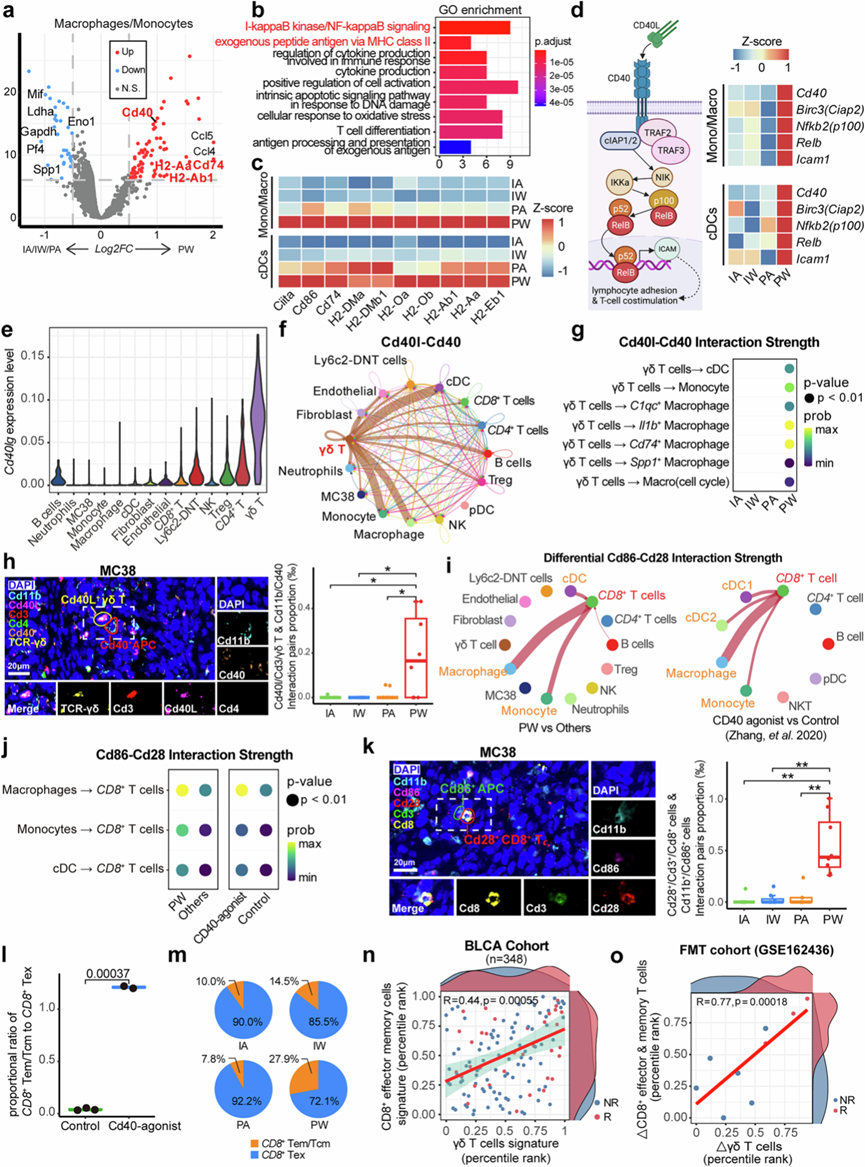
图7. γδT 细胞介导的 APC 对CD8 + T的刺激。
(a) 火山图描绘了 PW 组皮下肿瘤巨噬细胞和单核细胞与其他组相比的差异表达基因(DEG)。(b) DEG 的通路富集分析。(c) 热图显示了四组中抗原呈递传统树突状细胞 (cDC) 和单核细胞/巨噬细胞中 MHC-II 相关基因的表达水平。(d) 示意图(左)描述了非经典 NFκB 通路中的关键基因,该通路在四组小鼠的热图(右)中显示了在 cDC 和单核细胞/巨噬细胞中的表达。(e) 小提琴图揭示了所有细胞类型中Cd40lg的MAGIC表达水平。(f) 网络图描绘了 Cd40l-Cd40 通路中不同细胞类型之间的细胞相互作用强度。(g) 气泡图表示四组中 γδ T 细胞与 cDC、单核细胞和巨噬细胞亚群之间的 Cd40l-Cd40 通路相互作用强度。(h) 代表性多重免疫荧光 (mIF) 图像(左)说明了皮下肿瘤内相互作用的 Cd40l + γδ T 细胞和 Cd40 + APC 的空间分布,箱线图(右)显示了四组中皮下肿瘤内相互作用的 Cd40l + γδ T 细胞和 Cd40 + APC 对的数量。(i) 左侧的网络图显示了 PW 组中肿瘤浸润 CD8+ T 细胞与其他细胞类型之间的 Cd86-Cd28 通路相互作用强度与其他三组相比的差异;右侧的网络图显示了接受 Cd40 激动剂治疗的小鼠与对照小鼠相比,肿瘤浸润性CD8 + T 细胞之间 Cd86-Cd28 通路的相互作用强度差异。(j) 气泡图显示了(i)中肿瘤浸润性巨噬细胞/单核细胞/cDC 与CD8+ T 细胞之间 Cd86-Cd28 通路的相互作用强度。(k) 代表性mIF图像(左)说明了相互作用的 Cd86+ APC 和 Cd28 + Cd8+的空间分布皮下肿瘤内的 T 细胞,箱线图(右)显示四组皮下肿瘤内相互作用的 Cd86+ APC 和Cd28+ Cd8+ T 细胞对的数量。(l) 箱线图比较了Cd40 激动剂治疗小鼠和对照组之间肿瘤浸润CD8+效应记忆/中央记忆 T 细胞与CD8+耗竭 T 细胞的比例。(m) 饼图显示四组中 CD8+效应记忆/中央记忆 T 细胞与 CD8+耗竭 T 细胞的比例。(n) 边际密度散点图显示BLCA免疫治疗队列患者肿瘤浸润CD8 +效应记忆和 γδ T 细胞的比例。(o) 散点图显示FMT 前后γδ T 细胞丰度与CD8+效应和记忆 T 细胞丰度变化之间的线性相关性。
+ + + + + + + + + + +
结 论
本研究结果表明,完整的肠道菌群与 ICI 相结合可协同增加CD8+、CD4 +和 γδ T 细胞的比例,降低糖酵解代谢,并将耗竭的CD8+ T 细胞逆转为记忆/效应CD8+ T 细胞,增强抗肿瘤反应。这种协同作用还诱导巨噬细胞从 M2 原肿瘤Spp1+ TAM重编程为Cd74+ TAM,后者充当APC。这些巨噬细胞亚型在肿瘤内呈负相关性,尤其是在粪便菌群移植期间。在Spp1条件性敲除小鼠中,无论肠道菌群状态如何,消耗Spp1+ TAM均可增强ICI的疗效和T细胞浸润,这表明肠道菌群可能发挥上游作用,并凸显了Spp1+ TAM在巨噬细胞重编程过程中对免疫治疗结果的关键负面影响。这些结果强调了γδT细胞和SPP1相关巨噬细胞重编程在激活CD8+ T细胞中的潜在重要性,以及肠道菌群和ICI通过调节TME在免疫治疗中的协同作用。
+ + + + +



 English
English


