文献解读|Cancer Cell(48.8):非功能性胰腺神经内分泌肿瘤的蛋白质组学表征揭示了临床相关的亚组
✦ +
+
论文ID
原名:Proteogenomic characterization of non-functional pancreatic neuroendocrine tumors unravels clinically relevant subgroups
译名:非功能性胰腺神经内分泌肿瘤的蛋白质组学表征揭示了临床相关的亚组
期刊:Cancer Cell
影响因子:48.8
发表时间:2025.04.14
DOI号:10.1016/j.ccell.2025.03.016
背 景
胰腺神经内分泌肿瘤 (PanNEN) 是胰腺第二常见的上皮性肿瘤,在过去的四十年中,其发病率和患病率显著增加。根据世界卫生组织的分类,PanNEN 可分为高分化胰腺神经内分泌肿瘤 (PanNET) 和低分化胰腺神经内分泌癌。PanNET 占所有 PanNEN 的 90% 以上,根据是否存在临床激素分泌过多综合征,PanNET 可分为功能性 PanNET 或非功能性 PanNET (NF-PanNET)。NF-PanNET 约占 PanNET 的 90% ,其临床特征高度多变。大约一半的 NF-PanNET 患者在诊断时已经出现远处转移(主要转移到肝脏),中位生存期仅为 23 个月,而局部性疾病患者的中位生存期为 124 个月。虽然目前的治疗方案已证明具有效用,包括生长抑素类似物、酪氨酸激酶抑制剂、哺乳动物雷帕霉素靶点(mTOR) 抑制剂、和化疗药物(如替莫唑胺) ,但大多数药物只能改善无进展生存期,对总体生存期的影响有限。因此,迫切需要彻底了解 NF-PanNET的潜在分子机制。
实验设计
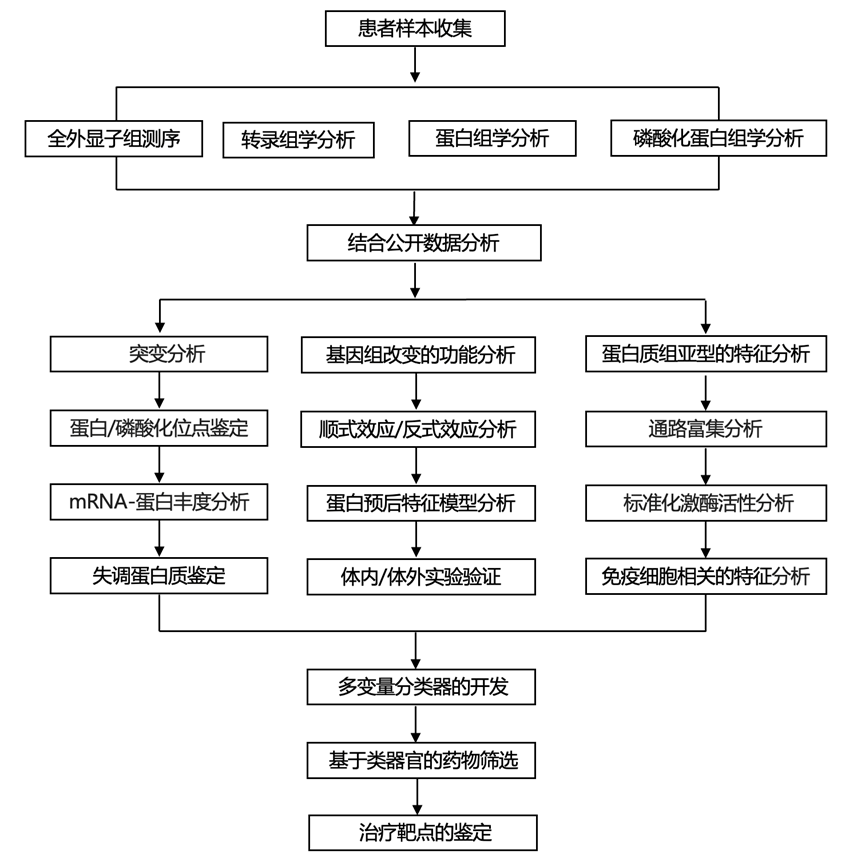
结 果
01
中国NF-PanNET的蛋白质组学概况
研究团队收集了144例胰腺神经内分泌肿瘤样本及其配对的正常癌旁组织(NAT)。排除患有神经内分泌癌或功能性PanNET、接受新辅助治疗或随访期间无影像学数据的患者,最终纳入108例未接受治疗的NF-PanNET病例作为发现队列。对发现队列进行了全面的多组学分析,包括全外显子组测序 (WES)、转录组分析(RNA-seq)以及蛋白质组学和磷酸化蛋白质组学分析(图1 A)。此外,以51例NF-PanNET病例作为验证队列,采用数据非依赖性采集(DIA)-MS对肿瘤样本进行分析(图1 A)。为了比较TMT-MS和DIA-MS的蛋白质定量结果,他们还对来自探索队列的84例肿瘤样本进行了DIA-MS分析。此外,还通过激光捕获显微切割技术从7例病例中获取了NAT区域的正常胰岛及其匹配的肿瘤内容物,并收集了另外13例胃肠道神经内分泌肿瘤(NET)样本并进行了分析比较。
在发现队列中具有 WES 谱的 99 个病例中,在已知的 PanNET 基因中反复发现非沉默体细胞简单突变(点突变和小插入/缺失)(图1 B),包括MEN1(32%)、DAXX(17%)、ATRX(15%)和VHL(6%),这与以前的基因组研究相似。值得注意的是,据报道DAXX和ATRX的突变是互斥的。除了这四个经常突变的基因外,在 mTOR 通路的多个负调节因子中还发现了非沉默突变,包括PTEN、 TSC1和TSC2 (影响总共 10% 的样本)和染色质重塑基因,如SETD2和ARID1A(总共 6% 的样本)。
癌症重要靶点的基因组识别 (GISTIC) 分析确定了反复出现的基因增益和缺失区域,包括含有已知神经内分泌肿瘤抑制基因MEN1(染色体 11q13.1)和VHL(3p25.3)的广泛缺失区域(图1B),而局部缺失峰突出了MEIS1(2p14,MEN1的已知靶点)的潜在肿瘤抑制作用,以及神经纤维瘤中经常缺失的基因(FAM19A3、INPP5D和RABGAP1L)。他们还观察到已知致癌基因的局部扩增,包括MET(7q31.2)和PAX4(7q32.1),其中MET与通过激活 mTOR 和神经生长因子轴促进胰腺癌神经周围侵袭有关。
对 108 个 NF-PanNET 样本和配对 NAT 进行整体蛋白质组学分析共鉴定出 10574 种蛋白质,而磷酸化蛋白质组学分析共发现 46385 个磷酸位点,对应 8827 种磷酸化蛋白质(图 1 A)。将 84 个肿瘤样本与 TMT-MS 和 DIA-MS 图谱进行比较,也表明这两种定量方法之间存在良好的一致性。随后的分析中纳入了至少 50% 样本中定量的共 9429 种蛋白质和 17309 个磷酸位点。此外,用 DIA-MS 对 7 个病例(发现队列)的显微切割正常胰岛和肿瘤内容物进行了分析。通过对本体组织和显微切割样本的分析发现,神经内分泌标志物,包括突触素 (SYP)、嗜铬粒蛋白 A (CHGA)、γ-烯醇化酶 (ENO2) 和 CD56 (NCAM1) 在肿瘤中显著升高(图 1 C)。本体/显微切割蛋白质组学图谱的基因集富集分析 (GSEA) 分别突出显示了肿瘤中上调通路活性的一致性,包括与癌症相关的通路(图 1 D)和与内分泌功能相关的通路,包括调节分泌和囊泡介导的运输。这与 PanNET 中内分泌细胞基因特征的强劲表达相一致,最近对胃肠胰腺 NET 的单细胞分析表明,肿瘤细胞与胃肠道发育的早期阶段相似。进一步比较分别鉴定出的差异表达蛋白质(肿瘤与正常),也显示出相当大的重叠。
RNA 和蛋白质丰度之间的基因相关性中值为 0.46(图 1 E),与最近两项胰腺导管腺癌研究的相关性相当。参与缺氧、糖酵解和上皮间质转化 (EMT)的基因表现出最高的 mRNA-蛋白质相关性(图 1 E)。此外, NAT 样本的 RNA 和蛋白质之间的基因相关性比肿瘤样本低得多(图1 F),其他肿瘤类型中也出现了类似的情况,这可能是由于正常样本之间的样本间变异较小。
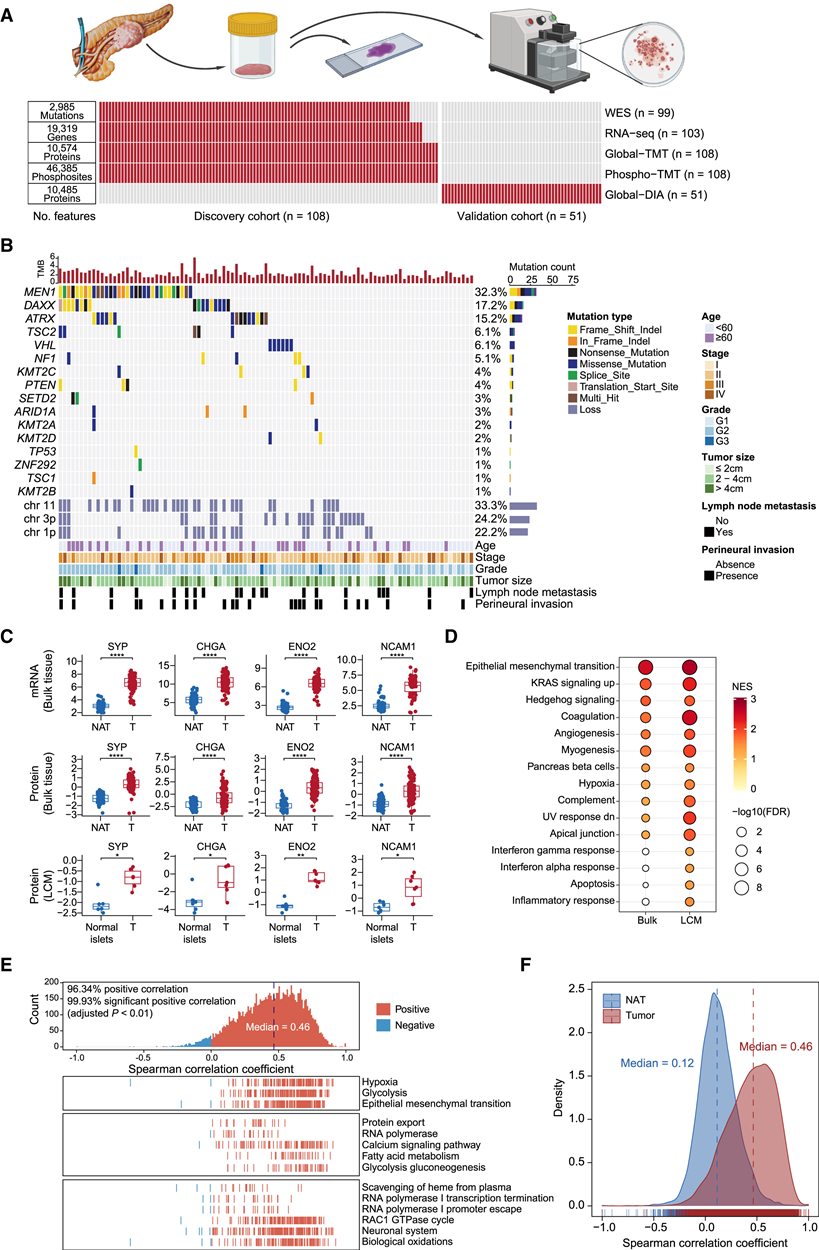
图1. NF-PanNET的蛋白质组学图谱。
(A) 示意图显示了发现队列和验证队列的样本数量和分子特征,这些样本通过全外显子组测序 (WES)、RNA-seq以及基于质谱的定量蛋白质组学和磷酸化蛋白质组学分析进行分析。(B) Oncoplot 显示 NF-PanNET 的基因组图谱,包括 PanNET 癌基因的体细胞简单突变(按突变频率排序)和频繁发生的广泛缺失。(C) 箱线图显示,分别通过使用组织样本(上)和通过激光捕获显微切割 (LCM) 获得的显微切割样本(下)的分析,NF-PanNET 肿瘤 (T) 中的典型神经内分泌标志物上调。(D) 气泡图描绘了GSEA结果,比较了肿瘤和配对NAT的蛋白质组学图谱。(E) NF-PanNET 中 mRNA 水平和蛋白质丰度之间的基因相关性分布(上),以及富集的癌症标志、KEGG 和 Reactome 通路的相关系数指示(下)。(F) 分别在肿瘤(红色)和 NAT(蓝色)中基因 mRNA-蛋白质相关性的分布。
02
PanNET体细胞驱动改变的蛋白质组学影响
接下来,他们表征了 NF-PanNET 中三个最常发生突变的基因(MEN1、DAXX和ATRX,共影响 51% 的患者)的体细胞简单突变分别对同源 mRNA、蛋白质表达和磷酸化水平(顺式效应)以及对与 PanNET 相关的通路中的基因(反式效应)的影响。在 mRNA/蛋白质表达(图 2 A)和磷酸化水平(图 2 B)中均发现了显著的顺式和反式效应。关于顺式效应,肿瘤抑制基因MEN1和DAXX的突变与各自基因产物的 mRNA/蛋白质水平下降显著相关。ATRX突变也与其 mRNA 下降和蛋白质水平下降有关。
就反式效应而言,MEN1或DAXX/ATRX (任一种)突变与 mTOR 信号网络多个上游基因(如 WNT4、WNT5 和 WNT7B)和下游基因(如PRKCA)的表达上调显著相关(图 2 A),以及染色质重塑基因(如着丝粒蛋白 V [ CENPV ] 和 NPM2 )的下调。体外和体内功能测定证实了它们在 PanNET 中的功能性作用,敲低PRKCA、WNT4和WNT5A导致肿瘤增殖显著下降,而敲低CENPV、LRP5和NPM2则产生相反的效果。值得注意的是,CENPV在 mRNA、蛋白质和磷酸位点水平表现出最明显的MEN1突变反式效应,CENPV在抑制 PanNET 的肿瘤生长方面具有保护作用,CENPV 是着丝粒组织和染色体正确分离所必需的。
为了进一步研究PanNET中MEN1 基因改变的潜在回路,他们利用 CRISPR-Cas9 系统构建了胰腺Men1条件性敲除 (Men1-KO) 小鼠,以消除人类 PanNET不同遗传背景下的表型变异。通过比较Men1-KO 和野生型小鼠富集纯化的胰岛蛋白质组学图谱,GSEA 分析发现Men1-KO 小鼠的代谢、增殖和信号通路显著上调(图 2 C),其中 mTORC1 信号在Men1-KO 小鼠和具有MEN1突变 (MEN1-mut) 的人类 PanNET 中均呈上调。在Men1-KO 小鼠中上调的蛋白质中,114 种蛋白质在MEN1 -mut 人类肿瘤中表现出一致的上调,其中 21 种蛋白质与患者预后不良显著相关(图 2 D)。他们选择了四个候选蛋白(持续上调的通路成员)进行进一步研究。在两种 PanNET 细胞系中,与对照组相比,敲低MEN1后PCP4表达显著上调,而过表达MEN1后 PCP4 表达显著降低。PCP4 是一种钙调蛋白结合蛋白,最初已知可以保护神经元免受 Ca2+诱导的毒性,43 PCP4的过表达最近与不成熟或功能失调的 β 细胞有关。在Men1基因敲除 (KO) 小鼠中下调的蛋白质中,CENPV 在小鼠和MEN1突变人类肿瘤(图 2 A)中均表现出一致的降低,并证实其在 PanNET 中具有保护作用。综合来看,整合的反式效应分析表明 CENPV 是 PanNET 中MEN1突变的潜在介导因子,以及其他有待进一步研究的候选因子。
最后,他们研究了体细胞拷贝数变异 (SCNA) 的顺式和反式效应。所有 23109 个出现拷贝数变异 (CNA) 的基因分别通过与 mRNA、蛋白质和磷蛋白水平的相关性分析进行评估。在所有 mRNA、蛋白质和磷蛋白水平中均观察到显著相关的对角线模式。在 29.5% (4,934/16,716) 的 CNA-mRNA、23.8% (2,117/8,899) 的 CNA-蛋白质和 8.6% (524/6,122) 的 CNA-磷蛋白对中观察到显著正相关。他们进一步关注具有复发性增益的区域,以确定可能在 NF-PanNET 肿瘤发生中发挥作用的假定 SCNA 驱动因素。在位于局部扩增峰的 394 个基因中,145 个基因的拷贝数与相应的 RNA 水平之间存在显著相关性,随后有 66 个基因显示出相关的蛋白质表达(图 2 E)。这 66 个具有局部扩增的基因是假定的 SCNA 驱动基因,在与 DNA 复制、分泌、内吞作用和囊泡介导的运输相关的生物过程中富集(图 2 F)。在这些富集的过程中,内吞作用已确定为肿瘤细胞转移潜能的中心调节过程。值得注意的是,在与内吞作用相关的假定 SCNA 驱动基因中(WASL、细胞周期蛋白依赖性激酶 [CDK] 5、ESYT2和MET)(图 2 G),CDK5 是第一个通过磷酸化动力蛋白 I 参与调节突触囊泡内吞作用的脱磷蛋白激酶。
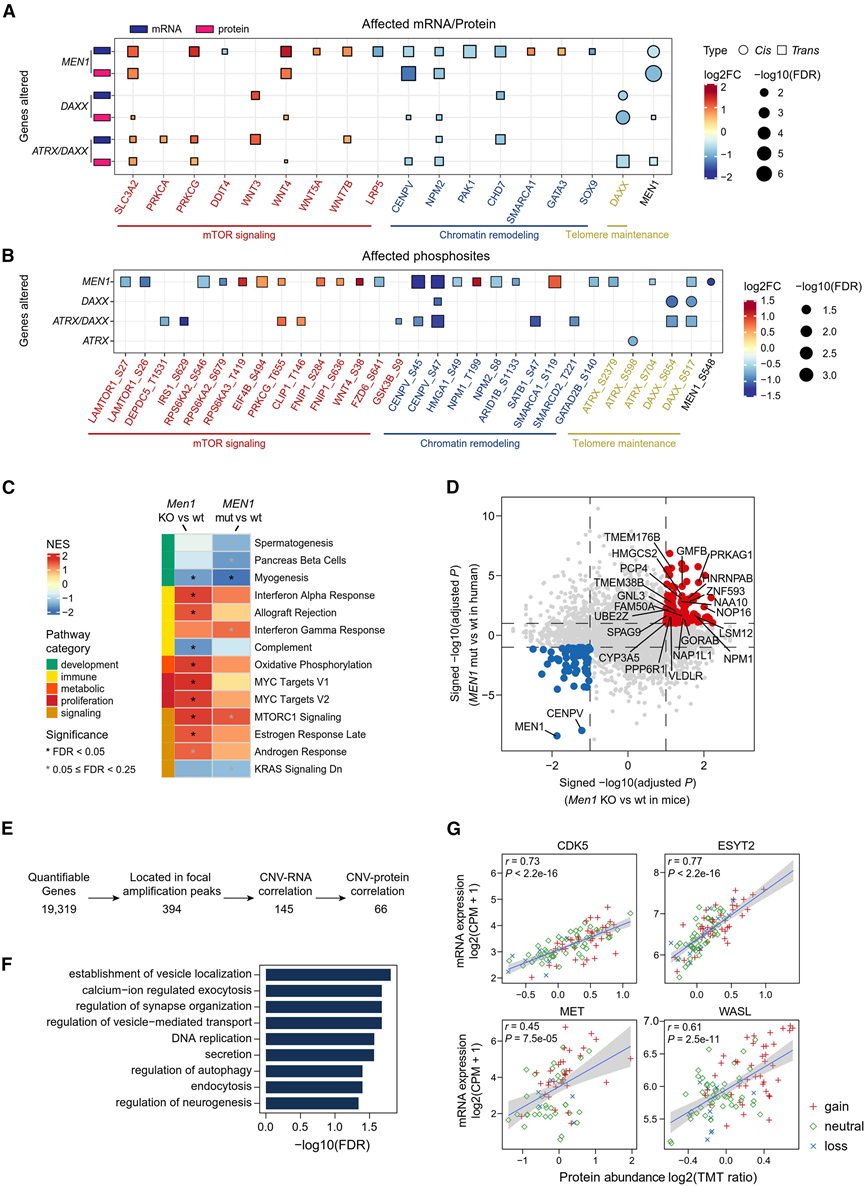
图2. 基因组改变对转录组、蛋白质组和磷酸化蛋白质组的影响。
(A) MEN1 、 DAXX和ATRX体细胞简单突变(y 轴)对参与 mTOR 信号传导、染色质重塑和端粒维持途径的基因的 mRNA 表达和蛋白质丰度(x 轴)的显著顺式和反式效应。(B) 与(A)相同,展示突变对磷酸位点的影响。(C) 热图显示,在Men1基因敲除小鼠(与Men1 wt 小鼠相比)和MEN1 mut 人类肿瘤(与MEN1 wt 肿瘤相比)中,失调的癌症标志性通路具有一致的方向。(D) 散点图显示Men1基因敲除小鼠和MEN1突变人类肿瘤中失调的蛋白质。(E) 说明识别假定的 SCNA 驱动因素的过程的流程图,该过程评估了具有复发性局部扩增的基因在 mRNA 和蛋白质水平上的顺式效应。(F)GO分析。(G) 散点图分别显示四种假定的 SCNA 驱动基因的 mRNA 水平和蛋白质丰度之间的相关性,其中拷贝数交替状态用不同的颜色和形状表示。
03
发现NF-PanNET预后的蛋白质组学特征
一种能够对具有不同结果的患者进行分层的预后生物标志物对于 PanNET 根治术后的疾病管理至关重要。在此,他们通过可重复预后分子特征平台开发了一种三蛋白预后特征,该特征采用引导程序来选择稳健的预测因子,并使用发现队列作为训练数据集(图 3 A)。特征蛋白 GNAO1(鸟嘌呤核苷酸结合蛋白亚基 α)和 INA(α-中间连接蛋白)的表达升高与较低的特征评分和良好的患者结果显著相关,而 VCAN(多功能蛋白聚糖核心蛋白)显示出相反的关联。与发现队列中的单一蛋白质相比,这种三蛋白预后特征在区分高风险和低风险患者方面表现出更好的性能,这表明多变量特征捕获了更多重要信息(图 3 B-C)。此外,该特征在估计绝对风险和有限的预测误差率方面表现出良好的校准性。
在发现队列(图 3 D)和验证队列(图 3 E)中,预测的高危组和低危组(按标签评分分层的患者)的生存率存在显著差异。预后组之间 5 年生存率的显著差异(51.4% vs 97.8 %)表明,高危患者需要在更短的时间间隔内以更紧密的术后 CT 复发监测进行监测。高危组肿瘤与DAXX/ATRX和MEN1非沉默突变以及不良临床病理变量(如更高级别、更晚期分期和神经周围侵犯等)有显著相关性。多元 Cox 回归分析包括临床病理风险因素、DAXX 和 ATRX 蛋白丰度,表明蛋白质组学特征是发现队列和验证队列中的独立预后因素。
他们还对具有福尔马林固定石蜡包埋 (FFPE) 切片的发现队列样本子集中的三种特征蛋白进行了免疫组织化学 (IHC) 标记,从技术上证实了它们的预后价值(图 3F)。此外,他们使用另一个组织微阵列 (TMA) 数据集验证了特征和单个特征蛋白的预后价值(图 3F)。此外,还通过 IHC 分析了来自上海长海医院的外部独立队列 (“CH 队列”),其结果进一步验证了特征的预后价值(图 3F)。
他们进一步探究了这三种特征蛋白的功能性作用,发现体外敲低 GNAO1 和 INA 可显著增加 QGP-1(图 3G)和 BON-1细胞的克隆形成和细胞增殖,而过表达则在 QGP-1和 BON-1中均表现出抑制作用。使用细胞系来源的异种移植模型进行的体内分析(图 3H)证实了它们在 NF-PanNET 中的保护作用,这与表达与良好预后的关系一致。相反,敲低 VCAN 可导致两种细胞系的增殖和集落形成显著减少(图 3G),并降低体内肿瘤生长(图 3H),表明 VCAN 在 NF-PanNET 进展中可能发挥作用,就像在其他癌症类型中一样。
此外,由于 VCAN 是一种分泌蛋白,他们通过 ELISA(酶联免疫吸附试验)检测了由 108 例肿瘤患者和 79 例健康对照者组成的独立队列中 VCAN 蛋白的血浆水平。ELISA 结果显示,与健康对照者相比,NF-PanNET 患者的 VCAN 血浆浓度显著升高(图 3I),即使与 I 期患者相比也是如此(图 3J)。此外,血浆中的 VCAN 水平与同一患者肿瘤组织中的丰度(通过 IHC 测量)高度相关(图 3K)。总之,这些结果表明 VCAN 具有作为 NF-PanNET 非侵入性生物标志物的潜力,值得进一步进行更大规模的研究。
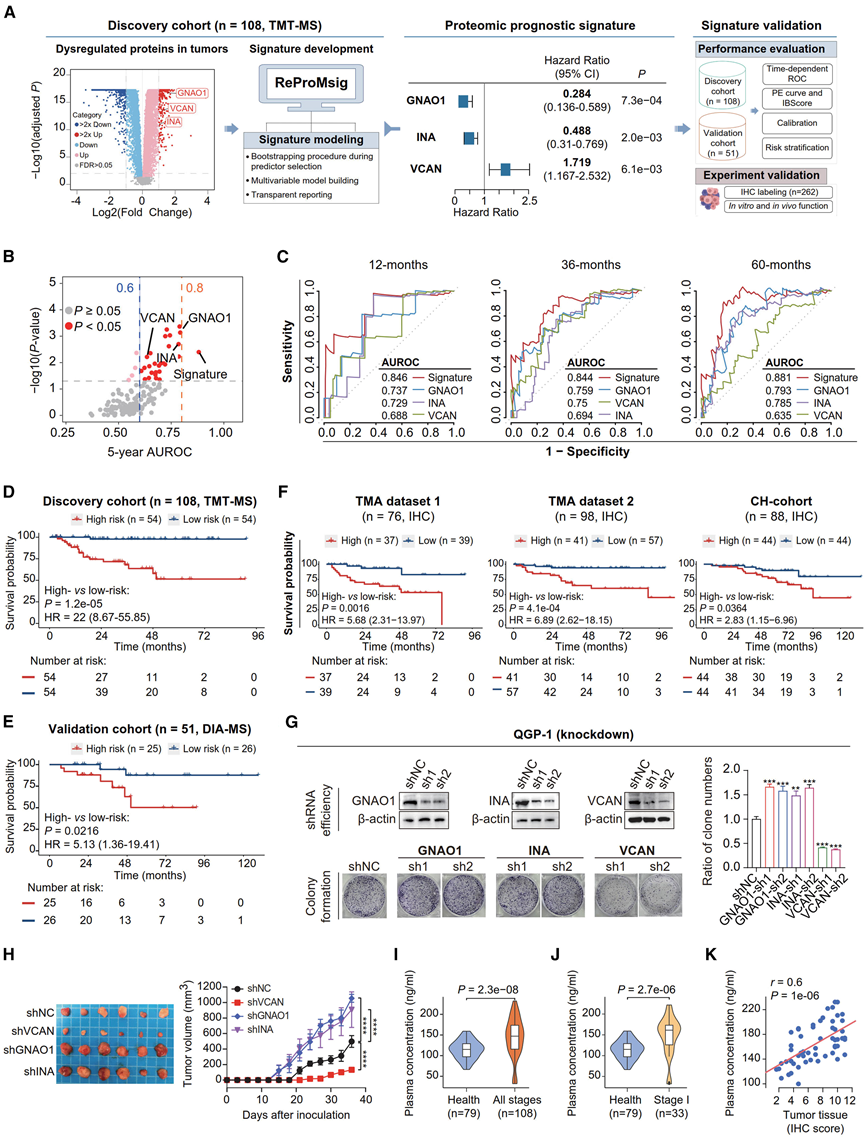
图3. 蛋白质组学预后特征的开发和验证。
(A) 说明开发和验证蛋白质组预后特征的工作流程的示意图。(B) 点图显示了已开发的三种蛋白质标记和150种在肿瘤中显著上调(而非NAT)的蛋白质的5年AUROC(ROC曲线下面积)和对数秩检验p值。(C) 1、3 和 5 年随时间变化的 ROC 曲线,比较了发现队列中特征蛋白和单个特征蛋白的预后准确性。(D) 按预测特征评分分层的患者组(发现队列)的Kaplan-Meier 生存曲线。(E) 对于验证队列,与(D)相同。(F) 与 (D) 相同,包括 TMA 数据集 1(左)、TMA 数据集 2(中)以及上海长海医院的外部队列(CH 队列,右)。(G) 敲低单个特征蛋白对QGP-1细胞克隆形成的影响。(H) 使用分别源自 shVCAN/shGNAO1/shINA BON-1 细胞的异种移植模型,在体内研究单个预后蛋白的敲低效应。(I-J) 小提琴图分别比较了健康捐赠者、NF-PanNET 患者和 NF-PanNET I 期患者的 VCAN 血浆蛋白水平。(K) 散点图显示 54 名具有肿瘤组织的 NF-PanNET 患者的 VCAN 血浆水平和配对肿瘤组织中 VCAN 蛋白丰度(通过 IHC 测定)之间的相关性。
04
具有不同生物学特征和临床病理学关联的蛋白质组亚型
通过对蛋白质组学谱的发现队列应用无监督共识聚类,他们在 108 个 NF-PanNET 中鉴定出四种蛋白质组亚型,分别称为 C1 (30%)、C2 (30%)、C3 (20%) 和 C4 (20%)。将相同方法应用于磷酸化蛋白质组学谱,鉴定出四种磷酸化蛋白质组亚型,这些亚型与蛋白质组亚型具有良好的一致性(图 4 A)。由于蛋白质组亚型对更多患者进行了高置信度分类,因此他们在以下分析中主要使用这种分类。蛋白质组亚型与患者预后和免疫特征相关,C1 型患者在四种亚型中预后最差(图 4 B),且富含三蛋白预后特征预测的高危患者和 III/IV 期患者。
分别对蛋白质组和磷酸化蛋白质组谱进行 GSEA 分析,以确定每种亚型失调的癌症标志基因集 (MSigDB)(图 4 C)。C1 肿瘤在蛋白质组和磷酸化蛋白质组水平上均表现出 EMT 和炎症反应的显著上调。C2 的特点是代谢通路(包括氧化磷酸化)上调。C3 肿瘤表现出增殖途径的上调,包括 MYC 靶点、E2F 靶点、G2-M 检查点和 DNA 修复,这与 DNA 复制压力的升高相一致。C4的特征是缺氧、糖酵解和肌生成通路上调,同时氧化磷酸化下调。值得注意的是,VHL突变主要见于 C4(图 4 A),VHL失活导致缺氧诱导因子 (HIF) 的 α 亚基稳定,这与 C4 肿瘤中 HIF-1 信号和缺氧通路的上调一致(图 4 C)。接下来,他们使用转录组谱进行了主调节因子分析,并发现了一组与上述每个亚型的通路相关的候选转录因子 (TF) 调节因子(图 4D)。具体而言,与 C1 肿瘤中上调的通路相关,发现 EMT 相关的 TF(SNAI2)显著激活,因此在 C1 肿瘤中发现EMT 蛋白丰度(包括间充质蛋白和胶原蛋白)升高。主调节因子分析揭示了胰腺神经内分泌细胞相关 TF 的亚型特异性活性。例如,发现 α 细胞特异性 TF(ARX、MAFB和IRX2)在亚型 C2 中显著激活(图 4D)。因此,与其他亚型相比,它们在 C2 肿瘤中的蛋白质丰度显著更高。这些结果与报道的 α 细胞样肿瘤的基因组特征一致,C2 肿瘤中ATRX、DAXX和MEN1突变富集。此外,考虑到PDX1表达更高且突变更少(图 4A),C3 肿瘤更像 β 细胞。
此外,他们研究了不同蛋白质组亚型的激酶活性,以揭示靶向治疗的线索。基于激酶底物相对于相应NAT的相对磷酸化水平,估算了每种肿瘤亚型的激酶活性。他们鉴定了普遍存在的激酶激活和亚型特异性激酶激活(图4 E)。值得注意的是,丝氨酸/苏氨酸CDK家族的非典型成员CDK5在所有亚型中均表现出显著的激活。CDK5是神经元发育的调节因子,最近的一项研究表明其异常激活在促进PanNET细胞生长中的作用。就亚型特异性激酶活化而言,C1 表现出对蛋白激酶 A 的两个催化亚基(PRKACB 和 PRKACG)以及 ROCK2 的独特活化,而 C3 则表现出对 CSNK2A1 和 CSNK2A2(参与细胞周期调控的异四聚体激酶的两个催化亚基)的特异性活化。C4表现出对 CAMK2G 和 RPKG1 的独特活化。总之,这些亚型相关的激酶活化为开发靶向治疗干预措施提供了潜在通路。
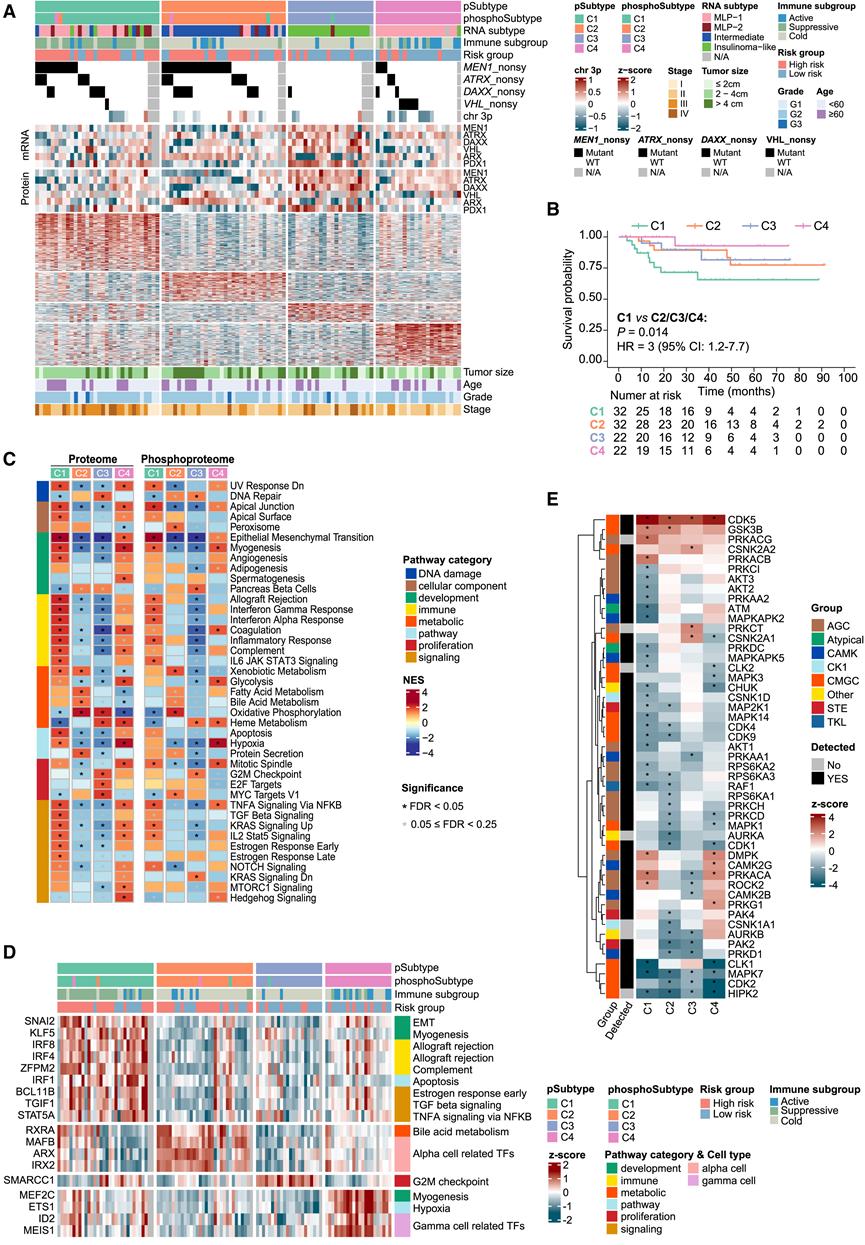
图4. 蛋白质组亚型呈现不同的生物学特征。
(A) 蛋白质组学谱的无监督共识聚类在发现队列中鉴定出四种蛋白质组亚型。(B) 按蛋白质组亚型分层的患者生存率 Kaplan-Meier 分析。(C) 热图描绘了通过GSEA分析鉴定的四种蛋白质组亚型中失调的癌症标志性通路,其中分别显示了蛋白质组和磷酸化蛋白质组图谱。(D) 热图显示与相应亚型中上调通路相关的亚型特异性 TF的标准化活性。(E) 热图显示不同蛋白质组亚型的标准化激酶活性。
05
NF-PanNET免疫景观的表征
他们随后通过探索免疫微环境特征来研究NF-PanNET的肿瘤微环境,并揭示其与蛋白质组学亚型等肿瘤特征的相互作用。通过使用代表免疫细胞浸润特征的基因集进行基因集变异分析(GSVA),他们鉴定出一组具有高免疫富集评分的免疫热性肿瘤(图5A),并与免疫冷性肿瘤组形成对比。进一步采用最近模板预测算法,利用捕获与免疫抑制相关的炎症性间质活化反应基因特征(图5A中"活化间质"特征),可将免疫热性肿瘤组细分为两个独特亚群。结果显示,27.8%的肿瘤(n=30)具有活化间质特征,定义为免疫抑制亚组;而其余17.6%的肿瘤(n=19)未显示此类激活,归类为免疫活性亚组(图5A)。为验证这一发现,他们对随机选取的部分肿瘤样本(n=59)进行组织病理学分析,发现相较于免疫冷性组,免疫热性组的肿瘤浸润淋巴细胞数量显著增加。CD3和CD8的免疫组化染色结果也表明,免疫热性肿瘤中T细胞浸润水平升高(图5C)。
免疫热性NF-PanNET的特征表现为多种免疫相关基因集和不同免疫细胞特征的活性显著升高(图5A)。其中免疫活性亚组的肿瘤显示出与抗肿瘤免疫应答相关通路活性的显著增强(如T细胞、促炎性M1巨噬细胞和IFN-γ特征)(图5A),并伴随效应基因(如GZMB和PRF1)(图5B)的过表达。相比之下,免疫抑制亚组则以免疫抑制成分的上调为特征,包括抗炎性M2巨噬细胞和泛巨噬细胞特征。特别值得注意的是,该亚组中转化生长因子β(TGF-β)信号通路的激活(图5A)以及TGFβ-1和TGFβ-3的过表达(图5B),暗示了TGF-β在抑制NF-PanNET宿主免疫应答中的重要作用——可能是通过促进M2巨噬细胞极化和诱导T细胞耗竭来实现的。
此外,在磷酸化蛋白质组水平上对上述免疫特征进行的样本层次分析显示,三个亚组的表现模式与蛋白质组水平的结果高度一致。为进一步验证,他们采用免疫组化方法对59例已进行组织病理学分析的肿瘤样本检测了免疫抑制标志物(CD39、CD68、CD163、TGFB1、TGFB3和TIM3)。结果显示,与其余肿瘤相比,免疫抑制亚组的肿瘤浸润淋巴细胞中这些免疫抑制蛋白的表达水平更高(图5D),该结果与基于质谱的蛋白质组分析结论相符。
不同免疫亚组与四种蛋白质组学亚型(图5E)及三蛋白标志物定义的风险分组均呈现显著相关性。免疫抑制亚组中高风险患者(24/30,80%)和C1型肿瘤(80%)占比显著偏高。Kaplan-Meier生存分析显示,各免疫亚组间存在显著生存差异(图5F),其中免疫抑制亚组相较于免疫活性亚组(p=0.024)和免疫冷性亚组(p=0.043)均表现出更差的临床预后。值得注意的是,PD-L1、IDO1和TIM3等抑制性免疫检查点在免疫热性肿瘤中表达显著升高(图5B),提示该亚组患者可能从免疫治疗中获益。为深入探究这种治疗潜力,他们检测了两个泛癌抗PD-1治疗预测特征(源自多癌种临床研究的6-基因IFN-γ特征和18-基因T细胞炎症特征),发现这两个特征在免疫热性肿瘤中均发生显著激活(图5A),进一步为这类患者接受抗PD-1治疗的潜在获益提供了证据支持。
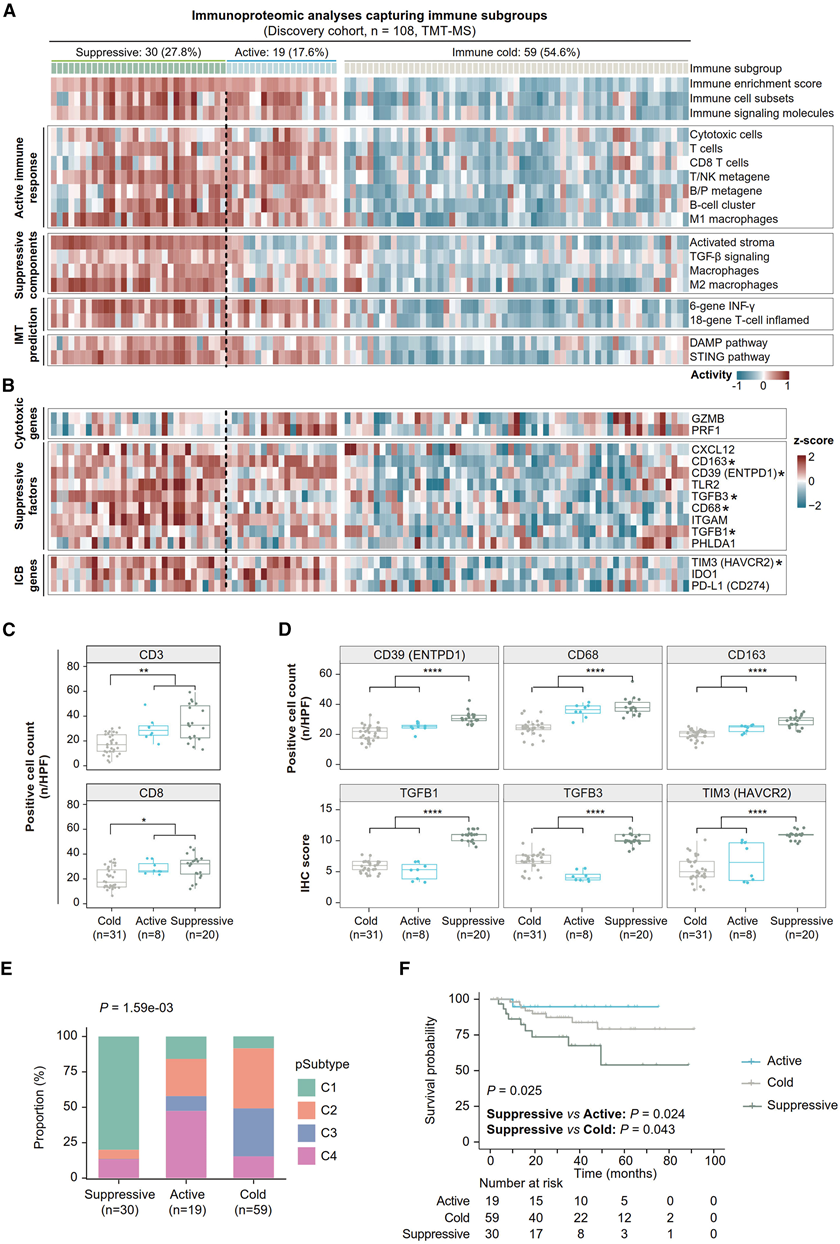
图5. 免疫蛋白质组学分析捕获活性和抑制性免疫亚群。
(A) 热图显示15个免疫相关特征的GSVA活性评分。(B) 热图显示关键免疫标志物的行尺度相对蛋白丰度。(C) 箱线图比较了不同肿瘤免疫亚型中 CD3(上)和 CD8(下)的 IHC 定量。(D) 箱线图比较了不同肿瘤免疫亚组中六种免疫抑制标志物的 IHC 定量结果。(E) 堆积条形图显示不同免疫亚群中蛋白质组亚型的比例。(F) 三个免疫亚组的 Kaplan-Meier 生存曲线。
06
针对与蛋白质组亚型相关的分子失调的治疗机会
为了实现蛋白质组亚型分析的应用,需要一个能够区分新肿瘤的稳健分类器。因此,他们开发并验证了两种多变量分类器,以适应不同的分析技术,包括用于基于质谱的蛋白质组分析的 PanNET-质谱 pSubtype 分类器 (mPC) 模型,以及支持更适合临床的 IHC 标记的 PanNET-ihc pSubtype 分类器 (iPC) 模型(图 6 A)。简而言之,他们将梯度提升方法 XGBoost 应用于发现队列,并采用递归特征选择方法,从而确定了七种分类蛋白的优先级。与 NAT 相比,所有分类蛋白在肿瘤中均显著上调,并呈现出亚型特异性表达(图 6 B),与上述亚型特征一致,包括 C1 上调的 EMT 通路基因(VCAN 和 PCOLCE)、C2 上调的 SLC3A2(表达与 C2 富集的MEN1突变相关)(图 2 A)、C3 上调的 BMERB1 和 C4 上调的糖酵解和缺氧基因(例如 PFKP)。通过 IHC 标记确认了亚型特异性模式(图 6 C)。除了使用发现队列进行 10 倍交叉验证(曲线下面积:PanNET-mPC 为 0.970,PanNET-iPC 为 0.926)之外,他们还在独立验证队列中进一步测试了 PanNET-mPC 分类器。分类蛋白的亚型特异性表达模式(图 6B)和失调通路以及生存差异(图 6D)证明了预测亚型的可靠性。由于 PanNET-iPC 分类器是使用离散化的蛋白质组学谱构建的,因此使用具有可用 FFPE 切片的发现队列肿瘤根据分类蛋白的 IHC 标记评分对其进行了进一步测试 ,准确率达到 90.2%。总之,PanNET-mPC 和 PanNET-iPC 分类器在区分不同蛋白质组亚型的肿瘤方面均表现出良好的性能。他们使用最近的 PNET 数据集测试了 PanNET-mPC 分类器,发现预测的蛋白质组亚型是相关的。
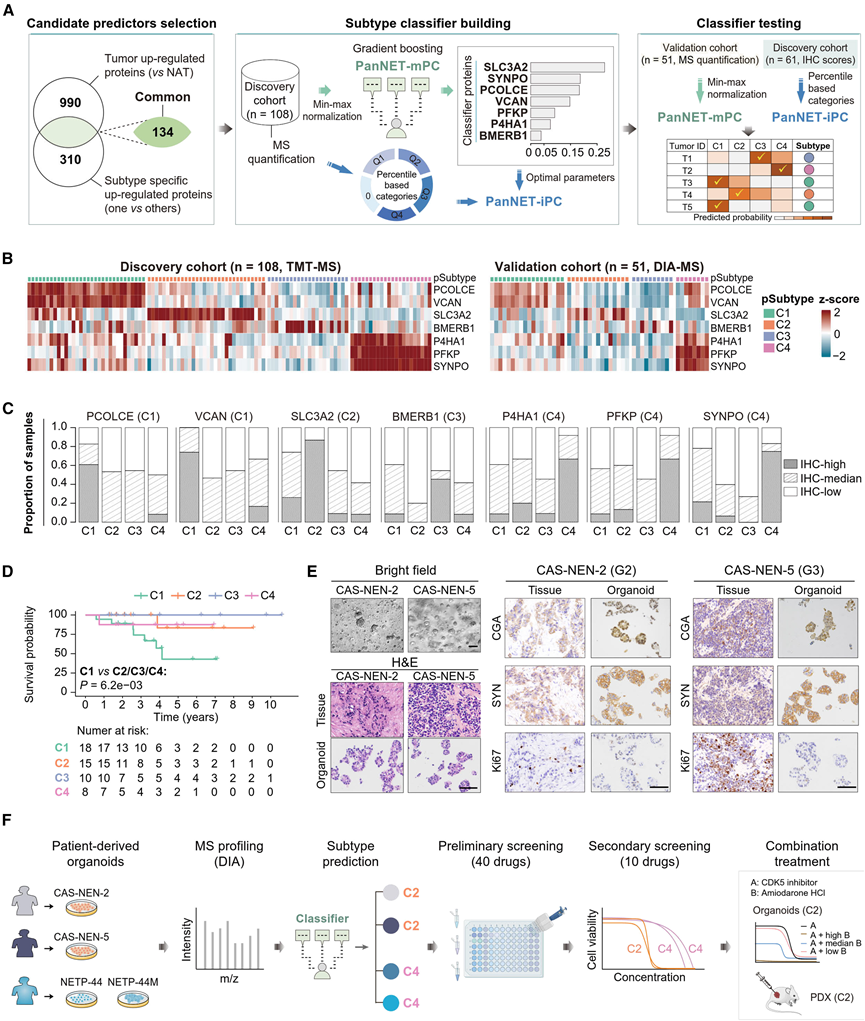
图6. 基于机器学习的蛋白质组亚型分类器及其在患者来源的类器官中的应用。
(A) 该示意图展示了开发和测试蛋白质组亚型分类器 PanNET-mPC 和 PanNET-iPC 的实验流程。(B) 热图显示发现队列(左)和验证队列(右)中分类蛋白的相对丰度。(C) 堆叠条形图显示不同蛋白质组亚型间分类蛋白丰度的离散化水平分布。(D) 验证队列中患者预测蛋白质组亚型的 Kaplan-Meier 生存曲线。(E) 患者来源的类器官(PDO)和亲本肿瘤组织的PanNET病理标志物的代表性明视野图像(20倍),以及H&E染色(40倍)和IHC标记(40倍)图像。(F) 示意图说明了应用 PanNET-mPC 分类器预测 PDO 蛋白质组亚型的过程,这些蛋白质组亚型用于筛选针对与相应蛋白质组亚型相关的分子失调的药物。
然后,他们探索了针对上述分析确定的分子畸变的治疗方案,并使用四个患者来源的 PanNET 类器官(图 6 E)进行初步药物筛选(图 6 F)。两个类器官(CAS-NEN-2 71和 CAS-NEN-5)通过 PanNET-mPC 分类器使用蛋白质组学图谱归类为 C2,而另外两个(NETP-44 和 NETP-44M)归类为 C4。由于 C4 肿瘤以亚型特异性上调 mTOR 通路为特征(图 4 C),且考虑到 mTOR 抑制剂依维莫司已用于临床实践,他们的初步药物筛选重点是确定针对 C2 肿瘤的潜在药物。筛选了四种靶向在C2中(与NAT相比)显著激活的两种激酶(CDK5和GSK3B)的药物,六种美国食品药品监督管理局(FDA)批准的靶向C2中(与其他肿瘤相比)独特上调的蛋白质/磷蛋白的药物,以及30种随机选择的FDA批准药物。根据初步筛选结果(图7 A),选择了六种药物(在至少一个C2类器官中相对细胞存活率<0.5)以及四种NF-PanNET临床使用的药物进行二次筛选。多剂量药物反应分析(图 7 B)显示,两种 C2 类器官对盐酸胺碘酮更敏感(靶向 C2 上调的磷蛋白 CACNA1D,钙电压门控通道的亚基)(图 7 C),而两种 CDK5 抑制剂 dinaciclib(图 7 C)和 cp681301在所有四种类器官中均有效。这些结果与 C2 中 CACNA1D 磷酸化的特定上调和所有亚型中 CDK5 的普遍激活相一致(图 4 E)。正如预期的那样,两种 C4 类器官对依维莫司敏感(图 7 D),而其对舒尼替尼(一种广谱受体酪氨酸激酶抑制剂)的敏感性仍有待确定。
此外,他们发现与胺碘酮联合治疗可以增强两种 C2 类器官对 CDK5 抑制的敏感性,胺碘酮与 dinaciclib(图 7 E)或 cp681301的联合治疗呈剂量依赖性。使用患者来源的异种移植模型进一步进行了体内验证。与 dinaciclib(图 7 F)和 cp681301单药治疗相比,胺碘酮与 CDK5 抑制剂联合治疗可显著降低肿瘤生长。相反,这种协同效应并未在 C4 类器官中显示,从而增强了对胺碘酮的 C2 特异性反应。总之,这些结果证明了针对与蛋白质组亚型相关的分子失调的潜力,这有助于为 NF-PanNET 患者开发精确有效的治疗方案。
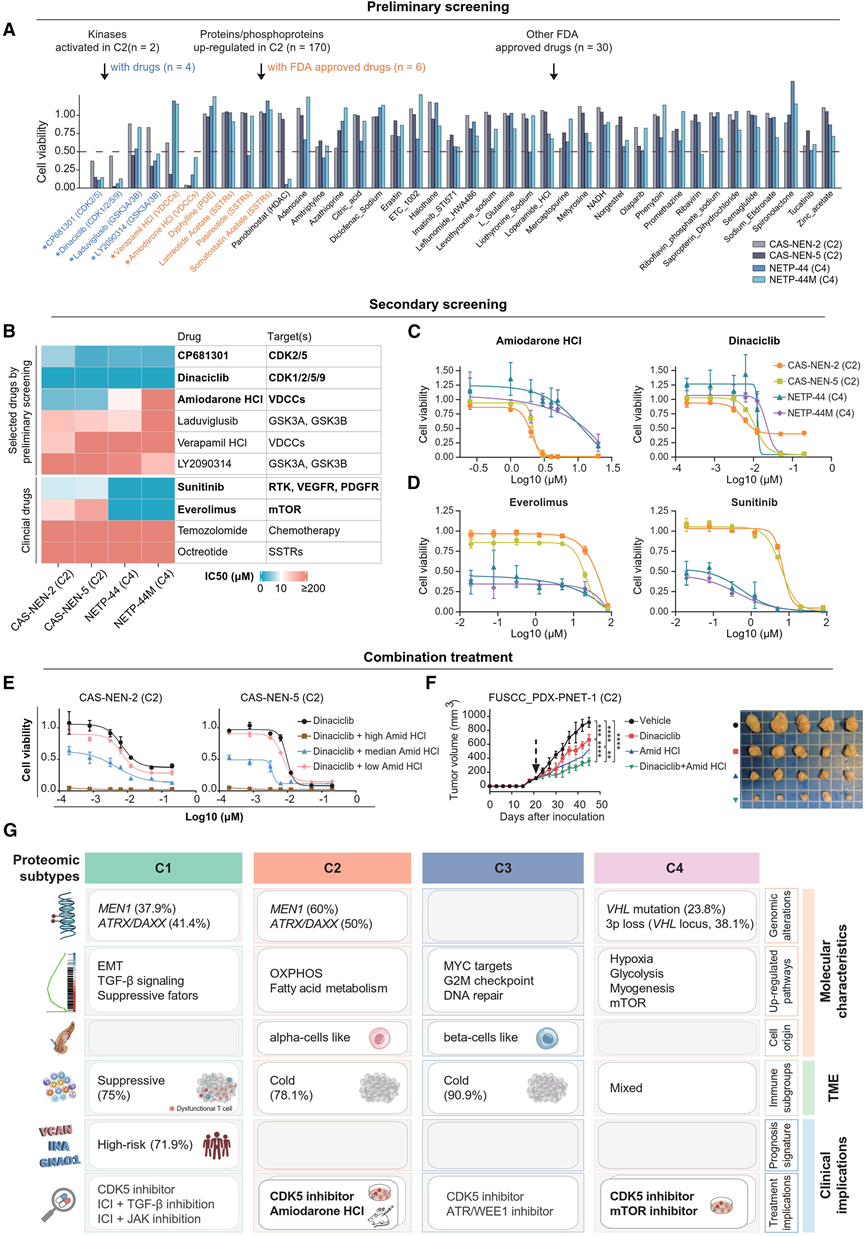
图7. 针对与蛋白质组亚型相关的分子失调。
(A) 使用两个C2类器官和两个C4类器官,对10种靶向C2中激活激酶或上调蛋白/磷蛋白的药物(10 μM)进行初步筛选,其中30种药物为随机选择的FDA批准药物。(B) 热图显示二次筛选的药物敏感性结果,包括初筛中筛选出的六种药物和临床用于治疗 PanNET 的四种药物。(C) 在代表蛋白质组亚型C2和C4的四个PanNET类器官中测试的盐酸胺碘酮(左)和dinaciclib(右)的剂量反应曲线。(D) 依维莫司(左)和舒尼替尼(右)与 (C) 相同。(E) 剂量反应曲线比较了两例C2期PDO患者中dinaciclib联合胺碘酮治疗与dinaciclib单药治疗的效果。(F) 使用患者来源的异种移植瘤 (PDX) 模型(预测为 C2 亚型)比较单药治疗和联合治疗的体内疗效。(G)汇总表重点介绍了NF-PanNET蛋白质组亚型的分子特征、免疫环境和临床意义。
+ + + + + + + + + + +
结 论
本研究通过整合基因组学、转录组学、蛋白质组学和磷酸化蛋白质组学谱分析,对 108 个 NF-PanNET 进行了全面的分子表征。蛋白质组学分析为 NF-PanNET 的基因组驱动变异提供了功能性见解,并使用Men1条件性基因敲除小鼠揭示了MEN1变异的潜在介导因素。基于机器学习的建模揭示了三蛋白特征作为独立的预后因素,并通过独立的外部队列进行了验证。基于蛋白质组学和磷酸化蛋白质组学的分层分析,鉴定出四种具有独特分子特征、免疫微环境和临床病理特征的亚型。利用患者来源的肿瘤类器官进行药物筛选,鉴定出CDK5 和CACNA1D分别为普遍存在的靶点和亚型特异性靶点,并通过异种移植模型进行了体内验证。总之,本研究的蛋白质组学分析揭示了 NF-PanNET 的全面分子图谱,揭示了其生物学见解和治疗靶点。
+ + + + +



 English
English


