文献解读|Nat Commun(14.7):综合蛋白质组学表征揭示低分化和未分化甲状腺癌的治疗靶点
✦ +
+
论文ID
原名:Integrative proteogenomic characterization reveals therapeutic targets in poorly differentiated and anaplastic thyroid cancers
译名:综合蛋白质组学表征揭示低分化和未分化甲状腺癌的治疗靶点
期刊:Nature Communications
影响因子:14.7
发表时间:2025.04.16
DOI号:10.1038/s41467-025-58910-3
背 景
甲状腺癌是最常见的癌症之一,2020 年全球估计新增病例 586202例。滤泡性甲状腺癌 (FTC)、髓样甲状腺癌 (MTC)、乳头状甲状腺癌 (PTC)、低分化甲状腺癌 (PDTC) 和间变性甲状腺癌 (ATC) 是甲状腺癌的主要组织学亚型。PTC 约占所有甲状腺癌的 80%,且 90% 以上的患者 10 年生存期可达。与之形成鲜明对比的是,虽然 ATC 和 PDTC 占甲状腺癌的 5%-10%,但它们是极具侵袭性的亚型,中位生存期分别仅为 0.5 年和 3.2 年。由于ATC患者普遍预后不良,且大多数患者无法切除或已发生转移,肿瘤-淋巴结-转移(TNM)分期系统通常将ATC患者归类为IV期(A、B或C期)。ATC的特征是广泛的局部浸润,15%–50%的患者在确诊时已出现远处转移。遗憾的是,目前尚无有效的治疗方法可以延长ATC患者的生存期。
实验设计
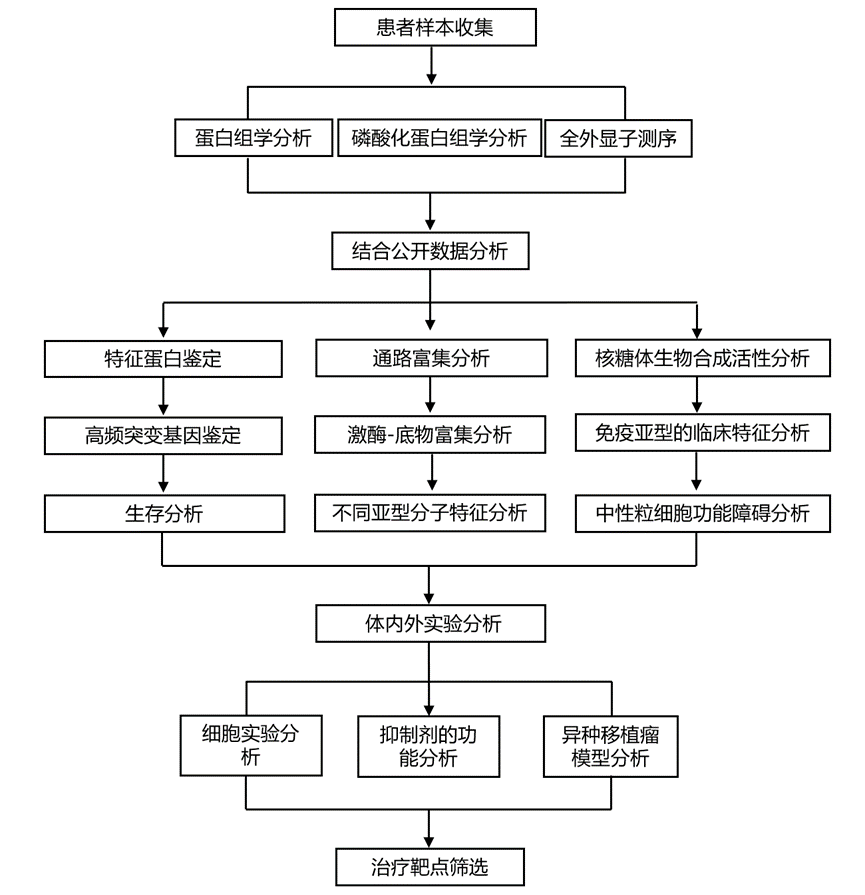
结 果
01
甲状腺癌队列蛋白质组学表征概述
为了确定侵袭性甲状腺癌的分子特征和治疗易感性,研究团队对 345 例患者的甲状腺肿瘤和非癌性癌旁组织 (NAT) 进行了一项涵盖三种不同数据类型(基因组学、蛋白质组学和磷酸化蛋白质组学)的深度分析(图 1A-B)。他们首先对 467 个样本进行了蛋白质组学分析,甲状腺肿瘤包括 124 个 ATC、47 个 PDTC 和 177 个 PTC 样本(包括三个生物学重复)。119 个 NAT 来源于 20 名 ATC 患者和 99 名 PTC 患者的肿瘤旁组织。在159例患者(113例ATC和46例PDTC样本)中,101例(75例ATC和26例PDTC样本)可获得随访生存信息。对63例ATC、25例PDTC、81例PTC和48例NAT样本(来自20例ATC患者和28例PTC患者的癌旁组织)进行了磷酸化蛋白质组学分析;对51例ATC、28例PDTC和19例NAT样本进行了全外显子组测序(WES)(图 1B)。共检测到9491个蛋白质,平均每个样本7307个蛋白质。蛋白质相对定量密度呈正态分布,所有样本均通过定量质控。在磷酸化测量中,识别出47376个磷酸化位点。磷酸化分析的定量分布和UMAP结果与蛋白质组的一致。然而,与其他样本类型相比,在ATC和PDTC中检测到更多的磷酸化位。
通过 WES基因组分析,鉴定出 ATC 和 PDTC 中的高频突变基因,如TP53(48%)、TERT启动子突变(36.5%)、BRAF(23%)和NRAS (18%)(图 1C)。TP53 (58.8 %)和TERT启动子突变(46.3%)是 ATC 中最常见的两种体细胞突变基因,高于 PDTC(TP53:28.6%,TERT启动子:18.2%)。DICER1是一种导致遗传性癌症易感综合征的致癌基因,在 PDTC 中的突变率(25%)高于 ATC(7.8%)(图 1D)。此外,前20个肿瘤相关基因的突变状态与临床病理特征相关。老年患者更容易获得BRAF突变(P =0.0011),男性NRAS突变 比例(3.2%)显著低于女性(28.6%)(图 1D)。TP53 ( P = 0.0065)、BRAF(P =0.00027)、TERT启动子(P <0.0001)和LRP1B(P =0.0027)突变与ATC和PDTC患者较差的总生存率显著相关(图 1E)。
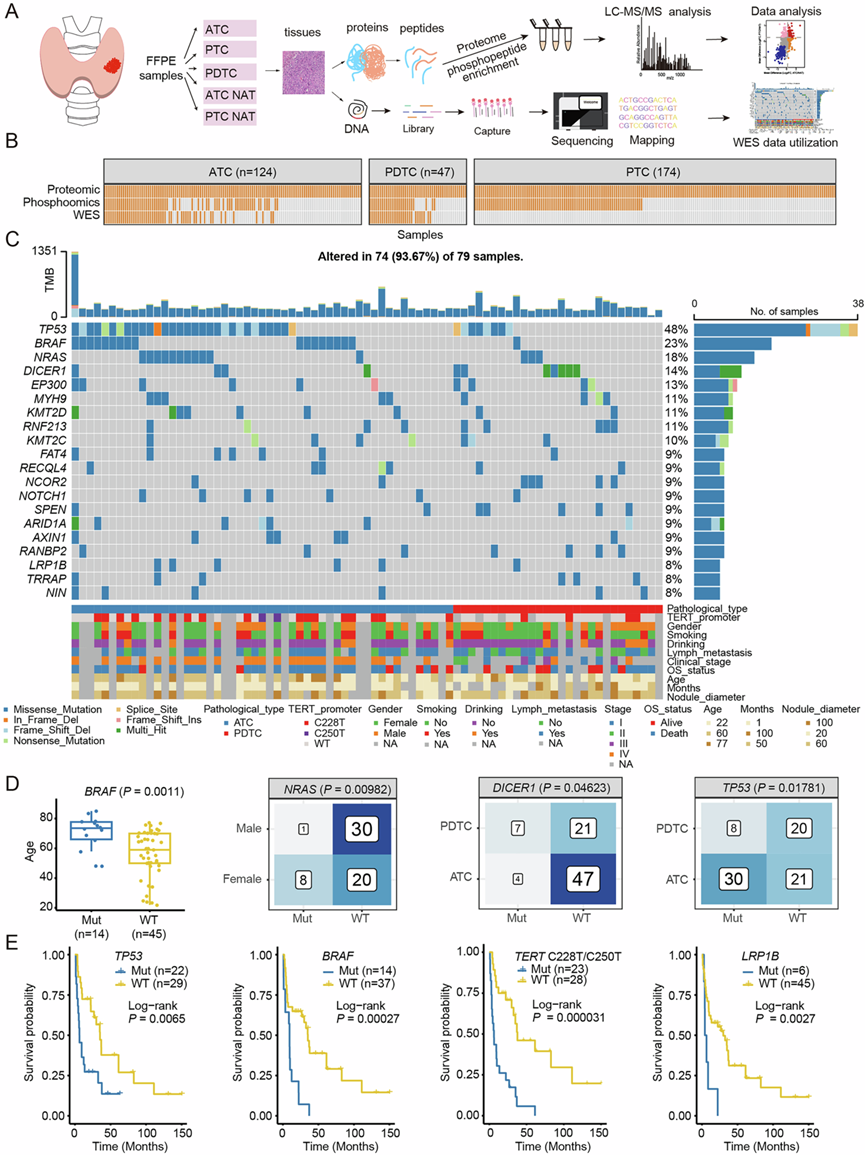
图1. 甲状腺癌的多组学图谱。
(A) 甲状腺癌分子谱分析的实验流程和样本类型。(B) 三种分子图谱(WES、蛋白质组学和磷酸化蛋白质组学)中检测到的样本概览。(C) 51 例 ATC 和 28 例 PDTC 患者的突变情况及相关临床信息。(D) 51例 ATC 和 28 例 PDTC 患者的病理特征与基因突变之间的关系。(E) Kaplan-Meier 曲线显示基因突变与患者生存之间的关系。
02
ATC的蛋白质组学和磷酸化蛋白质组学特征
蛋白质组学和磷酸化蛋白质组学分析在本研究的甲状腺癌队列中鉴定出共9491个蛋白质,其中3342个蛋白质发送磷酸化。ATC和NAT之间共有893个蛋白质存在差异表达,包括363个上调和530个下调的蛋白质(图 2A)。ATC中上调的蛋白质与细胞周期、核糖体生物合成和先天免疫反应有关,而ATC下调的蛋白质与紧密连接、甲状腺激素生成和上皮细胞分化有关(图 2B)。值得注意的是,与免疫反应相关的讨论,包括中性粒细胞胞外陷阱 (NET) 形成、中性粒细胞趋化性和 T 细胞增殖的负向调节,经常在 ATC 上调的蛋白质中富集。进一步分析显示,ATC 和 PTC 具有某些共同点,因为两者都在与细胞增殖和对缺氧的反应相关的讨论中富集(图 2C)。然而,它们也表现出不同的模式,因为 ATC 中上调的蛋白质专门富集在细胞迁移、细胞内蛋白质转运和小 GTPase 信号转导中,而 PTC 中的蛋白质主要参与 PPAR 信号转导和核苷酸代谢(图 2C)。有趣的是,他们发现 ARF4 和 ARHGAP9 这两种 ATC 特异性上调蛋白分别与细胞迁移和细胞内蛋白质运输有关,其高表达均与较差的生存率显著相关。
磷酸化蛋白质组学和定量蛋白质组学数据整合表明,磷酸化水平上调的蛋白质主要与细胞周期进程有关(图 2E-F)。此外,激酶-底物富集分析 (KSEA) 发现甲状腺癌中激酶活性发生改变,包括 CSNK2A1、CSNK2A2 和 AURKA 在内的激酶在 ATC 中显著激活(图 2G),而 SRC 和 EPHA4 在 PTC 中显著激活,从而揭示了潜在的治疗靶点。
BRAFV600E突变是驱动甲状腺癌进展的基础,它通过组成性激活 BRAF 激酶和下游信号通路。因此,他们探索了可能受BRAFV600E突变调控的下游磷酸化底物。在本研究中,发现 51 例 ATC 患者中有 11 例存在BRAFV600E突变(图 2H)。基于差异分析,他们鉴定出 18 个可能受BRAFV600E突变影响的磷酸化位点(图 2H)。这些受调控的底物与致癌信号通路密切相关,其中 ERBB2 和 EGFR 是重要的分子(图 2I )。在BRAFV600E突变样本中,ERBB2在 Serine1054[Phospho-ERBB2(Ser1054)]的磷酸化丰度显著下调。BRAFV600E突变与较差的生存率相关,而较高的 Phospho-ERBB2(Ser1054)丰度与更好的预后相关(图 2J)。多变量分析显示,TP53、LRP1B和TERT启动子的突变是 ATC 和 PDTC 患者总生存期 (OS) 的预测因子,但是在本分析中并未将 Phospho-ERBB2(Ser1054)和BRAF V600E突变确定为独立的预后因素(图 2K)。
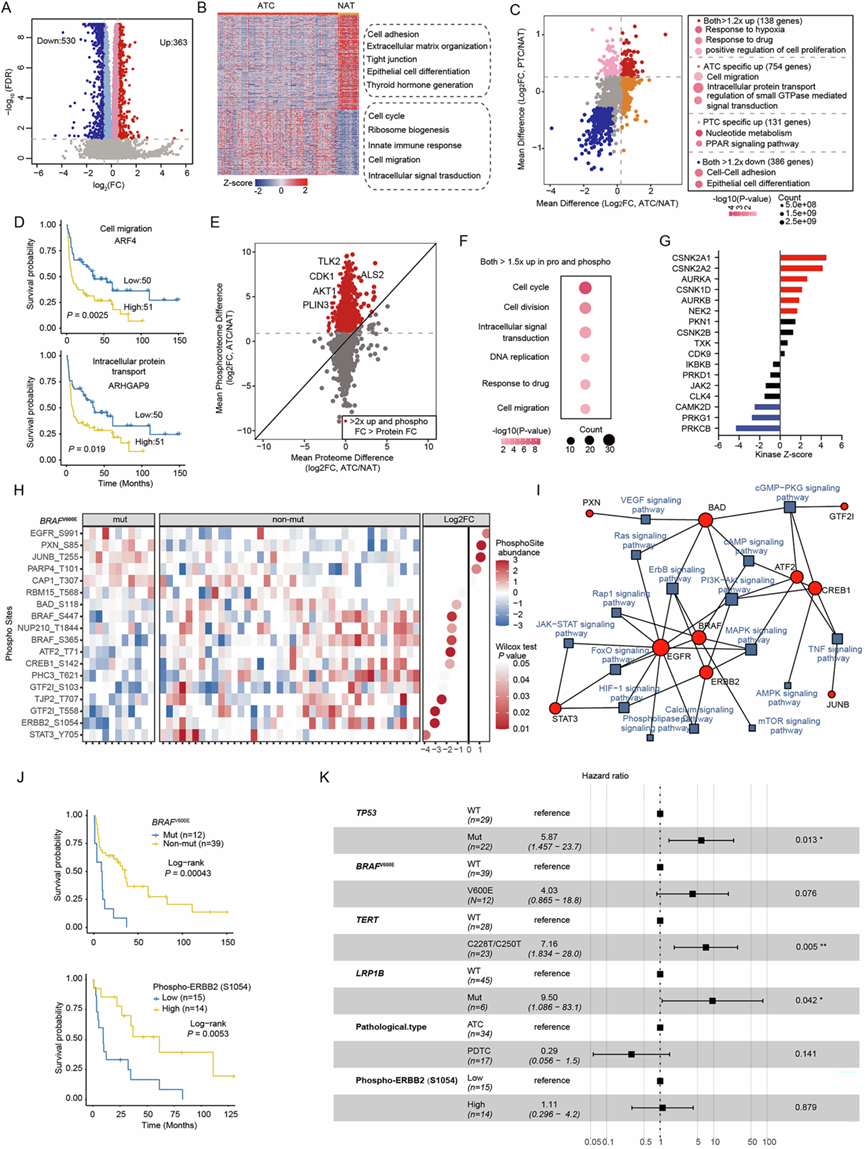
图2. 肿瘤组织中的蛋白质组学和磷酸化蛋白质组学分析与 NAT 的比较。
(A) 火山图显示ATC 和NAT 样本之间的差异蛋白质丰度。(B) 热图显示ATC 和NAT 样本之间显著差异蛋白质的丰度。(C) 散点图显示 与 NAT样本相比,ATC和 PTC中常见和特定蛋白质的变化。(D) Kaplan-Meier 曲线显示 ARF4 和 ARHGAP9 蛋白质丰度与患者总生存期 (OS) 之间的关系。(E) 散点图显示,与 NAT 样本相比,ATC 中蛋白质丰度变化和磷酸化丰度变化之间的关系。(F)气泡图显示,在磷酸化和蛋白质水平上,差异倍数大于 1.5 的蛋白质的富集通路显著增加。(G) 与NAT样本相比,ATC 中的激酶活性发生显著变化。(H) 潜在底物磷酸化丰度的变化。(I) 网络图显示了受BRAF V600E突变影响的潜在底物与其参与的通路之间的关系。(J) Kaplan-Meier 曲线分别显示基于BRAF V600E突变和 ERBB2 磷酸化丰度的ATC 患者的 OS。(K) ATC 患者基因突变和磷酸化 ERBB2 的多变量分析。(L) (M) (N)
03
甲状腺癌进展的分子特征
差异表达和主成分分析 (PCA) 表明不同甲状腺癌亚型之间存在不同的蛋白质组学景观(图 3A)。亚组特异性蛋白质的通路富集分析表明,ECM-受体相互作用、甲状腺激素合成和细胞氧化剂解毒在 NAT 中富集,而细胞外基质解聚、核糖体大亚基生物合成、DNA 复制和细胞周期与 ATC 有关(图 3A)。甲状腺癌细胞的去分化和间变性赋予了它极具侵袭性的表型。然后,他们探索了可能驱动甲状腺癌进展的分子特征和活性激酶。在从 NAT、PTC 到 PDTC 或 ATC 的进展过程中,共有 1586 种蛋白质依次增加或减少(图 3B)。类似地,他们发现连续上调的蛋白质主要富集在细胞周期、DNA修复和核糖体生物合成中,而下调的蛋白质主要参与 ECM-受体相互作用和甲状腺激素合成(图 3C-D)。
核糖体生物合成活性的增强引起了他们的兴趣,因为它在支持肿瘤发生和肿瘤进展中起着致癌作用。ssGSEA 证实,与其他甲状腺癌亚型相比,ATC 中的核糖体生物合成活性显著增加。此外,核糖体生物合成活性高的患者总体生存期明显较短(图 3E)。因此,他们认为核糖体信号通路在 ATC 组织中极其活跃,这与快速生长和不受抑制的增殖的特征一致。进一步研究发现,26 种参与核糖体生物合成的蛋白质是与不良预后显著相关的危险因素。基于使用 CRISPR 和 siRNA 筛选数据建立的 DepMap 数据库,发现六个基因(RRP9、RIOK1、PA2G4、BRIX1、NAT10 和 DDX21)在 CRISPR 敲除和 RNAi 数据集中都是必需的,高 RRP9 表达与不良预后相关。值得注意的是,RRP9 敲低显著抑制了不同 ATC 细胞系中的细胞活力和克隆形成(图 3F-G)。令人惊讶的是,与对照组相比,RRP9 的缺失显著降低了裸鼠中 8505C 衍生异种移植瘤的生长和肿瘤重量(图 3H-J),表明 RRP9 可能是 ATC 的治疗靶点。
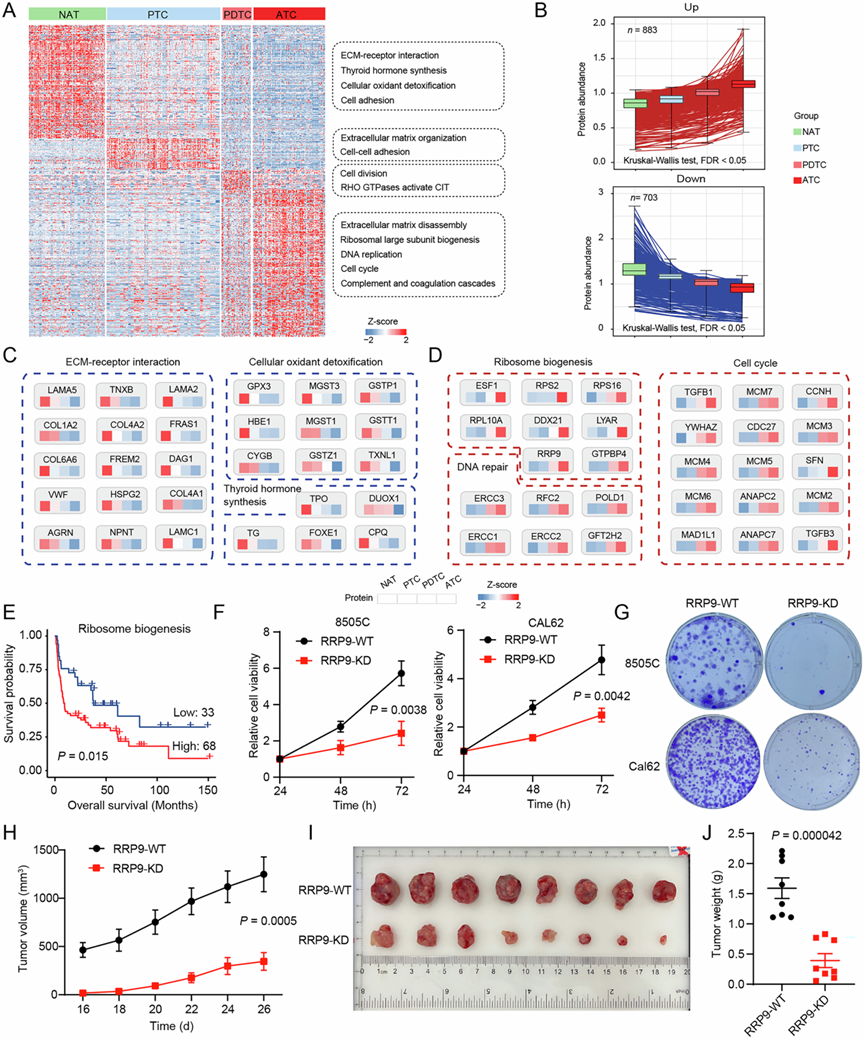
图3. 不同甲状腺癌亚型的分子特征。
(A) 热图显示与甲状腺癌进展显著相关的蛋白质丰度变化。(B) 箱线图显示随着甲状腺癌的进展,蛋白质的丰度逐渐增加或减少。(C) 随着癌症从正常甲状腺向 PTC(分化表型)、PDTC(低分化表型)和 ATC(去分化表型)发展,显著富集下调蛋白质的通路的蛋白质丰度变化。(D) 随着甲状腺癌的进展,显著富集上调蛋白质的通路的蛋白质丰度变化。(E) Kaplan-Meier 曲线显示基于 ssGSEA 估计的核糖体生物合成通路活性变化与患者总体生存率之间的关系。(F) 别 在8505C(n = 3)和 CAL62(n = 3)中敲低 RRP9 后的细胞活力。(G) 分别在 8505C 和 CAL62 中沉默 RRP9 后的克隆形成实验。(H-J) 肿瘤生长曲线、肿瘤大小和肿瘤重量。
04
蛋白质组聚类鉴定出三种 ATC/PDTC 分子亚型
基于共识聚类的 113 个 ATC 和 46 个 PDTC 肿瘤蛋白质组学数据集的无监督聚类显示出三种亚型,分别称为 Pro-I、Pro-II 和 Pro-III(图 4A)。这三种蛋白质组亚型表现出明显不同的预后,其中 Pro-III 亚型患者的生存率最差(图 4B)。这三种亚型的分子谱(包括基因组图谱、蛋白质特征和活性激酶)各有不同,并提供了对 ATC/PDTC 有价值的亚型特异性靶点。
NEB突变是最近定义的导致杆状体肌病的致病变异,与 Pro-II (8.3%) 和 Pro-III (17.6%) 相比,它更常发生在 Pro-I 亚型 (45.5%) 中。Pro-I 肿瘤中上调的蛋白质主要与胰岛素分泌、胰高血糖素信号通路和癌症中的转录失调有关(图 4C)。编码胰岛素样生长因子 1 的 IGF1R 在 Pro-I 肿瘤中特异性上调,并参与癌症中的转录失调(图 4D)。对三种蛋白质组亚型的磷酸化蛋白质组进行比较,揭示了 KSEA 激活的亚型特异性激酶,包括 Pro-I 的 CMGC 和 AGC 激酶家族、Pro-II 的 CAMK 激酶家族以及 Pro-III 的 CMGC 和 TK 激酶家族(图 4E)。 MAPK3 (ERK1) 和 MAPK1 (ERK2) 参与细胞迁移、增殖和存活等致癌过程,是 Pro-I 中最活跃的激酶(图 4F)。有趣的是,IGF1R 的激酶活性在 Pro-I 肿瘤中也升高。此外,GSK3A 和 AKT1 是 Pro-I 中主要的激酶,它们磷酸化胰高血糖素和胰岛素信号通路的底物(图 4G),这表明在 Pro-I 亚型中胰高血糖素和胰岛素信号通路存在异常激活。
Pro-II 亚型的分子特征与细胞分裂、染色质重塑和 DNA 修复调控有关。细胞周期蛋白家族成员(CCNK 和 CCNA2)以及 NIMA 相关的丝氨酸/苏氨酸激酶家族成员 (NEK2) 在 Pro-II 样本中特异性上调。Pro-II 亚型的特征是 ATM 和 ATR 的过度激活,它们通过其底物(包括 BRCA1 和 RAD50)的磷酸化与 DNA 修复信号密切相关(图 4F-G)。ATM 是 BRCA1 相关基因组监视复合体 (BASC) 的一部分,参与异常 DNA 结构的识别和修复。因此,活跃的细胞周期和 DNA 修复信号可能与 Pro-II 亚型的侵袭性有关。
Pro-III (64.7%) 和 Pro-II (66.7%) 均具有高于 Pro-I 亚型 (24.2%) 的TP53突变频率。值得注意的是, Pro-III 中BRAF和BRAF V600E的突变率高于其他亚型。Pro-III 具有丰富的肿瘤微环境 (TME),例如炎症反应、细胞外基质分解和补体凝血级联(图 4C)。免疫检查点 CD274 和 IDO1 在 Pro-III 亚型中特别增加。此外,C5a 受体(C5AR1)在 Pro-III 中上调。最近的研究表明,即使在表现出免疫抑制特征和 CD8 + T 细胞浸润较差的肿瘤中,抑制 C5AR1 也可以改善放射治疗。对Pro-III中激酶谱的分析发现,微管亲和力调节激酶家族成员(包括MARK1、MARK4和MARK3)在Pro-III中频繁激活(图 4F-G)。这些激酶磷酸化微管相关蛋白,从而调节微管动力学和细胞迁移。值得注意的是,具有血脑屏障通透性的MARK3/MARK4小分子抑制剂PCC0208017已在胶质瘤中表现出强效的抗肿瘤活性。
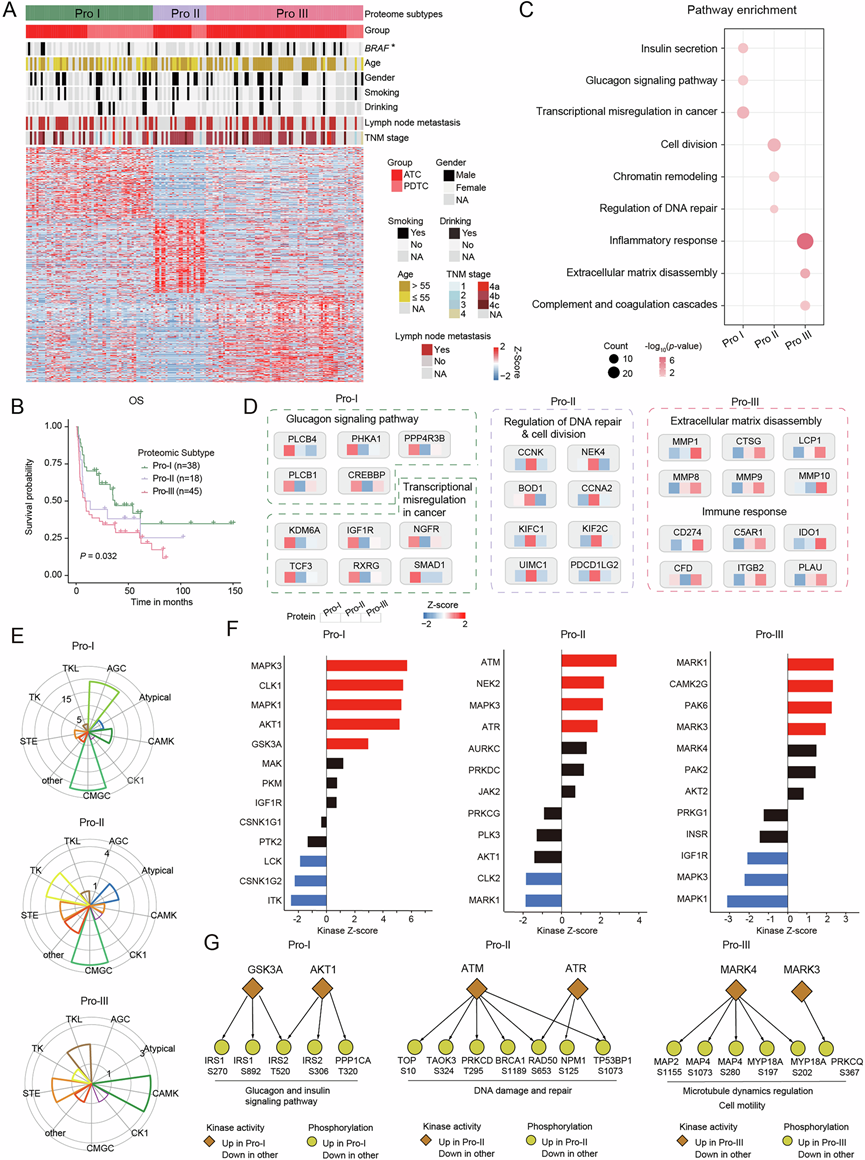
图4. ATC/PDTC 肿瘤中的蛋白质组聚类和分子特征。
(A) 根据蛋白表达谱将ATC和PDTC患者分为Pro-I、Pro-II、Pro-II三个亚型。下方热图显示各亚型特征蛋白的丰度。上方热图显示三种亚型患者的病理特征。(B) Kaplan -Meier曲线显示不同蛋白亚型患者总生存率存在显著差异。(C) 超几何检验气泡图显示三种亚型差异表达蛋白显著富集的通路。(D) 热图显示三种蛋白亚型关键调控通路下特征蛋白的丰度。(E) 雷达图显示三种蛋白亚型患者激酶家族活性的差异。(F) 条形图显示三种蛋白亚型中关键调控激酶的活性。(G) 三种蛋白亚型中,显著激活的激酶的下游调控底物参与不同的信号通路。
05
ATC/PDTC中的免疫景观和调节
基于 xCell 特征的共识聚类在 159 个 ATC 和 PDTC 队列中鉴定出三种免疫亚型(聚类1-3)(图 5A)。他们的分析揭示了三种不同的免疫亚型,具有不同的临床和预后特征。由 ATC 和 PDTC 患者组成的聚类1 表现出最低的免疫评分和最好的预后(图 5B-C)。该亚型富含与氧化磷酸化和 DNA 复制相关的通路。相反,主要由 ATC 患者组成的 聚类2 和聚类3 显示出更高的免疫评分并且与较差的预后相关(图 5A-E)。值得注意的是,与聚类2相比,聚类3的转移性样本比例降低,免疫细胞浸润增多,尤其是CD8+ T细胞、巨噬细胞和中性粒细胞(图 5A)。整合分析显示,聚类1亚型主要由Pro-I型样本组成,而大多数Pro-III和Pro-II型样本属于聚类3。值得注意的是,他们注意到聚类2亚型主要由Pro-III型样本组成,这表明Pro-III型的肿瘤微环境(TME)可能存在异质性。
为了鉴定造成该免疫表型的关键转录因子,对转录因子进行了整合筛选。转录因子分析显示,CEBPB、CSDE1、STAT1、ZBTB5 等与预后结果呈负相关(图 5F)。进一步对聚类 1 和聚类3 进行转录因子差异分析,发现聚类3 中 STAT1、RUNX2 和 CEBPB 等转录因子显著上调(图 5G)。对三个聚类之间 STAT1 表达的具体比较显示,聚类3 中 STAT1 的表达水平最高。相反,聚类1 中 STAT1 的表达水平最低(图 5H)。JAK-STAT 信号在聚类 3 亚型中持续激活(图 5A),表明 STAT1 在形成聚类3 的 TME 中起着至关重要的作用。
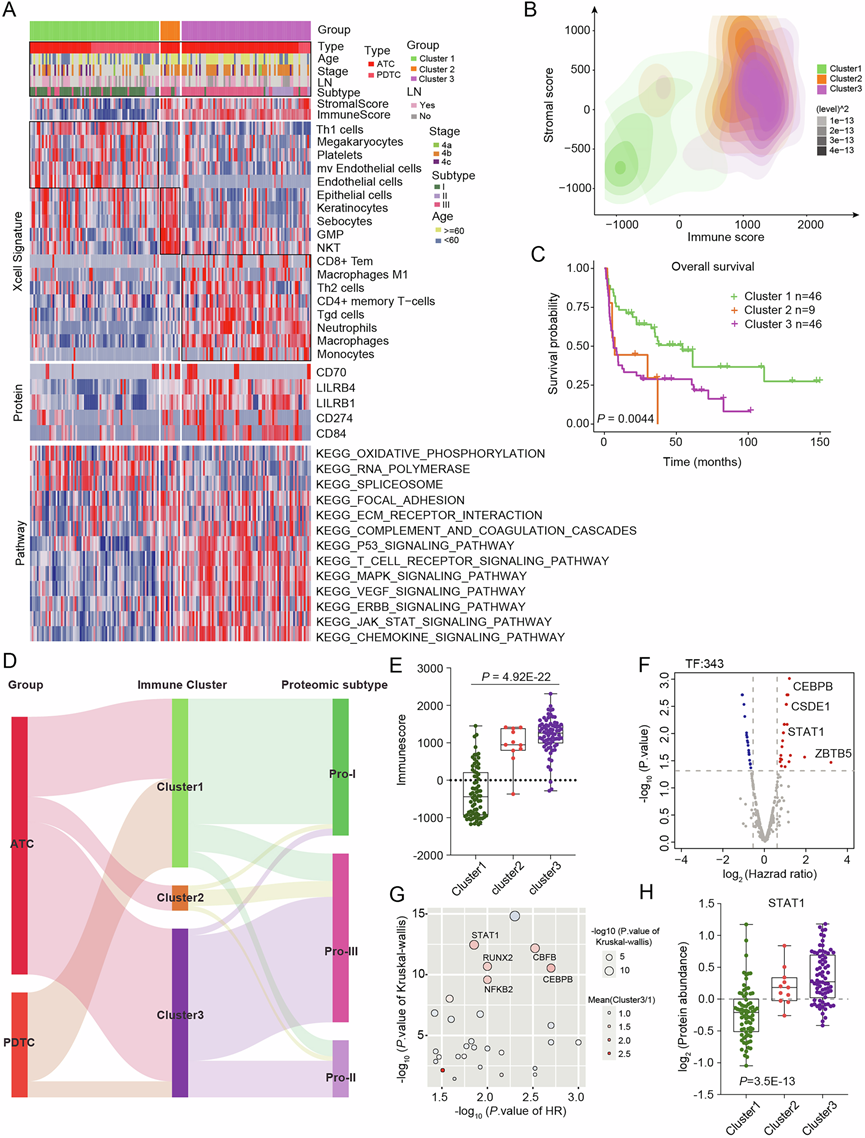
图5. ATC/PDTC 中的免疫亚型和调节因子。
(A) 使用 xCell 计算免疫细胞评分,将 ATC 和 PDTC 患者的免疫亚型分为三种。底部热图显示了三种免疫亚型患者的免疫细胞标志物丰度和通路活性。(B) 三种免疫亚型的免疫评分和基质评分热图。(C) Kaplan -Meier 曲线显示三种免疫亚型患者总生存期的差异。(D) 桑基图显示了 ATC 和 PDTC 样本在免疫亚型和蛋白质组亚型中的组成。(E) 三种免疫亚型的免疫评分箱线图。(F) 343 个转录因子 (TF) 的生存风险评分。(G) 患者生存风险评分方面的转录因子气泡图。(H) 箱线图显示了三种免疫亚型中转录因子 STAT1 的蛋白质丰度差异。
06
中性粒细胞功能障碍与 ATC 预后不良相关
鉴于 ATC 的特点是免疫信号传导,并且在蛋白质组学和免疫亚型中发现了较高的免疫评分,并且生存率较低(图 4和5),他们试图探索解释免疫微环境的潜在调节因子。CNA 分析显示,在 79 例 ATC 和 PDTC 患者中,1p、1q、5p、7p、7q、17q、20q 和 21p 染色体上存在显著扩增,13q、16q、17p 和 22q 上存在缺失,其中 1q 扩增是最常见的 CNA,发生率为 37%(图 6A)。CNA-蛋白质对的正相关性 在 1q 染色体上更为明显,表明 CNA 对 1q 蛋白质丰度具有强烈的顺式效应(图6B)。与 PDTC 组和 ATC 组患者相比,1q 扩增(41%)主要发生在 ATC 中。
在ATC组织中,中性粒细胞趋化作用和NETs经常富集,并且C5AR1通常参与这些通路,暗示C5AR1在中性粒细胞功能中起着基础性作用。免疫荧光染色支持与NAT和PTC组织相比,ATC组织中C5AR1表达显著增加(图 6J-K)。C5AR1高表达与不良预后显著相关(P =0.00046)(图 6L)。此外,C5AR1分别与MPO和PAD4显著相关(图 6M-N)。进一步分析表明,STAT1的表达与中性粒细胞浸润相关,并且C5AR1表达与STAT1丰度呈正相关。值得注意的是,他们发现 STAT1 的高表达和活性与 C5AR1 的表达升高之间存在密切关联(图 6O)。总体而言,ATC患者染色体1q区扩增导致NCF2 DNA片段丰度增加,从而促进NCF2蛋白表达。STAT1活性升高促进C5AR1表达。NCF2和C5AR1的上调协同触发中性粒细胞趋化和NET的形成(图 6P)。
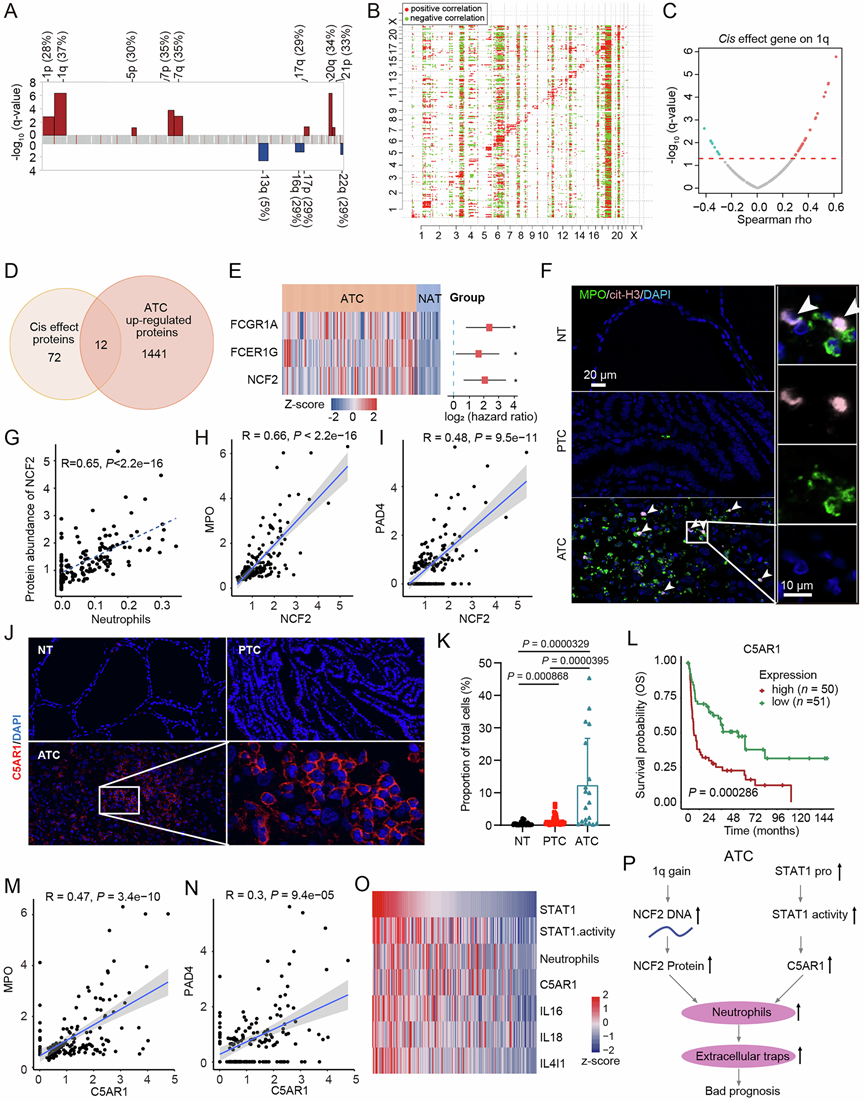
图6. 中性粒细胞浸润导致 ATC 预后不良。
(A) 条形图显示 ATC 和 PDTC 样本中基于拷贝数变异 (CNA) 的染色体臂显著改变。(B) 热图显示 ATC 和 PDTC 样本中拷贝数变异与蛋白质丰度之间的相关性。(C) 散点图显示 1q 染色体臂区域基因的 CNA 与其蛋白质丰度之间的 Spearman 相关性。(D) 维恩图显示 1q 区域的顺式效应基因与 ATC 中显著上调的蛋白质之间的重叠。(E) 重叠部分中前三种蛋白质的表达和生存风险评分。(F) 免疫荧光染色分析。(G) 散点图显示基于 xCell 计算的 NCF2 蛋白质丰度与中性粒细胞评分之间的 Spearman 相关性。(H-I) ATC/PDTC 样本中 NCF2、MPO 和 PAD4 丰度的 Spearman 相关性。(J-K) 免疫荧光染色分析。(L) ATC 或 PDTC 患者中 C5AR1 与总生存期的相关性。(M-N) ATC/PDTC 样本中 C5AR1、MPO 和 PAD4 丰度的 Spearman 相关性。(O) 热图显示 STAT1 的表达和活性及其对其下游底物蛋白的调控作用与中性粒细胞浸润相关。(P) 流程图显示与ATC患者不良预后相关的潜在生物学机制。
07
基于蛋白质组的ATC/PDTC亚型精准治疗
ATC/PDTC亚型的分子特性为个体化治疗提供了易受影响的靶点。对于Pro-I亚型患者,参与胰岛素信号传导和细胞存活的活性激酶,包括IGF1R、AKT1和ERK1/2,预计会由Figitumumab(III期临床试验)、依维莫司(已获批)和GDC-0994(I期临床试验)所阻断(图7A)。值得注意的是,BCL2因其参与铂类药物耐药途径而作为潜在的治疗靶点。BCL2的免疫组织化学染色证实了BCL2在三种蛋白质组亚型中存在异质表达。BCL2在Pro-I亚型中高表达,尤其是在肿瘤细胞而非基质中。相反,其在Pro-III亚型中的丰度较低(图 7B-C)。BCL2 抑制剂如维奈克拉已批准用于治疗淋巴瘤;然而,它们在治疗 ATC/PDTC 中的价值需要更多的数据支撑。Pro-II 亚型患者中 PD-L2 和 DNA 修复信号的上调暗示其在接受基于 PD-1 的免疫疗法和 ATM/ATR 抑制剂治疗后具有抗肿瘤活性(图 7A)。然而,由于单药治疗 ATC 的抗肿瘤效果有限,应考虑包括放化疗在内的联合治疗。Pro-III 是最具侵袭性的亚型,其特点是频繁的BRAF V600E突变以及 CD274 和 C5AR1 高表达(图 7A)。免疫荧光染色显示,Pro-III组C5AR1 +细胞(31.1%±5.3%)较Pro-I组(0.6%±0.5%)和Pro-II组(9.7%±2.4%)显著增加(图 7D-E);且Pro-III组中71.1%的C5AR1+细胞为C5AR1 + CD11b +髓系细胞,提示C5AR1主要表达于髓系细胞。
C5AR1 已开发为抗中性粒细胞胞浆抗体 (ANCA) 相关血管炎的新靶点。在 C5a 受体抑制剂中,avacopan 最近已批准用于治疗 ANCA ;然而,它作为针对 Pro-III 亚型的抗癌治疗的价值仍不清楚。鉴于 Pro-III 亚型的特点是BRAF V600E和TP53的突变频率高,他们在研究中引入了一种自发性 ATC 转基因小鼠模型(TPOCreER;Braf V600E/WT;Trp53−/−,以下称为 TBP),该模型表型复制了人类 ATC 的组织学特征。通过从 TBP 小鼠中分离肿瘤构建了原代细胞系 mATC。单独使用avacopan或抗PD-1抗体可达到中等程度的抗肿瘤效果,而avacopan与抗PD-1抗体联合使用可提高其抗肿瘤活性,并在免疫功能正常的小鼠模型中抑制mATC衍生肿瘤的生长(图 7F-G)。此外,avacopan治疗显著减少了肿瘤组织中NET的形成(图 7H)。
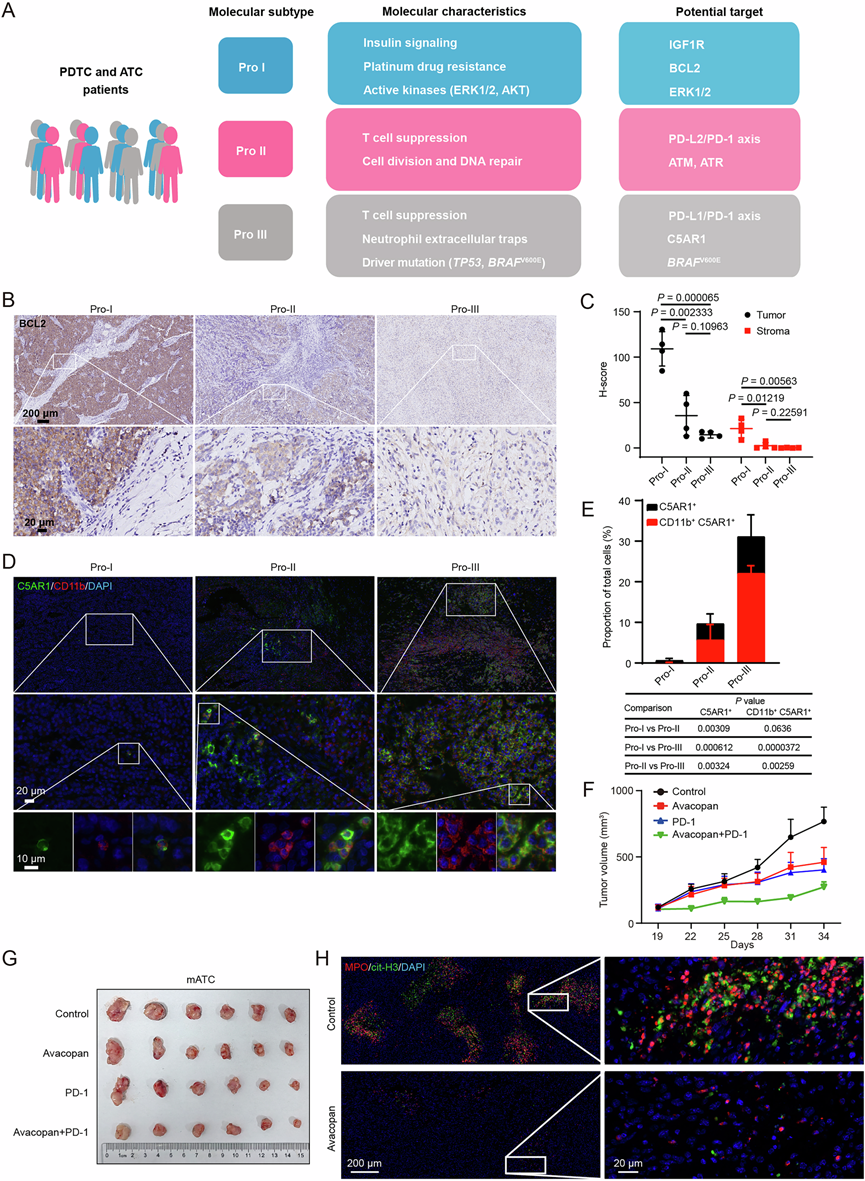
图7. ATC/PDTC 三种分子亚型的潜在靶点。
(A) 根据基于蛋白质组的 ATC/PDTC 亚型提出潜在靶点。(B-C) 三种蛋白质组亚型中 BCL2 的免疫组织化学染色。(D-E) 三种蛋白质组亚型中 C5AR1 和髓系标志物 CD11b 的免疫荧光染色。(F-G) 小鼠 ATC免疫功能模型中的肿瘤生长曲线和肿瘤大小。(H) 免疫荧光染色显示 Avacopan 治疗后 mATC 衍生肿瘤中 MPO 和 cit-H3 的代表性显微照片。
+ + + + + + + + + + +
结 论
本研究对 348 例甲状腺癌和 119 例癌旁样本进行了涵盖基因组、蛋白质组学和磷酸化蛋白质组学数据的深度分析。TP53 (48% )、TERT启动子 (36.5%) 和BRAF (23%) 是 PDTC 和 ATC 中最常发生突变的基因。核糖体生物合成是 ATC 的共同特征,而 RRP9 沉默可显著抑制肿瘤生长。蛋白质组学聚类分析确定了三种 ATC/PDTC 亚型。Pro-I亚型以异常的胰岛素信号传导和较低的免疫细胞浸润为特征,Pro-II以DNA修复信号传导为特征,而Pro-III则具有较高的TP53和BRAF突变频率以及密集的C5AR1 +髓系浸润。靶向C5AR1可协同增强PD-1阻断剂对ATC细胞衍生肿瘤的抗肿瘤效果。这些发现为肿瘤生物学提供了系统性的见解,并为药物研发提供了机会,从而加速恶性甲状腺癌的精准治疗。
+ + + + +



 English
English


