文献解读|Nat Genet(31.7):小鼠肾脏的多组学和空间分析揭示了整个生命周期中基因调控的性别差异
✦ +
+
论文ID
原名:Multi-omic and spatial analysis of mouse kidneys highlights sex-specific differences in gene regulation across the lifespan
译名:小鼠肾脏的多组学和空间分析揭示了整个生命周期中基因调控的性别差异
期刊:Nature Genetics
影响因子:31.7
发表时间:2025.04.21
DOI号:10.1038/s41588-025-02161-x
背 景
肾脏在体液平衡、血液过滤、重要分子重吸收以及调节血压和骨矿化的激素处理中具有重要作用。生物医学中一个重要的关注点是基因表达中表现出来的性别差异,如损伤的发生率和严重程度以及男性患肾癌的风险更高,因为女性可能具有激素保护作用。其他因素,如年龄、生活方式和性染色体,也会造成这种二态性。虽然已经从结构、生理、病理和药理反应方面研究了这些差异,但调节空间转录二态性(尤其是整个生命周期中)的潜在分子机制尚不清楚。
实验设计
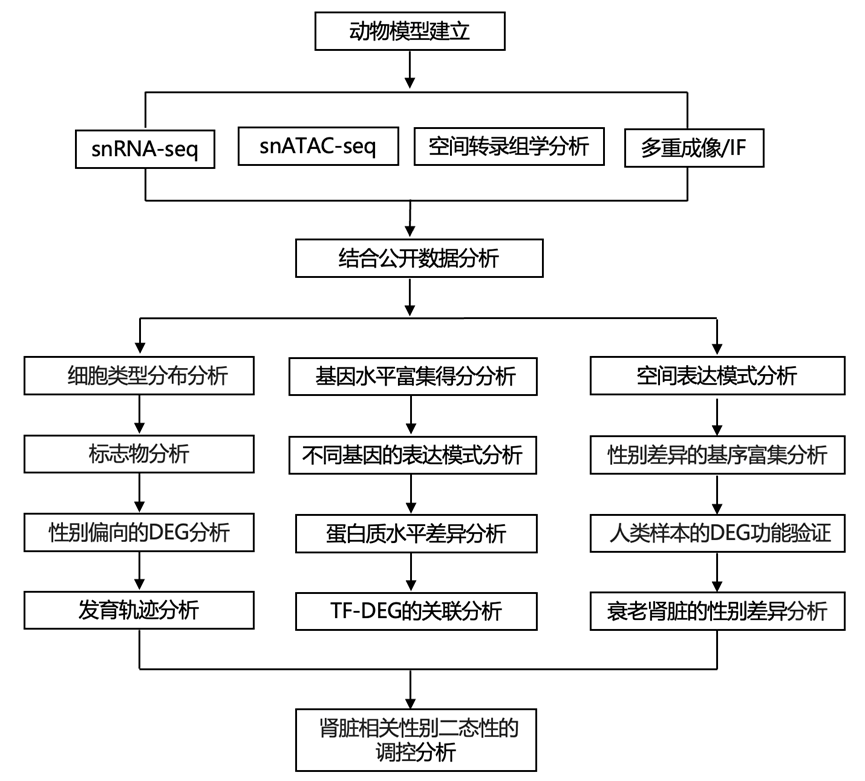
结 果
01
小鼠肾脏的综合多组学分析
研究团队于胚胎第16.5天(E16.5)、出生日(P0)、出生后第 3 周 (W3)、出生后第 12 周 (W12)、第 52 周 (W52) 和第 92 周 (W92) 收集了 C57BL/6J 小鼠(雌雄各半)的肾脏。这些时间点大致对应于人类的胚胎、新生儿、青年期、青春期、成年期和老年期。之后,处理样本并进行了多组学分析,包括单细胞核转录组分析(snRNA-seq)、单细胞核ATAC测序(snATAC-seq)、Visium空间转录组学分析(ST)和多重成像及免疫荧光(IF)分析,研究了雄性和雌性小鼠肾脏发育和衰老的差异(图1a)。均匀流形近似和投影 (UMAP) 和 Visium ST 上显示的 E16.5 和 P0 的细胞群体结构与之后的时间点不同(图1a),尤其是祖细胞和过渡细胞。在比较不同年龄段的 UMAP 时,他们从 W12 开始就注意到近端小管(PT)中的性别差异,而其他主要细胞群体在整个生命周期中在性别之间保持相似。虽然肾单元祖细胞 (NP) 和成纤维细胞在 E16.5 和 P0 时形成明显的聚类,但在后期时间点,表达节段特异性标志物的肾小管上皮细胞占大多数。Visium ST 中的正中矢状切面覆盖了所有主要肾脏区域,可以看到所有类型的细胞及其指定的解剖位置。在 P0 和 W3 之间检测到细胞类型分布模式的明显变化,反映了该时期肾脏细胞类型的急剧发育和成熟(图1a)。接下来,他们在 Visium ST 上分析了已知的肾脏节段标志物(图1b),这些标志物正确地勾勒出了各个肾节段的空间分布。例如,Slc5a12(PT 标志物)在皮质区域显著出现,而Aqp2[集合管主细胞 (CD_PC) 标志物]在髓质区域更为明显。此外,通过snATAC-seq技术,他们观察到每个标记都受到特定标记定义的细胞类型中独特的染色质可及性峰的严格调控,例如PT节段 1[PT(S1)]的Slc5a12,PT 节段 2[PT(S2)]的Slc13a3和PT 节段 3[PT(S3)]的Slc7a1229(图1c)。
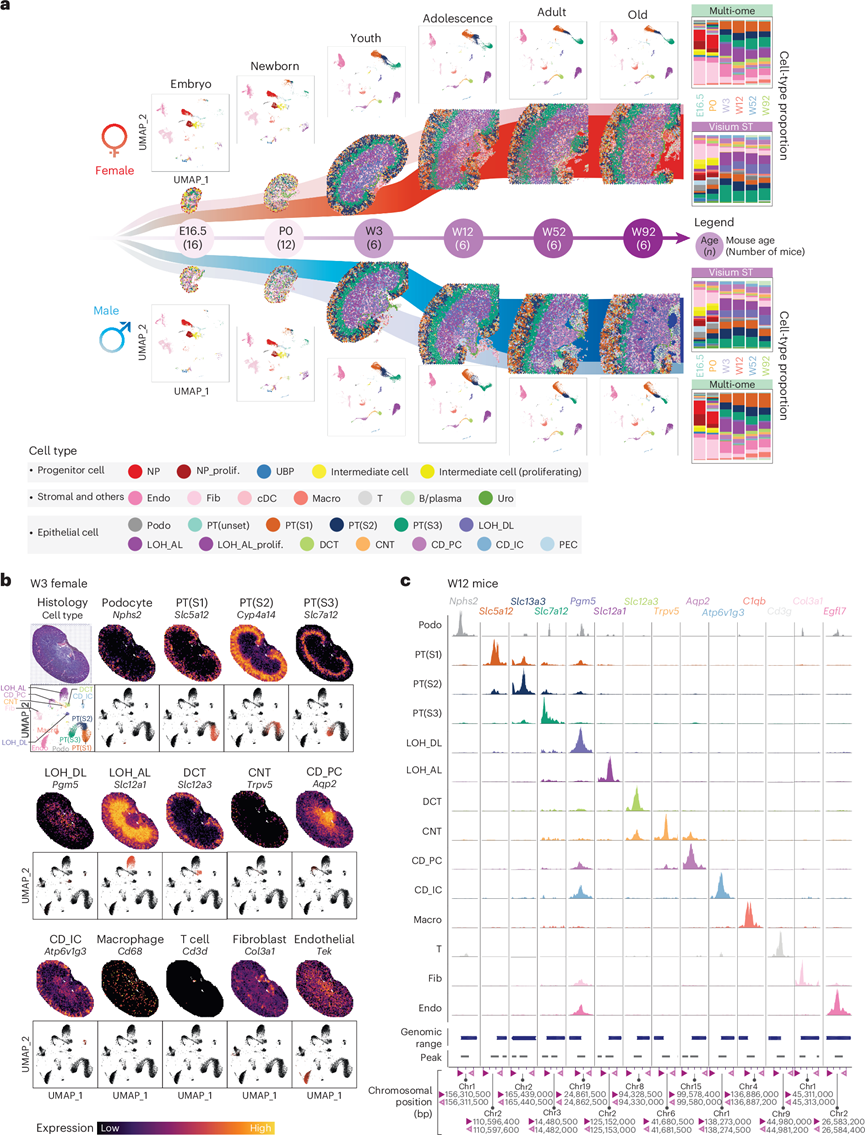
图1. Visium ST、snRNA-seq 和 snATAC–seq 的研究设计和综合细胞类型分布。
(a) 研究设计和多组学数据集。(b) W3 雌性小鼠肾脏中细胞类型标记基因的单核和空间表达谱。(c) W12 小鼠主要肾脏细胞类型的 snATAC-seq 峰可及性。
02
自青春期以来,PT 中转录的性别二态性就出现了
为了揭示小鼠生命周期中不同肾脏节段的性别差异,他们接下来分析了性别偏向的差异表达基因(DEG),从肾脏祖细胞群开始,首先检测了NP细胞和输尿管芽祖细胞(UBP)的基因表达谱,因为它们能够分化成肾脏中的所有上皮细胞,并且具有不同的发育轨迹。在所有细胞类型中,PT 细胞在发育和性别差异方面表现出最独特的模式(图2a-b)。相邻的 PT 节段有一组共有基因,同时也有独特的标记基因。例如,Slc34a1在 S1 和 S2 之间共存,而Slc5a12仅在 S1 中表达。总体而言,W3 肾脏与以后的年龄相比具有不同的基因表达谱,少数基因在表达上表现出较弱的性别偏向(图2a)。有趣的是,Rhobtb1和Ehhadh等基因的表达在 W3 时强烈上调,但在以后的年龄在两种性别中均降低。相反,Ghr等基因的表达在 W3 时不存在,但在以后的年龄在两种性别中均保持在高水平。此外, Slc7a12和Napsa等基因的表达在 W3 时很高,在雌性后期仍保持在高水平,但在雄性后期所有阶段都下降;Slc7a13、Cyp2j13、Cyp4b1和Slc22a30的转录本在整个生命周期中在雌性中均未检测到,但自 W12 以来在雄性中大量存在。这些基因在 W3 和 W12 之间都表现出基因表达模式的显著变化,W12 是性成熟发生和性激素调节可能在基因表达中发挥重要作用的时期。此外,一组基因在雄性中强烈表达,例如PT(S2) 中的Cyp2j13和Cyp4b1以及 PT(S3) 中的Atp11a和Slc7a13。另一方面,一组基因仅在雌性中表达,包括PT(S2) 中的Kynu和PT(S3) 中的Slc7a12。除了 PT 之外,他们还注意到亨利氏袢 (LOH) 升支、远曲小管 (DCT) 和集合管 (CD)的年龄依赖性表达模式,强调了定义早期发育阶段细胞类型特异性标记的重要性(图2a-b)。总体而言,他们总结了NP、UBP及其富集基因后代细胞在相应时期的发育轨迹,小鼠肾脏中PT的性别差异最为显著,在W3和W12之间最为明显,且在PT(S2)和PT(S3)节段的这种差异比PT(S1)更为明显。

图2. 肾脏主要祖细胞在整个生命周期中的发育轨迹。
(a-b) 每种细胞类型的DEG热图。(c) 发育轨迹显示了来自NP和UBP的细胞随时间的基因富集情况。
03
性别偏向的 DEG 最常出现在 PT(S3) 中
为了系统地研究不同细胞类型和年龄的性别差异,他们对每种上皮细胞类型进行了相关性分析,绘制了snRNA-seq 表达谱和 snATAC-seq 峰可及性谱,在三个 PT 片段中鉴定了 353 个雄性偏向基因和 406 个雌性偏向基因(图3a)。大多数性别偏向的 DEG 出现在 S3 中,其次是 S2,S1中很少。使用来自 MSigDB 30 个S3 DEG 的 Hallmark 基因集进行通路分析(图3b)显示,雌性富集了与肌肉生成、白细胞介素 2 (IL-2) –信号转导和转录激活因子 5 (STAT5) 信号传导和上皮-间质转化通路,雄性富集了异生物质和脂肪酸代谢等通路。这些发现强调了肾脏生理学中性别特异性基因调控的复杂性,并强调了在肾脏研究中将性别作为生物变量考虑的重要性。
对成年小鼠前 100 个 DEG 进行相关性分析表明,雄性小鼠的 S2/S3 相关性强于雌性小鼠(图3c)。S3 显示出的性别差异也略大于 S2(图3c),如 UMAP 聚类所突出显示(图3d)。使用已发表的数据集2(图3e)比较 PT(S2) 和 PT(S3) 中的DEG,证实了大多数性别偏向基因出现在 Visium ST 中的 W3 和 W12 之间,与此时期性激素水平上升相吻合。具体来说,睾酮在P30左右开始升高,雌二醇在P26至P29之间升高,孕酮早在P10就开始升高,并在P21左右显著升高。这个时间点表明性激素可能驱动两性异形分化,反映了性类固醇在塑造器官发育和成熟方面的“组织效应”。
他们在分析中验证了几个已知的性别偏向基因(Abcc3、Acsm2、Cyp7b1和Prlr)。值得注意的是,Abcc3和Prlr仅在青春期后表现出性别偏向表达—它们的表达水平在 W3时在两性中相似(图3e),但在雄性中迅速下降,而在成年雌性中保持稳定。他们还在 PT 中发现了以前未发现的性别偏向基因:Socs2和Akr1c21(图3e-g)。Socs2在基因表达和染色质可及性方面始终呈现雌性偏向,尤其是在 Visium 指示的内皮质和外髓质中,PT(S3) 片段主要位于此处。同样,Akr1c21在 PT(S3) 中显示出一致的雄性偏向表达和染色质可及性趋势,但在皮质中没有性别差异。这两个标记都在蛋白质水平上进行了验证,其中虚线突出显示的莲花四棱柱凝集素 (LTL) 阳性长直小管在形态上类似于 PT(S3)(图3f-g)。这两个基因都与类固醇激素信号传导有关,强化了激素调节在肾脏性别二态性中的作用。
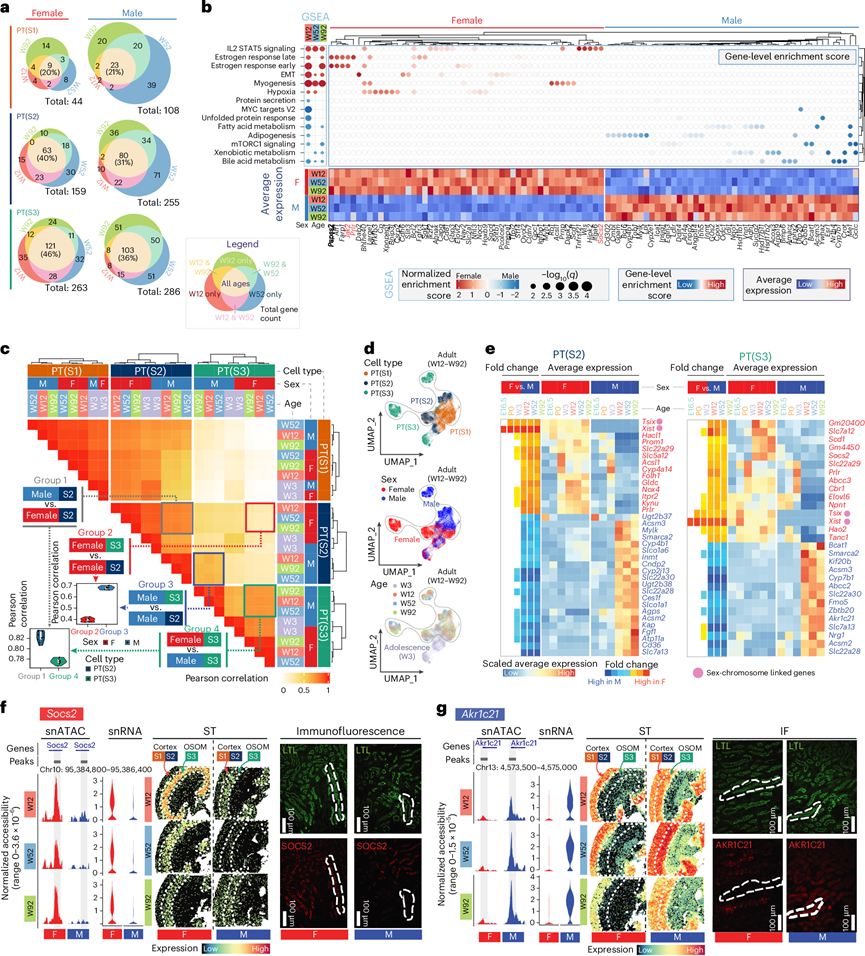
图3. PT中存在性别偏向的 DEG。
(a) 成年时间点 W12、W52 和 W92 时每个 PT 节段中性别偏向的 DEG 计数的欧拉图。(b) 来自 GSEA 的性别偏向归一化富集得分 (NES)(左)的气泡图和按表达水平加权的关键通路相关基因的基因水平富集得分 (GES)(右)。下图显示所选基因的表达。(c) PT 节段和性别的成对 Pearson 相关性分析。(d) UMAP 显示 PT(S1)、PT(S2) 和 PT(S3) 从 W3 到 W92 的转变,虚线标记来自成人肾脏(W12-W92)的细胞。(e) PT(S2) 和 PT(S3) 中性别偏向最强的 DEG 的 snRNA 表达热图。(f) 通过 snATAC-seq、snRNA-seq、ST 和 IF 染色比较两性之间Socs2的表达模式。(g) 使用 snATAC–seq、snRNA-seq、Visium ST 和 IF 染色比较不同性别的 Akr1c21 表达模式。
04
小鼠PT性别二态性的分子机制
接下来,他们检测了转录因子 (TF) 调控子活性,以确定性别偏向的 DEG 的上游调节因子。PT(S1) 和 PT(S2) 共有一组不同于 PT(S3) 的调控子。PT(S3) 中富集的大多数调控子都具有性别偏向,而 PT(S1) 和 PT(S2) 中的调控子则没有(图4a)。基于调控子活性的t分布随机邻域嵌入 (tSNE) 图显示,从 W12 开始,PT(S3) 细胞与部分混合的 PT(S1)/PT(S2) 群体相距更远,并且按性别分开,这与之前的 DEG 模式一致。值得注意的是,调控子富集在 W3 和 W12 之间发生显著变化,表明性激素参与其中。有趣的是,他们没有观察到性激素相关调控子的富集,这与最近的一项研究一致,该研究没有观察到小鼠肾脏中性别偏向的 DEG 启动子区域中激素反应元件的过度表达。
然后,他们研究了性别偏向的转录因子(TF)和 DEG 之间的联系(图3e)。一些雌性偏向的 TF,包括 Cebpd、Creb3l1 和 Foxq1,可能调节雌性偏向的 DEG Socs2和Jak2。由于 Jak2/STAT5 信号调节Socs2并由催乳素激活,而文献中报道Prlr是一种雌性偏向的 DEG,他们假设 PT(S3) 中存在一个由催乳素驱动的雌性偏向调控网络,通过 PRLR/JAK/STAT 信号通路。在该模型中,催乳素与 PRLR 结合,激活 JAK2/STAT5 进而上调Socs2(图4b)。
此外,雄性偏向的 TF BCL6 抑制Socs2表达,在性别之间与 STAT5 共有互斥的启动子结合位点。在雌性中,STAT5 可能结合并激活Socs2,而在雄性中,BCL6 结合并抑制它。有趣的是,在 PT(S3) 的所有雌性偏向基因中,只有Socs2和Prlr启动子含有 STAT5 和 BCL6 结合基序,表明 STAT5/BCL6 在 PRLR/SOCS2 通路上存在独特的竞争性结合机制(图4c)。其他雌性偏向的 DEG,例如Abcc3和Acot7,是 STAT5 的下游靶点,但不是 BCL6 的下游靶点(图4d),并且似乎仅受催乳素诱导的 JAK2/STAT5 激活调控,而不受 BCL6 的参与。
综上所述,他们提出以下两种机制调控 PT(S3) 中雌性偏向的DEG:催乳素诱导的 JAK2/STAT5 激活和STAT5/BCL6与靶启动子竞争性结合。Socs2和Prlr的表达可能同时受这两种机制控制,而Abcc3和Acot7仅依赖 JAK2/STAT5(图4e)。由于催乳素受雌激素调节,该通路体现了雌激素对雌性偏向的 DEG的潜在间接控制。STAT5/BCL6 对Socs2和Prlr 的竞争性调控与肝脏性别二态性和肺动脉高压有关。本研究研究将 STAT5/BCL6 竞争性结合与肾脏中的性别二态性联系起来,强调了驱动性别偏向基因调控的激活因子和抑制因子的复杂相互作用(图3f)。

图4. 调节网络分析揭示的 PT 的性别差异。
(a) 从 E16.5 到 W92 年龄的所有样本的 PT 片段中细胞类型特异性调控子的平均二元活性热图。(b) 参与Socs2表达调控的基因热图。(c-d) 预测为 STAT5 和 BCL6 下游靶点并受 STAT5 严格控制的 PT(S3) 衍生的雌性偏向基因的表达。(e) 性别偏向的调控机制图。
05
性别偏向的空间分布模式
本研究利用单细胞空间平台Xenium,分析了12周和92周雌性和雄性小鼠肾脏的空间表达模式。根据组织学和细胞类型组成,他们确定了以下四个不同的肾脏区域:皮质、外髓质外条带(OSOM)、外髓质内条带和内髓质(IM)(图5a-b)。雌性肾脏的皮质比雄性薄,外髓质比雄性厚。根据皮质和 OSOM 的表达特征,他们鉴定出五种不同的性别二态空间表达模式(图5c-d)。模式 1 在雄性皮质和 OSOM 中高度表达,模式 2 在男性 OSOM 中高度表达,模式 3 在雄性皮质中高度表达,模式 4 在雄性皮质和雌性 OSOM 中高度表达,模式 5 在雌性 OSOM 中高度表达。模式 1、3 和 5 在雄性或雌性中均显示出较高的基因表达水平,而模式 2 和 4 显示出更复杂的动态(图5c-d):模式 2 在两种性别中均显示在皮质中表达,但在雄性 OSOM 中表达更高;模式 4 突出显示了性别偏向的 DEG,其可以在不同的肾脏区域中同时表现为雄性偏向和雌性偏向,这表明研究肾脏性别二态性与空间内容的重要性。
接下来,他们定量了关键基因Pigr(模式 1)和Akr1c21(模式 2)沿肾脏区域近端到远端轴线的空间表达(图5e-h),分别使用节段标记Lrp2和Aqp7来定义 PT 和 PT(S3)。Pigr是模式 1 基因,在 PT(S3) 内的皮髓质连接处达到峰值,揭示了先前未曾研究过的极化空间表达(图5e-f)。类似地,Akr1c21在 PT(S3) 中表现出雄性特异性富集,而在雌性OSOM 中表达急剧下降(图5g-h),OSOM 的 PT(S3) 中表达偏向雄性(图3g)。
他们还检测了模式5(图5i-k)中涉及JAK/STAT通路的雌性偏向基因(Prlr、Jak2和Socs2),这些基因是通过snRNA-seq和snATAC-seq(图4d)鉴定出来的。这些基因在雌性PT(S3)中表达较高,趋势图突显了OSOM中的表达峰值(图5k),这暗示OSOM中存在独特的雌性偏向激素调控。

图5.性别偏向的空间分布模式。
(a) H&E 图像,空间分辨的肾区和细胞类型。(b) 雌性和雄性肾脏中肾区和肾小管细胞类型的放大视图。(c) 每种模式的平均和百分比表达水平的气泡图。(d) 单细胞性别偏向的空间表达模式。(e) 雄性偏向基因Pigr的裁剪空间表达模式,分别与 PT 和 PT(S3) 标记Lrp2和Aqp7一起显示。(f) 雌性和雄性小鼠肾脏中Pigr、Aqp7和 PT(S3)的放大 OSOM 视图。(g) 雄性偏向基因Akr1c21以及 PT 和 PT(S3) 标记Lrp2和Aqp7的裁剪空间表达模式以及 Akr1c21的平均表达趋势图。(h) 雌性和雄性小鼠肾脏中Akr1c21、Aqp7和 PT(S3)的放大 OSOM 视图。(i) 两种性别肾脏中Prlr、Jak2和Socs2的单细胞空间表达谱。(j) 两种性别小鼠肾脏 OSOM 区域Prlr、Jak2、Socs2和 PT(S3)的放大视图。(k) Prlr、Jak2和Socs2的表达趋势图。
06
核受体(NR)调节PT中的性别偏向DEG
为了研究控制小鼠肾脏性别差异的染色质区域,他们进行了基序富集分析,以从差异可及染色质区域(DAR)中鉴定性别富集的基序。专注于PT(S2)和PT(S3),他们确定了性别特异性基序(图6a-b)。例如,C/EBP家族在雌性中高度富集,而NR1、NR2和NR3在雄性中富集。POU结构域因子表现出更复杂的模式。在S2中,POU4 / POU6在雄性中富集,而在S3中,POU1 / POU2 / POU3 / POU5在雌性中更富集。
类固醇受体属于 NR 家族,他们接下来对所有 NR 家族基序进行了系统分析。性别偏向的基序主要位于 PT(S2) 和 PT(S3) 中的 NR1/NR2/NR3 亚组。此外,所有富集的基序仅在雄性中富集(图6c)。同时,雌激素相关基序 (ESR1、ESR2、ESRRA、ESRRB 和 ESRRG) 均未在两种性别中表现出富集模式(图6d),表明雌性偏向的 DEG 不直接受雌激素调控。相反,雄激素受体 (AR) 基序在雄性所有三个 PT 节段中均显示出显著更高的富集,表明雄激素直接参与雄性肾脏中性别偏向基序的富集。与 NR3 亚组相比,NR1和 NR2 在雄性 PT(S3) 中高度富集,尤其是 HNF4A (var.2)、HNF4G 和 HNF4A,这表明 NR1 和 NR2 既塑造了雄性 PT 节段差异,也塑造了性别二态性,而 NR3 仅驱动性别差异。在三个 PT 节段中所有雄性偏向的 DEG 中,他们发现大约 14% 是 AR 基序的下游靶点(图6e),包括众所周知的Slco3a1、Serpinf2、Slc7a13、Slc22a30、Cyp4b1和Acsm2。

图6. 基序富集分析揭示的 PT 性别差异。
(a-b) PT(S2)和 PT(S3)中两性特异性峰中富集的基序分析。(c) PT 片段中 NR 基序家族中高于或低于阈值(具有性别富集模式)的基序数量。(d) 从 NR 家族中选择的基序的概览。(e) 热图显示 PT 片段中Ar基序预测的下游靶标的平均表达。
07
评估小鼠 PT 性别 DEG 在人类中的应用
接下来,他们评估了基于小鼠的人类样本发现。在单细胞数据集中鉴定了主要的肾小管上皮细胞群。与小鼠的结果一致,PT 是人类中性别 DEG 数量最多的细胞类型。在雌性和雄性两个物种中,分别有 87%(906)和 82%(796)的性别 DEG 表现出相同的趋势。有 135 个和 111 个重叠 DEG 表现出小鼠和人类中两倍以上的表达差异(图7a)。例如,SPP1在雌性中表达较高(图7b)。在多种肾脏疾病中都观察到 SPP1 的上调,包括急性肾损伤 (AKI) 和慢性肾病 (CKD) 。在 PT 中具有性别差异的基因中,与正常的邻近组织相比,男性偏向的 DEG Dock5在透明细胞肾细胞癌 (ccRCC) 中的表达水平更高。Dock5 的高表达与男性ccRCC患者的生存率较低有关,但与女性 ccRCC 患者无关(图7c)。据报道,Dock5在头颈部鳞状细胞癌和肺腺癌中具有致癌作用,以促进侵袭和转移,但尚不清楚其在 ccRCC 中是否具有类似的功能。
他们进一步使用 IF 染色和多重成像(PhenoCycler)研究了蛋白质水平上的人/鼠一致性。SOCS2、SCD、CYP4B1 和吲哚乙胺N-甲基转移酶 (INMT) 在人类肾脏 PT 细胞中表现出明显的性别差异,这已在三对独立细胞中得到验证(图7d-g)。SOCS2 和 SCD 在雌性 PT 细胞中的表达始终明显较高,而 CYP4B1 和 INMT 在雄性 PT 细胞中的表达较高。Cyp4b1在Xenium 中的雄性小鼠皮质中也表现出性别偏向的空间表达模式(图5c-d)。使用具有 22 个标记物的多重成像,他们发现雌性小鼠肾脏小管中的 SOCS2 表达较高。在LOH、DCT或CD的粗升支中观察到的差异无统计学意义(图7k)。这表明SOCS2在女性人类PT中具有较高的蛋白表达水平,但在其他肾单位节段中则没有。

图7. 人类肾脏中的性别 DEG 表达模式。
(a) 在人类数据中,小鼠和人类之间重叠的男性和女性特异性 PT 基因。(b) 左图,PT 中SPP1 snRNA 表达的小提琴图。右图, Visium ST 中SPP1表达的小提琴和空间图。(c) 左图:正常人肾脏样本 PT 中的DOCK5表达。中间图:ccRCC 肿瘤组织与正常邻近组织相比的DOCK5表达。右图:基于低/高DOCK5表达的男性和女性患者生存状态的 Kaplan-Meier 曲线。(d-g) 女性和男性人类肾脏组织中SOCS2、SCD、CYP4B1和 INMT表达的 IF 图像和荧光强度定量。(h) 肾元结构图。(i) 女性和男性人类肾脏中 SOCS2、LRP2、AQP1、CALB1、UMOD 和 AQP2 的 CODEX 图像。(j) SOCS2、LRP2 和 AQP1 的 CODEX 图像显示人类肾脏中女性和男性的 SOCS2 差异。
08
衰老影响不同性别肾脏中的不同细胞类型
为了探究衰老肾脏的性别差异,他们将92周龄肾脏与较年轻肾脏进行了比较(图8a)。重新聚类后,他们发现免疫细胞,即巨噬细胞(C9)、树突状细胞(C22)、T细胞(C17)和B细胞/浆细胞(C20和C28),从12周龄到92周龄,其细胞比例稳步增加(图8b),表明肾脏随着衰老而出现免疫细胞的积累。
比较不同细胞类型中W12和W92肾脏中与年龄相关的DEG数量(图8c),PT在衰老过程中表现出最多的改变,并且这些差异在老年男性中比在老年女性中更为显著。另一方面,CD_PC在女性中表现出更丰富的年龄相关改变。接下来,他们探讨了PT(S2)、PT(S3)和成纤维细胞在衰老过程中的DEG,它们代表上皮细胞和基质细胞,因为它们表现出更丰富的衰老相关DEG。他们发现几个与衰老相关的 DEG 也是 SASP 的成员和SenMay中的成员,例如PT(S2) 中的Fgf1、Pappa和Spp1 ,以及 PT(S3) 中的Serpine2,这表明它们可能在肾脏衰老中发挥与衰老相关的重要作用(图8d-f)。
一些与衰老相关的基因与肾脏或肾脏疾病有关。例如,他们发现Pappa在雌性中的表达水平更高,并且表达随着年龄的增长而稳步增加(图8e)。缺乏这种基因的小鼠平均寿命增加 22-43%,并且在 21 个器官中,这种影响在肾脏中表现得最为明显,这表明Pappa在与衰老相关的肾脏中可能具有性别偏向性作用。Spp1在老年女性中表达也有所增加(图8e),并且已知它参与肾结石的形成。患肾结石疾病的风险随着年龄的增长而增加,这表明Spp1在老年女性肾结石的形成中可能起着促进作用。他们发现了一组衰老DEG本研究中排名靠前的性别DEG,例如S2中的Atp11a和Smarca2,以及S3中的Acsm3、Cyp7b1、Hao2和Prlr(图3e,图8d-e)。作为代表性的男性偏向DEG,Acsm3和Cyp7b1在snRNA-seq和ST中,在男性中表达随年龄增长明显下降(图8g),这凸显了在研究肾脏衰老时纳入两种性别的必要性。
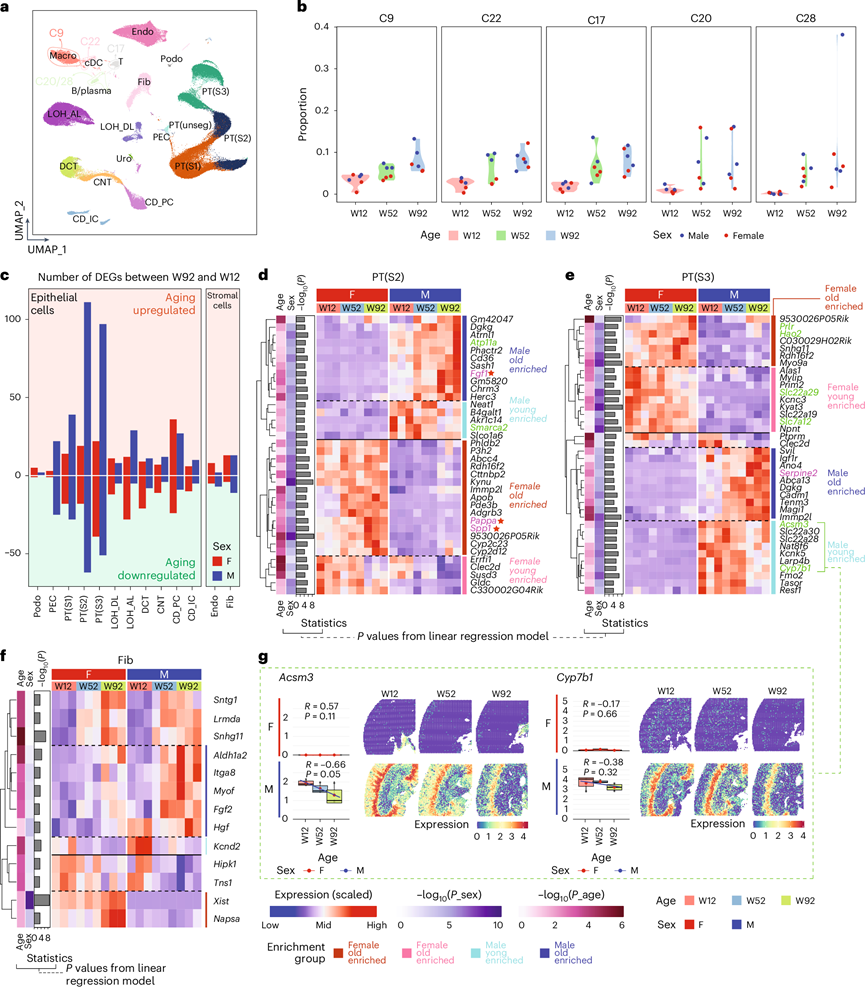
图8. 不同肾脏细胞类型的衰老。
(a) 基于多组学数据的成人肾脏细胞类型分布。(b) 小提琴图显示每个样本中来自聚类9、22、17、20 和 28 的细胞比例。(c) 分别比较女性和男性中 W92 和 W12 样本的主要细胞类型中的 DEG 数量。(d-f) 与衰老相关的DEG 热图。(g) snRNA-seq中年轻男性富集的 PT(S3) 基因的表达。
+ + + + + + + + + + +
结 论
本研究整合了多组学数据,对68只小鼠在六个发育和成年时间点的76个肾脏样本进行了特征分析,构建了小鼠肾脏在生命周期内(包括两种性别)的分子图谱。近端小管在3周龄后出现的性别DEG最多,并且与激素调节相关。本研究揭示了雄激素和雌激素直接和间接调控的潜在机制。空间分析识别出皮质和外髓质外条带中存在明显的性别差异空间模式。此外,老年小鼠在亨利氏袢、近端小管和集合管中表现出更多与衰老相关的基因改变,且这种改变与性别相关。本研究研究结果增强了对肾脏相关性别二态性背后的空间分辨基因表达和激素调节的理解。
+ + + + +



 English
English


