文献解读|Cell(45.5):双向营养供应环境通过对营养吸收和宿主防御的差异调节来促进小肠生理学
✦ +
+
论文ID
原名:A two-front nutrient supply environment fuels small intestinal physiology through differential regulation of nutrient absorption and host defense
译名:双向营养供应环境通过对营养吸收和宿主防御的差异调节来促进小肠生理学
期刊:Cell
影响因子:45.5
发表时间:2024.10.19
DOI号:10.1016/j.cell.2024.08.012
背 景
小肠包含由肠腔内饮食和微生物代谢物(肠内侧)以及来自宿主的全身代谢物(浆膜侧)形成的双前端营养供应环境。然而,尚不清楚每一侧如何对小肠生理学产生不同的贡献。
实验设计
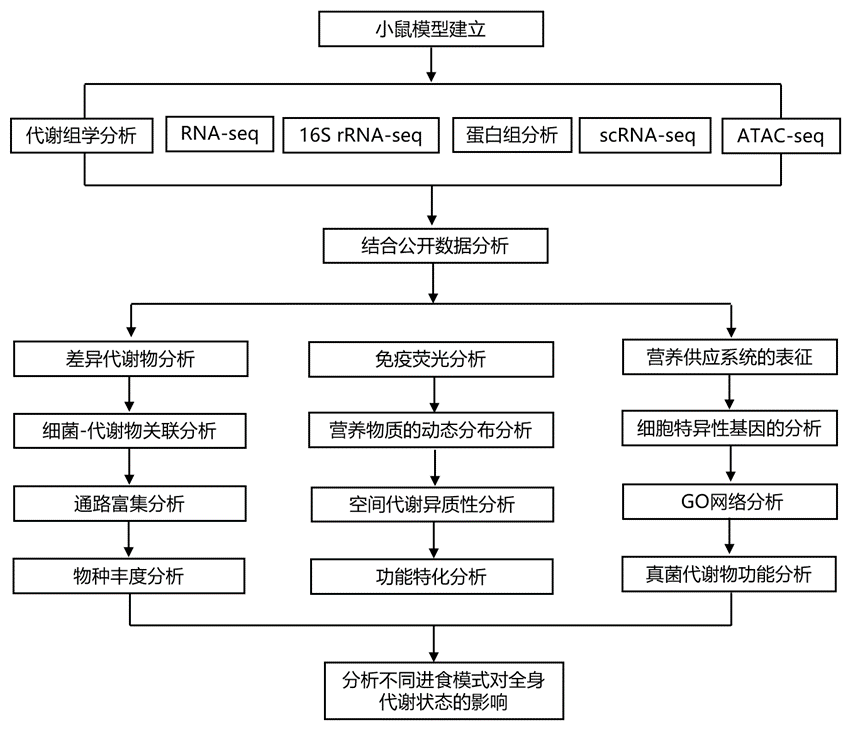
结 果
01
小肠双前端营养供应系统分析
为了全面研究双前端营养供应系统的生理影响,研究团队设计了三种小鼠喂养模型[假手术组、完全肠外营养(TPN) 组、饥饿组],其中小肠由不同的供应源提供营养(图 1 A)。所有小鼠开始均以正常食物(NC)自由进食,并在 24 小时适应期内持续尾静脉输注 4.8 mL/天生理盐水。在随后的空肠组织采集前的 24 小时内,假手术组小鼠保持原始进食状态。作为一种绕过胃肠道并作为唯一外部营养来源的喂养方法,TPN 组中的小鼠虽然中断进食,但接受尾静脉输注 TPN,它们每天可吸收约 5.8 kcal 和 30 mg 氮,以满足自由进食的需求。在饥饿组中,小鼠中断进食并持续尾静脉输注盐水。24 小时后,TPN 组的体重、指示全身代谢的血清代谢物水平以及绒毛的解剖结构和细胞规律与假手术组相当。与之前针对短期禁食的研究一致,饥饿组的一些参数表现出轻微变化,例如体重、血糖、绒毛长度和细胞活力。来自膳食内容的营养物质、微生物代谢物和宿主营养储备以及各种分泌蛋白(如激素和调节因子)动态地扩散并汇聚到绒毛内的细胞外空间。他们开发了一种提取肠间质液 (GIF) 的新方法,GIF 是一种近端细胞外液,积聚在小肠组织内,代表内部微环境和各种细胞类型之间的通讯(图 1 A)。简而言之,通过调节离心速度以及使用 Cy3 标记的人血清白蛋白 (Cy3-HSA)、乳酸脱氢酶 (LDH) 释放和细胞器成分释放作为血管浸润和细胞破裂的指标,优化了提取程序,最终采用了特定的离心力,以产生最大的 GIF 体积,同时将血清和细胞内内容物的污染降至最低(图S2A-E)。GIF内容物的组成由管腔和浆膜输入决定,包括饮食、微生物和细胞衍生的代谢物以及相关蛋白质因子。为了在跨尺度水平上全面探索这些过程,他们通过无偏代谢组学和定量蛋白质组学分析对GIF内容物的组成进行了分析,并通过16S核糖体RNA测序(16S rRNA-seq)和转录组分析(RNA-seq)技术分别表征了粘膜相关微生物组和空肠组织的肠道转录组。然后应用深入的跨尺度生物信息学分析,将这些微生物和细胞信息与GIF代谢组学和蛋白质组学数据集整合在一起(图1 A)。
三种喂养模式中整体营养物质利用度的差异使他们能够区分各个营养物质供应侧的优先效应。假手术组与TPN组之间的比较用于反映肠内供应侧的优先影响,而TPN组与饥饿组之间的比较用于反映浆膜供应侧的优先影响。他们发现空肠样本中两侧共有的共同调节的GIF代谢物、GIF蛋白和小肠基因数量非常有限,以及它们各自的富集通路存在差异(图S2F-G)。他们发现肠内侧优先富集脂质相关代谢物,而浆膜侧诱导更多的与碳水化合物和有机酸相关的代谢物的积累(图1B)。值得注意的是,物种来源分析显示,这些 GIF 代谢物中有相当一部分是由微生物产生的(图 1 B),表明微生物衍生的代谢物对小肠细胞外空间环境做出了重大贡献。代谢富集通路分析显示,浆膜侧上调的 GIF 代谢物优先富集在与合成代谢相关的通路中,例如脂肪酸和氨基酸的生物合成(图 S2 H)。相比之下,肠内侧似乎优先积累类固醇激素生物合成的代谢物(图 S2 H)。通过 16S rRNA 基因测序,然后基于加权 UniFrac 距离的主成分分析 (PCA),他们发现组间空肠微生物群含量存在显著变化(图 S2I-J)。此外,基于模型的代谢物观测和物种丰度整合 (MiMoSA) 表明,在不同的营养供应条件下,微生物群对小肠代谢环境的贡献不同。例如,乳酸杆菌是参与脂质吸收和代谢的次级胆汁酸的重要来源。值得注意的是,空肠组织中的乳酸杆菌和牛磺胆酸均在肠内供应侧富集(图 1C)。持续地,乳酸杆菌定植导致胃肠道内各种胆汁酸的丰度显著增加(图 1D图S2K),同时脂质吸收能力增加(图 1E-F)。相比之下,浆膜供应侧富含Parabacteroides及其相关代谢物十八碳三烯酸(图1C)。
为了深入了解宿主和微生物组之间的跨尺度相互作用,他们通过将微生物组和转录组数据集与 GIF 代谢组和蛋白质组数据集相结合,进行了深入的跨尺度生物信息学分析(图 1G,图S2G)。基于富集代谢物和调节元件的不同整合模式,他们发现肠内供应侧对脂质吸收和代谢、上皮的屏障功能和激素产生具有“跨尺度”影响。相比之下,浆膜侧似乎对肠道组织结构和细胞适应性的基本支持(如细胞外基质组织和 DNA 成分)以及免疫调节表现出更大的影响(图1G ,图S2G)。总之,通过全面分析和解剖小肠的复杂成分及其潜在的相互作用,他们在代表小肠生理学的许多方面确定了营养供应环境的显著异质性。
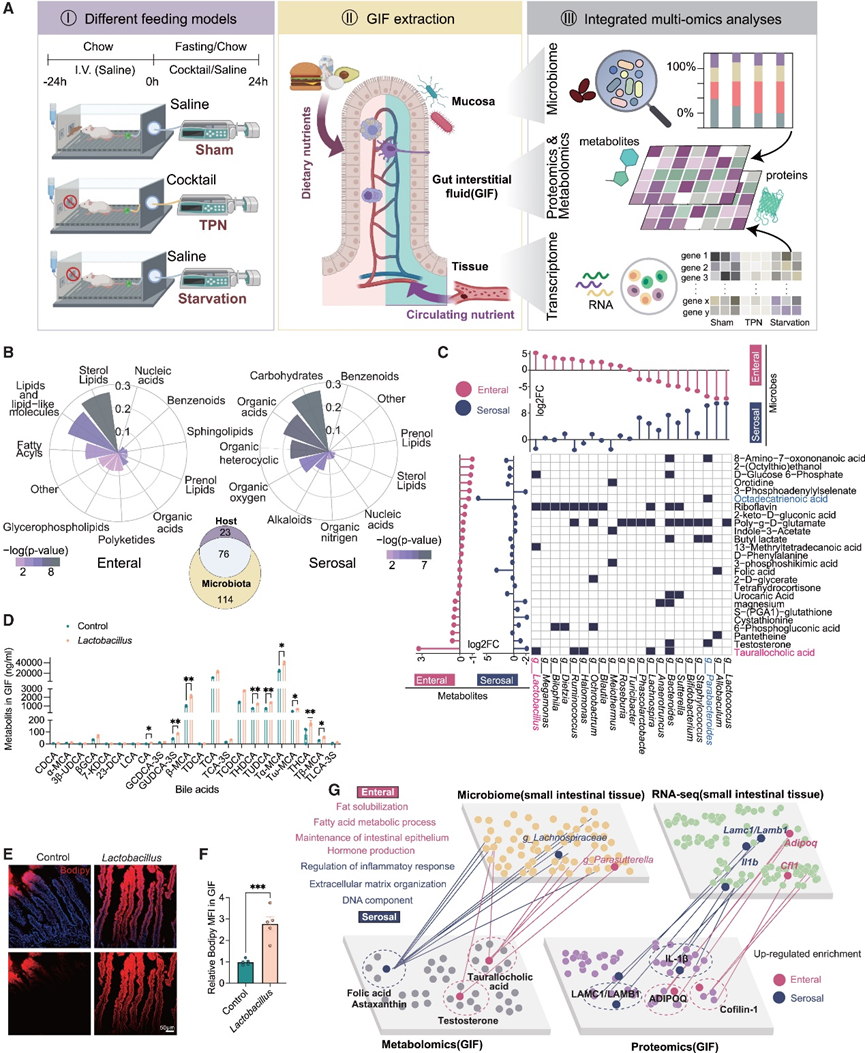
图1. 小肠双前端营养供应系统。
(a) 实验设计。(b) 柱状极坐标图显示了 GIF 非靶向代谢组中肠内和浆膜差异代谢物的分类富集分析,维恩图显示了三组非靶向代谢组数据中所有代谢物的物种来源预测。(c) 利用 MIMOSA 模型预测细菌菌株对代谢物产生或降解的贡献。 (d) 定量代谢组学分析。(e-f) 小肠脂肪酸吸收的代表性共聚焦结果。(g) 多组学调控网络图。
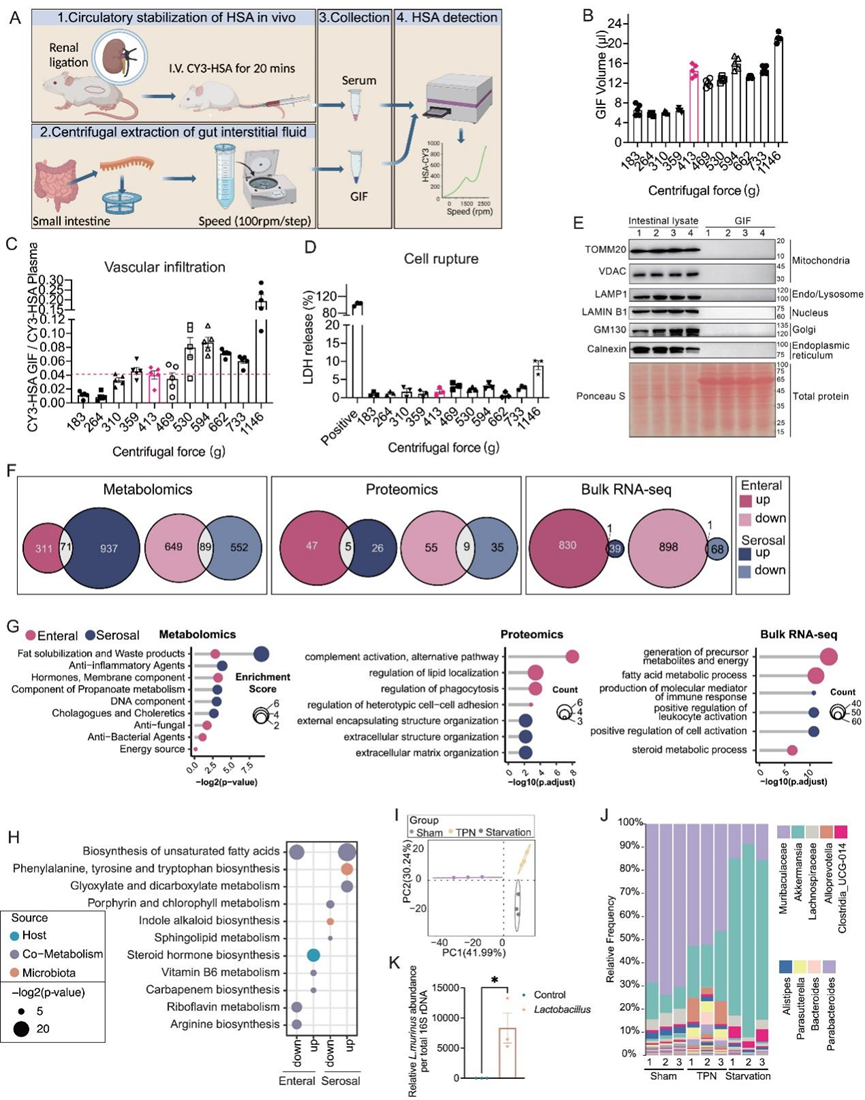
图S2. 小肠中的 GIF 提取和检测。
(a) 小肠中的 GIF 提取和检测。(b-d) GIF 体积 (B)、GIF 中 HSA 浓度与血浆中 HSA 浓度之比,以及 LDH 释放变化统计值随离心转速增加而变化。(e) 免疫印迹分析。(f) GIF 非靶向代谢组、定量蛋白质组和RNA-seq数据中差异表达的肠内和浆膜分子的重叠显示。 (g) 对各种组学数据集(包括代谢组学、蛋白质组学和批量 RNA 测序)中的差异表达成分进行了富集分析。(h) 差异代谢物的富集通路。(i) PCA证明欧几里得距离的组间分布和差异。(J) 基于物种丰度表在属级别对组内样本之间的物种组成进行分析。(K)小肠中乳酸杆菌的 16S 定量实时 PCR 定量结果。
02
肠浆膜供给系统具有营养物质吸收的时空特征
上皮细胞的顶端-基底外侧极性使小肠上皮能够通过两个相反的细胞膜区域获取和运输营养物质,这促使他们研究肠道和浆膜营养物质进入小肠的动态过程。在包括碳水化合物、脂质和氨基酸在内的多种常量营养素中,以葡萄糖、胆固醇和谷氨酰胺为代表,研究它们的肠道吸收情况。为了评估体内这些过程,他们通过管饲(肠内侧)或静脉注射(浆膜侧)给小鼠施用荧光标记的 2-NBDG、Cy3-胆固醇和 Cy5-谷氨酰胺类似物,并分别检测血清和 GIF 样本中荧光信号的首次出现时间和强度(图 2 A)。此外,他们使用超快光学透明化方法 (FOCM) 对小肠组织进行成像,以原位观察吸收过程中各种营养物质沿绒毛的空间分布(图 2 A)。管饲处理时,5 分钟后在 GIF 样品中检测到明显的荧光信号,10 分钟后略有下降(图 2 B)。相应地,直到管饲 10 分钟后血清中才出现荧光信号(图 2 B),表明从肠内吸收的营养物质通过上皮和固有层进入体循环。为了直观地了解这些动态,他们通过荧光显微镜观察了荧光标记营养物质在绒毛内的时空分布。在肠内吸收葡萄糖的过程中,2-NBDG 的荧光信号在管饲后 3 分钟主要集中在上皮层,然后在 5 分钟时扩散到固有层区域(图 2 C)。胆固醇和谷氨酰胺进入绒毛的吸收稍晚于葡萄糖(图 2 C)。值得注意的是,2-NBDG 的吸收几乎均匀分布在绒毛上,但胆固醇的吸收主要发生在绒毛尖端(图 2C-D),这与之前的研究结果一致,即胆固醇和脂质吸收机制向绒毛尖端分区,以及脂质管饲后不久绒毛尖端的乳糜微粒密度更高。令人惊讶的是,虽然绒毛上部的吸收总体上更多,但吸收的谷氨酰胺似乎特别积累在某些特定的上皮细胞中(图2C-D)。FOCM 结合三维 (3D) 扫描和从顶端视点重建也可视化了这些吸收特性的类似结果(图 2G)。为了阐明谷氨酰胺在哪些细胞类型中积累,他们检测了各种上皮细胞类型的标志物,并发现谷氨酰胺主要在杯状细胞和丛状细胞中优先积累(图 2H)。当这些营养物质通过浆膜侧静脉注射到小肠时,他们分别在注射后 5 和 7 分钟在血清和 GIF 样本中检测到它们显著的荧光信号(图 2E)。随后由于全身消耗,血清中的信号迅速下降,GIF 样本中的信号在注射后 10 分钟也下降(图 2E),这意味着它们可由小肠局部细胞吸收。与肠内营养侧不同,浆膜侧对这些营养物质的吸收模式相似,在绒毛上没有明显的区域或细胞类型特异性(图 2 F)。总之,两个前端营养供应侧的营养吸收模式存在明显差异。
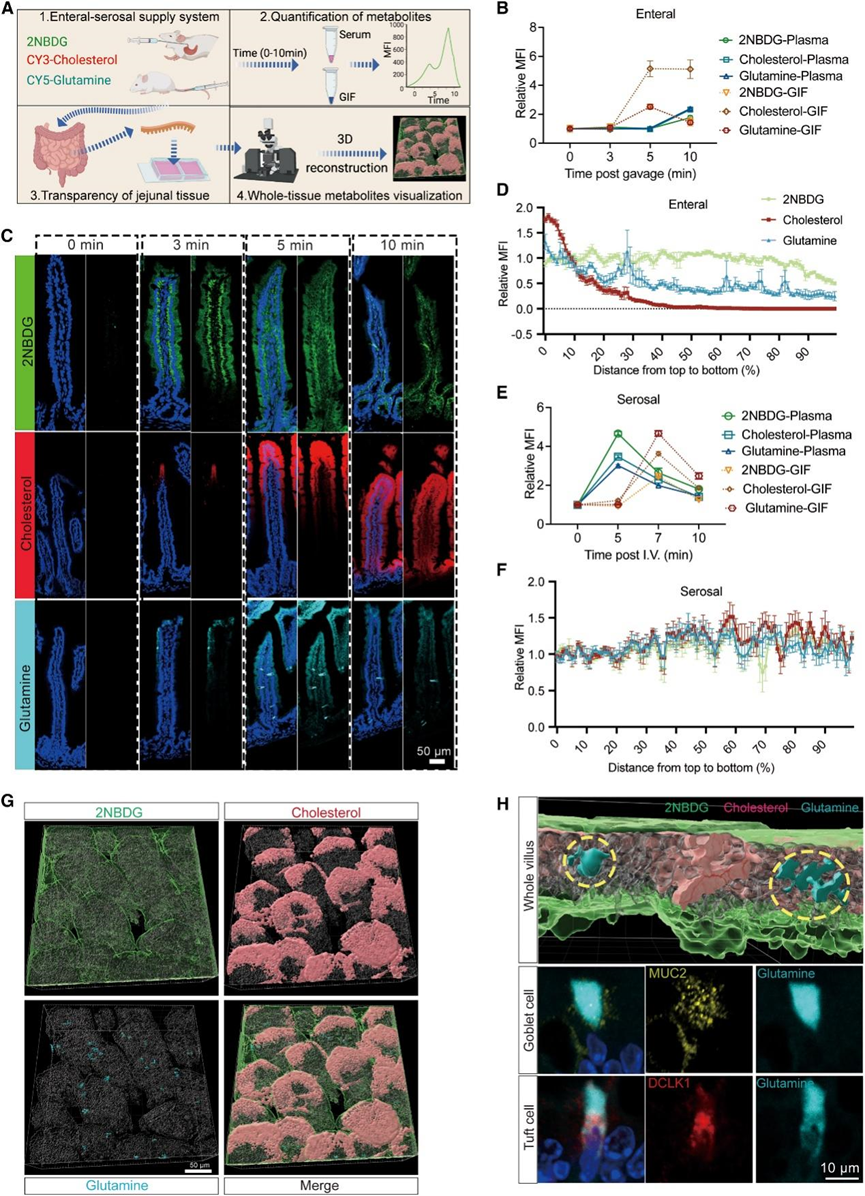
图2. 肠内浆膜供给系统具有营养物质吸收的时空特征。
(a) 吸收率示意图和肠道内营养物质双向供应的直观表示。(b) 随时间推移管饲GIF和血浆中三种营养素的MFI统计。(c) 代表性免疫荧光图显示口服谷氨酰胺、胆固醇和葡萄糖随时间的分布。(d) MFI 统计数据描绘了沿着从绒毛顶部到底部的梯度进行的肠内营养输送。(e) 随时间推移静脉注射 GIF 和血浆中三种营养素的 MFI 统计数据。(f) MFI 统计数据描绘了三种营养物质沿着绒毛从顶部到底部的梯度向浆膜输送的情况。(g) 口服 3 种营养物质 5 分钟后整个小肠绒毛的代表性三维成像。(h) 代表性免疫荧光图像。
03
空间表征绒毛内的高分辨率代谢异质性和功能特化
小肠的生理学由其功能和代谢的异质性和特化所决定。营养吸收的差异赋予小肠显著的异质性代谢环境,以支持不同细胞类型的特定功能。接下来,他们应用了基质辅助激光解吸/电离-MSI (MALDI-MSI) 方法,该方法能够以接近单细胞分辨率同时对代谢物进行空间定位和半定量,用于空肠组织的原位代谢分析。含将有杯状细胞的区域标记为代谢物分析点,相邻的非杯状上皮细胞作为对照(图 3 A)。与上述发现一致(图 2G-H),在假手术组中,杯状细胞与邻近的肠细胞相比表现出更高的谷氨酰胺积累(图 3 B),而在 TPN 组中这种积累显著减少,在饥饿组中进一步减少(图 3 C)。谷氨酰胺在细胞内吸收后,为碳利用和氮代谢通路供能量,包括三羧酸 (TCA) 循环、核苷酸合成和谷胱甘肽 (GSH) 合成。值得注意的是,与假手术组相比,TPN 组的杯状细胞中一系列参与关键抗氧化因子 GSH 合成的代谢物(包括谷氨酸、还原型 GSH 和半胱氨酰甘氨酸)的水平同时降低。杯状细胞需要抵消由于高强度的黏蛋白合成和分泌而产生的活性氧 (ROS)。为了探索肠内谷氨酰胺摄取在黏液产生中的作用,他们给小鼠喂养了4周的无谷氨酰胺 (Gln−) 饮食。当用 PAS/AB 和 Carnoy 固定剂或抗 Muc2 抗体对黏蛋白进行染色时,NC 组小肠绒毛间隙充满黏液,而 Gln− 组的这些信号大大减弱(图 3D-E)。NC组的微球由绒毛外的粘液层阻挡,而Gln−组的微球直接穿过绒毛间隙,与绒毛表面直接接触(图3F-G)。小肠粘液层疏松的性质为共生菌的定植提供了良好的环境,同时阻止了致病菌直接侵入上皮细胞。使用凝集素荆豆凝集素 I (UEA-I) 对粘液进行染色,使用 EUB338(通用 16S rRNA 探针)对肠道共生细菌进行染色,再次证实了 Gln− 组小鼠绒毛间隙中没有粘液(图 3 H),这反过来导致生活在疏松粘液层而不是管腔空间中的细菌数量显著减少(图 3 I-J)。值得注意的是,在 Gln− 组中,一些细菌直接粘附在上皮表面,而没有隔开(图 3 H)。当小鼠感染病原体C. rodentium (Cr) 时,他们在管饲感染的第 4 天观察到 Gln− 组的肠道Cr负荷明显增加,尤其是在小肠中(图3K-L)。总之,这些结果强调了饮食中谷氨酰胺的吸收在促进杯状细胞产生粘液方面发挥的关键作用。
接下来,他们尝试分析不同喂养模式对区域特定代谢特征的影响。基于 H&E 染色,将空肠组织分为四个不同的亚区域:隐窝、固有层、上皮和管腔区域(图 3 M)。两个营养供应侧在所有亚区域产生了大量差异富集代谢物 (DEM)(图 3 N)。随后对上调的 DEM 进行富集分析表明,与脂质代谢相关的通路在所有亚区域中均响应肠内营养物质而显著富集(图 3 O)。他们在所有 MSI 数据点中确定了具有不同代谢特征的七个聚类(聚类 0-6),并且三个喂养组在这些聚类的空间分布上表现出明显差异(图 3 P)。他们根据 H&E 得出的解剖信息将 7 个聚类与其空间坐标对齐,并可视化了不同聚类中特征代谢物的分布。在 TPN 和饥饿组中,聚类 1 的相对比例降低(图 3 P-Q)。两种胆汁酸,牛磺胆酸和磺基胆酸甘氨酸,在聚类1 中最为丰富(图 3 R)。聚类1 主要分布在绒毛的顶端上皮部分(图 3 P-T),这也是脂质吸收的主要部位(图 2 C-D),表明聚类 1 亚区域对肠内脂质的有效吸收具有特殊的贡献。相比之下,聚类2 则特别局限于隐窝中(图 3 P-S)。多不饱和缩醛磷脂,如 PE(P-40:3)、PE(P-38:3) 和 PE(P-40:5),在聚类 2 中高度富集(图 3 R-T),并且在 TPN 和饥饿时聚类 2 的相对比例增加(图 3 P-Q)。缩醛磷脂是一种甘油磷脂,是抗氧化应激的强效抗氧化因子,它们在隐窝区域的积累可能与保护干细胞微环境免受过度氧化应激有关。在 TPN 和饥饿条件下,聚类 6 的相对比例增加(图 3 P-Q)。他们发现溶血磷脂,尤其是 LysoPA(18:0)、LysoPE(18:0)、LysoPE(20:4) 和 LysoPE(22:6),在聚类 6 中高度富集(图 3 R-T),可能分布在固有层中(图 3 P-S)。溶血磷脂是参与血管发育和内皮细胞粘附的重要调节因子,这可能反映了由于肠内营养物质缺乏,固有层对血管生成的需求增加,以增强来自浆膜侧的营养供应。
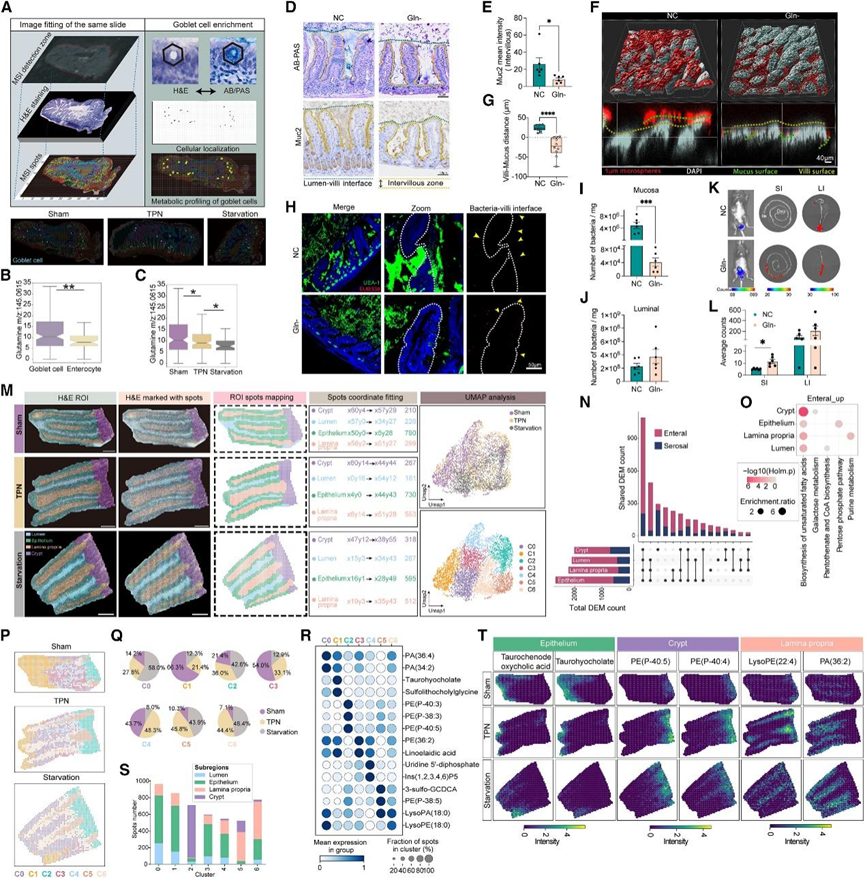
图3. 绒毛内高分辨率代谢异质性和功能特化的空间表征。
(a) MALDI-MSI 检测杯状细胞原位代谢特征示意图。(b) 统计结果表明,假手术组的杯状细胞与肠细胞相比具有更高的谷氨酰胺丰富度。(c) 统计结果显示三组杯状细胞中的谷氨酰胺含量。(d-e) 小肠 AB/PAS 和 MUC2 染色的代表性图像和数据统计。(f-g) 微球装载和小肠 3D 重建的代表性图像和数据统计。(h) 代表性FISH结合免疫荧光染色结果。(i-J) 对肠粘膜和肠腔中的细菌进行 16S qPCR 定量分析。(K-L) 小肠和结肠的原位Cr 荧光强度。(M) 使用 MALDI-MSI 表征双向营养供应系统下空肠不同亚区内提取代谢物的概况的策略。(N) 每组中定量的肠内富集代谢物和浆膜富集代谢物的数量,以及它们在不同组之间的共同出现情况。(O) 各亚区肠内富集代谢物的富集反应组通路生物过程。(P) Visium 阵列斑点通过基于图的聚类算法在三个组之间着色。(Q) 饼图显示了不同聚类中每个样本的斑点比例。(R) 点图显示每个聚类中标记代谢物的强度水平。(S) 堆积条形图显示不同聚类内每个子区域中的斑点数量。(T) 三组代谢物的 MS 图像。
04
在单细胞分辨率下表征双前端营养供应系统
接下来,他们进行了单细胞转录组分析(scRNA-seq),在三种条件下获得了 41632 个高质量细胞,并以无监督的方式汇总和聚类了它们的转录组谱。基于之前报道的标记基因,他们注释了 18 种已知细胞类型,进一步大致分为 5 类:上皮细胞、淋巴细胞、髓细胞、基质细胞和干细胞(图4 A)。三种喂养模式对各种细胞类型比例的影响截然不同(图 4 B),表明不同细胞类型对营养供应状态的反应存在异质性。每种细胞类型的差异表达基因 (DEG) 分析表明,与浆膜侧相比,来自肠内侧的营养物质总体上对多种细胞类型的影响更大,其中肠细胞是受影响最大的细胞类型(图 4C)。使用RNA-seq数据作为参考,他们定义了“肠内评分”和“浆膜评分”,以反映每种营养供应侧的不同影响,然后使用 scRNA-seq数据可视化每种细胞类型的这些评分(图 4D)。主要的上皮细胞亚型肠内评分最高(图 4D),表明它们在响应肠内营养供应方面发挥着重要作用。其他细胞类型虽然只占一小部分,但也显示出不同的肠内/浆膜评分富集模式。值得注意的是,与它们优先从肠内侧吸收谷氨酰胺一致,杯状细胞和丛状细胞显示出更高的肠内评分(图 4D)。相比之下,壁细胞和内皮细胞显示出更高的浆膜评分(图4D),这可能反映了它们作为血管组成部分的作用,促进营养物质从浆膜侧运输。此外,富集的反应组通路分析显示,肠侧诱导的肠细胞DEG在与膳食有机分子氧化相关的通路中显著富集(例如,“生物氧化”和“TCA循环和呼吸电子传递”一词)(图4E)。与这些反映功能性适应的通路相比,浆膜侧似乎为细胞周期的调节提供了更重要的支持(图4F)。
营养转运蛋白对于营养吸收和细胞类型特异性功能至关重要。转运蛋白基因在响应肠内供应侧和浆膜供应侧时表现出不同的表达谱。例如,Fabp2、Npc1l1、Abcc2、Slc28a1、Slc6a20a、Slc46a1、Rbp2和Cubn的表达总体上在肠内供应侧有所增加(图 4 G)。令人惊讶的是,在响应肠内营养供应时,顶端膜定位谷氨酰胺转运蛋白Slc6a19 , 在杯状细胞中的表达水平大大增加。与这些分析一致,透射电子显微镜(TEM)分析显示,与假手术组相比,TPN和饥饿组的肠上皮细胞顶端表面微绒毛密度降低,微绒毛长度总体减少,宽度增加(图4H-I),反映了刷状缘对肠内侧营养吸收需求减少的形态适应。
最后,为了更全面地了解不同营养供应条件下各种细胞类型之间的协同适应,他们使用综合 GO 网络分析方法分析了主要细胞群的 DEG。网络中的每个圆圈节点(或模块)代表一组密切相关的特定通路,在一种或多种细胞类型中富集(图4 J)。响应来自肠内营养输入,富集的通路模块紧密互连并集中到反映小肠主要任务的几个关键功能过程,包括营养吸收、氧化还原稳态、免疫调节和宿主-微生物组相互作用(图 4 J)。相比之下,浆膜供应侧富集了相对较少的通路模块,这些模块主要代表对上皮细胞的必需代谢支持以及对免疫细胞和血管生成的调节。因此,肠内营养供应对小肠生理学中各种细胞类型之间的协同作用具有更深远的影响。
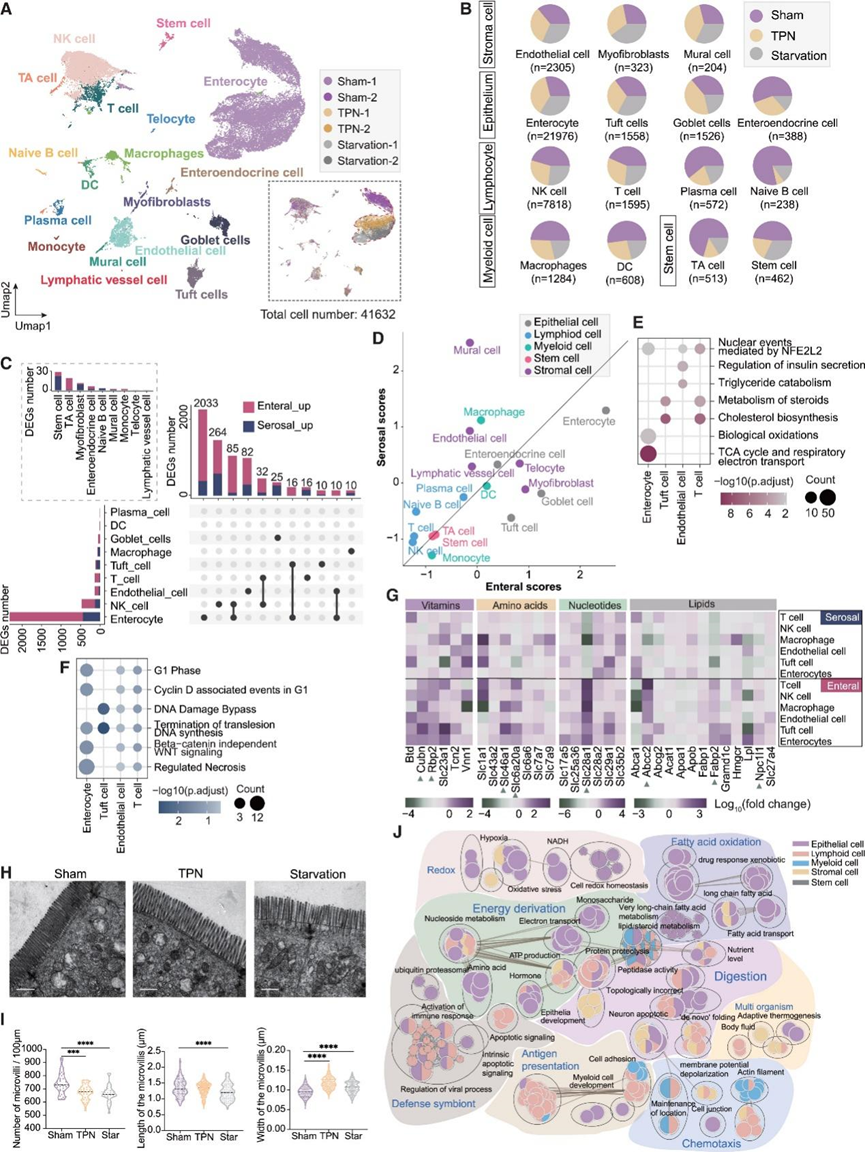
图4. 在单细胞分辨率下表征双前端营养供应系统。
(a) UMAP 可视化假手术组、TPN 组和饥饿组中来自两个批次的 41632 个细胞,并标注了主要细胞类型和样本。(b) 各批次中不同细胞类型的细胞百分比分布。(c) 每种细胞类型中量化的肠特异性基因和浆膜特异性基因的数量,以及它们在不同细胞类型中的共同出现情况。(d) 肠道特异性基因集和浆膜特异性基因集定义的肠道评分和浆膜评分。(e-f) 每种细胞类型中肠特异性基因和浆膜特异性基因的富集反应组通路生物过程。 (g)热图显示所选营养转运相关基因在 6 种细胞类型的肠道和浆膜中的表达。(h) 热图显示所选营养转运相关基因在 6 种细胞类型的肠道和浆膜中的表达。(i) 定量100 μm 上皮细胞周长上微绒毛的数量。(J) 用肠特异性基因描绘跨不同细胞类型的生物过程的网络。
05
两个营养供应侧通过真菌代谢物轴差异地配置上皮细胞的空间分区功能并校准屏障完整性
小肠上皮是一种复杂的组织,需要沿绒毛轴精确调节肠细胞功能的空间分区。当他们分析scRNA-seq 数据中的肠细胞群时,假手术、TPN 和饥饿组细胞的转录组有明显区别(图 5 A)。然后,他们用了之前研究中展示肠细胞功能分区的参考数据集,并在本研究的数据中确定了六个具有相似基因分区谱的肠细胞聚类,从绒毛底部(区域 1 和 2)、中部(区域 3 和 4)到顶部(区域 5 和 6)排序(图 5 A)。对底部、中部和顶部肠细胞中 DEG 的分析表明,与屏障功能相关的通路,例如“细胞连接组装”和“细胞-细胞连接组织”,在肠内营养供应后在绒毛顶部的肠细胞中显著富集,但在浆膜供应侧则呈负向富集(图 5B),这表明这种有效的营养吸收区域在不同的营养供应条件下也需要动态调节其屏障功能。为了探索这种调节背后的潜在代谢机制,他们分析了 GIF 代谢组学数据,发现一种具有强肌动蛋白细胞骨架破坏活性的细胞通透性真菌代谢物细胞松弛素-H (CyH) 在 GIF 样本中因肠内营养供应而略有降低,但因浆膜供应而急剧增加(图 5C)。因此,他们应用内部转录间隔区测序 (ITS-seq) 来表征空肠真菌微生物群 (mycobiota)。与假手术组相比,TPN 和饥饿导致菌群组成发生显著变化,真菌多样性显著降低。他们在假手术组中鉴定出 236 种真菌,而在 TPN 组和饥饿组中分别发现了 71 种和 81 种。通过分析各组间真菌富集的差异, Alternaria tenuissima(一种具有产生细胞松弛素潜在能力的真菌)在 TPN 组中富集。为了评估 CyH 与小肠屏障功能之间的相关性,他们应用了靶向定量代谢组学技术分析来检测 GIF 样本中的 CyH 水平。一致的是,经过 24 小时的 TPN 处理后,GIF 中的 CyH 含量显著增加(图 5 D),小肠通透性也增加(图 5E)。有趣的是,葡聚糖硫酸钠 (DSS) 引起的屏障功能损伤大大增加了小肠通透性,而 CyH 的数量没有变化(图 5D-E),这表明 TPN 诱导的 CyH 积累可能是肠道屏障损伤的上游事件。为了验证这一假设,他们使用了抗真菌药物氟康唑 (AFX),发现 TPN 诱导的 CyH 积累和屏障功能损伤均得到恢复(图 5D-E),这表明真菌代谢物在 TPN 调节屏障功能中起着因果作用。抗生素 Augmentin (ABX) 处理或饥饿也导致小肠通透性增加,但 GIF 中的 CyH 没有变化(图 5D-E),可能是因为肠道屏障功能中涉及的其他细菌微生物群和免疫调节机制。细菌和真菌之间的竞争在肠道稳态中发挥重要作用,抗生素处理后真菌负担急剧增加。与单独使用TPN相比,TPN + ABX 处理导致 GIF 中 CyH 的额外积累以及小肠通透性相应增加(图5D-G),免疫荧光染色也验证类这一结果(图 5H-I)。他们给小鼠注射 CyH 24 小时,并两次管饲 200 μL CyH(150 ng/μL)或在 AFX 处理后用 3 × 108 CFU 的Alternaria tenuissima管饲(图 5 J)。定量质谱分析表明,这些处理使 GIF 样品中的 CyH 浓度达到约 120 ng/μL(与 TPN 处理的 GIF 样品中的浓度相当)(图 5 K),从而诱导类似于 TPN 诱导的屏障功能障碍,包括紧密连接结构的开放和肠道通透性增加(图 5 L-N)。
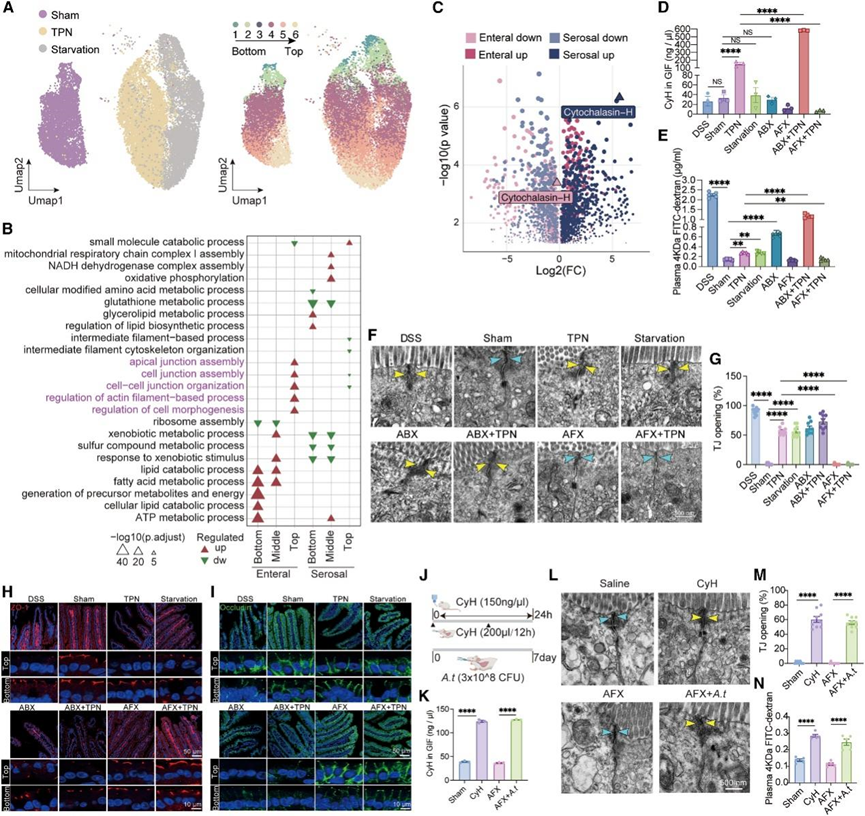
图5. 两个营养供应侧以不同的方式配置上皮细胞的空间分区功能,并通过真菌代谢物影响屏障完整性。
(A) UMAP 图显示肠细胞按组聚类结果和预测的空间分布。(B) GO 富集结果。(c) 火山图显示受肠道和浆膜方向营养供应的影响, GIF 非靶向代谢组中代谢物丰度的变化,其中细胞松弛素-H 在肠道中下调,而在浆膜侧显著增加。(d) GIF 中细胞松弛素-H 的绝对水平。(e) 通过血清中异硫氰酸荧光素 (FITC)-葡聚糖含量测量肠道通透性。(f) 代表性透射电子显微照片显示小肠上皮细胞之间的紧密连接。(g) (F) 中紧密连接 (TJ) 开放的统计结果。(h-i) 代表性免疫荧光共聚焦结果。(J) CyH生理浓度对肠上皮屏障影响的实验示意图。(K) 四组小鼠GIF中CyH含量的定量质谱检测统计。(L-M) 小肠上皮细胞间紧密连接的代表性透射电子显微照片和统计结果。 (N) 通过血清中 FITC-葡聚糖含量测量肠道通透性。
06
特定时间范围内肠内营养物质的缺乏会重塑空间组织的吸收功能
此外,他们关注了肠细胞营养吸收的空间分区功能。通过评估绒毛顶端区域的标志物蛋白 SLC5A1,他们发现 TPN 和饥饿总体上增加了绒毛轴线上的 SLC5A1 蛋白水平,表明肠细胞分区因肠内营养缺乏而发生重塑。为了确定这种重塑是否会导致绒毛轴线上营养吸收的适应性,他们用 2-NBDG、Cy3-胆固醇和 Cy5-谷氨酰胺混合物管饲假手术组、TPN 组和饥饿组小鼠 5 分钟,并评估它们的小肠吸收情况。假手术组的胆固醇吸收主要发生在绒毛顶端,而 TPN 或饥饿处理不仅大大增强了这种吸收,而且还将其扩展到绒毛中部区域。此外,他们发现 TPN 组和饥饿组的 GIF 样本中的总胆固醇 (TC) 和甘油三酯 (TG) 水平升高。同样,谷氨酰胺吸收也整体沿绒毛轴增强,而 2-NBDG 吸收则显示出相对有限的变化,尤其是在 TPN 组,这表明肠细胞吸收的这种适应性可能与营养类型有关。接下来,他们探究了肠内营养剥夺如何诱导小肠营养吸收的动态适应性。经过 24 小时正常喂养适应期后,从时间 (ZT)0 开始(在 ZT0 时亮灯,在 ZT12 时灭灯)给予不同时长(4、8、12、20 或 24 小时)的 TPN,然后管饲 2-NBDG、Cy3-胆固醇和 Cy5-谷氨酰胺混合物 5 分钟,随后评估它们在小肠的吸收情况(图 6 A)。采用了二维和三维图像分析,结果显示,在接受 TPN 的小鼠的绒毛中,胆固醇和谷氨酰胺的吸收在 16 小时内达到峰值,而 2-NBDG 的摄取变化很小(图 6 B-C)。由于16小时内(ZT0-ZT16)肠内营养物质缺乏而导致的营养物质过度吸收,有点类似于人类不吃早餐的现象,这种现象在西方青少年和成年人中比较常见,是一种有损健康的生活方式,会导致代谢不良,包括肥胖和心血管疾病。
为了研究模拟不吃早餐 (BSF) 的喂养模式的相对长期影响,他们设计了一种喂养装置,可以通过无线方式自动将每日食物摄入时间限制在 ZT16-ZT24 的一致窗口内,而对照组的喂养窗口设置为 ZT12–ZT24 (图 6 D)。10 天后,与对照组相比,BSF 组小鼠体重略有增加,但食物摄入量保持不变。他们进一步对空肠上皮细胞进行了分选,发现关键胆固醇转运蛋白基因Npc1l1和脂肪酸转运蛋白基因Fabp2的表达水平在 BSF 反应中显著增加(图 6 E)。有趣的是,模仿不吃午餐(LSF)(进食窗口:ZT12-ZT16 和 ZT20-ZT24)或模仿不吃晚餐(DSF)(进食窗口:ZT12-ZT20)的进食模式对Npc1l1上调的影响逐渐减弱(图 6 F),表明该 BSF 窗口对营养吸收的适应性有更大的影响。为了深入研究 BSF 模式特异性背后的分子机制,他们进行了转座酶可及染色质高通量测序 (ATAC-seq) 和RNA-seq,以分析对照组、BSF、LSF 和 DSF 组的整体染色质可及性和转录景观。ATAC-seq 和 RNA-seq 数据的 PCA 显示,所有三个无序进食组在 RNA-seq 中均与对照组有显著差异(图 6 G)。在 ATAC-seq 中,BSF 组与其他两组(LSF 和 DSF)的差异更为显著(图 6 G)。进一步深入研究开放染色质区域 (OCR) 的变化表明,与 LSF 和 DSF 组相比,BSF 组染色质可及性方面特异性峰数量总体上显著增加(图 6 H)。通过分析转录因子 (TF) 结合基序,发现由脂肪酸激活并参与脂质代谢的关键 TF,包括过氧化物酶体增殖激活受体 α (PPARα) 及其伴侣类视黄酸 x 受体 (RXR),在 BSF 特异性 OCR 中富集(图 6 I)。令人惊讶的是,在Npc1l1转录起始位点上游 10 kb 区域内发现了 8 个 PPARα 基序结合位点(位点 1-8) (图 6 J)。 ATAC-seq 数据显示,结合位点 1–3 位于染色质可及性较高的区域(图 6 K),这意味着它们可能参与Npc1l1的转录调控PPARα 诱导的结合。为了验证这一点,他们对分选的小肠上皮细胞进行了染色质免疫沉淀 (ChIP) 试验,发现与其他位点相比,BSF 诱导的 PPARα 结合在位点 1(-2,331 至 -2,345 bp)显著增加(图 6 L)。相比之下,在 LSF 和 DSF 组中未发现这种 PPARα 结合诱导(图 6 M)。
他们最后提出的一个问题是:这种 BSF 诱导的适应是否具有类似记忆的特性?
为了解决这个问题,他们在 BSF 或对照喂养模式下给小鼠喂食 NC 2 周,然后以对照模式喂养所有小鼠另外 2 周,最后在 BSF 或对照喂养模式下将 NC 改为高胆固醇饮食 (HCD) 一周(图 6 N)。通过测量体重、血清 TC 和 TG 水平以及Npc1l1表达,发现最初以 BSF 模式喂养的小鼠即使在停止 BSF 模式后仍保持脂质过度吸收(图 6 O-R),这表明在特定时间窗口内一段时间的无序喂养可能会导致小肠营养吸收的持续改变。这种类似记忆的效果的关键机制之一可能是重塑染色质的可及性以维持开放的染色质构象。
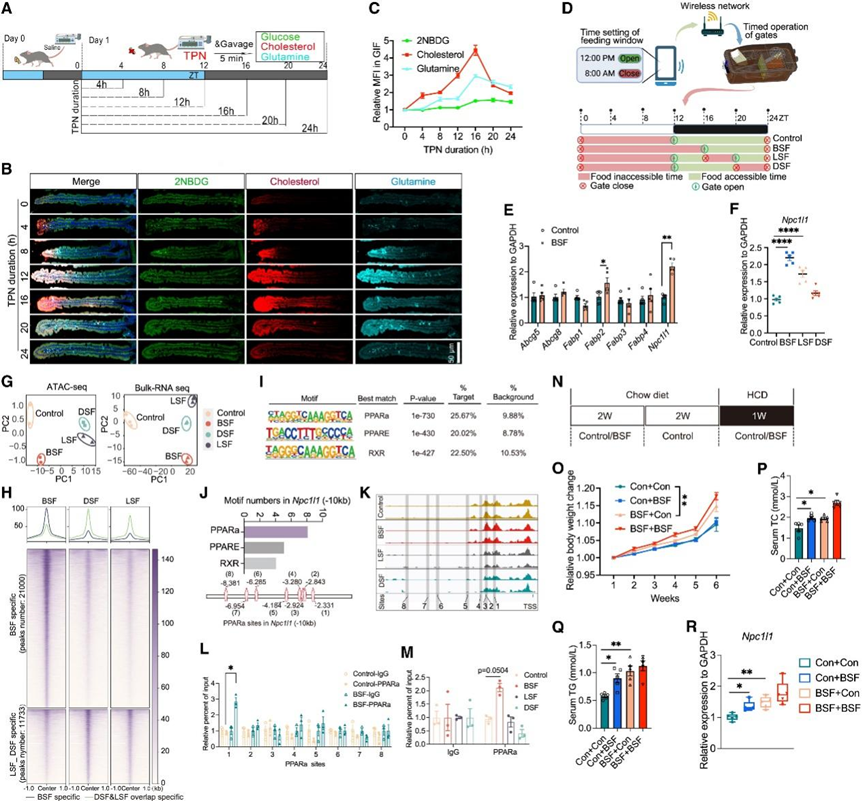
图6. 特定时间范围内肠内营养物质缺乏会重塑空间组织的吸收功能,并干扰小肠对脂质的吸收。
(a) 小鼠接受不同时长 TPN 的实验示意图。(b) 代表性荧光共聚焦结果显示三种营养素的肠道吸收随 TPN 处理持续时间的不同而存在差异。(c) GIF 小鼠中葡萄糖、胆固醇和谷氨酰胺的 MFI 统计数据。 (d) 可无线自动控制小鼠喂食窗口的喂食系统装置示意图。(e) RT-qPCR 检测评估 10 天后对照组和 BSF 组小鼠分选获得的空肠上皮细胞中与脂质和固醇代谢相关的基因的表达。(f) 通过 RT-qPCR 测量空肠上皮细胞中Npc1l1基因的相对表达。(g) 主成分分析 (PCA) 结果。(h) BSF、DSF 和 LSF 组之间空肠上皮细胞 ATAC-seq 结果中按 K 均值分组的差异开放染色质峰的全基因组分布。(i) 已知转录因子基序及其相应转录因子在 (H) 中 BSF 特异性峰中的富集情况。(J) 使用 JASPAR 基序数据库和 Npc1l1 中约 -10 kb 对中的 PPARα 位点识别了 Npc1l1 中约-10 千碱基对中的基序。(K) Npc1l1中约 -10 kb 对中已识别的 PPARα 位点的对齐情况。(L) 通过 ChIP 分析确定的 BSF 和对照组中每个位点的 PPARα 相对结合亲和力。(M) 通过 ChIP 分析确定 4 组中位点 1 处 PPARα 的相对结合亲和力。(N) BSF 诱导小鼠类似记忆的超吸收状态示意图。(O) 小鼠体重随时间的变化统计。(P-Q) 5 周结束时小鼠血清中 TC和 TG水平的统计。(R) RT-qPCR 检测小鼠接受不同处理后空肠上皮细胞中Npc1l1基因的相对表达。
07
不吃早餐等混乱的进食模式会导致全身代谢稳态受损
在美国和日本人群的队列研究中,不吃早餐与心血管疾病发病率增加有关,但其潜在机制仍不清楚。鉴于过量脂质的吸收和积累在动脉粥样硬化等心血管疾病的病理学中起着至关重要的作用,他们在 BSF 中或对照喂养模式下给易患动脉粥样硬化的 Apo-E 缺陷 (Apoe−/−) 小鼠喂养 HCD,持续 10 周(图 7 A)。Npc1l1主要定位于吸收性肠细胞的刷状缘膜,而膳食胆固醇会诱导 Npc1l1 的内吞作用,从而促进肠细胞对胆固醇的吸收。令人惊讶的是,BSF 导致 Npc1l1 的上皮表达及其从细胞表面向细胞质区域的内吞作用急剧增加(图7 B),表明在 BSF 条件下小肠中胆固醇的吸收增强。在系统水平上,虽然两组的食物摄入量相似(图7 C),但 BSF 导致血清 TG、TC 和低密度脂蛋白胆固醇 (LDL-C) 水平升高,同时降低粪便排泄胆固醇水平(图 7 D-E)。他们给小鼠施用Ezetimibe(Npc1l1 的特异性抑制剂),发现 BSF 诱导的 NPC1L1 表达和内吞作用增加(图 7 B)、全身胆固醇水平增加(图 7 D)和排泄胆固醇减少(图 7 E)均得到恢复。最后他们检测了动脉粥样硬化病变的形成,发现BSF导致动脉粥样硬化病变面积显著增加,并且这些病变中积累了更多的脂质和胶原蛋白,而Ezetimibe仍然具有阻止这些病理改变的能力(图7F-I)。
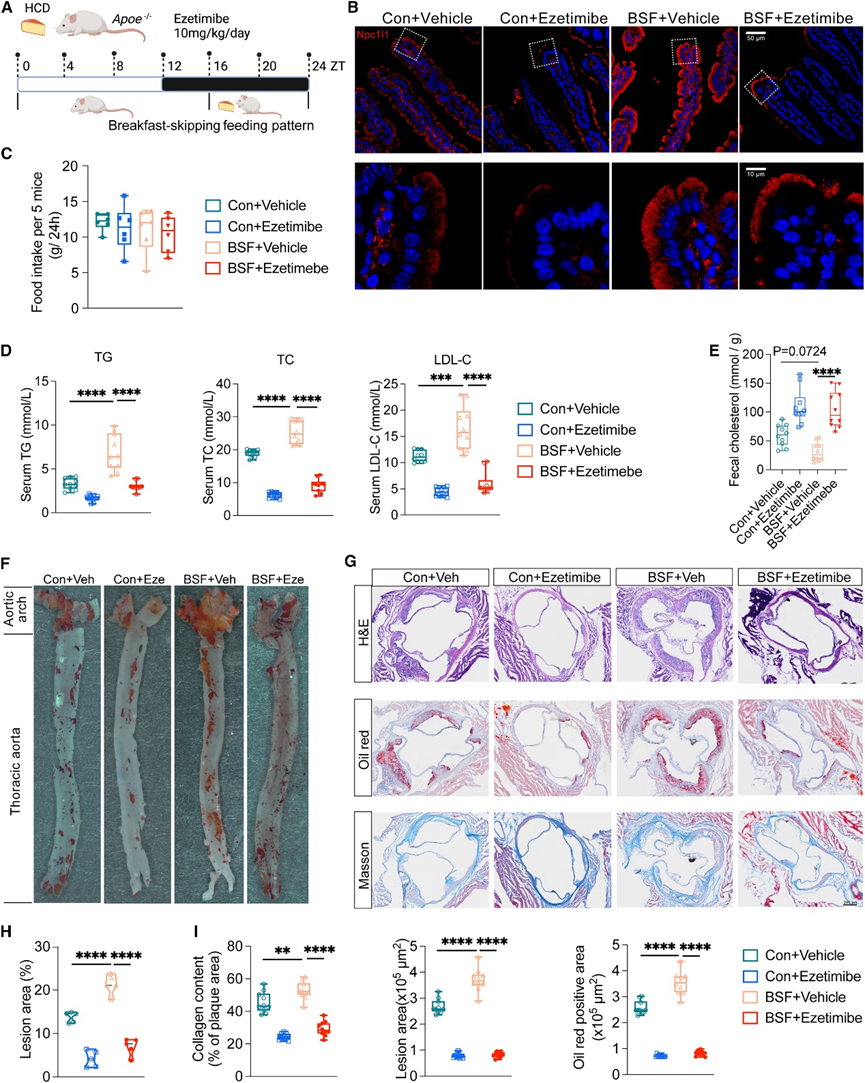
图7. 不吃早餐等混乱的饮食模式导致全身代谢稳态受损。
(a) 接受高胆固醇饮食和 BSF 的Apoe −/−小鼠动脉粥样硬化实验模型示意图。(b) 代表性免疫荧光共聚焦图像。(c) 处死前最后一周测量的每 5 只小鼠 24 小时食物摄入量。(d) 血清中 TC、TG 和 LDL-C 的定量。(e) 血清中 TC、TG 和 LDL-C 的定量。(f) 通过用油红 O 染色来可视化整个主动脉的脂质含量。(g) 各组代表性主动脉瓣 H&E、Masson 和油红 O 染色结果。(h) 统计整个主动脉中油红 O 阳性斑块面积的比例。(i) 主动脉瓣病变面积、胶原面积比和油红 O 阳性面积。
+ + + + + + + + + + +
结 论
本项研究生成了小肠双前端营养供应环境的全面多组学图谱,利用体内追踪和空间代谢组学技术,分析了营养吸收的时空动态和细胞类型趋向性以及绒毛内特定区域代谢异质性。具体而言,肠内侧的谷氨酰胺为杯状细胞提供能量以支持粘液产生,而浆膜侧通过调控真菌代谢物来影响上皮屏障。混乱的进食模式类似于人类不吃早餐的生活方式,通过诱导上皮对脂质吸收的记忆来增加代谢疾病的风险。这项研究增进了对小肠如何在其独特的营养环境中进行时空调控的理解。
+ + + + +



 English
English


