文献解读|Sci Adv(13.6):将志愿者置于微重力条件下超过21天,会导致T细胞基因表达和适应性的变化
✦ +
+
论文ID
原名:Exposure of volunteers to microgravity by dry immersion bed over 21 days results in gene expression changes and adaptation of T cells
译名:将志愿者置于微重力条件下超过21天,会导致T细胞基因表达和适应性的变化
期刊:Science Advances
影响因子:13.6
发表时间:2023.08.25
DOI号:10.1126/sciadv.adg1610
背 景
免疫系统无法激活和控制会导致反复感染、血液学异常、皮肤表现、胃肠道症状和自身免疫性疾病。太空飞行对人体带来极大的挑战,并损害免疫系统,并且在恢复正常重力后很长一段时间内变化仍持续存在。深空探索的下一步是载人月球和火星任务,为了确保机组人员的安全太空任务,了解太空飞行对免疫系统的影响非常重要。
实验设计
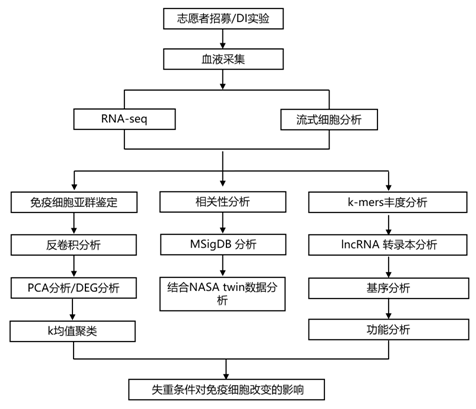
结 果
01
CD3 + T 细胞的转录组根据 DI 期间而暂时分离
干浸 (DI) 模拟微重力的影响,例如液体的重新分布和支撑卸载,提供了在没有宇宙辐射、压力和隔离等混杂因素的情况下研究人体生理学的可能性。
为了研究模拟重力对 T 细胞转录组的影响,志愿者接受了总共 21 天的 DI 方案(图 1A)。研究者团队在第 0 天(DI 前 7 天)、DI 期间的第 7、14 和 21 天以及 DI 后第 7 天(第 28 天)采集血样并进行转录组分析(RNA-seq)。血液淋巴细胞、粒细胞和单核细胞的流式细胞分析表明,DI期间,细胞群没有发生重大变化(图1B)。对分离的CD3+ T细胞的bulk RNA-seq表达数据进行反卷积分析显示,在所有时间点上,T细胞的纯度都很高(图1C)。他们在所有时间点检测到CD4+ T细胞(non-Treg细胞)、Treg细胞和CD8+ T细胞的比例相似(图1C)。
主成分分析(PCA)揭示了患者间的强烈变异性,同时样本的细胞在DI期间发生聚集(图1D)。DI 14天,RNA表达与第0天相比偏差最大,与第0天相比,994个上调基因和1343个下调基因的表达发生了显著变化(图1E-F)。第7天,与第0天相比,242个基因上调,569个基因下调。DI 21天后,T细胞转录组变化较小,与第0天相比,第21天只有一个基因上调。当比较第28天和第0天时,再次观察到基因表达差异的增加,这表明DI后7天基因表达变化可能“重置”(图1F)。
接下来,他们使用k均值聚类,根据一段时间内的表达谱对显著失调的基因进行聚类,其中2 个中心位于在至少一个时间点比较中发生显著变化的转录本上。这两个聚类代表的基因集在 DI 后分别表现出上和下调(图 1G)。
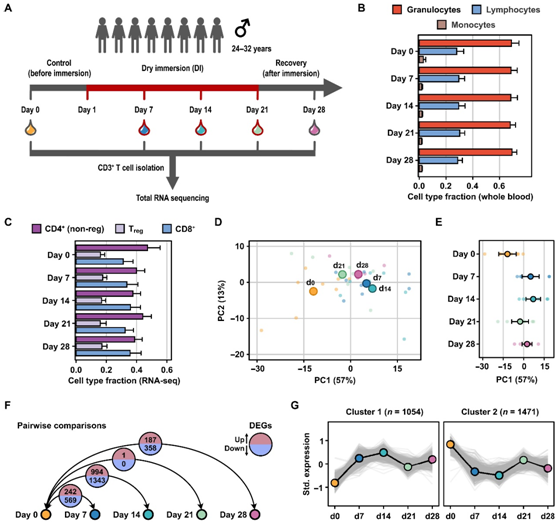
图1. DI 引起八名志愿者的转录组变化。
(A) 示意图描述了实验过程。(B) 水平条显示在 CD3 + T 细胞分离之前通过流式细胞测定的血液分离物中粒细胞、淋巴细胞和单核细胞的分数。(C) 水平条显示在bulk RNA-seq 数据中可检测到的 T 细胞群的估计分数。(D) PC分析的析因图将每个志愿者的bulk RNA-seq基因表达数和所有志愿者的平均值分开。(E) 点图显示了bulk RNA-seq 样本按时间点的 PC1 分离。(F) 显示了使用 DESeq2 通过成对时间点比较识别出的差异表达基因 (DEG)。(G) 折线图显示两个k均值聚类以及在至少一个时间点比较中检测到的每个聚类差异表达基因的数量。
02
DI 床中的模拟微重力导致分化标记物和细胞因子信号传导抑制因子下调
T 细胞的激活和分化受基因表达变化的调节,涉及细胞因子信号传导和特定转录因子的激活。他们研究了随时间推移受 DI 影响的每个基因聚类内上调或下调的基因(图 2A)。DI 后,他们发现对 T 细胞激活和分化很重要的基因(例如 AP-1 复合体成员JUNB、JUND和FOS,以及 DUSP 家族蛋白)的转录表达持续下调(图2A-B)。此外,早期T细胞激活标志物即时早期反应基因2 (IER2)和CD69在DI后下调(图2A)。
T 细胞稳态和分化为 TH细胞是由 JAK-STAT 信号激活的,该信号受到 SOCS 蛋白家族的负调控。有多种 SOCS 蛋白(SOCS1 至 SOCS7),每种蛋白都会影响不同的 T 细胞分化途径。SOCS1 和 SOSC3 抑制 TH 1 和 T H 17 分化,以及幼稚 T 细胞激活过程中的 IL-2R 和 IL-7R 信号传导。此外,SOCS1 调节 CD8 + T 细胞稳态。SOCS1和SOCS3DI 暴在DI后下调(图2A-B)。
这些数据表明,T 细胞稳态和分化的基因表达在 DI 后失调。在DI期间T细胞中上调的基因中,他们鉴定了趋化因子受体CCR2和CCR10归巢到组织中、TCR成分CD3G、以及转录因子FOXP3、EOMES和RORC,表明 DI 上调了决定 T 细胞激活和组织归巢的基因。
接下来,他们使用分子特征数据库(MSigDB)对人类免疫基因集进行了阈值无关的基因集富集分析。以研究 T 细胞命运决定的这些关键过程的变化(图 2C)。幼稚CD4+ T细胞中高表达的基因在DI后在T细胞中上调(图2C)。在DI后的所有时间点上,T细胞活化的基因都显著下调(图2C)。同样,在T细胞激活时下调的基因在DI后的T细胞中上调(图2C)。此外,与T细胞从胸腺前体细胞分化并产生效应T细胞的重要驱动因素相关的基因组,例如TCF-1和BCL6,也受到干扰(图2C)。在 TCF1 敲除 T 细胞“TCF1 KO: UP”和 BCL6 low T 细胞“BCL6 Low:UP”中上调的基因集在 DI T 细胞中下调,表明 DI T 细胞与表达 TCF1和BCL的 T 细胞更相似(图2C)。与幼稚CD8 + T 细胞相比,CD8+ T 记忆细胞高表达的基因特征在 DI T 细胞中下调(图 2C)。总之,该数据比较表明 DI 后T 细胞具有与幼稚 T 细胞更相似的基因表达特征。

图2. DI 时CD3 + T 细胞转录组扰动会影响增殖、分化和激活。
(A)热图显示了差异表达基因k-means聚类。(B)所选基因相对于第0天的RT-qPCR和RNA-seq log2 FC的线形图。(C) 垂直条显示使用 MSigDB 从基因集富集分析中获得的富集免疫基因集组。
03
转录组分析
接下来,他们将 DI (本研究)中发现的转录组变化与 NASA 双胞胎研究中鉴定 CD4 +和 CD8+ T细胞中发现的转录组变化进行了比较。与NASA双胞胎研究的基因表达分析发现,与T细胞活化相关的关键基因(如IER2和增殖和分化)的表达减少,包括SOCS3、JUNB和FOSL2(图3A-B)。此外,他们证实了T细胞功能的其他调节因子,如DUSP基因,在DI和NASA的双胞胎研究中都是下调的(图3A-B)。
此外,他们证实了 T 细胞功能的其他调节因子,例如DUSP基因,在 DI 和 NASA 双胞胎研究中均发生下调(图 3A- )。还有一些基因表现出相反的模式,例如 CD69,在 DI 后的T 细胞中下调,而在 NASA T 细胞中上调(图 3A-B)。总之,T 细胞激活、增殖和分化的关键调节因子的转录表达水平在 DI 后下调,这些变化与国际空间站机组成员的 T 细胞的变化相当。

图3. DI 中 T 细胞转录组的变化类似于真实的太空飞行。
(A) 热图显示了DI 上鉴定的CD3+ T 细胞中总体下调基因的表达(左),这些基因与在 NASA 双胞胎研究中获得的 CD4+(中)和 CD8 +(右)T 细胞中的基因重叠。(B) 垂直条显示所选基因的表达变化。(C) 点图表示通过流式细胞测定的细胞表面标记物 CD25 与对照相比的平均荧光强度 (MFI) 比率。
04
长链非编码 RNA 的一个子集在 DI 期间受到影响
长非编码 RNA (lncRNA) 广泛表达,并已成为在转录和转录后水平调节关键细胞过程的转录物类别。因此,他们探索了功能相关的 lncRNA 组,它们在 DI 后表达发生改变,可以调节 T 细胞活化、增殖和分化。他们使用不同的k值在多种分辨率下检测了 lncRNA 的功能分组并发现了序列聚合的共享模式,该模式主要将 lncRNA 转录物分成具有高相似性的不同聚类。对已建立的聚类的进一步检测,发现了具有介导T细胞细胞过程潜力的lncRNA子集,包括DI时观察到的转录组变化(图4A)。
MALAT1通过与转录阻遏蛋白 EZH2 相互作用来调节 T 细胞分,而MALAT1在 DI 中下调(图 4A-B)。PRANCR和DLEU2也下调,并且与细胞增殖和癌症进展相关。(图4A-B)。相反,HCG11和LINC00861在 DI 后上调(图 4A-B),并且可以抑制细胞生长并分别与免疫检查点基因(例如PD-1和CTLA4)呈正相关。这些lncRNA都是聚类1的一部分,并且共享富集相同的A/U丰富基序(图4C)。聚类2 包含与基因表达和增殖改变相关的 lncRNA,包括CHASERR和PVT1(图4A-B),以及几个反义转录本。例如,PDCD4-AS1在DI中下调,这可以促进翻译起始抑制剂PDCD4的基因表达增加,并表现出类似的富含C/G的基序富集(图4D)。最后,聚类3 没有显示出明显的基序富集,这可能表明该聚类内发现的 lncRNA 具有多种功能关联(图4E)。
总体而言,他们检测到 DI 后 lncRNA 频繁失调,并在 T 细胞中建立了具有共享调控序列特征的不同功能组。进一步分析了 lncRNA 基因表达的变化,这些变化可能会改变微重力条件下 T 细胞的增殖和分化。

图4. lncRNA 组在 DI 后在 T 细胞中具有调节潜力。
(A) 热图显示差异表达 lncRNA 基于 6-mer富集特征的k均值聚类。(B)折线图显示了选定的lncRNA基因的基因表达变化。(C-E)显示lncRNA聚类1、聚类2 和聚类3 中鉴定的前100个富集6-mers的基序。
+ + + + + + + + + + +
结 论
本项研究分析DI对 8 名健康志愿者的血液样本中分离出的 T 细胞转录组的影响。CD3 +T 细胞的转录组分析在所有时间点都显示转录变化,其中大多数变化发生在 DI 后的 14 天。而第 21 天,T 细胞显示出适应的变化,其转录谱与 DI 前 7 天相似。DI 后 7 天,T 细胞再次改变了转录谱。这些数据表明,T 细胞通过“重塑”转录组来适应模拟失重,并且当机体重新位于正常重力时,“重塑”过程仍然存在。
+ + + + +



 English
English


