文献解读|J Extracell Vesicles(17.337):来自肺组织的细胞外囊泡驱动炎症中骨髓中性粒细胞募集
✦ +
+
论文ID
原名:Extracellular vesicles from lung tissue drive bone marrow neutrophil recruitment in inflammation
译名:来自肺组织的细胞外囊泡驱动炎症中骨髓中性粒细胞募集
期刊:Journal of Extracellular Vesicles
影响因子:17.337
发表时间:2022.05.20
DOI号:10.1002/JEV2.12223
背 景
细胞外囊泡(EV)被越来越多地认为是疾病的生物标志物和体内长期细胞间通信的载体。EV已成为一种新的生物体信息系统,介导细胞-细胞和器官间的通信,并在多细胞生物中维持体内稳态和健康,但从完整组织中分离EV的技术目前还不理想。
肺是一个复杂的器官,与其他器官有潜在的潜在交互作用。在没有局部转移的情况下,肺肿瘤也可以远程激活骨骼中的成骨细胞,并从骨髓中诱导中性粒细胞促进肿瘤生长。这些发现表明,肺脏与其他器官具有未发现的潜在通信。基于EV的DNA分泌认为通过从细胞中排出有害DNA来促进细胞稳态和减少线粒体损伤,并可能成为有用的肿瘤诊断生物标志物。显然,还需要进一步的研究来更好地理解EV在DNA分泌中的作用。
基于此,作者想要探究生理EV如何在体内发挥稳态或病理功能。
实验设计
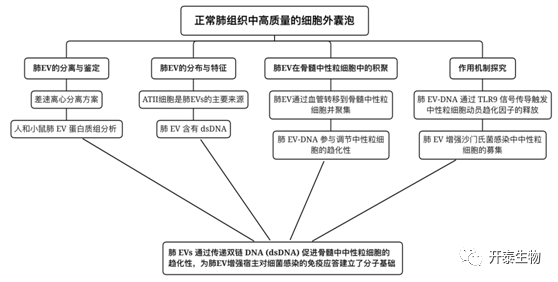
结 果
01

肺EV的分离与鉴定
作者为了从正常肺组织中收集高质量的EV,开发并优化了一种基于差速离心的方案。人和小鼠中消化后的活细胞分别占总细胞的96.2%和94.2%。这表明,肺细胞在消化过程中得到了很好的保护。WB结果表明,在小鼠样本中,EV相关蛋白(ALIX、TSG101、CD9、CD81)在110000×颗粒(P110kg)中高度富集,而高尔基体(GM130)、内质网(Calnexin)和线粒体蛋白(TOM20)在P110kg部分中检测不到或仅微弱存在。人类样品 P110kg 部分中 EV 标记蛋白存在类似富集,并且囊泡的相似形态和大小分布与已知的 EV 特征一致。(图1)。
这些结果表明,通过改进的分离方法,可以有效地从人类和小鼠的肺组织中收集到显示真实EV的物理生化特性和特征的高质量EV。

图 1. 从人和鼠肺组织中收集高质量的 EV
02

人和小鼠肺 EV 的蛋白质组学分析
与来自肺组织的细胞相比,肺 EV 显示出不同的蛋白质谱。除了经典的 EV 标志物(CD9、CD81)外,还鉴定了肺特异性 EV 标志物(GPRC5A、AGER)。与 EV 中的典型蛋白质相比,在肺细胞中检测到更高水平的位于细胞骨架(如 TUBB)和细胞质(如 AHGDIB)的蛋白质。此外,人类和鼠肺 EV 的蛋白质组相似,检测到的蛋白质中有一半以上是共享的。对分析鉴定的蛋白质进行GO富集分析,无论物种如何,肺 EV 蛋白中细胞外泌体、质膜和胞质溶胶等GO条目高度富集,证明 EV 中蛋白质的囊泡和细胞外性质。
在EVs中更丰富的典型蛋白质中, GPRC5A和AGER在转录水平上在肺组织中特异性表达。WB也证实这些蛋白在肺EV中的表达。使用EGFP标记的GPRC5A和AGER蛋白来观察细胞内定位发现,两种蛋白在质膜和细胞内囊泡上高度组装。细胞质中GPRC5A和AGER荧光点与EV标记CD63和CD9共定位明显(图2)。
GPRC5a和AGER被鉴定为肺标记,证实了分离的EVs的组织来源。

图 2. 蛋白质分析证明肺 EV 的囊泡和组织特异性
03

ATII是肺部EV的主要来源
作者选择高丰度EV蛋白并生成热图。结果表明,肺EV中的蛋白质可以反映其细胞来源。在人类和鼠类样本中,ATIIs(II型肺上皮细胞)可以标记大多数EVs,表明ATIIs是肺组织EVs的主要来源。人类样本中单个成纤维细胞释放的EVs最多,而小鼠样本中的ATI细胞释放的最多。与免疫细胞相比,更多的EVs来源于单个非免疫细胞。GSEA结果表明所有非免疫细胞中的EV分泌相关基因的显著富集。非免疫细胞中EVs分泌相关基因的上调意味着更强的释放EVs的能力(图3)。
结果表明, ATII细胞是肺EVs的主要来源,并且非免疫细胞通常比免疫细胞释放更多的EVs(每个细胞)。
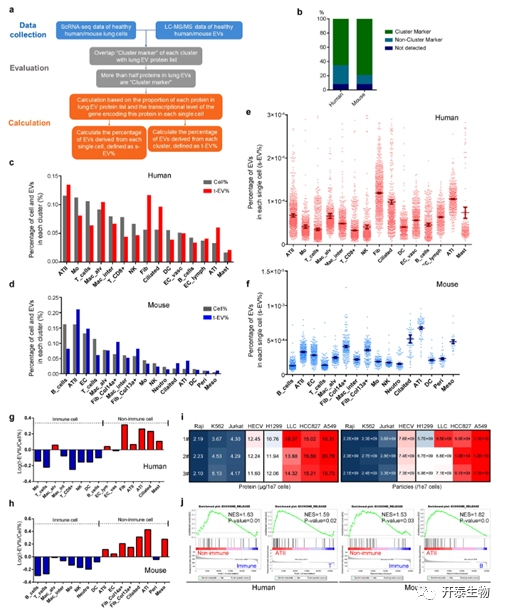
图 3. EV蛋白质组学分析和scRNA序列数据评估肺EV起源
04

肺 EV 含有 dsDNA
在定量从不同组分中提取的dsDNA(双链DNA)后,dsDNA以双峰方式分布在组分中并存在于低密度肺EVs和高密度非囊泡成分中。流式结果成功鉴定肺EVs,而未检测到缺乏膜结构的非囊泡成分。用DAPI对EVs染色,大约10-20%的人和鼠肺EVs的dsDNA呈阳性。肺EVs的DNA全基因组测序结果显示,肺EVs含有跨越所有染色体的不同长度的dsDNA片段。此外,细胞和EVDNA中的拷贝数变异(CNVs)非常相似(图4 A-F)。
用DNaseI处理以降解附着在外膜上的DNA,导致总DNA减少约40%。流式结果显示DNase I处理后DAPI阳性颗粒类似减少。在DNase I处理后,在非囊泡成分中几乎没有检测到dsDNA。使用核酸染色剂来标记存在于EVs外部或表面的DNA。结果显示,40%的肺EV为阳性。用DAPI和DiI染色后,观察到DNA和囊泡膜结构的共定位(图4 G-I)。
这些数据有力地表明肺EVs中的dsDNA来源于基因组DNA并且存在于表面和内部。
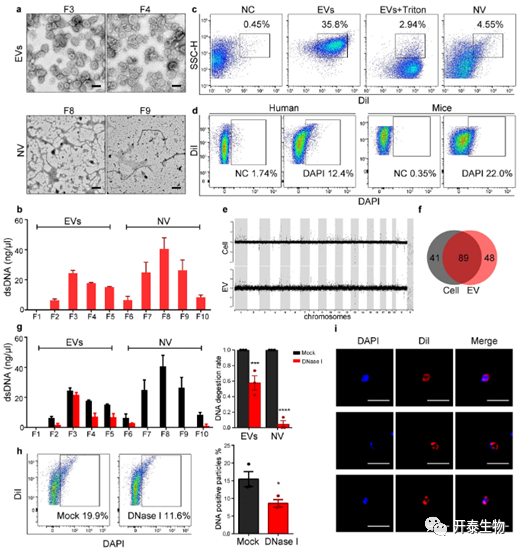
图 4. 肺EV含有来源于基因组DNA的双链DNA
05

肺EV在骨髓中性粒细胞中的积聚
流式结果表明,与对照小鼠相比,注射肺EVs的小鼠的下肢显示出高荧光信号。相对于对照小鼠,注射DiI标记的EV的小鼠的骨髓中检测到更多的红色荧光。不同给药途径不影响肺EVS在骨髓中的积聚,通过静脉注射在骨髓中检测到更多具有红色荧光的细胞,表明肺EVS通过血管转移。骨髓中的红色荧光细胞随后鉴定为主要是中性粒细胞(52.7%)和单核细胞(24.1%)。用红色荧光标记的肺EV与鉴定为CD45+Ly6G+细胞的中性粒细胞共定位(图5)。
结果表明,肺EV通过血管转移到骨髓中性粒细胞并聚集。
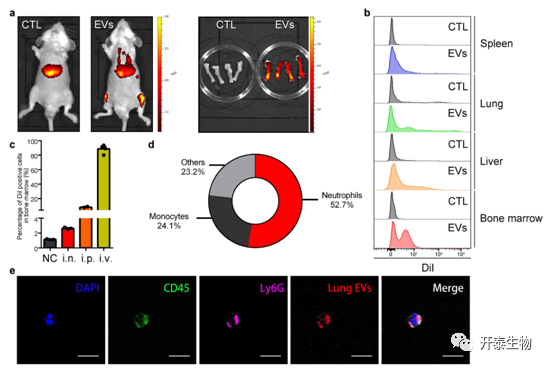
图 5. 荧光标记的肺EV被转移到骨髓中
06

肺EV-DNA增强中性粒细胞的趋化性
注射三种不同量的肺EV的小鼠显示招募到腹腔灌洗部位的中性粒细胞数量呈剂量依赖性增加。相反,PBS或EV治疗小鼠的外周血中中性粒细胞的数量没有差异。数据表明,肺EV促进中性粒细胞迁移,而不是增加其在外周血中的数量。在将 DNaseI 注射到小鼠体内之前,用 DNaseI 孵育会降低肺 EV 促进中性粒细胞趋化性的能力,表明肺 EV-DNA 负责趋化性的上调。此外,具有相同 DNA 含量的非囊泡成分对中性粒细胞没有影响(图6)。
结果表明,肺 EV-DNA 参与调节中性粒细胞的趋化性。

图 6. 肺EV-DNA增强中性粒细胞的趋化性
07

肺EV-DNA通过TLR9信号触发中性粒细胞动员趋化因子的释放
肺EVs处理后,促炎趋化因子的转录水平显著上调并且中性粒细胞趋化相关基因显著富集。与对照组相比,肺EV刺激的中性粒细胞以剂量依赖的方式显著增加趋化因子CXCL1和CXCL2的分泌,证实了体内中性粒细胞转录程序的变化。
通过将生物素化的肺 EV-DNA 与链霉亲和素珠一起孵育,TLR9 从过表达 TLR9 的 HEK293 细胞的裂解物中富集。未生物素化的肺 EV-DNA 有效竞争结合,表明 TLR9 可以与肺 EV-DNA 结合。DiI标记的肺EV与中性粒细胞内内源性TLR9的共定位。使用 ODN2088 和 E6446 阻断中性粒细胞中内源性 TLR9 的 DNA 结合位点,用肺 EV 孵育的中性粒细胞有效降低了 CXCL1 和 CXCL2 mRNA 水平。
这些结果表明,肺 EV-DNA 通过 TLR9 信号传导触发中性粒细胞动员趋化因子的释放。

图 7. 肺EV-DNA通过TLR9信号触发中性粒细胞动员趋化因子的释放
08

肺 EV 增强沙门氏菌感染中中性粒细胞的募集
感染伤寒沙门氏菌的小鼠分离出的肺 EV 中的 DNA 水平更高,表明肺 EV 参与细菌感染的过程。沙门氏菌感染下用肺 EVs 预处理的小鼠显示更多的中性粒细胞被募集到腹膜灌洗液中且存活的时间明显更长。存活时间和外周血中细菌 DNA 的结果表明,GW4869 治疗的小鼠比 DMSO 治疗的小鼠感染更严重。肺EV 可以有效地增强中性粒细胞的募集,抑制肺 EV 的分泌会导致中性粒细胞趋化性受损,从而降低宿主的免疫防御。
这些观察结果表明,中性粒细胞对肺 EV-DNA 作出反应的调节机制在沙门氏菌的细菌感染和肺 EV 治疗期间也起作用,从而延长了受感染小鼠的存活时间。

图 8. 肺 EV 在沙门氏菌感染期间增强中性粒细胞的募集
+ + + + + + + + + + +
结 论
作者开发并验证了严格的肺部组织来源的EVs分离方案,以精确测定其分子组成和研究其在体内的生理功能。研究证实肺 EVs 通过传递双链 DNA (dsDNA) 促进骨髓中中性粒细胞的趋化性,为肺EV增强宿主对细菌感染的免疫应答建立了分子基础,并为理解囊泡介导的系统通信提供了新的见解,对进一步研究疾病中释放的病理性肺EV对未来的治疗潜力和治疗干预措施设计也具有重要意义。
+ + + + +



 English
English

