文献解读|Nat Commun(16.6):通过整合单细胞和空间转录组分析描绘肢端黑色素瘤的早期传播机制
✦ +
+
论文ID
原名:Delineating the early dissemination mechanisms of acral melanoma by integrating single-cell and spatial transcriptomic analyses
译名:通过整合单细胞和空间转录组分析描绘肢端黑色素瘤的早期传播机制
期刊:Nature Communications
影响因子:16.6
发表时间:2023.12.08
DOI号:10.1038/s41467-023-43980-y
背 景
肢端黑色素瘤(AM)是一种罕见的黑色素瘤亚型,其特点是淋巴结(LN)转移率高。与皮肤黑色素瘤 (CM) 中与紫外线特征相关的广泛体细胞突变不同,AM 显示激活突变的发生率较低,例如BRAF和NRAS中的突变,而KIT、NF1和PTEN 中的突变频率较高。AM 的另一个特点是高拷贝数变异 (CNV),包括CDK4和CCND1扩增、TP53失活和TERT改变。目前对 AM 的了解仍然有限,这凸显了根据其独特的生物学特性制定治疗方案的迫切需求。
实验设计
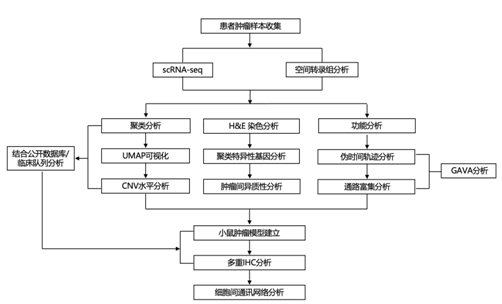
结 果
01
AM单细胞转录组图谱
为了全面表征AM的生态系统,研究者团队收集了12名患者的原发肿瘤组织进行单细胞转录组分析(scRNA-seq),其中6名有淋巴结转移(LN+ AM),6名没有(LN- AM)(图 1a)。生成了包含 52382 个细胞和 30097 个基因的聚合基因表达矩阵。获得了分辨率为 2.0 的 38 个独特的细胞聚类,并通过均匀流形近似和投影 (UMAP) 图进行可视化(图 1b)。将11 个注释为肿瘤细胞,因为它们表达高水平的黑色素瘤相关标记基因(MLANA、MITF、PRAME和SOX10)。其余聚类分为 12 种非肿瘤细胞类型。使用无监督的整体聚类相似性矩阵将这 38 个聚类分类到其相应的元聚类中(图 1c),证实每种细胞类型都以高特异性表达其众所周知的标记基因(图 1d-e)。
几乎每个患者体内都检测到了这 13 种细胞类型;然而,它们的比例差异很大(图1f)。黑色素瘤是最丰富的细胞类型,具有最高的转录本和CNV水平,这与其高度恶性的特征一致(图 1f)。T细胞是最丰富的免疫细胞类型。与LN- AM中相比,LN+ AM中的浆细胞样树突状细胞(pDC)和NK细胞略有减少,而两组之间的T细胞没有观察到差异(图1f)。基质间室,包括内皮细胞、成纤维细胞和表皮细胞,在LN+AM的肿瘤微环境(TME)中显著降低(图1f)。总体而言,AM表现出高度异质性。

图1. AM 生态系统的单细胞特征。
(a) 研究设计的示意图。纳入有或无淋巴结转移的 AM 患者,收集其原发肿瘤病灶进行 scRNA-seq 和空间转录组分析(ST-seq)。(b) UMAP 图显示 12 个原发性 AM 组织的细胞分布。 (c) 热图显示了来自 12 个肿瘤组织的 38 个聚类之间的成对相关性。(d) 热图识别选定标记基因在注释细胞类型中的表达。(e) 特征图呈现注释细胞类型的经典标记基因。(f) 条形图表示来自LN+AM和LN-AM患者以及每个患者的注释细胞类型的比例;直方图显示标注细胞类型的细胞计数;箱形图显示了注释细胞类型中转录本和CNV水平的中位数、第25和75百分位数和异常值。
02
空间转录组表明“冷”TME
他们通过空间转录组分析(ST-seq)获得了3例LN+AM患者和2例LN-AM患者的原位基因表达谱。使用基于条件自回归的反卷积(CARD)算法将斑点划分为肿瘤区和非肿瘤区(图2a)。在肿瘤区域,他们区分了CNV水平显著差异的6个聚类,这些聚类构成了不同患者的斑点。例如,患者6与聚类2和聚类4相关,而患者11与聚类1相关,且CNV水平最高(图2b-c)。在非肿瘤区域,鉴别出5个聚类,患者6、11、14和15共有第4聚类(图2d-e),这些结果表明肿瘤区域具有高度的肿瘤间异质性。
免疫细胞主要聚集在非肿瘤区域,但在肿瘤区域明显减少(图 2f)。值得注意的是,LN + AM的肿瘤生态系统中浸润的免疫细胞少于LN-AM 的肿瘤生态系统(图 2g)。因此,AM 是一种“冷”TME,尤其是对于有淋巴结转移的患者。
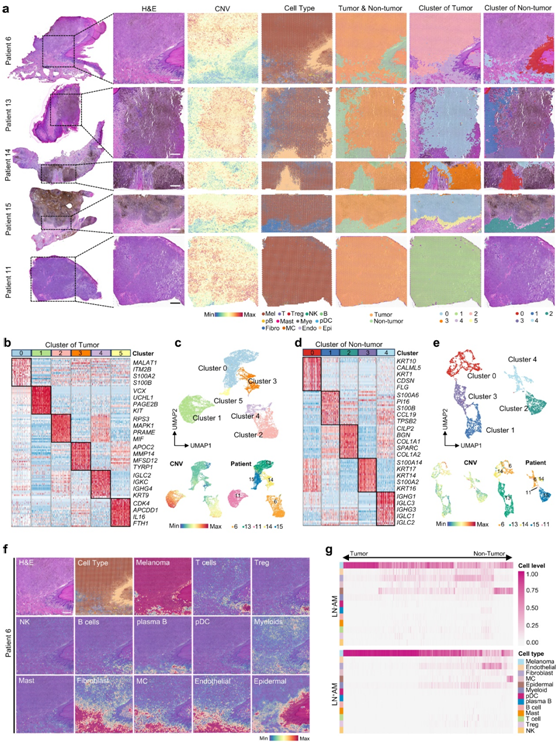
图2. 空间转录组表明 AM 中存在“冷”TME。
(a) 第一列显示 H&E 染色图像,显示五位 AM 患者的肿瘤组织。 (b) 热图描绘了肿瘤区域中的聚类特异性基因。 (c) UMAP 图显示肿瘤区域中的斑点,根据注释的聚类、CNV 水平和样本进行着色。(d) 热图说明非肿瘤区域中的聚类特异性基因。 (e) UMAP 图显示非肿瘤区域中的斑点,根据注释的聚类、CNV 水平和样本进行着色。 (f) 具有相似结果的五个 AM 组织切片中 scRNA-seq 数据的注释细胞类型的空间特征图。(g) 热图显示了 LN-AM(上图)和 LN+AM(下图)患者中从肿瘤区域到非肿瘤区域的注释细胞类型的浸润水平。
03
单细胞水平上黑色素瘤细胞的高度异质性
为了分析肿瘤细胞的结构,他们将23501 个黑色素瘤细胞重新分为五个亚聚类。这些亚聚类具有独特的基因表达模式和生物学功能,并且它们在患者之间的比例差异很大,表明肿瘤内和肿瘤间具有较高的异质性(图3a-b)。MYC+黑素瘤(MEL) 细胞在 LN+ AM中增加,并表达高水平的MYC、MITF、SNAI2和KIT,所有这些在肿瘤进展中都起着至关重要的作用。例如,MYC 调节主要涉及增殖、分化、代谢和血管生成的下游靶基因,是一个潜在的治疗靶点。因此,MYC + MEL细胞在间充质和干细胞发育方面功能富集(图 3b)。CXCL10 + MEL 亚群具有高水平的CXCL10、CXCL8和IRF1,在免疫反应调节、免疫效应过程和白细胞趋化性方面功能富集。TMSB4X、IGKC和IGLC2高表达的TMSB4X+MEL亚群在i-κB激酶/NF-κB信号通路、细胞因子分泌和细胞趋化方面功能富集(图3b)。这些癌症免疫相关聚类在LN+AM中下调,表明肿瘤细胞可以通过形成“冷”TME来促进LN传播(图3a)。CENPF + MEL 亚聚类具有高水平的CENPF、CCNB1、PCNA和MKI67,在 DNA 复制和细胞周期中功能富集,而NEAT1+ MEL 亚聚类具有高表达NEAT1、KLF6、JUN和FOS ,在响应活性氧和氧化应激功能富集(图 3b)。
然后他们描述了五种黑色素瘤亚群的特征。LN+AM组总黑色素瘤细胞及各亚群的CNV水平均显著高于LN-AM组(图3c)。然后,他们将SCENIC分析应用于这些亚聚类(图3d)。与肿瘤转移和进展相关的转录因子(TF),如MITF、MYC和CTNNB1,在MYC+ MEL 亚聚类中表现出高转录活性。同样,免疫/炎症相关的 TF,例如NFKB2、STAT1、RELA和FOXO3,在CXCL10+ MEL 和TMSB4X+ MEL 亚聚类中表现出高活性,这是肿瘤细胞免疫调节表型的基础。
然后,他们分析了这些黑色素瘤亚聚类的伪时间轨迹(图 3e-f)。0期以CENPF MEL亚群为主(85.1%),表达高水平的增殖相关基因,如CCNB1和CENPF。因此,RNA速度证实黑色素瘤细胞起源于CENPF MEL细胞。1期主要由CXCL10+MEL和TMSB4X+MEL亚群组成(65.3%),高表达免疫相关分子,如CCL2、C1R和STAT3(图3g)。二期主要由MYC MEL和NEAT1 MEL亚群组成(70.5%),并表达高水平的转移相关分子,如MITF、KIT和VIM(图3g),这些结果突出了肿瘤细胞在AM生态系统中发挥的多方面作用。
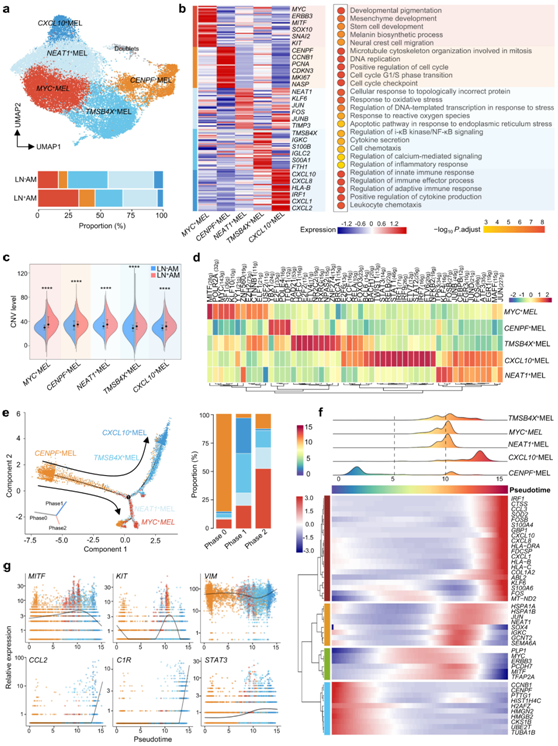
图3. 不同 AM 亚聚类的功能和进化轨迹。
(a) 所有黑色素瘤细胞的 UMAP图均按带注释的亚聚类进行颜色编码,条形图显示这些带注释的亚聚类源自 LN+AM 和 LN-AM 患者的比例。(b) 热图(左)显示聚类特异性基因,点图显示(右)这些带注释的黑色素瘤亚聚类相应富集的生物学功能。 (c) 分割小提琴图,说明由 LN-AM 和 LN + AM着色的注释亚聚类的 CNV 水平。(d) 热图显示带注释的黑色素瘤亚聚类中关键转录因子的表达。(e) 对这些 AM 细胞的伪时间排序分析(左)识别出两种不同的细胞命运,并按亚聚类着色。 (f) 热图显示基因表达沿伪时间的动态变化。(g) 二维图显示选定基因沿伪时间的动态表达,按亚聚类着色。
04
MYC + MEL 细胞中激活的脂肪酸代谢途径
与LN- AM相比, LN + AM中的MYC+ MEL聚类显著增加,表明在LN转移中起关键作用(图 4a)。LN +AM 中MYC+ MEL 亚群显著增加,高MYC + MEL 评分与低评分相比预后较差。值得注意的是,他们发现多个脂肪酸氧化 (FAO)相关基因,包括EPHX1、GAPDHS和HSP90AA1,在MYC+ MEL亚群中升高(图4b)。与脂肪酸代谢相关的基因集在MYC+ MEL亚聚类中富集(图4c)。
考虑到淋巴结转移需要代谢向FAO转变,他们推测在MYC+MEL细胞中观察到的FAO通路的过度激活可能促进了淋巴结转移。
MITF(MYC + MEL 细胞中的关键转录因子) 及其调节子活性与FAO 评分之间呈正相关。使用ST-seq数据,他们观察到MITF表达和FAO得分之间具有良好的空间一致性,并且较高的FAO得分出现在MITFhigh点中(图 4d-e)。这些结果表明,MITF 可以促进FAO 在AM 区域的激活。为了探索MITF介导的FAO激活在淋巴结转移中的潜在作用,他们建立了小鼠脚垫接种模型(图4f)。他们延长了时间以实现更高的淋巴结转移率,特别是考虑到药物治疗后较低的淋巴结转移率。在终点时,他们观察到 B16F0- Mitf组腘窝淋巴结的大小和转移面积显著大于 B16F0-Vector组(图4g-h)。
他们进一步将Etomoxir(一种临床批准的FAO抑制剂)局部应用于小鼠腿部的前外侧。尽管Etomoxir处理不影响原发肿瘤的大小或荷瘤小鼠的体重,但它显著抑制LN转移(图 4g-h)。所有这些结果证明 MITF 有助于增加 FAO 过程,从而促进 AM 中的 LN 转移。
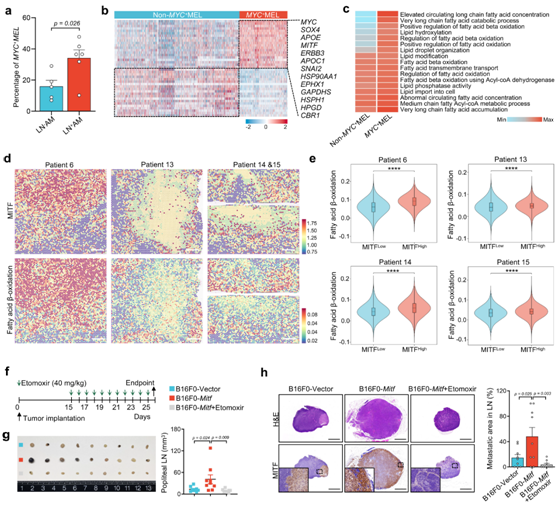
图4. MITF 介导的FAO 激活驱动肿瘤淋巴结转移。
(a) 直方图显示了LN–AM和 LN+A组中MYC+MEL 细胞的比例。 (b) 用 scRNA-seq 数据显示MYC + MEL 组与非MYC + MEL 组中选定 DEG 表达水平的热图。 (c) 热图显示MYC + MEL 和非MYC + MEL 组中脂肪酸代谢相关途径。 (d) 空间特征图显示所选组织切片中MITF表达和 FAO 评分。(e) 小提琴图显示每个组织切片中MITFHIGH和 MITFLOW之间的 FAO 分数。 (f) Etomoxir在C57BL/6小鼠肿瘤植入模型中的治疗方案。(g) 腘窝淋巴结大体外观图像,以及B16F0-Vector、B16F0-Mitf和B16F0-Mitf+Etomoxir组腘窝淋巴结大小散点图。(h) 腘淋巴结的 H&E 和抗 MITF 染色图像。
05
LN + AM抗肿瘤免疫功能受损
他们共提取13521个免疫细胞,并将其分为18个亚聚类(图5a-c)。这些亚群的比例在患者之间以及LN+AM和LN-AM组之间差异很大。根据聚类特异性标记基因将CD8+ T细胞命名为GZMK+ (效应细胞)、ANXA1+ (记忆细胞)、IFNG+ (细胞毒性细胞)和CXCL13+(耗竭细胞)。与LN−AM相比,CXCL13+ CD8 +T细胞增加,而IFNG+ CD8+ T细胞在LN−AM中略有减少,表明抗肿瘤TME受损(图5a)。对于CD4+T细胞,CXCL13+(耗竭)和FTH1+(幼稚)细胞在LN+ AM中略有增加,而KLRB1+(效应)和FOS+(记忆)细胞的比例在LN +AM和LN-AM之间没有差异(图5a)。NK/NKT细胞表现出强大的抗肿瘤反应。在LN+ AM中,XCL2+NK和FGFBP2+ NKT细胞比LN−AM中减少(图5a),提示LN+ AM患者抗肿瘤免疫功能明显减弱。
接下来,他们进行了GSVA分析,并观察到多种免疫调节途径,包括干扰素-α/γ反应和IL- 2/STAT5信号,在CD8+T亚聚类中富集(图5d)。有趣的是,在XCL2+NK和FGFBP2+NKT细胞中,几乎所有选择的通路都发生激活,表明它们具有较高的增殖和抗肿瘤活性(图5d)。XCL13 + CD8 + T 和CXCL13 + CD4 + T 细胞(称为耗尽 T 细胞)表达高水平的免疫检查点分子,如TIGIT、CTLA4、LAG3和PDCD1(图5e)。重要的是,FGFBP2 + NKT 细胞表达最高水平的抗肿瘤细胞因子,表明它们具有强大的抗肿瘤作用。他们还使用 SCENIC 分析并鉴定了一组与不同免疫细胞类型的生物学有关的 TF。在FGFBP2 + NKT 细胞中,多个 TF 高度激活,尤其是CEBPB,它与活跃的 TME 和转移性黑色素瘤的良好预后相关。
此外,他们进一步进行了 RNA 速度分析(图 5f)。T细胞主要起源于幼稚细胞,分化为记忆细胞、效应细胞和细胞毒性细胞,最后分化为衰竭细胞。耗尽的CD8 + T细胞主要源自效应CD8 + T细胞,而细胞毒性CD8 + T细胞则源自效应和记忆CD8 + T细胞。重要的是,FGFBP2 + NKT细胞主要源自效应CD8 + T细胞,而不是XCL2 + NK和CD4 + T细胞。
鉴于其强大的肿瘤杀伤能力,他们提取CD8+ T 和 NK 细胞用于进一步分析,观察到CXCL13 + CD8 + T 和FGFBP2 + NKT 细胞分别具有最高的耗竭和细胞毒性分数(图 5g)。因此,FGFBP2+ NKT细胞表达最高水平的细胞毒性基因,如GZMB、GZMH、PRF1和GNLY,表明FGFBP2 + NKT细胞具有最强的肿瘤杀伤作用(图 5h)。
由于其强大的抗肿瘤能力,他们进一步研究了FGFBP2 + NKT细胞与AM中淋巴结转移的关系。与LN-AM中的相比,LN + AM中的FGFBP2 + NKT细胞显著减少(图 5i)。通过多重免疫组化实验,他们发现FGFBP2 NKT细胞(CD8、NCAM1和FGFBP2阳性)主要存在于肿瘤旁区域,在肿瘤区域稀疏分布(图5j)。统计学分析显示,LN+AM患者TME中FGFBP2+NKT细胞明显低于LN - AM患者,FGFBP2+NKT细胞减少的患者预后更差(图5k)。这些结果表明FGFBP2+ NKT细胞的减少与AM的LN转移密切相关。
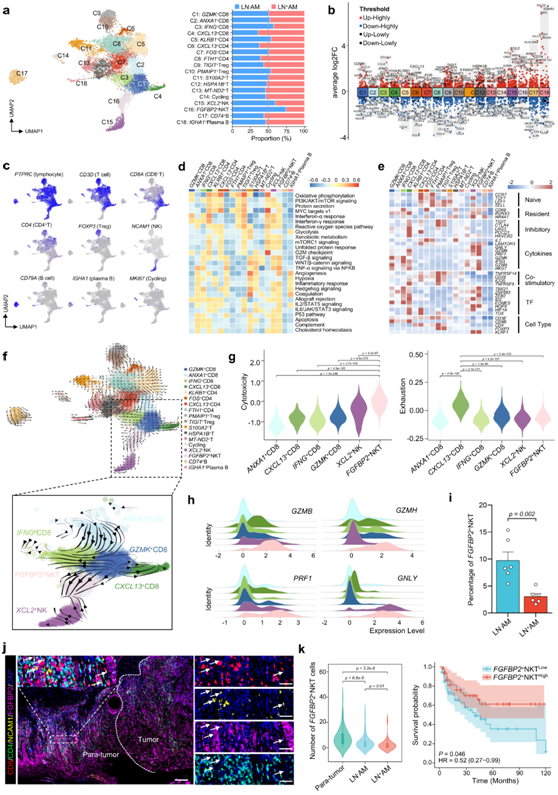
图5. LN+ AM 中FGFBP2 + NKT 细胞减少。
(a) UMAP图(左)显示免疫细胞,条形图(右)显示 LN + AM 和 LN-AM 组中每个亚聚类的比例。(b) 火山图显示带注释的免疫细胞亚聚类中的 DEG。 (c) 用于亚聚类注释的经典标记基因的特征图。 (d) 对这些亚聚类中选定的标志路径进行 GSVA 分析。 (e) 热图显示这些亚聚类中选定基因集[包括幼稚基因组、常驻基因组、抑制基因组、细胞因子、共刺激基因、转录因子 (TF) 和细胞类型]的表达。(f) RNA 速度分析展示了这些亚聚类的进化轨迹。(g) 小提琴图显示所选亚聚类中的细胞毒性和耗竭分数。 (h) 岭图显示这些亚聚类中GZMB、GZMH、PRF1和GNLY的表达水平。(i) 使用显示LN+ AM和 LN – AM组中FGFBP2 + NKT 细胞比例的直方图。 (j)多重IHC分析。 (k) 小提琴图(左)显示肿瘤旁组、LN−AM组和LN+AM组中FGFBP2+NKT细胞的数量。KM分析(右)显示了101例具有高水平和低水平FGFBP2+NKT细胞的AM患者的总生存率。
06
巨噬细胞在 AM 中发挥抗炎作用
他们总共收集了 5212 个骨髓细胞,并重新为 13 个亚群,包括巨噬细胞、单核细胞、中性粒细胞、树突状细胞(DC) 和浆细胞样树突状细胞(pDC)(图 6a-c)。例如,SPP1 +巨噬细胞(SPP1+ Mac)表达高水平的SPP1,并且在该亚群中CCL2和MMP9水平升高(图 6c)。与LN - AM相比,LN + AM中存在更多的巨噬细胞,特别是CXCL10 + Mac细胞,而GZMB+ pDC细胞更少(图 6d)。这些肿瘤相关巨噬细胞的信号通路和代谢特征差异很大(图 6e)。SPP1+ Mac 和APOE + Mac 细胞的活性氧 (ROS)、脂肪酸代谢、糖酵解和氧化磷酸化水平升高,而CXCL10+Mac 和F13A1+ Mac 细胞的补体和干扰素-α 反应富集。代谢相关通路,如胆汁酸代谢和血红素代谢,几乎在所有巨噬细胞中都发生激活。多种免疫/炎症通路发生富集,如TNF-α信号通过NFKB, IL6/JAK/STAT3信号和INF-γ反应,表明在免疫/炎症调节中起关键作用。
接下来,他们进行了RNA速度分析。巨噬细胞主要来源于APOE+ Mac,然后向两个方向分化:SPP1+ Mac、CXCL10+ Mac和F13A1+ Mac。使用Monocle2,他们确认伪时间轨迹以APOE+ Mac开始,然后分化为SPP1+ Mac和CXCL10+ Mac,并以F13A1+ Mac结束(图 6g)。APOE+ Mac显示炎症/免疫相关基因的低表达,而SPP1+ Mac、CXCL10+ Mac和F13A1+ Mac表达高水平的炎症/免疫相关基因。然而,表达谱却截然不同,表明执行了不同的生物学功能(图 6h)。他们还观察到这些亚群表达高水平的免疫检查点分子;例如,SPP1+ Mac表达高水平的CD274和HAVCR2,CXCL10+ Mac表达高水平的CD274、PDCD1和TIGIT,F13A1+ Mac表达高水平的大多数免疫检查点分子,这与终末分化状态一致(图 6h)。通过计算M1/M2极化分数,他们发现大多数巨噬细胞偏向M2表型,除了APOE+ Mac细胞,其呈现低M1/M2分数(图 6i-j),表明大多数巨噬细胞在AM生态系统中发挥抗炎症效应。
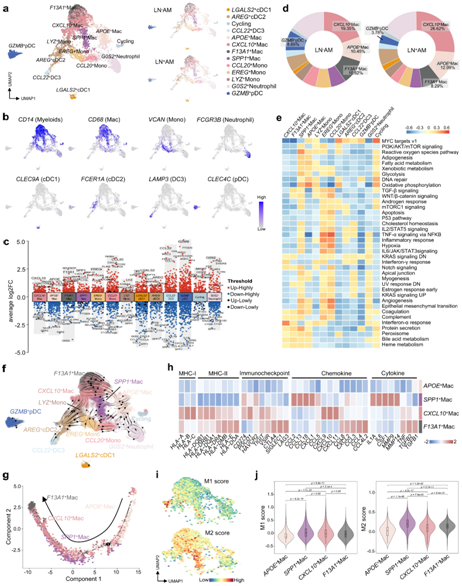
图6. 分析 AM 中骨髓细胞的功能。
(a) UMAP图显示所有肿瘤样本的骨髓细胞景观。 (b) 特征图显示用于注释这些亚聚类的经典标记基因。(c) 火山图显示这些带注释的亚聚类中的 DEG。 (d) 饼图显示 LN + AM 和 LN – AM 组中这些骨髓细胞亚群的比例。 (e) 对这些亚聚类中选定的标志路径进行 GSVA 分析。 (f) RNA 速度分析展示了这些亚聚类的进化轨迹。(g) 巨噬细胞的伪时间排序分析。(h) 热图显示巨噬细胞亚群中选定免疫/炎症基因的表达水平。 (i) 特征图显示巨噬细胞亚聚类中 M1/M2 极化特征的得分。(j) 箱线图说明了巨噬细胞亚聚类中 M1/M2 极化特征的得分。
07
癌症相关成纤维细胞促进血管生成
他们将10148个基质细胞重新分为13个亚群,分别是癌症相关成纤维细胞(CAF)、肌肉细胞(MC)、表皮细胞和内皮细胞(图7a-b)。CAF表达高水平的MMP2、CFD和FN1,并分为两种不同的类型。MMP2+ CAF、CFD+ CAF 和SOD2+ CAF 亚群表达高水平的细胞因子和趋化因子,与炎症 CAF(iCAF、PDGFRA+)类似。与MC类似,THY1、ACTA2和TAGLN表达水平较高的THY1+CAF,因此他们将其命名为myoCAF。在LN+ AM中,这些iCAF亚聚类增加,而myoCAF和MC亚聚类减少(图7c-d)。根据RGCC、ACKR1、SEMA3G和PROX1的表达,将内皮细胞分为毛细血管内皮细胞、静脉内皮细胞、动脉内皮细胞和淋巴内皮细胞(图7a-b)。利用SCIENIC分析,他们确定了可能介导这些亚群生物学功能的关键TF,例如,IRF8在CCL21+内皮细胞(CCL21+Endo)中高度活化。
功能富集分析显示基质细胞中不同的途径发生激活(图 7e)。CAF 和 MC 中富集了多种途径,例如血管生成、上皮间质转化和肌生成。这些亚群也具有独特的生物学功能。如细胞对FGF的趋化性和G-CSF的产生,在iCAF中富集。RNA速度分析显示,这些CAF亚聚类主要来源于MMP2 CAF,然后分化为myoCAF和MC(图7f)。
值得注意的是,血管生成途径在所有 CAF 亚聚类中均富集(图 7e)。使用ST-seq数据,他们发现内皮细胞和成纤维细胞具有明显的共定位,呈现出良好的空间一致性(图 7g)。Pearson相关分析显示内皮细胞评分与CAF之间呈正相关,重要的是,LN + AM组观察到更高的相关系数(图 7h)。
他们进一步推测CAF促进血管生成并形成纤维血管生态位,这在肿瘤进展中发挥积极作用。为了证实这一点,他们进行了多重免疫组织化学 IHC 测定,发现 CAF 经常与内皮细胞一起出现并包裹在它们周围形成纤维血管生态位(图 7i)。与LN - AM相比,LN + AM存在更多的纤维血管生态位。这些结果表明,CAF促进血管生成并形成纤维血管生态位,从而促进AM的早期传播。
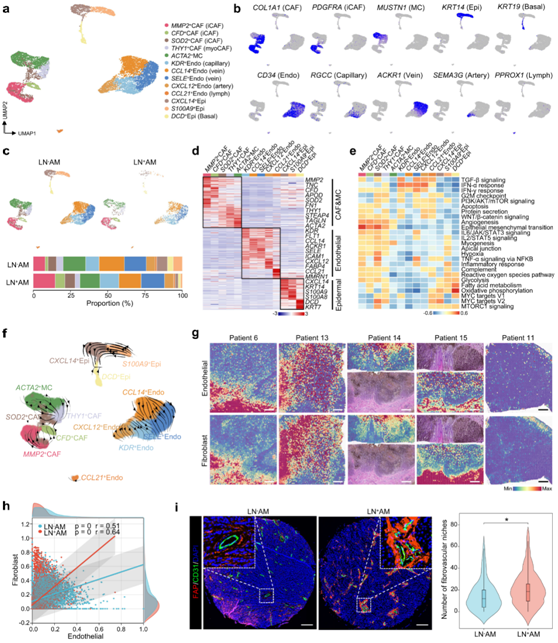
图7. AM 基质室内的纤维血管生态位。
(a) UMAP图显示了所有基质细胞的景观。(b) 显示用于注释这些亚聚类的经典标记基因的特征图。(c) UMAP 图显示亚聚类LN + AM 和 LN - AM 中的比例。 (d) 热图呈现这些亚聚类的聚类特定基因。(e) 对这些亚聚类中选定的标志路径进行 GSVA 分析。 (f) RNA 速度分析展示了这些亚聚类的进化轨迹。 (g) 使用 ST-seq 数据显示组织切片中内皮细胞和成纤维细胞得分的空间特征图。 (h) 散点图显示内皮细胞(x轴)和成纤维细胞(y轴)之间的相关性。 (i) 多重 IHC 检测在 AM 切片中通过抗 FAP 和抗 CD31 检测到的纤维血管生态位的代表性图像,以及显示 LN – AM和 LN+ AM中纤维血管生态位数量的小提琴图。
08
AM 中复杂的细胞间通讯
CellChat 分析检测到 AM 生态系统中的细胞间通讯广泛而复杂(图 8a)。黑色素瘤和基质细胞主要充当发送者,因为它们具有高的传出相互作用强度,而免疫细胞主要充当接收者,因为它们具有高的传入相互作用强度(图 8b)。浆B细胞 (Plasma B) 由于其传入和传出的相互作用强度较低而表现出较少的交流。
CLEC网络主要由CLEC2C/CLEC2B/CLEC2D-KLRB1对组成,并且在非肿瘤细胞中特异性表达。与LN - AM相比,LN + AM中CLEC途径的激活显著降低(图 8c)。C型凝集素超家族基因在NK细胞中高表达,可能参与NK细胞活性的调节。LN + AM中 CLEC 通路活性降低可能导致 NK 和 NKT 细胞减少。他们还展示了 GALECTIN 信号通路网络,该网络在 LN+ AM 中显著激活(图 8d)。主要配体LGALS9在LN−AM中主要表达于髓系细胞,在LN +AM中内皮细胞也有表达。CD44、CD45和HAVCR2作为受体,表明内皮细胞来源的LAGALS9在肿瘤细胞LN转移中起重要作用(图8e)。重要的是,他们在AM队列中证实了GALECTIN通路的配体-受体(L-R)对之间的相互作用(图8f)。这些结果表明,特定的细胞间通讯有可能塑造 AM 独特的 TME。
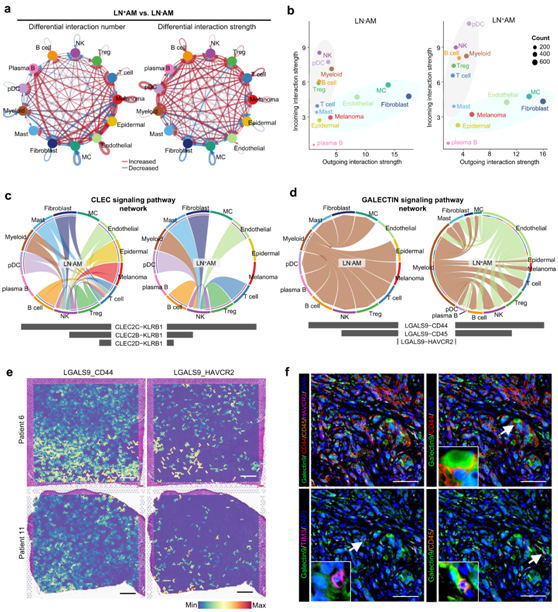
图8. AM 中的细胞间通信网络。
(a) 比较 LN + AM 和 LN - AM之间 13 种注释细胞类型的差异相互作用数量和强度。 (b) 散点图显示了 LN – AM 和 LN + AM 中 13 种注释细胞类型的传入和传出相互作用强度。 (c-d) 弦图显示了LN + AM 和 LN - AM 中所选的 CLEC和 GALECTIN信号通路网络。 (e) 使用 ST-seq 数据展示患者 6 和患者 11 组织切片中选定 LR 对的相互作用活动的空间特征图。 (f) 通过多重 IHC 测定捕获的AM 队列中 LR 对(Galectin-9_CD44、Galectin-9_TIM-3 和 Galectin-9_CD45)的代表性图像。
+ + + + + + + + + + +
结 论
本项研究结果揭示了 AM 中显著的肿瘤间和肿瘤内异质性,以及高度免疫抑制的肿瘤微环境和复杂的细胞间通讯网络,特别是在淋巴结转移的患者中。值得注意的是,他们发现MYC+黑色素瘤 (MYC+MEL) 和FGFBP2+ NKT 细胞与淋巴结转移之间存在很强的关联。此外,本项研究证明 LN 转移需要MYC+ MEL 细胞中 MITF 诱导的向FAO的代谢转变。Etomoxir是一种临床批准的FAO抑制剂,可以有效抑制MITF介导的LN转移。本项研究增加了对 AM 淋巴结转移的理解,并为早期 AM 传播的潜在治疗目标提供了新的理论依据。
+ + + + +



 English
English


