文献解读|Neuron(14.7):综合多组学分析揭示人类唐氏综合症患者大脑中保守的细胞投射缺陷
✦ +
+
论文ID
原名:Integrative multi-omic analysis reveals conserved cell-projection deficits in human Down syndrome brains
译名:综合多组学分析揭示人类唐氏综合症患者大脑中保守的细胞投射缺陷
期刊:Neuron
影响因子:14.7
发表时间:2024.08.07
DOI号:10.1016/j.neuron.2024.05.002
背 景
唐氏综合症 (DS) 是一种由人类21号染色体(HSA21)多余拷贝引起的神经发育障碍。患有唐氏综合症的人存在认知缺陷、言语和运动技能较差以及适应行为受损。从大脑解剖学角度来看,唐氏综合症的特征是海马/皮质生长减少、神经元迁移异常、树突分支减少以及突触可塑性异常。然而,一小部分基因的三重化如何影响唐氏综合症大脑病理生理的不同方面尚不清楚。
实验设计
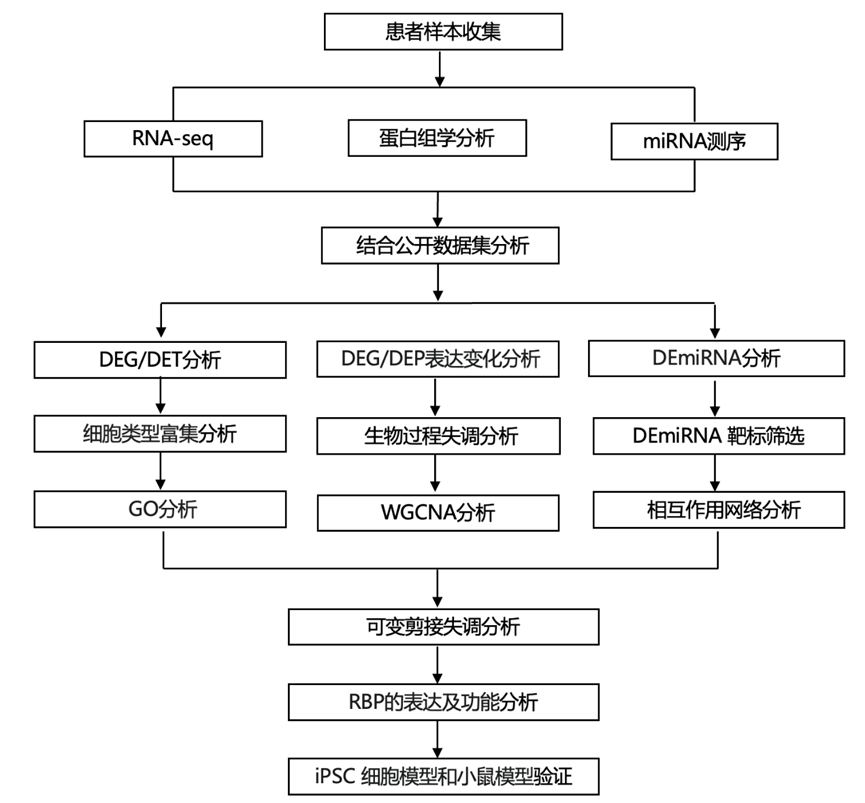
结 果
01
基因和转录本的表达存在差异,表明唐氏综合征患者脑样本中的失调仅部分重叠
为了探索唐氏综合征人脑样本中失调的新分子靶点,研究团队对 11 个对照和 9 个唐氏综合征海马样本以及 12 个对照和 10 个唐氏综合征皮质样本进行了转录组分析(RNA-seq)、蛋白质组学和miRNA测序。他们分别从海马和皮质中获得了 14221 和 14181 个基因、132552 和 138774 个转录本、3992 和 4109 个蛋白质以及 705 和 685 个 miRNA 的表达数据。由于存在可变剪接(AS),单个基因会生成多个转录本,因此他们定量了差异表达基因 (DEG) 和差异表达转录本 (DET) 的表达(图 1 A)。分别在海马和皮质中鉴定了 4827 个和 5548 个 DEG(图1B)。分别鉴定出海马和皮质中 5090 和 4718 个 DET,它们源自 3948 和 3623 个基因(图 1 B)。DS 和对照大脑之间的表达变化在转录水平上比在基因水平上更明显(图 1 C)。海马中约 51% 的 DEG 和皮质中 41% 的 DET 至少在一个特定转录本上失调(图 1 D)。此外,两个大脑区域中 35% 的 DET 源自非 DEG(图 1 B),这表明基因水平的失调可能不足以证明 DS 中转录组范围的变化,强调了研究单个基因的个体转录本的必要性。海马中的 DEG 数量低于皮质中的 DEG 数量(图 1 B),但两个区域之间共有许多 DEG。在转录水平上,海马中的 DET 数量高于皮质中的 DET 数量(图 1 B),皮质中的三重 DET 数量(40%)更丰富。然而,两个区域之间共有的 DET 数量少于 DEG 数量。
特定组织中的表达变化可能源于细胞类型比例的变化或这些细胞内基因表达的变化。他们使用bootstrap分析来检测DEG和DET在不同脑细胞类型中的富集。上调的基因/转录本在所有类型的胶质细胞(星形胶质细胞、小胶质细胞和少突胶质细胞)(图1E),而下调的基因/转录本富集在已知在神经元细胞(中间神经元和锥体细胞)(图1 e)。接下来,他们对数据进行了GO分析,以确定生物过程、分子功能和细胞组分的显著富集(图 1 F-G)。在海马中,DEG 和 DET 之间的共有通路包括轴突形成、细胞死亡、神经发生、细胞投射形态发生、核糖体生物发生、GABA 受体复合物和细胞外囊泡。相反,干扰素-γ 介导的信号通路、RNA 加帽和GTPase调节活性特定于基因水平。对 TGF(转化生长因子)、病毒过程和磷酸化的反应特定于转录水平。
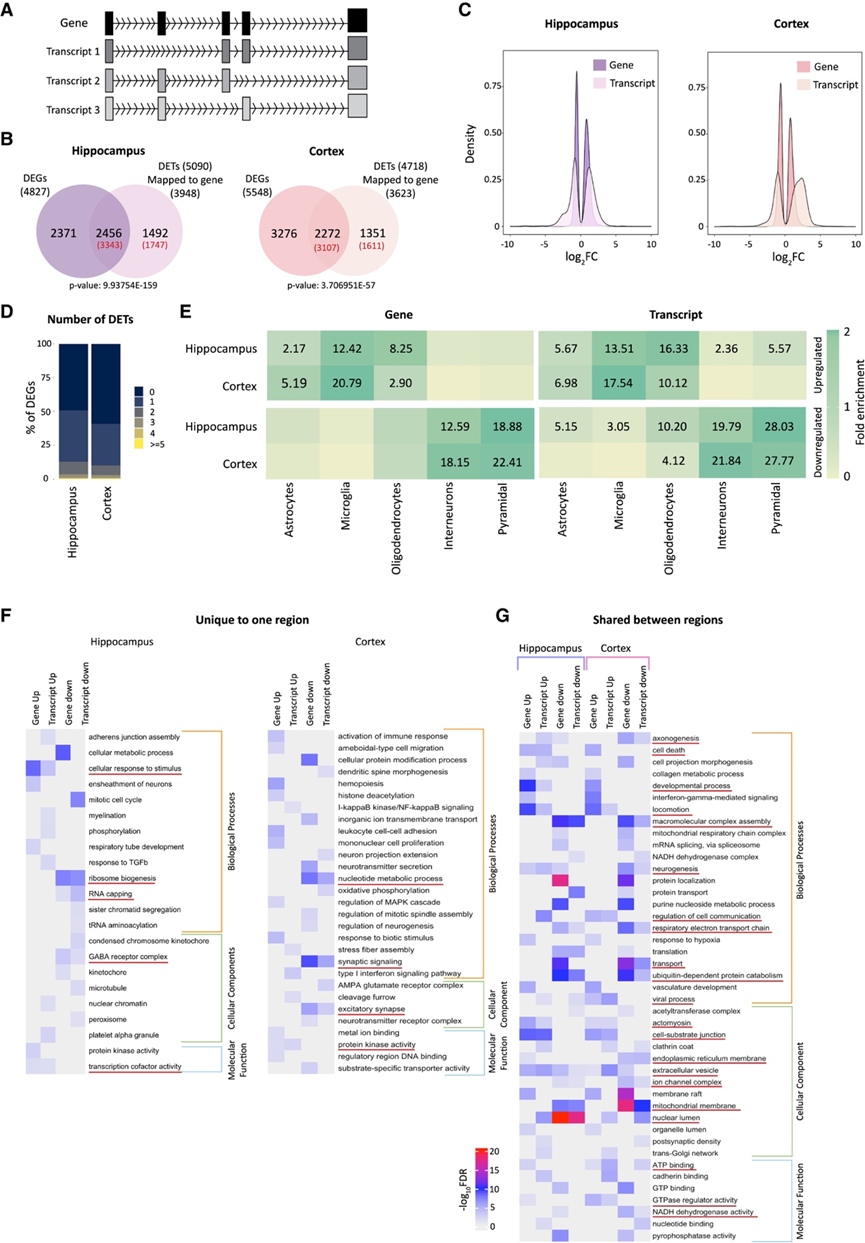
图1. 基因和转录本的表达存在差异。
(A) 基因/转录本关系。(B) 显著差异表达基因 (DEG) 和转录本 (DET)。(C) DS 和对照组海马体(紫色)和皮质(粉色)中的 DEG/DET 数量。 (D) 海马/皮质中具有不同数量 DET 的 DEG 百分比。(E) 不同细胞类型中上调/下调基因和转录本的细胞类型富集。 (F-G) GO分析。
02
DEG 与蛋白质仅揭示了唐氏综合征患者脑样本中一些常见的失调生物过程
接下来,他们整合了RNA-seq和蛋白质组数据集,并比较了所有检测到的蛋白质(包括未差异表达的蛋白质)在基因(即 mRNA)和蛋白质水平上的整体表达变化。对于三倍体和非三倍体基因,海马和皮质中的mRNA 和蛋白质表达之间存在低但显著的相关性(图 2 A)。然而,他们没有观察到单独的倍体基因的显著相关性。两个大脑区域之间的整体表达模式在 mRNA 和蛋白质水平上都高度相关(图 2 B)。
他们在海马体和皮质中观察到许多显著差异表达的蛋白质 (DEP)(分别为 1158 和 1029)(图 2 C)。大约 40% 的 DEP 在基因水平上也在海马体(465 个重叠的 DEP/DEG)和皮质(420 个重叠的 DEP/DEG)中存在差异表达(图 2 C)。当他们分析共有 DEP/DEG 的上调或下调的方向时,只有海马中的 251 个 DEP 和皮质中的 292 个 DEP(分别占总 DEP 的 54% 和 70%)在 mRNA 水平上显示出与相应蛋白质相同方向的变化(图 2 D)。他们还对 DEP 进行了细胞类型富集分析,结果与 DEG 和 DET 分析的结果一致(图 2 E),虽然总体表达变化在 mRNA 和蛋白质水平上可能表现出较低的重叠性,但它们都趋于一致,以识别特定于不同细胞类型的表达失调。蛋白质水平的生物富集与基因水平的生物富集大多不同,它们之间只有少数功能富集是相同的,例如轴突发育、神经发生、神经递质分泌、突触信号传导、细胞-底物连接和细胞外囊泡(图 2 F-G)。
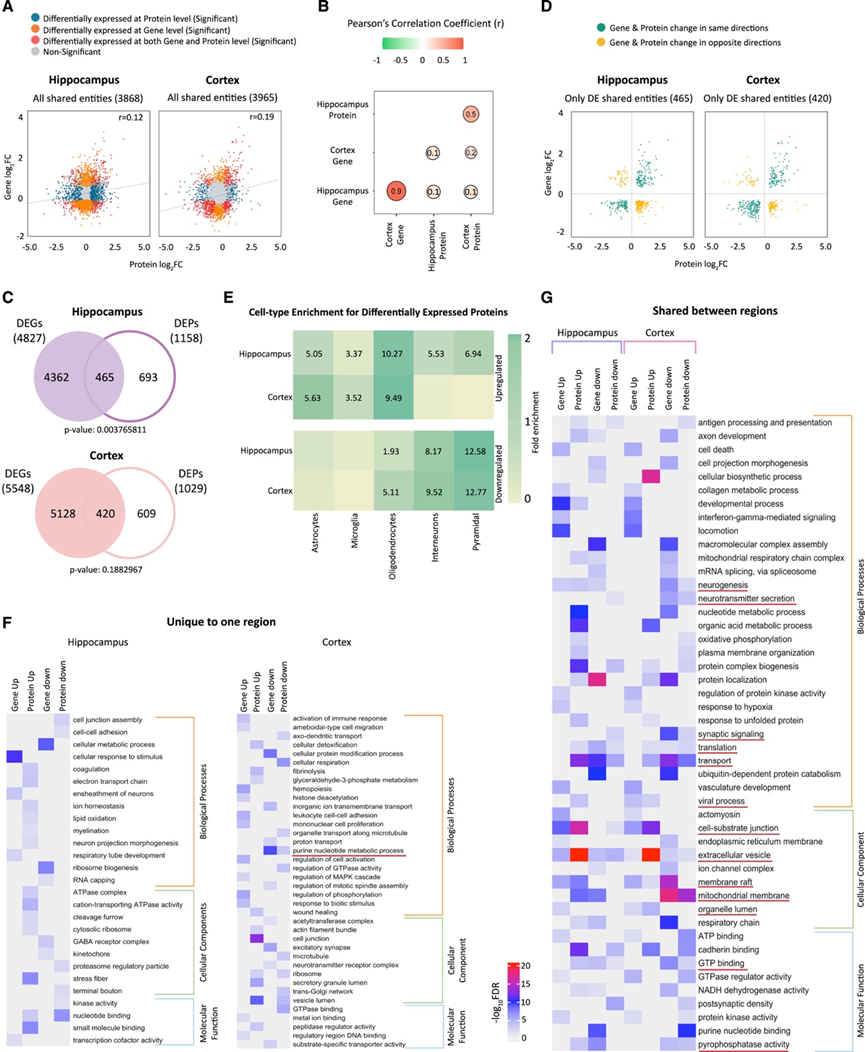
图2. 差异表达基因与蛋白质揭示了唐氏综合征患者脑样本中不同的生物过程失调。
(A) 海马/皮质中基因和蛋白质分析中所有实体的基因/蛋白质表达变化。(B) 差异表达基因和蛋白质的基因和蛋白质表达相关性。(C) 具有重叠和不重叠实体的DEG/DEP 。(D) 重叠 DEG/DEP 的基因表达和蛋白质表达变化。(E) 细胞类型富集。(F-G)GO分析。
03
不同的基因与蛋白质模块分析
鉴于 DS 中基因表达和蛋白质表达普遍失调,他们研究了这些变化在系统层面的影响。他们使用加权基因共表达网络分析 (WGCNA) 确定了具有高水平共表达的基因和蛋白质的独立模块。他们在海马样本中发现了19个基因和16个蛋白质模块,其中3个基因和3个蛋白质模块与DS呈显著正相关(图3 A-B)。另有3个基因和3个蛋白质模块与DS呈显著负相关。
他们进行了细胞类型富集分析,以确定单个模块中涉及的基因和蛋白质的重要性,一些海马基因模块显著富集了神经胶质细胞表达的基因(图 3 A),而其他基因模块主要富集了神经细胞基因。两个海马蛋白质模块显著富集了神经胶质细胞蛋白质,其中 P-HH-2 模块也富集了神经细胞蛋白质,而模块 P-HH-1、P-HH-3 和 P-HH-6 富集了神经细胞蛋白质。接下来,他们对重要模块进行了 GO 分析,正相关的基因模块在神经发生、细胞通讯、免疫和细胞死亡方面富集,而负相关的基因模块在RNA 剪接、电子传递链和核糖体生物合成方面富集(图 3 A-B)。
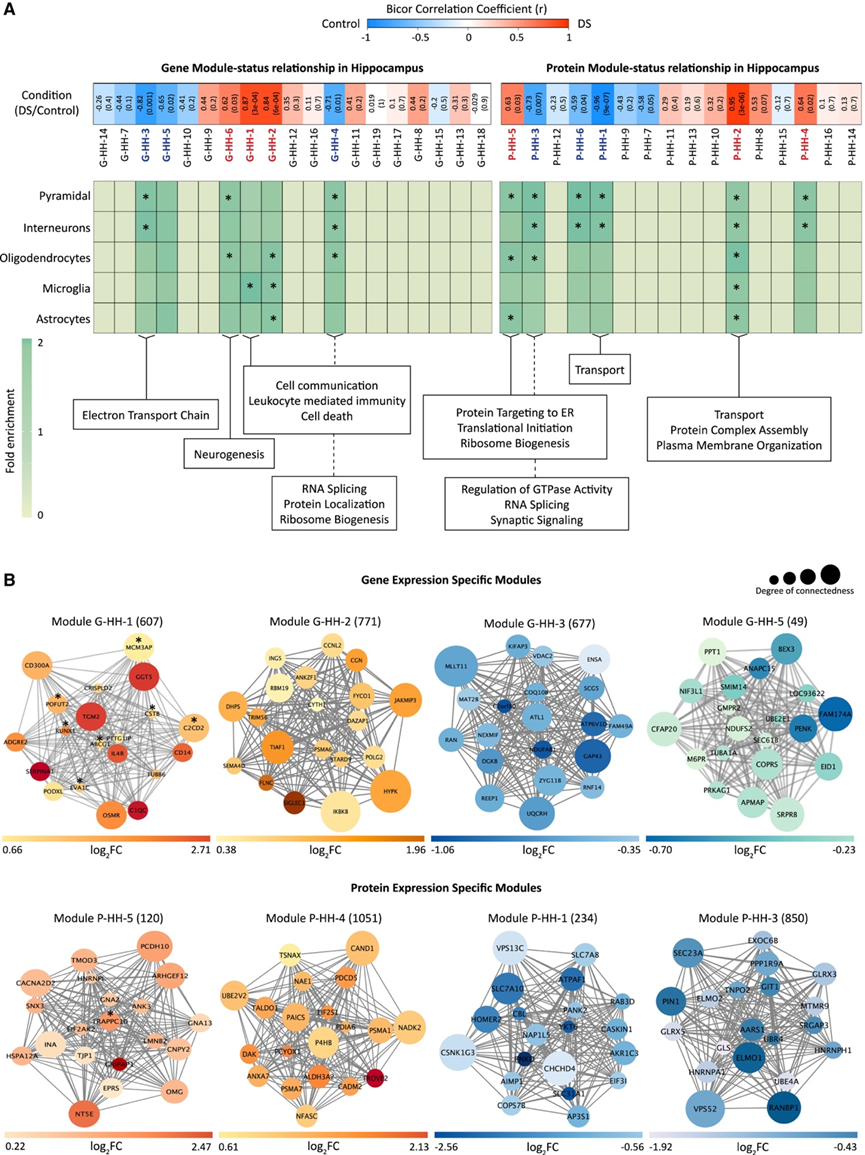
图3. 海马体中不同的基因与蛋白质模块分析。
(A) 加权基因共表达网络分析(WGCNA)。 (B) 基因-基因(上)或蛋白质-蛋白质(下)相互作用网络。
04
miRNA 在唐氏综合征患者脑样本中存在差异表达
他们通过研究 miRNA 的作用进一步研究了基因和蛋白质失调,miRNA 通过降解靶基因 mRNA 或抑制其翻译来降低靶基因的表达。miRNA 测序分别在 DS 海马和皮质中鉴定出 32 个和 50 个差异表达 miRNA (DEmiRNA)(图 4 A)。两个大脑区域之间共有六个 miRNA(图 4 A)。
他们还评估了 DEmiRNA 与其预测靶基因之间的可能关系,首先使用 TargetScan 数据库预测了 DEmiRNA 靶标,接着他们筛选了预测的靶基因,以分离出那些(与相应的 DEmiRNA 表达相比)在基因或蛋白质水平上表达呈负相关的基因(图 4 B)。DEmiRNA 可能导致海马中 32% 的 DEG 和 29% 的 DEP 失调以及皮质中 62% 的 DEG 和 61% 的 DEP 失调(图 4 C),而 12% 的海马和 28% 的皮质靶标在 mRNA 和蛋白质水平上均失调(图 4 C)。他们对所有 DEmiRNA 的差异表达靶标进行了 GO 分析,发现它们参与了轴突形成、细胞死亡、细胞投射形态形成、中枢神经系统发育、运动、神经形成和Wnt 信号通路(图 4 D)。对单个 DEmiRNA 靶标的进一步评估表明,海马 miR-181a-5p 和皮质 miR-15b-5p(图 4 C)具有差异表达最多的负相关靶标,这些靶标显示出细胞投射、轴突形成和神经形成的富集。
最后,在基因、转录本和蛋白质水平上对 WGCNA 与 DEmiRNA 的共表达模块进行评估,结果表明下调的 miRNA 与下调的模块呈正相关,反之亦然。进一步的层次聚类分析表明,具有相似变化的 miRNA 或模块聚集在一起(图 4 E)。为了更好地可视化 DEmiRNA 与其相关模块之间的关系,他们为海马体中的显著相关性创建了一个相互作用网络(图4E-F)。该网络突出显示了可能作为调节基因、转录本或蛋白质水平共表达模块及其之间关系的潜在枢纽的 DEmiRNA(图 4 F)。
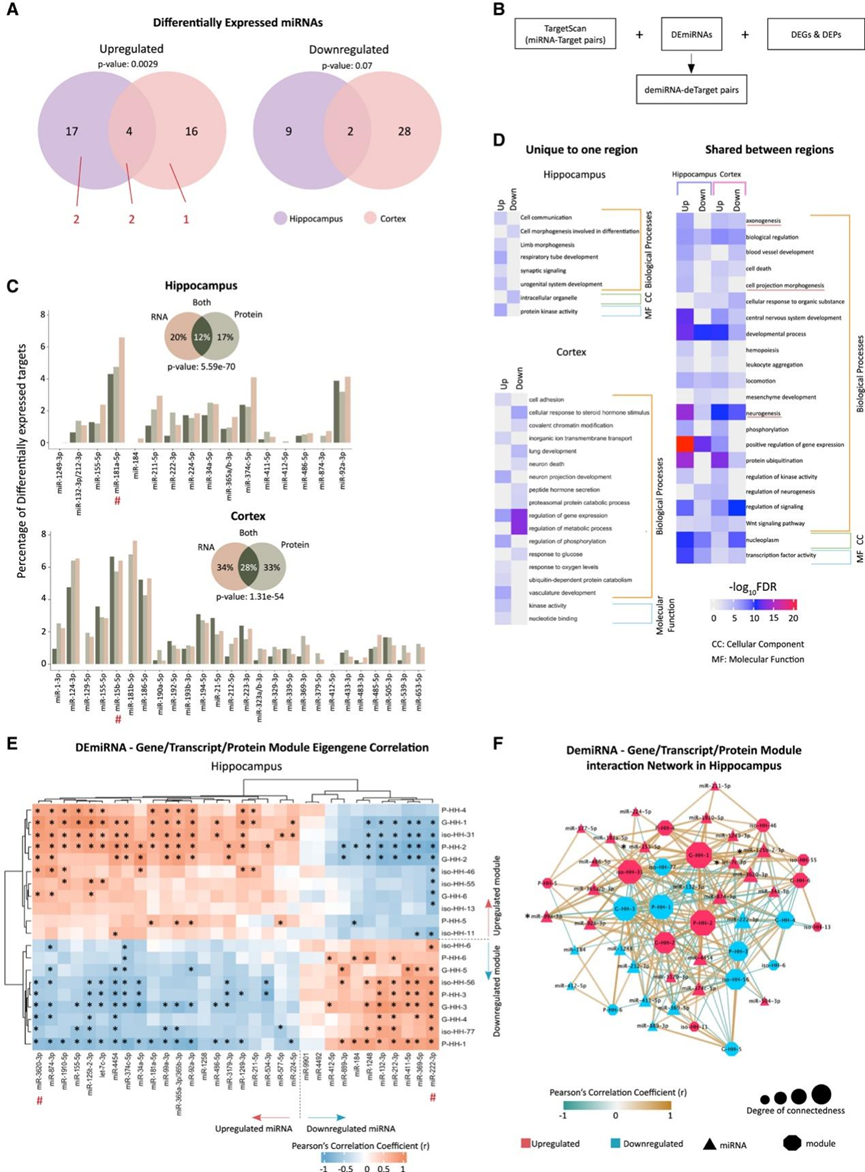
图4. 唐氏综合征患者体内失调的 miRNA 控制靶标属于多个生物过程。
(A) DEmiRNA 在海马体和皮质之间重叠。(B) 差异表达分析示意图。(C) 海马和皮质中显著 DEmiRNA 在 RNA(浅棕色)、蛋白质(浅绿色)或基因和蛋白质水平(深绿色)上与总体差异表达分析相比有显著差异表达的 miRNA 靶标百分比。(D) GO 分析。(E) DEmiRNA 与模块特征基因之间的 Pearson 相关系数。(F) DEmiRNA 的相互作用网络。
05
唐氏综合征患者大脑样本中的 AS 失调
为了进一步探索导致 DS 中基因表达失调的调控机制,他们研究了 AS 的作用。对 RNA-seq数据进行了 VAST-Tools分析,并估计了 DS 和对照样本中可能发生的不同类型的剪接事件(图 5 A)。他们发现内含子保留(IR) 和外显子跳跃(EX) 是两组中最丰富的事件,占海马和皮质中所有剪接事件的 85% 以上(图 5 B)。EX 和 IR 事件在海马和皮质之间显示出中度重叠。
他们还发现许多基因经历了多重剪接事件,其中 224 个基因同时经历了 EX 和 IR 事件(图 5 C)。这些结果表明 AS 可能导致基因表达的差异,他们分别在海马和皮质的 DEG 中发现了 EX和 IR剪接事件。海马体和皮质中的大部分下调基因都经历了 EX(图 5 C)。海马体中许多下调的基因经历了 IR 事件。相反,皮质中许多上调的基因经历了 IR(图 5 C)。GO 分析显示海马体和皮质中富集了轴突形成、细胞投射组织、神经发生、细胞周期、染色质修饰、代谢过程、运输和 RNA 剪接(图 5 D)。
与其他组织相比,神经元组织中的微外显子(长度为3 - 27nt的外显子)丰富。它们对大脑的生理发育很重要,它们的耗竭与社会行为、学习和记忆缺陷有关。与对照样本相比,DS的微外显子与大外显子的跳跃减少(>27 nt)。他们发现内含子长度存在显著差异,保留内含子的长度比非保留内含子的长度短(图5 F),同时 3′ 和 5′ 剪接强度较低,GC 含量较高。
最后,他们定义了参与 EX 和 IR 的基因的细胞类型富集。该分析得出海马和皮质中所有细胞类型(EX 的小胶质细胞和 IR 的部分中间神经元除外)的普遍富集(图 5G),表明 AS 缺陷可能是 DS 细胞的普遍特征。
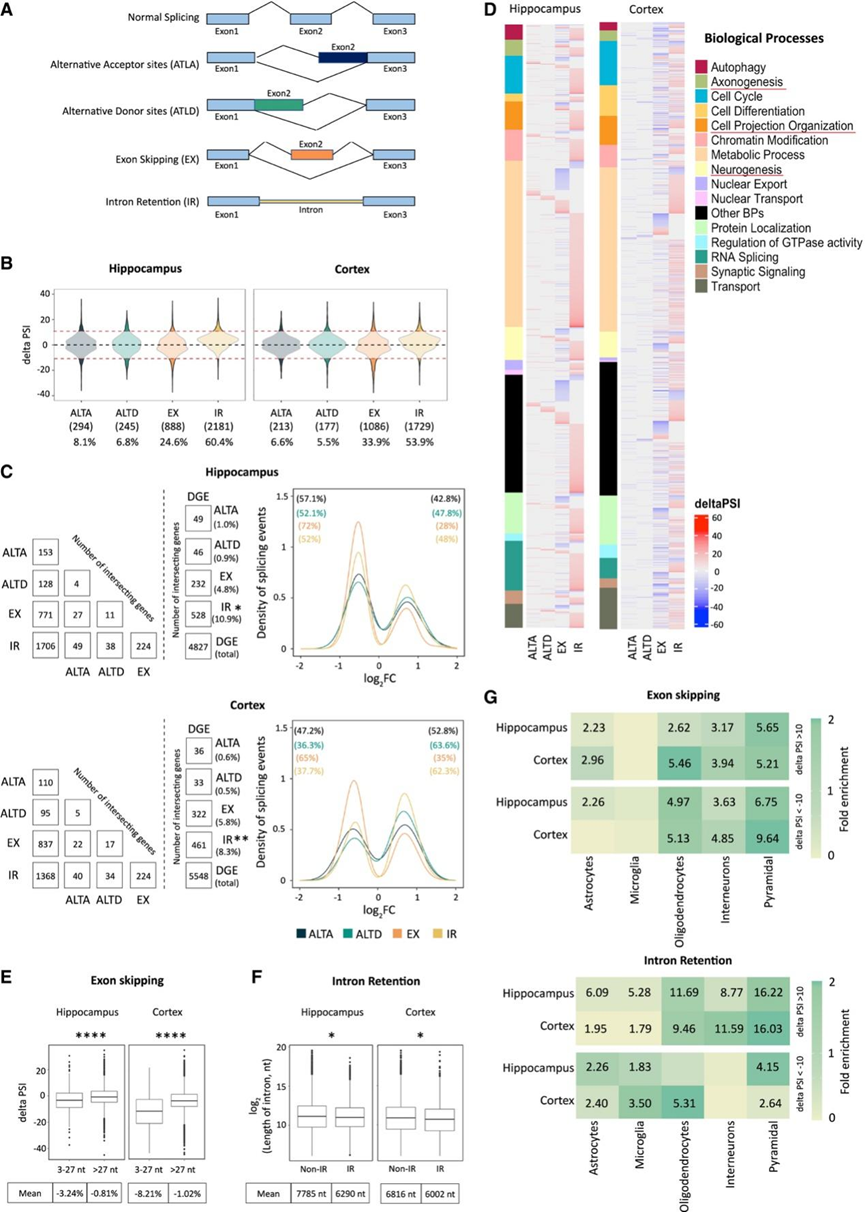
图5. 唐氏综合征患者脑样本中的可变剪接失调。
(A) 差异剪接分析中考虑的可变剪接事件。 (B) 可变剪接事件的 PSI 变化分布。(C) 发生可变剪接事件的基因与海马/皮质相应 DEG 的重叠(左)。发生不同可变剪接事件的基因数量及其对应的海马/皮质 log 2 FC 分布(右)。(D) GO分析。(E) DS 组和对照组之间的微外显子 (3–27 nt) 和大外显子 (>27 nt) 的 DeltaPSI。(F) 是否发生 IR 的基因中内含子的长度。(G) IR 和 EX 事件中 deltaPSI >10 或 <-10 的细胞类型富集。
06
RBP 的表达与唐氏综合征大脑中 EX 的改变相关
多种RNA结合蛋白(RBP)调控 AS,他们利用RBP 结合基序数据集评估了哪些 RBP 可能调控 EX。他们预测了这些 RBP与DS 中差异跳跃外显子周围序列的结合,并根据外显子和内含子区域将它们分为六个区域(图 6 A)。在预测与跳跃外显子周围序列结合的 RBP 中,从蛋白质组学数据集中分离出存在差异表达的 RBP(图 6 A)。他们发现 26 个 RBP 存在差异表达,并且位于两个基因 EX 连接处的 6 个不同区域附近,且 delta PSI >10 或 <-10(图 6 B)。
接下来,他们计算了参与 EX 的基因的蛋白质水平差异表达 RBP 丰度与 PSI 之间的 Pearson 相关性,并筛选了 RBP-PSI 相关对,其中p < 0.05 和 r > |0.8|(图 6 C)。他们仅关注与相关性最高的 RBP 相比具有 70% 以上显著相关性的 RBP(图6D)。多个 RBP 涉及不同层面的单个分析:(1)位置权重矩阵(PWM) 区域富集(图 6 B)、(2) RBP-PSI 相关性(图 6 D)和 (3) RBP-基因表达相关性(图 6 F)。然而,当整合所有三种分析时,发现它们之间只有一个 RBP,即多聚嘧啶束结合蛋白 2 (PTBP2) 是共有的(图 6 G)。考虑这些单独分析中 PTBP2 的靶标并进行另一次重叠后,两个或多个分析之间有六个 PTBP2 靶基因是共有的(图 6 H)。DS 样本中 PTBP2 蛋白丰度与其靶基因的基因表达和剪接之间存在显著相关性,但在对照样本中没有。这表明 chr21 基因的三倍表达可以极大地影响非三倍体基因的表达,例如 PTBP2 及其下游靶标。最后,对 PTBP2 靶标进行 GO 分析表明,它们在细胞投射组织和神经发生中富集(图 6 B-H)。

图6. RNA 结合蛋白是唐氏综合征患者海马样本中外显子跳跃的原因。
(A) 外显子跳跃基因中 RNA 结合蛋白 (RBP) 基序富集(黄色)的方法。 (B) 在进行 EX 时,deltaPSI >10 或 <-10 的基因不同区域中每个差异表达 RBP 的结合基序数量。(C) RBP 与 EX 相关性方法。(D) 随机选择的差异表达 RBP 子集的 RBP-EX 相关性。(E) RBP 与基因表达相关性方法。(F) 随机选择的差异表达 RBP 子集的 RBP-基因表达相关性。(G) RBP 重叠分析,从而确定 PTBP2 为共同的 RBP。(H) PTBP2 的靶基因分析。
07
来自唐氏综合征患者的 iPSC 和来自 Ts65Dn 小鼠的海马原代培养物的神经元表现出神经元极化缺陷
生物信息学研究表明,在所有分析层面上,DS 中与轴突形成相关的基因普遍失调。神经元中单个轴突 (SA) 和多个树突的形成称为神经元极化,它对于正常的神经元网络功能至关重要。确定在体外发育过程中人类神经元的神经元极化(轴突形成)是否存在缺陷,他们分析了分化成神经元 (iNeurons) 的人类对照和 DS 诱导多能干细胞(iPSC)。使用了对照(Ctrl1:DS2U)和从患有嵌合体型 DS 的个体中获得的三体(Ds1:DS4)同源基因对细胞系。在最终接种神经元分化30 天后的 iNeurons 上,他们进行了 RNA-seq 分析,发现通路富集模式与DS 脑数据集类似,包括轴突形成、突触信号传导、GABA 受体和离子通道复合物富集(图 7 A)。他们通过使用轴突标记物Trim46和树突标记物 Map2染色,直接评估了接种 30 天后 iPSC 衍生的 iNeurons 中的神经元极化。他们定量了显示单个轴突(一个初始轴突节段 [AIS])、无轴突(无 AIS)或多个轴突(多个 AIS)的细胞百分比(图 7 B)。与同源对照系相比,他们发现 DS 系中具有多个轴突的细胞百分比显著增加(图 7 C-D)。他们还从第二个患有 DS 66嵌合体型的人体内收集了第二对同源对照和三体细胞系(Ctrl2 和 Ds2),获得了类似的结果(图 7 D)。
他们在两种不同的 DS 小鼠模型[Ts65Dn和 Dp(16) ]的海马中进行了蛋白质组学分析,并发现了几种 DEP。虽然数量不同,但两种模型之间共有很大一部分 (50.8%) 的 DEP,表明表达失调的模式相似。GO分析突出显示了两种模型中轴突发育和 RNA 剪接的改变(图 7 E),从而验证了在人类大脑样本和神经元中的结果。
最后,他们通过使用轴突标记物AnkG和Pan-Nav以及Map2进行染色来验证 Ts65Dn 原代海马神经元的轴突表型(图 7 F)。他们发现在体外14 天和 21 天时 DS 神经元中具有多个轴突的海马神经元(DIV)百分比显著增加(图 7 G-H)。此外,在小鼠 DS 培养物中,他们发现具有一个轴突的神经元(DIV 14)数量显著减少,而没有轴突的神经元数量显著增加,表明神经元极化存在缺陷。

图7. 唐氏综合征患者的 iPSC 衍生的神经元和唐氏综合征小鼠模型的原代海马培养物中存在神经元极化缺陷。
(A) GO分析。(B) 对轴突标记物Trim46和树突标记物Map2进行染色。(C) 来自实验的 iNeurons 的神经树。(D) 具有单个、多个或没有轴突的神经元的百分比。(E) GO分析。(F) 对轴突标志物Pan-Nav和AnkG以及树突标志物Map2进行染色。 (G) 实验中的小鼠神经元的神经树与 (F) 中相同,其中细胞的位置经人工排列以显示轴突(红色)和树突(蓝色)。(H)具有单个、多个或没有轴突的神经元的百分比。
+ + + + + + + + + + +
结 论
本项研究采用了多组学方法分析了人类死后唐氏综合症大脑两个不同区域的表达特征,发现三倍体基因的过度表达会引发整体表达失调,对已知和新型生物候选通路中涉及的转录本、miRNA和蛋白质产生不同的影响。本项研究观察到RNA 剪接的改变,特别是调节唐氏综合症大脑中涉及细胞骨架和轴突动力学的基因的表达。唐氏综合症人类iPSC和小鼠的神经元轴突极化发生了改变。本项研究提供了一个集成的多层表达数据库,能够识别新的潜在靶点,以帮助设计未来的唐氏综合症临床干预措施。
+ + + + +



 English
English


