文献解读|Cell(45.5):脑脊液蛋白质组学鉴定出常染色体显性阿尔茨海默病的早期变化
✦ +
+
论文ID
原名:CSF proteomics identifies early changes in autosomal dominant Alzheimer’s disease
译名:脑脊液蛋白质组学鉴定出常染色体显性阿尔茨海默病的早期变化
期刊:Cell
影响因子:45.5
发表时间:2024.09.26
DOI号:10.1016/j.cell.2024.08.049
背 景
常染色体显性阿尔茨海默病 (ADAD) 约占所有阿尔茨海默病(AD)病例的 1%。ADAD的特征是淀粉样蛋白前体蛋白 (APP)、早老素-1 (PSEN1) 或早老素-2 (PSEN2)基因存在常染色体显性突变。这种罕见的AD 形式对于阐明关键的病理机制和与 AD 相关的大脑变化的时间进展至关重要。因此,全面研究这种疾病形式的脑脊液 (CSF) 蛋白质组变化有助于加深对其病理生理学的理解,并有助于识别以前未报告的生物标志物和潜在的治疗策略。
实验设计
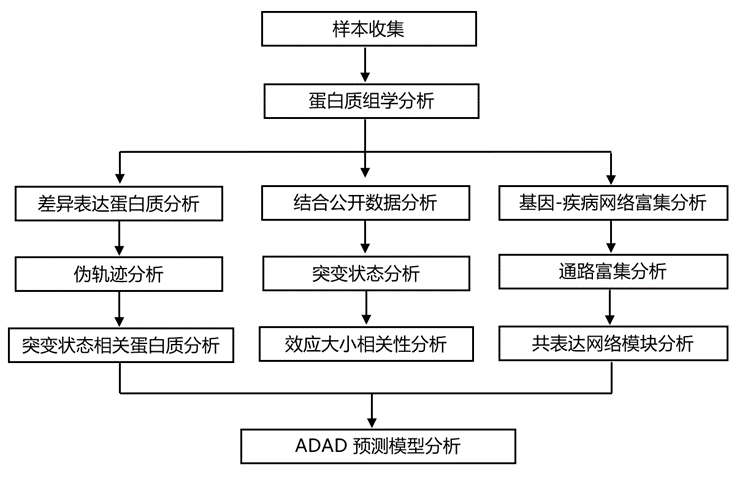
结 果
01
脑脊液样本中的蛋白质鉴定
本研究的主要目标是确定在脑脊液和血浆中,与ADAD突变非携带者 (NC)相比,ADAD 突变携带者 (MC)中出现早期变化的蛋白质。本研究旨在确定 ADAD 的最早生物标志物,从而有可能为 ADAD 的症状前阶段提供有价值的见解,并制定早期干预策略。为此,研究团队使用了一种独特的方法,利用预计的AAO(在症状出现时表现出的年龄)来评估伪轨迹,并确定了 MC 和 NC 之间存在显著差异的蛋白质。
他们从显性遗传阿尔茨海默病网络研究(DIAN)中的AD 突变的样本中提取脑脊液(CSF)(6163 种蛋白质)和血浆(6022 种蛋白质)并进行了蛋白质组学分析(图1)。MC 包括有症状和症状前的 DIAN 参与者,他们携带三个 ADAD 基因(APP、PSEN1或PSEN2)之一的致病变异。症状前的参与者是认知正常的 MC。匹配的 NC 来自 MC 的家族。该对照组的参与者具有相似的遗传背景和环境影响,进一步增强了本项研究检测可靠蛋白质组学改变的能力。
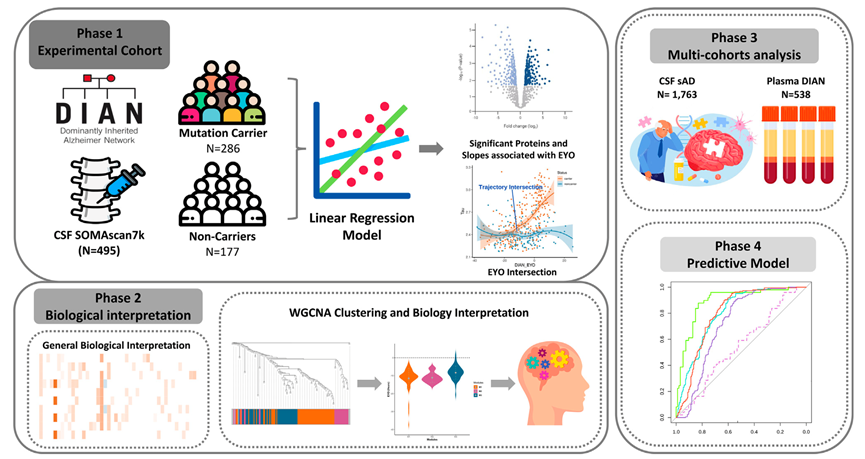
图1. 研究概述。
他们分析了 286 个 MC 和 177 个 NC 中的 6163 种独特蛋白质。在初始阶段(143 个 MC 和 88 个 NC),他们鉴定出 247 种蛋白质(259 种适体),它们在 MC 和 NC 之间表现出明显不同的伪轨迹(图2 A)。在重复实验阶段,仅检测了这 247 种蛋白质(259 种适体),并且在初始和重复之间的效应方向相同(图2 A)。将Aβ、pTau 和 Tau 纳入比较,因为它们是已知且经过充分验证的 AD 生物标志物(图 2 C)。前 30 个匹配项包括据报道与 AD 相关的蛋白质,例如神经丝 (NEFH、NEFL)、钙调神经磷酸酶复合物 (PPP3CA、PPP3R1)和 14-3-3 蛋白 (14-3-3 beta、gamma、zeta)。本项研究还分析了其他具有重要意义的蛋白,这些蛋白未曾报道,包括细胞外基质结合(SMOC2, SLIT2),蛋白质代谢过程的负调控(PEBP1, GPI, PTPA, CRKL, PIN1),细胞骨架蛋白结合(PDLIM4, PDCD5, STMN2, TMOD3或MAPRE3),细胞质功能(CHN1, DLG2)和蛋白质结合(TCEAL5, GARS1)。
在ADAD MC中,只有一种蛋白下调:NPTX2。对137种鉴定的蛋白质进行了额外的分析,根据突变所在的基因对个体进行分层(即仅在PSEN1和PSEN2中突变的个体)(图3)。为了确定伪轨迹分析的可靠性,他们根据突变状态作为表型进行了进一步分析,比较了 MC 和 NC(图 2 B)。他们鉴定出 227 种与突变状态相关的蛋白质(240 个适体)(图 3 B)。在 227 种显著蛋白质中,14 种蛋白质在 MC 中下调,其余 239 种蛋白质上调。除 16 种与伪轨迹相关的蛋白质外,所有蛋白质在此分析中也具有显著性(图 3 B)。与突变状态相关的上调最显著的蛋白质包括壳三糖苷酶 (CHIT1)、NEFL、YWHAG、ITGA1/ITGB1和 PPP3CA/PPP3R1。下调的蛋白质包括 NPTX2、EPHA4 或 RELT。他们发现这两次分析的效应大小之间存在很强的相关性(图 3C)。在本研究中鉴定的蛋白质中,有 12 种存在于 Johnson 等人的研究中,并且所有蛋白质也与本研究相关(图3D)。Van de Ende 等人使用基于 Olink 的蛋白质组学检测了 22 个 MC 和 20 个年龄和性别匹配的对照中的 808 种蛋白质。该队列独立于本研究中包括的样本。 Olink Panel上存在的 19 种重要蛋白质中,有两种蛋白显示出显著的关联(GFAP 和 SFRP1)(图 3 E)。当他们整合两项研究的数据时,在 137 种伪轨迹蛋白质中,有 26 种独特蛋白质存在于至少一项研究中,并且它们都在其中一项研究中表现出名义关联和一致的关联方向,证明了本项研究结果的稳健性。在比较与突变状态相关的 227 种时也发现了类似的结果(图3F-G)。
当检测与 DIAN 中的突变状态相关的 227 种蛋白质时,他们发现散发性阿尔茨海默病(sAD)和 ADAD 突变状态分析之间的效应大小具有非常高的相关性(图3H)。有7种蛋白与sAD负相关:DLK2、EPHA4、GAGE2A、TNFRSF21、HS6ST3、RELT和LRP1。DLK2与神经突生长、突触可塑性和神经保护有关,并与焦虑和抑郁有关。EPHA4参与了突触功能障碍导致的AD的进展,并在神经元中富集。GAGE2A在癌症中的免疫系统功能发挥重要作用,但其在神经系统疾病中的作用尚不清楚。RELT是肿瘤坏死因子(TNF)受体超家族的一员,已证明有助于血脑屏障特性的获得和发展。TNFRSF21和RELT(又名TNFRSF19)都是血脑屏障内皮细胞中Wnt/ β -catenin信号通路的下游靶点。当TNFRSF21/TNFRSF19信号失调时,可导致血脑屏障内皮层的破坏。值得注意的是,Wnt/ β -连环蛋白信号通路对中枢神经系统(CNS)血管生成至关重要,但对外周血管的发育并不重要。HS6ST3和GAGE2A都与免疫反应和炎症有关。EPHA4和LRP1参与突触结构和细胞内运输这些发现强调了内皮细胞、血脑屏障、炎症和内溶酶体途径中不同蛋白质和改变的差异调节如何导致不同的疾病(ADAD和sAD)结果。
为了研究哪些蛋白质与 sAD 或 ADAD 的关联强度存在差异,他们确定了效应大小超出所有 227 种与 ADAD 相关的蛋白质的回归的 95% 置信区间 (CI) 的蛋白质。有五种蛋白质(CHIT1、SMOC1、SMOC2、NEFL 和 CAND1)在 ADAD 中的效应大小明显高于在 sAD 中的效应大小(图 3 H)。ADAD 中差异最大的蛋白质是 CHIT1。CHIT1 是小胶质细胞活化的假定标志物,已证明在 AD 患者的脑脊液和外周血中升高。在 ADAD 中的另一种重要蛋白质是 CAND1,它参与调节泛素-蛋白酶体途径 (UPP)。在 ADAD 中,唯一表现出显著较低效应大小的蛋白质是 NPTX2,它在 ADAD 和 sAD 中均下调。NPTX2 是一种谷氨酸受体,存在于已建立的突触中,与多巴胺能神经细胞的非凋亡性细胞死亡有关(图 3H)。
总之,该分析揭示了 ADAD 和 sAD 之间存在显著程度的重叠,同时也验证了 sAD 中的 MC 蛋白质组学分析,并强调了 sAD 和 ADAD 之间不同的几种蛋白质和潜在机制。
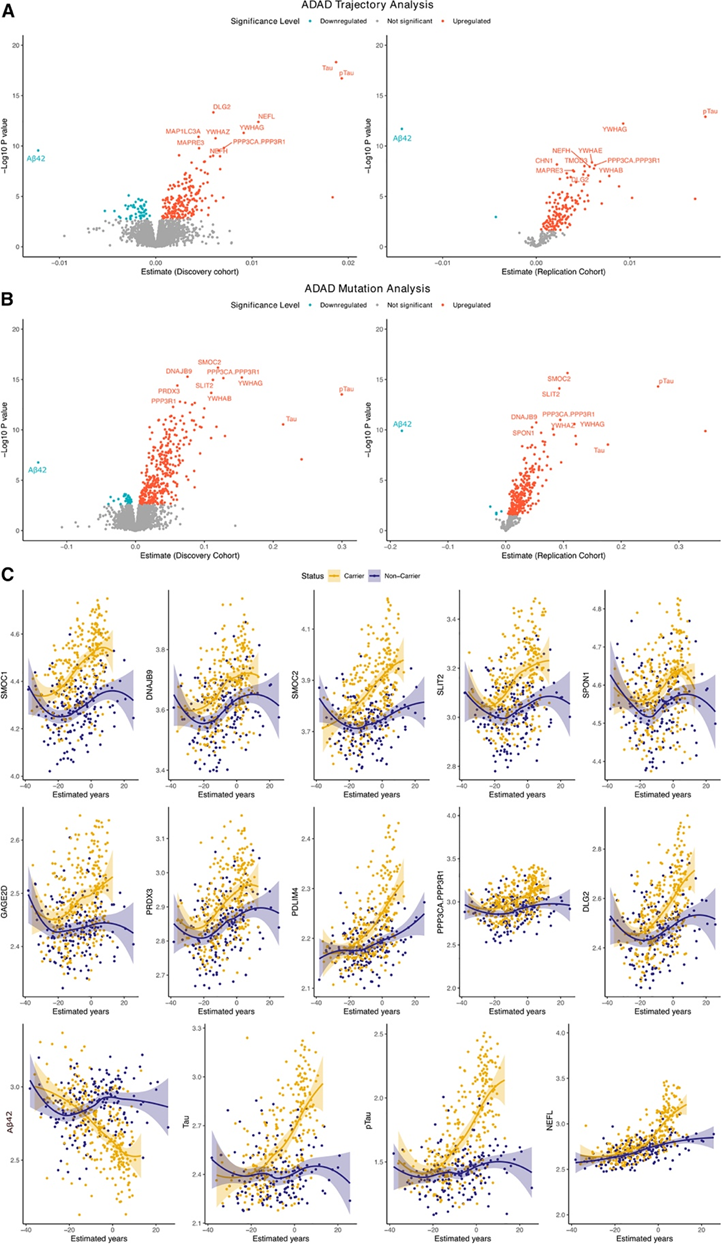
图2. CSF 中与 ADAD 突变状态相关的显著伪轨迹蛋白和显著蛋白。
(A-B) 火山图显示所有测试蛋白质的变化。(C) 十二种伪轨迹蛋白。
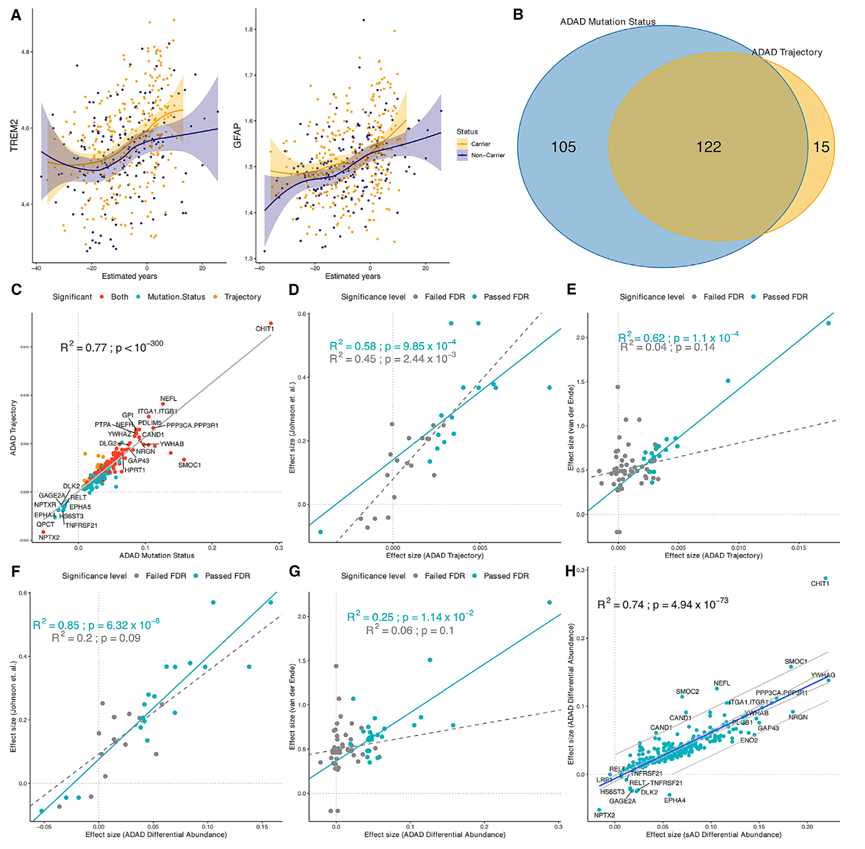
图3. 重要伪轨迹蛋白的验证。
(A) TREM2 和 GFAP 的拟轨迹曲线。(B) MC 与 NC 的轨迹分析和 ADAD 突变状态分析中重叠的显著蛋白质。(C-H)重复的显著轨迹蛋白的散点图。
02
脑脊液失调蛋白涉及与神经元死亡和炎症有关的通路
他们应用相同的模型对来自 ADAD 血浆样本的 325 个 MC 和 213 个 NC 进行伪轨迹和突变状态分析。伪轨迹分析显示,在 6022 种蛋白质中,三种蛋白质表现出显著变化(图 S2 A)。复合蛋白-2 (CPLX2) 和突触素-1A (STX1A) 在 MC 中上调,而囊泡胺转运 1 (VAT1) 下调。在检测症状出现时间时,CPLX2 的伪轨迹在症状出现前大约七年开始发生变化,而 STX1A 的改变在症状出现前大约四年开始(图 S2 B)。在MC vs. NC分析中,九种蛋白质与突变状态相关(图 S2 C),包括 CPLX2 和 STX1A。此分析中确定的其他蛋白质包括 MAD1L1、SMOC1、PPP4R3A、CPLX1 和 CAST,它们发生显著上调,而两种蛋白质(SSBP1 和 VOPP1)发生下调。SMOC1 是在血浆和 CSF 样本中唯一确定的蛋白质(图 S2 D)。总体而言,与 CSF 相比,他们在血浆中确定了有限数量的与 ADAD 相关的重要蛋白质(图 S2 E-F)。
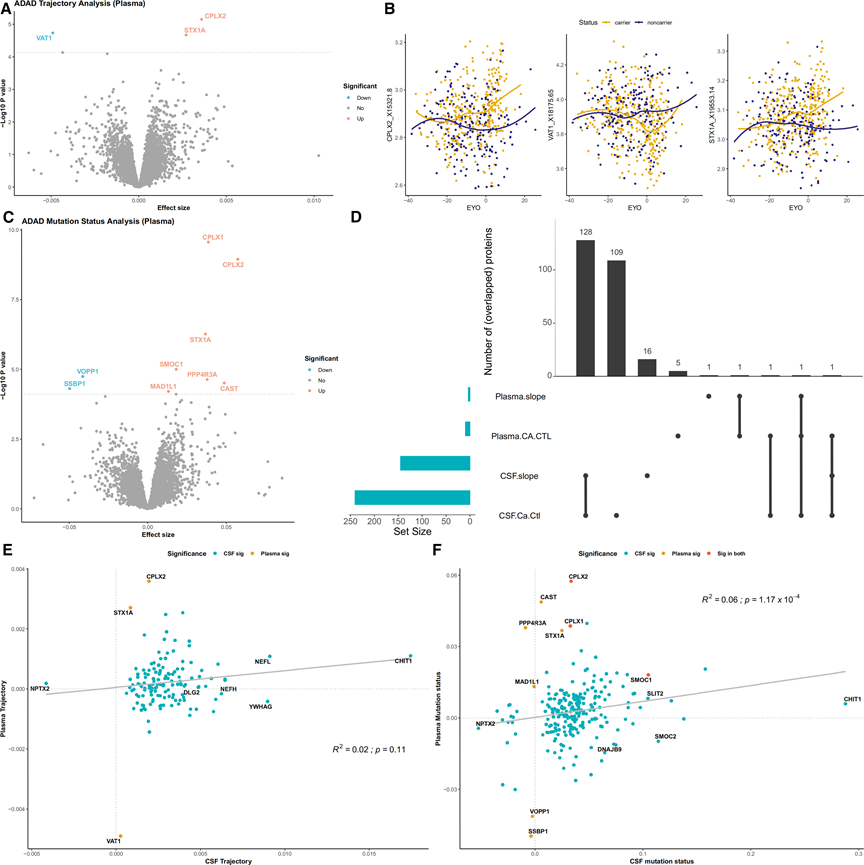
图S2. 血浆中 MC 与 NC 的轨迹和 ADAD 突变状态分析。
(A-B) 火山图显示所有测试蛋白质的变化。 (C) CPLX2 和 STX1A 在血浆中表现出显著轨迹。(D) 识别 CSF 和血浆轨迹与 ADAD 突变状态分析之间重叠的显著蛋白质。 (E) CSF 和血浆之间显著轨迹蛋白质的效应大小相关性。(F) CSF 和血浆 ADAD 突变分析之间显著蛋白质的效应大小相关性。
他们通过进行基因-疾病网络富集分析来探究这些蛋白质是否与其他疾病有关。在这45个疾病中,有16个具有神经退行性疾病特征,包括“家族性阿尔茨海默病(FAD)”(图4A)。与这些疾病有关联是由已知与一般神经退行性变有关的共同核心蛋白(SPP1, GFAP, NRGN, NEFL, ACHE, YWHAZ或PIN1)引起的。其中一些蛋白质也是各种细胞功能的关键连接器,如突触后信号传导(NRGN, NEFL, GAP43, PIN1),神经元投射(STMN2, ENO1, GPI)和细胞连接(PPIA, YWHAZ, ACHE),表明它们可能是这些疾病的共同贡献者(图S4B)。此外,45种疾病中有18种具有癌症或免疫相关特征,包括神经母细胞瘤、癌、纤维肉瘤或神经胶质瘤。与这些疾病有关联的蛋白包括ITGB1、SPP1、TNFRSF1B或GFAP。
他们还对这 137 种蛋白质进行了通路富集分析,以深入了解其生物学功能和导致疾病的生物学过程。有 60 条显著富集的通路属于 13 个主要类别。主要过表达的通路类别是“信号转导”(17 条通路),其次是“神经系统”(15 条通路)和“疾病”(7 条通路)(图 S4 C)。信号转导包括13种蛋白:胆碱能突触蛋白(ACHE、CAMK2B、PLCB1和PRKCG)、谷氨酸能突触蛋白(GLUL和HOMER1)、信号蛋白(DLG2和DLG4)、细胞通讯蛋白(LIN7A、LIN7B和NRGN)、与解剖结构发育有关的蛋白(PDLIM5)和已知的AD生物标志物(NEFL)。“神经系统”类别中的特定通路包括与NMDA受体(NMDAR)相关的几种通路。另一个重要的通路是“激活BAD并转位到线粒体”,属于“程序性细胞死亡”超级通路(图S4D)。这种超级通路与“自噬”有关,这些蛋白可能参与ADAD中早期神经元死亡和自噬事件。
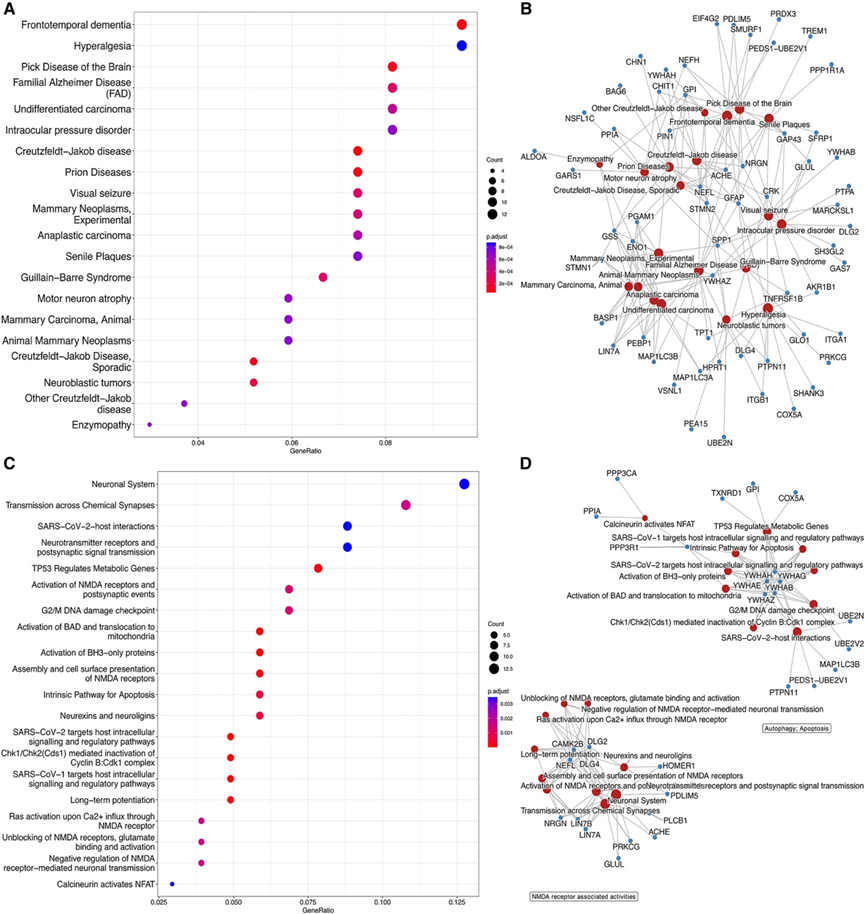
图S4. CSF 中重要轨迹蛋白的通路富集分析。
(A) DisGeNET富集分析排名前20的显著富集的疾病。(B) 排名前20的显著富集疾病的网络图。(C) Reactome通路分析中轨迹分析显著蛋白的排名前20的通路。 (D) Reactome通路中排名前20的显著富集的通路及其相关基因以网络形式呈现。
03
共表达网络分析确定了ADAD 时间进展的模块
DAD 中有许多通路失调(图 S4)。为了确定特定通路是否在不同的疾病阶段失调,他们进行了加权基因共表达网络分析 (WGCNA),然后在每个模块中进行通路分析。首先对6163 种蛋白质/7005 种适体进行 WGCNA,确定了 18 个模块,总共包含 4,909 种蛋白质(图 S5)。其余 2096 种蛋白质未分配到 18 个模块中的任何一个,因此分组到 M0(灰色)模块中。M1(青色)模块包含与 MC 中相关的129 种(137 种适体)。M1 模块内的通路分析揭示了在疾病发作的不同阶段失调的多条通路。它们涵盖了细胞对刺激的反应(在非常早期的阶段)、代谢和免疫通路(在中期阶段)以及自噬(刚开始之后)。
由于大多数相关蛋白质都包含在同一个共表达网络模块(M1)中,他们进一步进行了额外的聚类分析,仅关注那 137 种已识别的蛋白质(145 种适体)。他们确定了四个模块:MEgray、MEchocolate(M1)、MEhotpink(M2)和 MEdeepskyblue(M3)(图 4)。MEgray 模块包含未聚类到其他三个模块的蛋白质,因此未将其包括在进一步分析中。他们发现各个节点呈现出不同的平均估计发病年份 (EYO),其中 M1 富含变化最早的蛋白质,其次是 M2和 M3。 M1 和 M2 的平均 EYO 之间的差异在统计学上并不显著;然而,在比较 M1 和 M3 的平均 EYO以及 M2 和 M3 的平均 EYO时观察到了显著差异。
M1 模块显示出最早的蛋白质组学变化,主要富集于星形胶质细胞和少突胶质细胞蛋白,而神经元蛋白则较少(图 4 A)。蛋白质-蛋白质相互作用表明钙调神经磷酸酶复合物、自噬体膜、突触后密度和谷氨酸能突触通路中富集。在 M1 中存在的 64 种蛋白质中,22 种蛋白质在 34 种不同的通路中显示出显著富集。这 24 条通路属于 8 个超级通路(超级通路标记为 C1-C8)。最主要的通路类别包括NMDAR突触信号传导(C1)、钙调磷酸酶/NFAT通路(C2)、蛋白质定位(C3)、巨噬(C4)、细胞周期(C6)和几种免疫相关通路(图 4C-D)。线粒体凋亡通路(C5)由 14-3-3γ、14-3-3 eta和 PPP3R1驱动,它们是 EYO 最低的一些蛋白质。已鉴定的微管相关蛋白(MAP1LC3A、MAP1LC3B)富含巨自噬和线粒体自噬(C4)和神经元蛋白(图4C),表明早期神经元病理学变化可能涉及微管功能障碍。
发现 M2 中的蛋白质主要在神经元细胞中富集,内皮细胞中含量较少(图 4 A),其中包括在 M1 之后改变轨迹的蛋白质,表明捕获了后期过程。在 M2 中的 17 种蛋白质中,有 10 种在生物通路中富集。通路分析揭示了许多与细胞凋亡(C2)(图 4 E)、死亡受体信号传导(C4)以及与信号传导(C4)和极早期免疫反应(C5)相关的过程。与其他两个模块不同,M2 显著地参与了炎症信号转导通路和早期免疫反应。八种已鉴定的蛋白质(五种 14-3-3 蛋白、CAMK2B、NEFL 和 PEA15)参与了复杂的生物通路相互作用(图 4 E)。该网络包括丝裂原活化蛋白激酶 (MAPK) 家族信号级联和涉及 G 蛋白偶联受体 (GPCR)、Hippo、Notch、神经营养性原肌球蛋白受体激酶 (NTRK) 和 Rho GTPases(C4)的信号转导途径,以及细胞损伤/死亡通路,例如细胞凋亡(C2) 和 Rap1 信号(C12)。更接近症状发作的 M3 模块在小胶质细胞类型中富集,并与涉及先天免疫系统(C2)和细胞间通讯相关通路。研究发现,富含小胶质细胞的蛋白质(如 CAB39/CAB39L、CRK/CRKL、EIF4B 和 SPP1)与哺乳动物雷帕霉素靶蛋白 (mTOR)、MET、NTRK和血小板衍生生长因子 (PDGF) 的信号通路相互作用,而这些通路已知与神经退行性疾病有关(图 4G-H)。
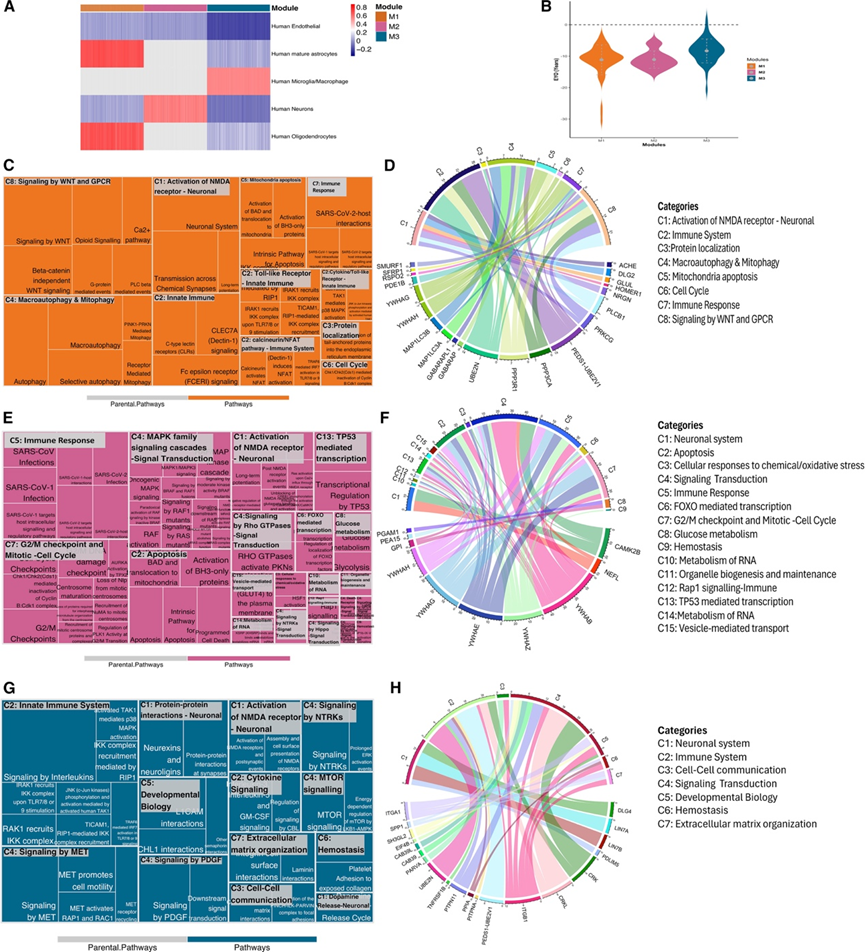
图4. 各模块显著伪轨迹蛋白和通路富集的共表达网络分析。
(A) 热图显示模块中每种细胞类型的 GSVA 分数。(B) 对 Reactome 通路分析中已鉴定的功能性蛋白质进行 EYO 比较。(C-H) 各模块的反应组通路分析。
04
ADAD 预测模型
接下来,他们试图探究本研究中发现的蛋白质是否可以预测突变状态(MC 与 NC)。利用机器学习模型,他们确定了可最大限度提高预测能力的最少蛋白质数量,应用了 50 次随机抽样迭代,每次将 CSF DIAN 队列分成独特的训练(60%)和测试(40%)数据集。然后,他们全面选择了信息量丰富的蛋白质,以开发出能够预测突变状态的六种蛋白质(GFAP、NPTX2、PEA15、SMOC1、SMOC2 和 TNFRSF1B)的蛋白质组学特征模型。该模型对 ADAD 突变状态的分类表现出很强的预测能力,曲线下面积 (AUC) 为 0.911(图 5 A)。该蛋白质组学特征的 AUC 明显优于 pTau181(AUC:0.755)、Aβ42(AUC:0.709)和 pTau/Aβ42(AUC:0.783)。阴性预测值 (NPV) 和阳性预测值 (PPV) 分别为 0.876 和 0.777,在区分 MC 和 NC 时表现出比经典 AD 生物标志物更好的性能。
此外,他们根据脑脊液抽取日期的临床状况将 MC 分为亚组。在 MC 中,有 186 名个体没有临床症状(症状前),105 名个体有症状。他们检测了该模型是否也能区分症状前个体和症状个体。六种蛋白质预测模型显示 AUC = 0.930可区分受影响的 MC 与未受影响的 MC(图 5B)。NPV(0.847)和灵敏度(0.915)与 pTau181/Aβ42(NPV 0.825 和灵敏度 0.902)相似,这表明六种蛋白质特征可能捕捉到了非常早期的疾病变化特征(图 5C)。
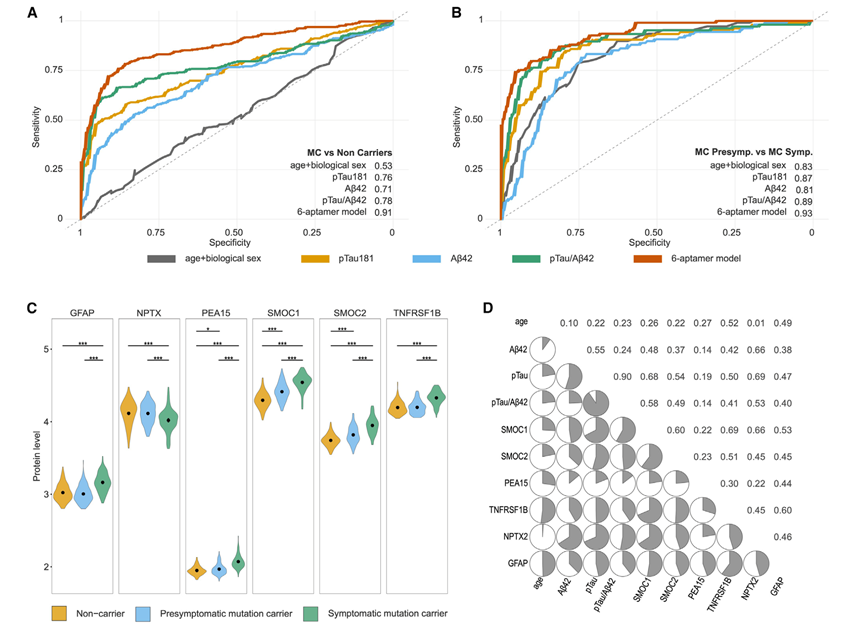
图5. ADAD 预测模型。
(A-B) β-淀粉样蛋白 42、pTau 181 和 pTau181/Abeta42 比率在预测突变携带者与非携带者方面的预测能力,以及有症状突变携带者与无症状突变携带者的预测能力。(C) 小提琴图比较了非携带者、无症状携带者和有症状携带者中预测模型中包含的六种蛋白质的水平。(D) 与预测模型中包含的六种蛋白质的 Spearman 相关性相对应的相关矩阵。
+ + + + + + + + + + +
结 论
本项研究分析了 286 名MC和 177 名NC的 CSF 蛋白。开发的多层回归模型区分了这些组之间具有不同伪轨迹的蛋白质。使用独立的 ADAD 以及AD 数据集验证了这些结果。本项研究确定了 137 种在 MC 和 NC 之间具有不同轨迹的蛋白质,其中 8 种在传统 AD 生物标志物之前发生变化。这些蛋白质分为三个阶段:早期(应激反应、谷氨酸代谢、神经元线粒体损伤)、中期(神经元死亡、凋亡)和晚期症状前阶段(小胶质细胞变化、细胞通讯)。与传统生物标志物相比,预测模型揭示了六种蛋白质子集,可以更有效地区分 MC 和 NC。
+ + + + +



 English
English


