文献解读|Microbiome(13.8):肿瘤定植的变形链球菌代谢重编程肿瘤微环境并促进口腔鳞状细胞癌
✦ +
+
论文ID
原名:Tumor-colonized Streptococcus mutans metabolically reprograms tumor microenvironment and promotes oral squamous cell carcinoma
译名:肿瘤定植的变形链球菌代谢重编程肿瘤微环境并促进口腔鳞状细胞癌
期刊:Microbiome
影响因子:13.8
发表时间:2024.10.05
DOI号:10.1186/s40168-024-01907-9
背 景
口腔鳞状细胞癌 (OSCC) 仍然是头颈部鳞状细胞癌 (HNSCC) 患者发病和死亡的主要原因。尽管近年来在手术技术、辅助治疗、分子靶向治疗和免疫治疗方面取得了进展,但治疗效果仍然不令人满意,尤其是晚期 OSCC 患者,5 年生存率不到 20%。尽管遗传因素、烟草、槟榔、酒精和不良口腔卫生是 OSCC 的主要危险因素,但 OSCC 的确切发病机制仍不清楚。口腔致癌是一个逐步的进化过程,从正常到发育不良,然后是癌变。口腔白斑 (OLK) 具有典型的异型增生组织学特征,是最常见的口腔癌前病变类型,恶性转化为 OSCC 的概率为 1.1-40.8%。因此,探究驱动 OSCC 发展、进展和不良预后的分子机制对于发现 OSCC 潜在的新预防和治疗靶点至关重要。
实验设计
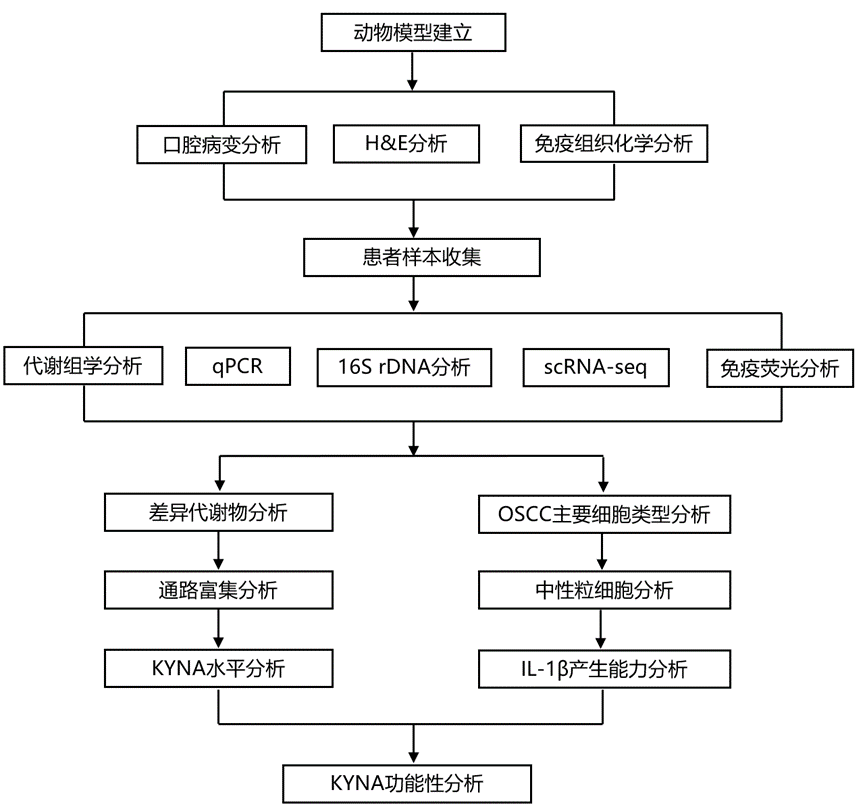
结 果
01
OSCC 患者唾液显著促进 4NQO 诱发的大鼠口腔癌发生
研究团队首先假设改变的口腔微生物群落可能会改变唾液中微生物群和代谢物的组成和丰度,从而可能导致在 OSCC 的发展和进展过程中口腔微环境的代谢和免疫稳态发生破坏。为了验证这一假设,他们对4-硝基喹啉-N-氧化物(4NQO)处理的大鼠同时施加来自OSCC患者、OLK患者和健康对照组(HC)的唾液(图 1 A)。虽然所有大鼠舌头均有颗粒状增生、白色鳞片和斑块,但用 OLK 和 OSCC 唾液处理的大鼠舌病灶在第 20 周时明显表现出更大规模的糜烂、溃疡和边界不清的内生性生长(图 1B)。重要的是,与接受 HC唾液处理的大鼠相比,接受 OLK 和 OSCC 唾液处理的大鼠的侵袭性癌数量显著增加(图 1C-D)。此外,通过基于苏木精和伊红 (H&E) 染色的口腔致癌病理定量分析显示,用 OLK 和 OSCC 唾液处理的大鼠舌头显示出更高的病理评分(图 1E)。为了初步检测肿瘤微环境(TME)的一般免疫特征,他们进行了免疫组织化学 (IHC) 分析,以分析 Ki67、CD11b、CD3 和程序性细胞死亡蛋白 1 (PD-1) 的表达。IHC 结果显示,与用 HC 和盐水唾液处理的大鼠相比,用 OSCC 唾液处理的大鼠的舌头在舌头病变中显示出更多的浸润 Ki67-、CD11b- 和 PD-1-,但 CD3- 表达细胞较少(图 1 F-G),这表明用 OSCC 唾液处理的舌头显示出更多的 CD11b+髓系细胞,CD3+T 细胞浸润不足,以及更多的抑制性或耗竭性免疫特征。总之,这些发现表明 OLK 和 OSCC 唾液的移植促进了口腔致癌作用。
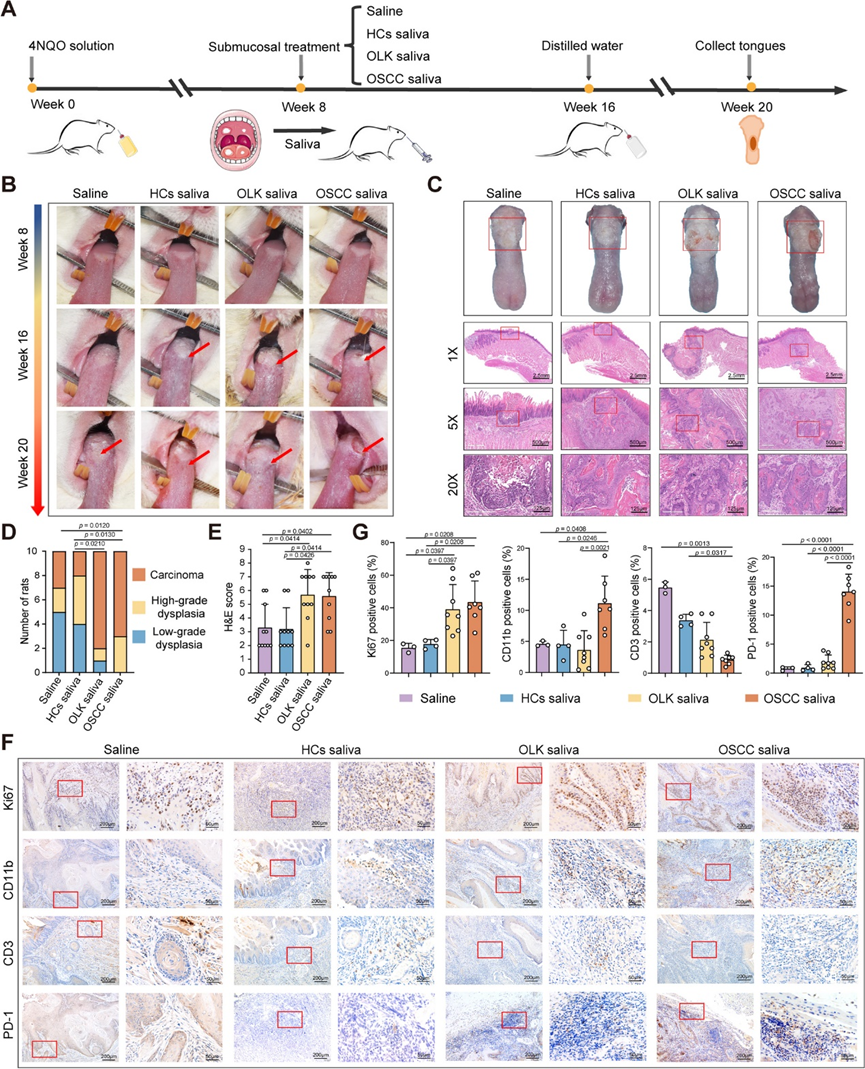
图1. OSCC 患者唾液在 4NQO 诱发的大鼠模型中促进口腔致癌作用。
(a) 4NQO 诱发的致癌作用模型中的实验方案示意图。(b)大鼠舌头病变的代表性图像。(c) 大鼠舌头的代表性大体观察和 H&E 图像。(d)对大鼠进行低度不典型增生、高度不典型增生和癌症的组织学程度的定量。(e) 对大鼠进行组织病理学诊断的 H&E 评分。(f) 对大鼠进行 Ki67、CD11b、CD3 和 PD-1 的代表性 IHC 图像分析。
02
唾液中 KYNA 含量升高会导致口腔致癌
由于 OLK 和 OSCC 患者的唾液可促进口腔癌变,因此可以合理地推测 OSCC 唾液可能含有蛋白质、碳水化合物、代谢物和 DNA/RNA 等病理成分,这些病理成分的丰度水平改变可能会导致口腔上皮稳态发生破坏,有利于恶性转化。为了确定哪种唾液成分是导致异型增生恶性转化的主要驱动力,他们招募了 OSCC 患者、OLK 患者和健康对照者 (HC)。采用超高效液相色谱-串联质谱 (UPLC-MS/MS) 对这些个体唾液进行广泛靶向的代谢组学分析。质量控制 (QC) 样品的总离子电流 (TIC) 图曲线高度重叠,保留时间和峰强度一致,表明整个检测过程中信号稳定(图 S2A)。主成分分析 (PCA) 和正交偏最小二乘判别分析 (OPLS-DA) 显示,OSCC 和 OLK 患者和 HC 之间的唾液代谢物存在显著差异(图 S2B-C)。与 HC 相比,OLK 患者唾液中 42 种代谢物的丰度水平增加,116 种代谢物的丰度水平降低。此外,与HC唾液相比,在OSCC患者唾液中分别鉴定出84种上调和61种下调的代谢物(图 2 A)。维恩图分析显示,HC vs. OLK和HC vs. OSCC患者之间有69种重叠的差异丰度代谢物(图 2 B)。由于口腔致癌作用的逐步进化过程,在筛选出HC vs. OLK和HC vs. OSCC患者之间69种重叠的差异丰度代谢物后,他们进一步根据每种代谢物的丰度水平从正常到OLK,从OLK到OSCC唾液中筛选出逐步上调或下调(可持续增加或减少)的代谢物。结果显示,38种化合物在口腔致癌过程中表现出最显著的差异丰度水平。值得注意的是,上皮恶性转化(从OLK到OSCC)中上调最显著的前10种代谢物包括9(S)-HpOTrE、KYNA 2-甲基琥珀酸等,其中犬尿酸 (KYNA)在筛选出的亲水性化合物中增幅最大。上皮恶性转化中下调最显著的前10种代谢物包括UDP-D-半乳糖、UDP-葡萄糖、Met-Glu等(图 2B)。KEGG分析显示,这38种差异表达代谢物主要富集在色氨酸代谢等生物合成和代谢过程中(图 2C和图S2D)。重要的是,与来自 HC 和 OLK 的唾液相比,OSCC 唾液中 KYNA 的含量明显更高,KYNA 是参与色氨酸代谢的犬尿氨酸通路的关键产物(图 2 D)。
为了验证 OSCC 患者唾液中 KYNA 含量确实升高,进一步通过高效液相色谱 (HPLC) 和酶联免疫吸附试验 (ELISA) 检测了独立队列中的 KYNA 水平。OSCC 患者唾液中的 KYNA 显著高于 HC 患者唾液中的 KYNA(图 2 E)。此外,与 HC 唾液相比,OLK 和 OSCC 患者的唾液中 KYNA 的上游代谢物犬尿氨酸显著增加(图 S2E)。代谢组学分析表明 OSCC 患者唾液中的 KYNA 水平远高于 OLK 患者和 HC。
然后,他们分析了 KYNA 是否确实参与了 OSCC 的发病机制。对来自同一患者的 OSCC 肿瘤组织和邻近非肿瘤组织进行了 UPLC-MS/MS 分析,发现 OSCC 组织中 KYNA 和犬尿氨酸的含量比来自同一患者的邻近非肿瘤组织高得多(图2 F-H 和 S2F-I)。值得注意的是,色氨酸分解代谢酶 (TCE)[例如色氨酸-2,3-双加氧酶 (TDO2)、吲哚胺-2,3-双加氧酶 1 和 2(IDO1 和 IDO2)、芳基甲酰胺酶 (AFMID) 和犬尿氨酸氨基转移酶 1 (KYAT1)]可介导色氨酸降解产生生物活性下游代谢物,与癌症基因组图谱 (TCGA) 数据集中的邻近非肿瘤组织相比,它们在HNSCC 肿瘤组织中显著上调(图 2 I)。这些数据表明较高浓度的 KYNA 确实与 OSCC 有关。
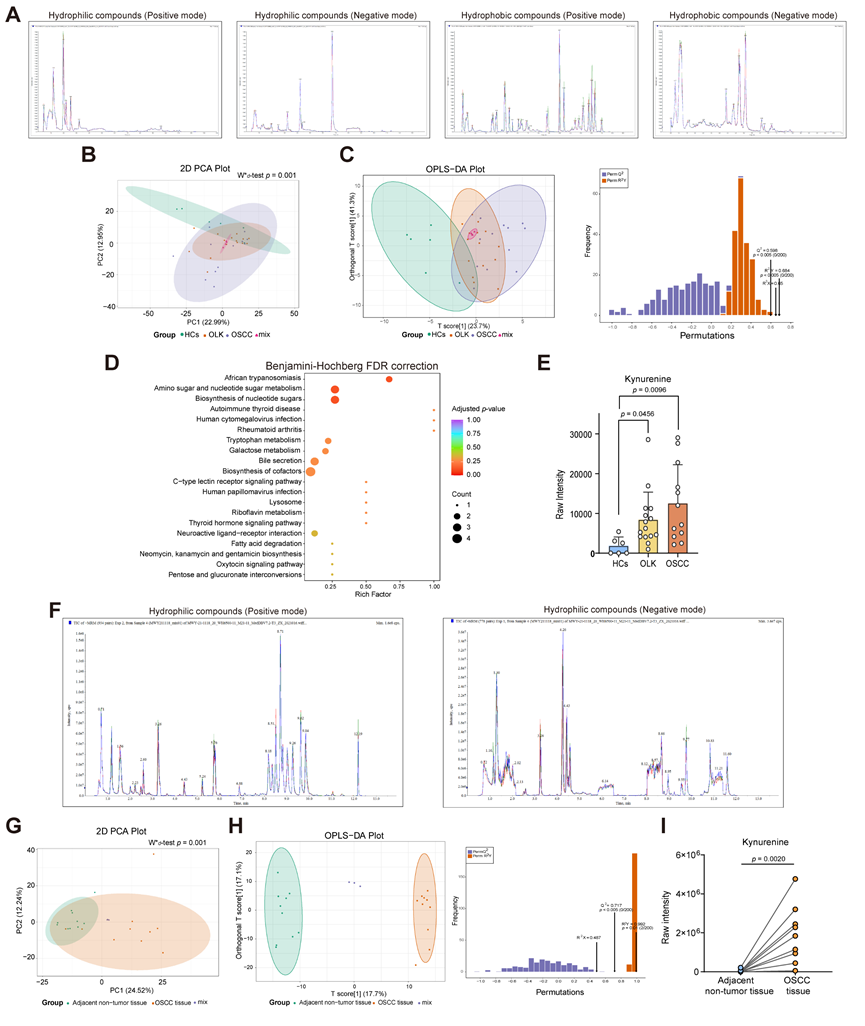
图S2. 广泛针对唾液和组织代谢组学测序分析。
(A)监测唾液质量控制(QC)样品在正、负离子模式检测中的代表性重叠TIC图。(B) 全唾液hc、OLK、OSCC及混合组的PCA。(C) OPLS-DA分析。(D) KEGG代谢组学通路分析。(E) 全唾液中犬尿氨酸的相对浓度。(F) 广泛靶向代谢组学(亲水化合物)在正负离子模式检测中监测组织QC样品的代表性重叠TIC图。(G) 癌旁非肿瘤组、肿瘤组及混合组的PCA分析。 (H) 相邻非肿瘤、肿瘤组织和混合组的OPLS-DA。(I) UPLC-MS/MS法测定OSCC患者配对邻近非肿瘤和肿瘤组织中犬尿氨酸的相对浓度。
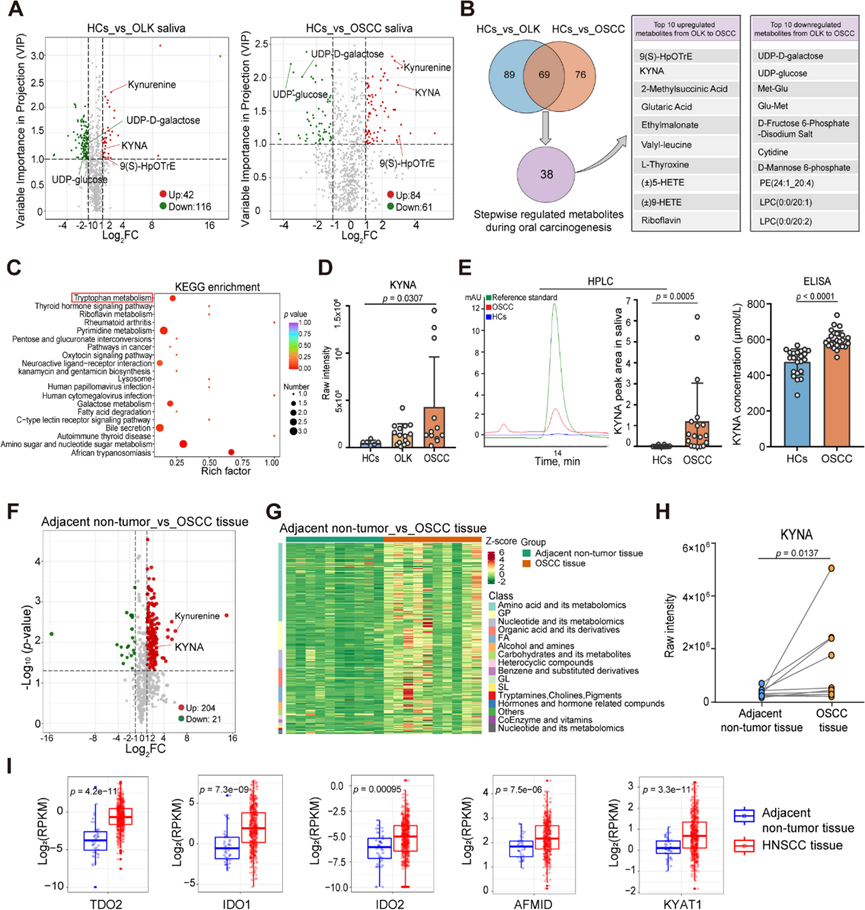
图2. OSCC 患者唾液中的 KYNA 浓度显著高于 HC和 OLK 患者。
(a) 火山图通过广泛靶向的代谢组学比较全唾液中 HC与OLK 患者和 HC与OSCC 患者的代谢物。(b) 重叠、差异富集的代谢物。(c) KEGG 通路分析。(d) 通过UPLC-MS/MS 测定 HC、OLK 和 OSCC 组中全唾液中 KYNA 的相对浓度。(e) 全唾液中 KYNA 的代表性色谱图和相对浓度。(f) 肿瘤和邻近非肿瘤组织之间的代谢物。(g) 热图和聚类分析显示 OSCC 患者肿瘤和邻近非肿瘤组织中的代谢物谱。(h) 对邻近非肿瘤和肿瘤组织中 KYNA 的 UPLC-MS/ MS相对浓度 。(i) TCGA 数据集中 HNSCC 患者肿瘤和邻近非肿瘤组织中色氨酸分解代谢酶的表达。
03
分析肿瘤定植的变形链球菌(S. mutans)
然后,他们试图探索口腔鳞状细胞癌唾液中 KYNA 浓度升高的机制。肿瘤相关微生物群是肿瘤微环境的内在组成部分,它对肿瘤微环境的代谢模式和免疫状态有至关重要的影响。他们假设肿瘤驻留链球菌可能会诱导更高丰度的 KYNA 水平并进一步促进口腔致癌作用。为了探索链球菌种群的潜在丰度变化,通过荧光定量聚合酶链式反应 (qPCR) 分析了 OSCC 患者口腔肿瘤和邻近非肿瘤组织中主要口腔链球菌种群(包括S. sanguis、S.parasanguis、S.salivarius、S.mitis、S.gordonii和S.mutans)的相对丰度(图 3 A)。与 OSCC 患者的非肿瘤组织相比,S. mutans在肿瘤组织中的丰度水平增加最为显著(图 3 B)。这些数据表明变形链球菌是口腔鳞状细胞癌患者肿瘤组织中定植的主要口腔细菌种类,但也暗示变形链球菌可能从唾液或口腔上皮浅层转移到肿瘤组织。
此外,他们还收集了 OSCC 患者和 HC的唾液和拭子,以研究口腔微环境中变形链球菌的丰度。值得注意的是,OSCC组的变形链球菌的相对丰度水平明显高于 HC 组(图 3C),这表明变形链球菌可能在致癌过程中从唾液或口腔上皮浅层移位并渗透到肿瘤组织中。为了进一步验证这一点,使用变形链球菌16S rDNA 特异性探针对来自 OSCC 患者的配对肿瘤和邻近非肿瘤组织的切片进行荧光原位杂交 (FISH) 分析。结果表明,与邻近的非肿瘤组织相比,变形链球菌在 OSCC 肿瘤组织中表现出更高水平的定植和丰度(图 3D)。因此,这些数据表明大量变形链球菌已经渗透并定植于口腔鳞状细胞癌的肿瘤组织中。
然后,他们进一步分析了变形链球菌在口腔鳞状细胞癌组织中的肿瘤内定植是否确实会导致 KYNA 的增加。将活的变形链球菌菌株 (UA159) 和在肿瘤组织中没有明显定植的S. gordonii (NCTC 7865) 作为阴性对照,口服培养在 4NQO 诱发的自发性口腔鳞状细胞癌大鼠的口腔黏膜上皮下,并对第 20 周大鼠的舌头进行基于 UPLC-MS/MS 的色氨酸及其代谢物分析(图 3 E)。结果显示,用变形链球菌处理的大鼠肿瘤组织中的色氨酸代谢物水平与用S. gordonii对照或盐水处理的大鼠有显著差异(图 3 F)。口腔黏膜上皮下口服S. mutans诱导的 KYNA 产量远高于对照细菌S. gordonii和盐水(图 3G)。这些数据表明S. mutans可以渗透并定植于口腔黏膜上皮下,从而促进体内KYNA 的产生。
接下来,他们研究了变形链球菌的哪些细菌成分介导了 KYNA 产量的增加。为了解决这个问题,将活的变形链球菌、热灭活的变形链球菌和对照细菌戈登链球菌与舌上皮来源的 OSCC 细胞(SCC1 细胞系)共培养,以定量分析 KYNA 的产生(图 3H)。SCC1 细胞暴露于活的变形链球菌中导致培养上清液中的 KYNA 产量比热灭活的变形链球菌和对照细菌高得多(图3I)。由于热处理可能会保留大多数细菌脂质和多糖的生物活性,但通过改变细菌结构使大多数外膜蛋白失活并进一步影响细菌的功能,因此,这一结果表明变形链球菌特异性蛋白质成分可能是介导 OSCC 细胞高 KYNA 产量的主要驱动力。
由于 PAc,特别是 PAc 的 A 区,是变形链球菌的主要表面蛋白之一,而后者介导与生物膜和口腔上皮上的葡聚糖的关键粘附相互作用,他们进一步推测 PAc 可能是驱动 KYNA 产生的主要毒力因子。因此,选择PAc的 A 区来确定 PAc 是否驱动 KYNA 的产生和随后的炎症反应。为了确定这一点,将跨越 PAc A 区的肽(残基 301-319)和具有相似长度的阴性对照肽(ftsZ:残基 409–428)与 SCC1 细胞一起孵育,并对培养上清液进行 KYNA 生成分析(图 3 J)。他们发现,与对照肽相比,PAc 肽显著诱导 KYNA 浓度升高(图3K)。因此,这些数据共同表明,变形链球菌利用 PAc 的 A 区激活色氨酸代谢通路,导致 OSCC 细胞大量释放KYNA。
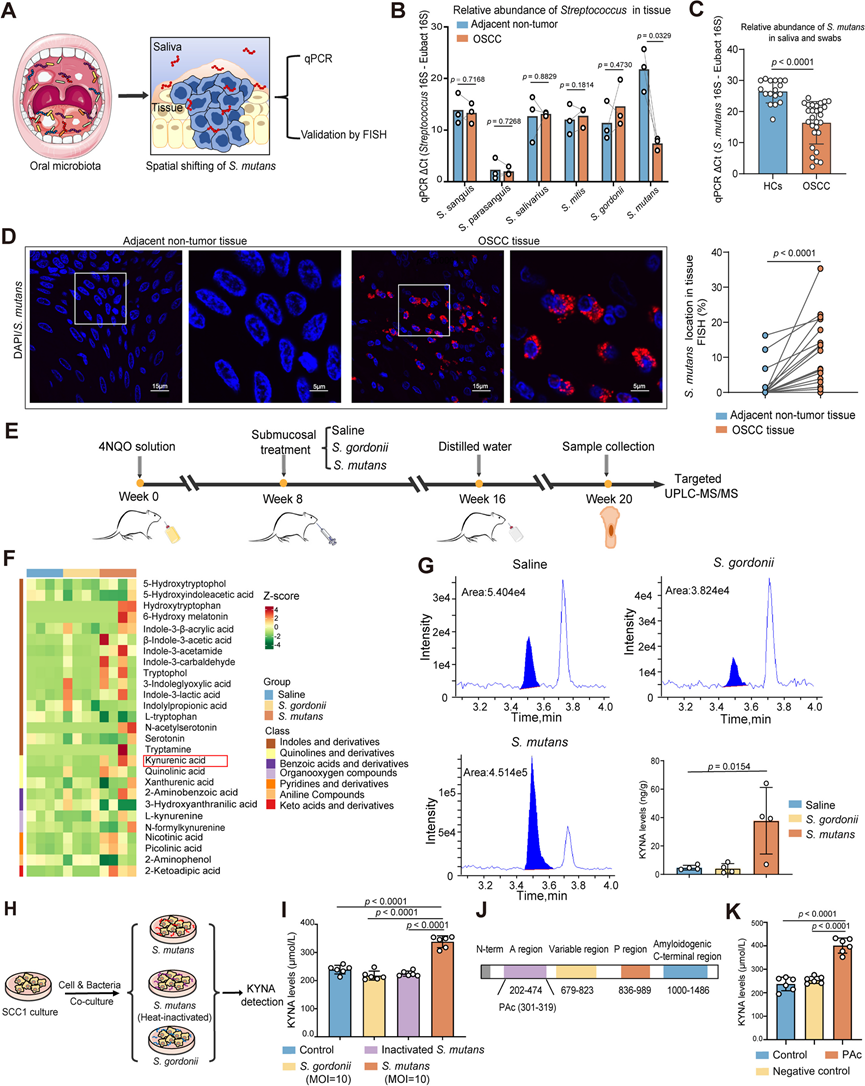
图3. 大量变形链球菌在 OSCC 组织中定殖,并利用其 PAc 的 A 区诱导 KYNA 过量产生。
(a) 用于确定唾液和肿瘤组织中变形链球菌的相对丰度和空间分布的实验图。(b) 通过 qPCR 检测到的 OSCC 患者肿瘤和邻近非肿瘤组织中代表性链球菌种的相对丰度。(c) 通过 qPCR 检测到的 HC和 OSCC 患者唾液和拭子中变形链球菌的相对丰度。(d) 代表性 FISH 图像(左)和定量分析(右)。(e) 代表性 FISH 图像(左)和定量分析(右)。(f) 热图显示了通过基于 UPLC-MS/MS 的靶向代谢组学对盐水、变形链球菌处理和戈登链球菌处理的大鼠舌组织色氨酸代谢物谱的影响。(g) 通过靶向 UPLC- MS / MS检测的 KYNA 代表性色谱图。(h) 实验示意图。(i) 上清液中的 KYNA 浓度。(J) PAc的 A 区一级序列内相关域的示意图。(K) 通过 ELISA 检测 SCC1 上清液中的 KYNA 浓度。
04
变形链球菌诱导的 KYNA 促进 TME 的免疫抑制和 OSCC 的肿瘤进展
他们将 PAc 和 KYNA 与 SCC1 细胞共培养,以评估 SCC1 细胞的增殖。PAc 和 KYNA 处理显著促进了 OSCC 细胞的增殖(图4A)。免疫荧光染色 (IF) 显示,PAc 和 KYNA 处理有利于癌症干性,促进 CD44 表达(图 4 B)。KYNA 是一种在色氨酸降解过程中沿犬尿氨酸途径产生的生物活性化合物。溶质载体家族 7 成员 5 (SLC7A5)和溶质载体家族7成员8(SLC7A8)在将色氨酸代谢物转运到细胞中方面发挥作用。因此,他们假设 KYNA 可以上调SLC7A5和SLC7A8转运蛋白。此外,转录分析显示,PAc 和 KYNA 处理显着上调了SLC7A5和SLC7A8的基因表达(图 4 C)。此外,流式细胞检测发现暴露于 KYNA 的 SCC1 细胞的芳烃受体 (AHR) 表达显著升高(图 4 D),同时CYP1B1的 mRNA 表达水平升高(图 4 E)。CYP1B1 是 AHR 激活的标志性基因。AHR 是一种配体激活的转录因子,可由包括 KYNA 在内的内源性代谢物激活,在 TCGA 数据集中,与邻近的非肿瘤组织相比,它在 OSCC 肿瘤组织中的表达水平也更高。白细胞介素 1β (IL-1β) 长期以来因其对炎症的多效性作用而闻名,炎症在肿瘤进展中起着复杂的作用。值得注意的是,KYNA 上调了SCC1 细胞中的IL-1β表达。因此,这些数据表明 KYNA 上调了犬尿氨酸转运蛋白的表达,激活了 AHR,促进了肿瘤进展,并加剧了 OSCC 细胞中的炎症。
为了进一步验证 KYNA 促进口腔癌发生,他们在 4NQO 处理的大鼠模型中通过舌黏膜下注射给予 KYNA(图 4 F)。H&E 染色表明接受 KYNA 处理的大鼠口腔病理损伤更严重(图4 G-I)。在接受 4NQO-KYNA 同时进行KYNA处理的大鼠中,9 只(90%)大鼠发展为口腔癌,而仅接受 4NQO 处理的大鼠中只有 4 只(40%)大鼠发展为口腔癌(图 4 H)。IHC 检查显示,用 KYNA 处理后,肿瘤中 Ki67 表达显著上调(图 4 J)。此外,KYNA 处理导致肿瘤中 CD8 +细胞数量减少,免疫抑制性 PD-1 +、CD11b +和 IL-1β +细胞数量增加,表明 KYNA 在调节肿瘤免疫微环境中起着至关重要的作用(图 4 J)。总之,这些结果表明S.mutans和 PAc 刺激 OSCC 细胞产生更多 KYNA,这进一步增加了 OSCC 的增殖和干细胞性,诱导了更具免疫抑制性的 TME,并加剧了口腔致癌作用。
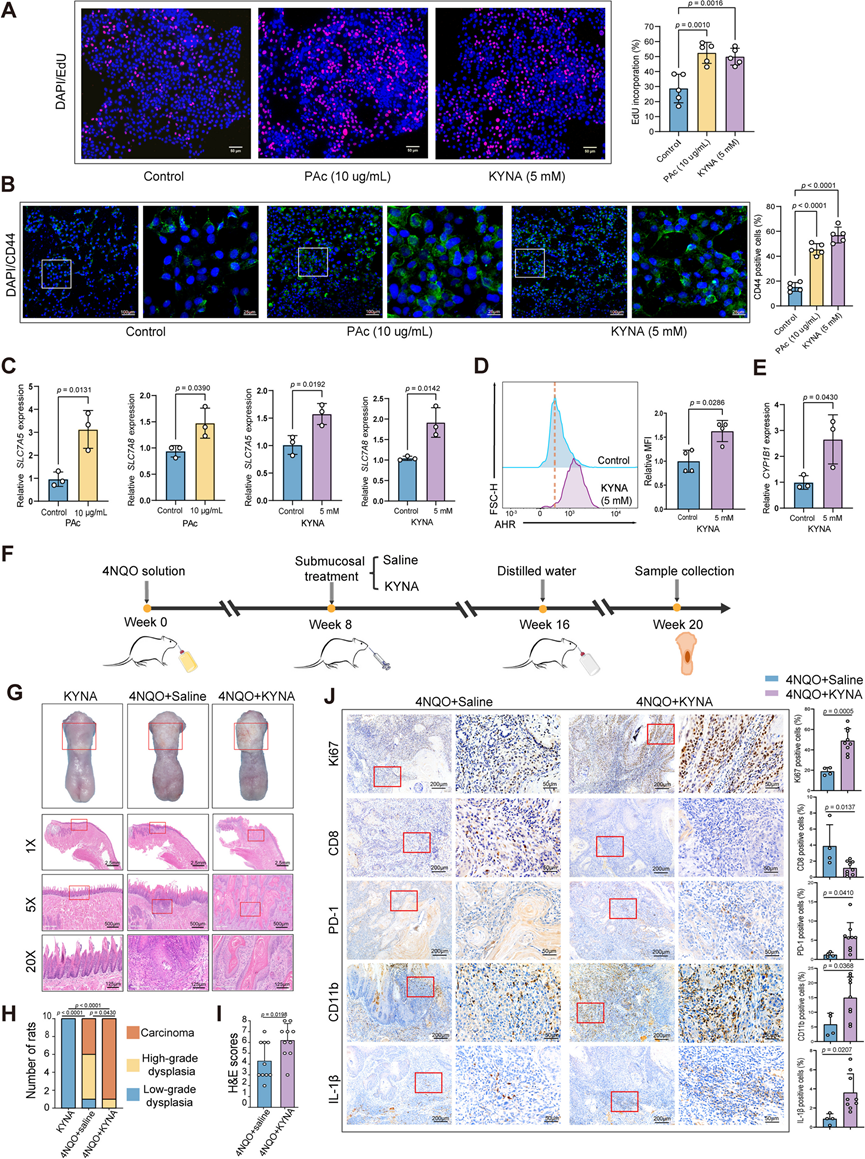
图4. KYNA 促进 4NQO 诱发的自发性 OSCC 大鼠的 OSCC 细胞恶性表型和口腔致癌作用。
(a) 通过 EdU 分析检测使用 PAc 和 KYNA 刺激后 SCC1 的增殖能力。(b) 代表性免疫荧光 (IF) 图像(左)和统计分析(右)。(c) 用RT-qPCR 检测 PAc 和 KYNA 处理后 SCC1 中SLC7A5和SLC7A8的相对表达。(d) 用流式细胞技术检测AHR的表达。(e) RT-qPCR 检测CYP1B1 mRNA 表达。(f) 4NQO诱导大鼠模型实验方案示意图。(g) 代表性大体观察和H &E 图像。(h) 大鼠低度发育不良、高度发育不良和癌组织的组织学程度分布。(i)大鼠的组织病理学诊断的H &E 评分。(J) 代表性 IHC 染色图像和 Ki67、CD8、PD-1、CD11b 和 IL-1β 的定量分析。
05
KYNA 主要扩增中性粒细胞,并在 OSCC 的 TME 中在单细胞水平上改变细胞类型
为了深入了解 KYNA 调节 OSCC TME 的机制,他们进行了单细胞转录组分析 (scRNA-seq)(图5A),在初步质量控制后,保留了 20326 个细胞,并根据差异表达基因将其分成 13 个聚类,包括上皮细胞、内皮细胞、成纤维细胞和免疫细胞(图5B)。与 OLK 来源的舌组织相比,在恶性转化过程中,含有较高浓度 KYNA 的 OSCC 舌组织中的中性粒细胞、巨噬细胞和 T 细胞显著增加(图 5 C)。特别是,中性粒细胞的数量增加了约 10 倍,在增加时间方面远远大于巨噬细胞和 T 细胞(图 5 D),这表明中性粒细胞可能是 KYNA 介导的 TME 中的主要调控靶点。
事实上,IHC 分析表明 OSCC 大鼠舌组织中的 CD11b+ 细胞数量比 OLK 大鼠的多 (图5E)。此外,对 KYNA 处理大鼠舌头肿瘤组织的 IHC 分析显示中性粒细胞比例较高(图 5 F)。为了验证中性粒细胞也是 KYNA 在人类中的主要靶点,他们用 KYNA体外刺激 OSCC 患者的外周血并进行流式细胞分析。结果表明,体外KYNA 处理显著增加了 OSCC 患者的中性粒细胞群(图 5 G)。进一步发现, KYNA 上调了中性粒细胞中 SLC7A8 (KYNA 转运蛋白)和 AHR的表达(图5 H-I),表明 KYNA 激活了 KYNA 转运蛋白和 AHR,促使中性粒细胞摄取更多的 KYNA 以进一步扩增。因此,KYNA 以扩增为主,增加了 OSCC 肿瘤组织中中性粒细胞的浸润,从而显著改变了 OSCC TME 中的细胞类型组成。
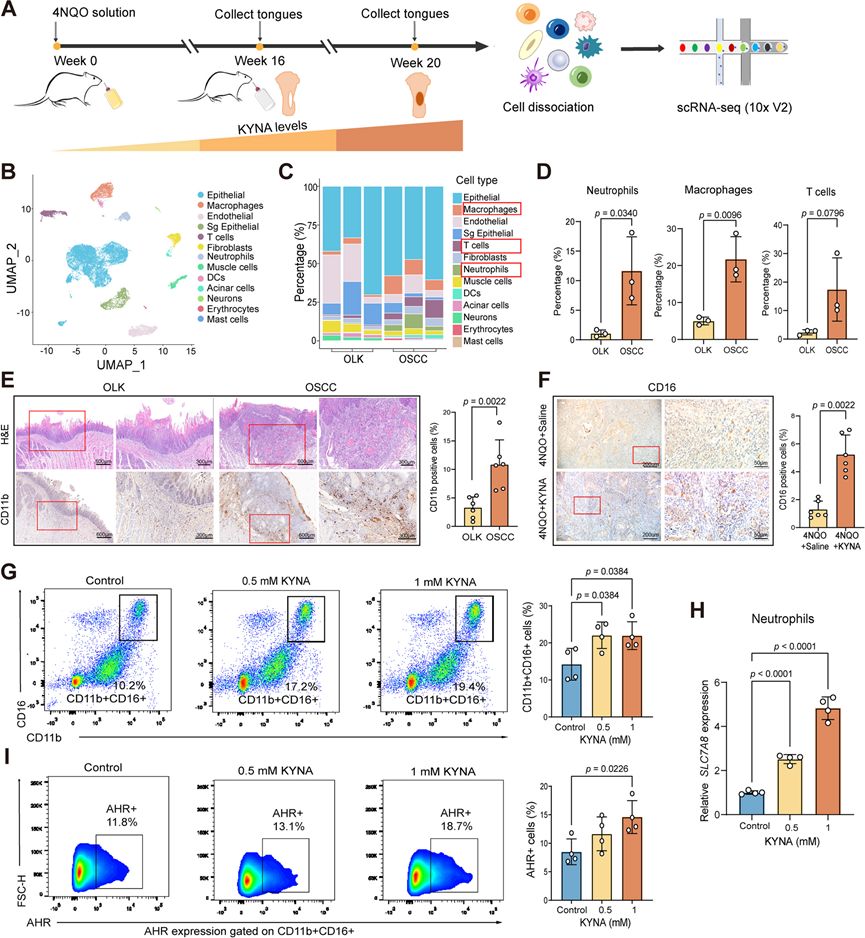
图5. 单细胞转录组分析揭示了口腔癌变过程中细胞类型的变化。
(a) OLK和 OSCC 大鼠舌组织 scRNA-seq 分析实验流程概述。(b) OLK和 OSCC 组织中 13 种主要细胞类型的聚类结果的 UMAP 图。(c) OLK 和 OSCC 组织中不同细胞百分比的堆叠直方图。(d) OLK和 OSCC 组织中非上皮细胞中中性粒细胞、巨噬细胞和 T 细胞的定量分析。(e) 实验大鼠 OLK 和 OSCC 组织中 CD11b 的H &E 和 IHC 染色。(f) 盐水和 KYNA 处理的 4NQO 大鼠中 CD16 的代表性 IHC 染色图像和统计分析。(g)代表性流式细胞点图和统计分析。(h) OSCC 患者中性粒细胞中SLC7A8 的相对表达。(i) 代表性流式细胞点图和统计分析。
06
S100a8highS100a9high表型和 IL-1β 产生能力
由于 KYNA 主要扩增并增加中性粒细胞在口腔鳞状细胞癌 TME 中的浸润,他们收集了口腔癌发生发展和进展阶段的外周血和大鼠的口腔鳞状细胞癌组织,以分选 CD11b/c+ His48+中性粒细胞进行进一步的 scRNA-seq 分析,以探索中性粒细胞在口腔鳞状细胞癌进展中的动态细胞状态和功能演变(图 6 A)。在 OSCC 进展过程中,分选出的中性粒细胞可分为两个群体,特征为 S100a8highS100a9high和S100a8lowS100a9low(图6B)。S100a8和S100a9的表达可能赋予中性粒细胞高度促炎、髓源性抑制细胞 (MDSC) 样免疫抑制特征。与从外周血中分离的中性粒细胞相比,来自TME 的中性粒细胞优先显示S100a8highS100a9hig促炎、MDSC 样免疫抑制表型(图 6C)。此外,S100a8 high S100a9 high中性粒细胞中S100a8和S100a9的表达在 OSCC 组织中远高于外周血中的表达(图 6D)。他们进一步比较分析了S100a8highS100a9high和S100a8lowS100a9low中性粒细胞的基因表达模式。这两组中性粒细胞的特征基因表达显示出明显差异(图6 E)。特别是,S100a8highS100a9high中性粒细胞表达更广泛的趋化因子配体(CXCL1、2、3)以及细胞因子(Ptgs2、IL1r2、IL23、IL-1β)(图 6 E)。
由于 IL-1β 信号在 TME 中起着至关重要的促癌作用,因此进一步分析了IL-1β的动态表达。首先,S100a8highS100a9high中性粒细胞在 OSCC 组织中表达的IL-1β水平远高于从正常、OLK 和 OSCC 期外周血中分离的细胞(图 6F-G)。此外,在口腔癌发生过程中,四组中性粒细胞表达的 IL-1β 水平远高于具有S100a8lowS100a9low 表型的细胞(图6H)。同时,他们发现 KYNA 在体外培养过程中提高了 OSCC 患者外周血中性粒细胞的 IL-1β 水平。重组IL-1β处理增强了中性粒细胞的扩增(图 6I),增加了PD-1的表达(图 6J),并抑制了抗肿瘤效应功能,降低了CD8+T细胞的肿瘤坏死因子-α(TNF-α)和干扰素-γ(IFN-γ)的表达(图 6K)。这些数据共同表明,KYNA 扩增的中性粒细胞优先表达S100a8/S100a9,这表明中性粒细胞具有高度免疫抑制特征和更强的表达 IL-1β 的能力,而 IL-1β 增加了 PD-1 的表达并抑制了 CD8 + T 细胞的抗肿瘤效应功能,而 OSCC 的 TME 中的功能受损和衰竭更为严重。
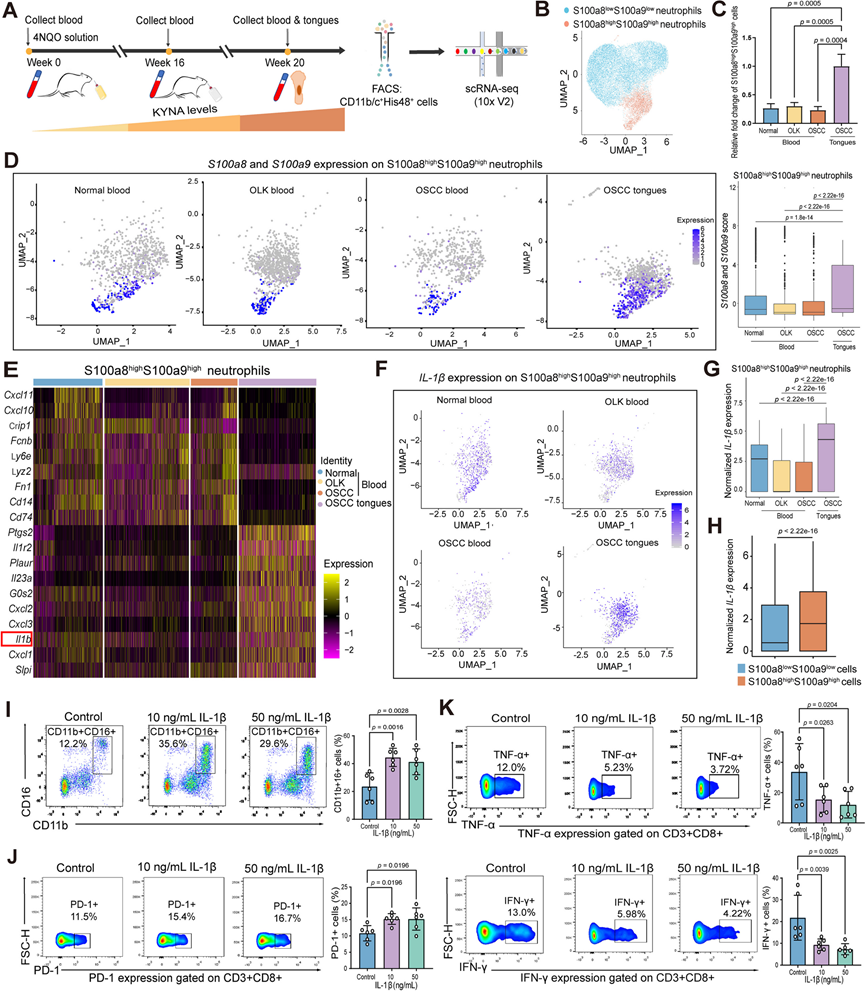
图6.在口腔癌变过程中,较高的 KYNA 浓度驱动中性粒细胞优先出现 S100a8highS100a9high表型。
(a) scRNA-seq 流程图。(b) UMAP可视化。(c) S100a8highS100a9high 中性粒细胞的统计分析。(d) S100a8和S100a9评分的 UMAP 图(左)和统计分析(右)。(e) 4NQO诱导的大鼠外周血和 OSCC 组织中S100a8highS100a9high中性粒细胞的基因分析热图。(f-G) IL-1β 的表达和定量分析。 (h) IL-1β 表达的比较。(i-J) 代表性流式细胞点图和统计分析。
07
KYNA 的功能分析
OSCC 中 PD-1/PD-L1 阻断疗法的响应度仅为 13% 到大约 18%,需要显著改善。由于S.mutans介导的 KYNA 在 OSCC 中诱导了高度免疫抑制的 TME,特别是中性粒细胞浸润增加以及 IL-1β 和 PD-L1 表达增加,因此他们推测 KYNA 是否是 OSCC 中 IL-1β 和 PD-1/PD-L1 阻断疗法响应度低或无响应的主要发病机制驱动力。
为了解决这个问题,他们进一步研究了 KYNA 对 4NQO 诱导的致癌模型中 IL-1β 和 PD-L1 阻断疗法的影响。在有或没有阻断抗 IL-1β 单克隆抗体 (IL-1β mAb) 或抗 PD-L1 mAb (PD-L1 mAb) 的情况下用 KYNA 处理4NQO 处理的大鼠(图 7 A)。基于 H&E 染色的病理分析的显微镜观察表明,用 IL-1β mAb 或 PD-L1 mAb处理的大鼠表现出较轻的粘膜病变,而 KYNA 处理显著损害了 IL-1β 或 PD-L1 mAb 处理带来的有益作用,甚至显著加剧了 OSCC 的病理损害(图7 B-D)。IHC 分析还表明,在 OSCC 的 TME 中,在存在 IL-1β mAb 的情况下,KYNA 处理显著降低了 CD8+ T 细胞的数量,而在存在 PD-L1 mAb 处理的情况下,增加了 PD-1 和 CD11b 的表达(图 7 E-F)。这些数据表明,KYNA 可能是一种致病性肿瘤代谢物,是 OSCC 对 IL-1β 和 PD-1/PD-L1 阻断疗法反应不佳的原因。
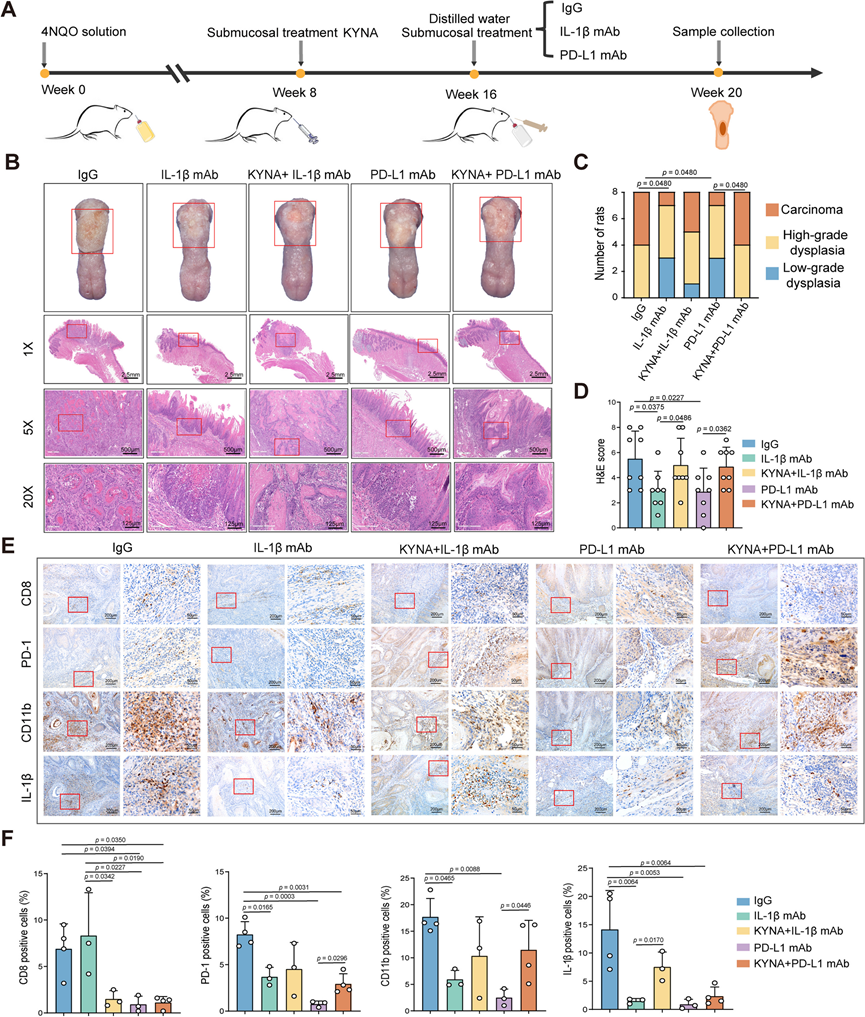
图7. KYNA 是 4NQO 诱发的致癌模型中 IL-1β 和 PD-L1 阻断疗法反应性较差的主要发病机制驱动力。
(a) 4NQO 诱发的口腔致癌模型中的实验方案示意图。(b)大鼠的舌头代表性大体观察和 H&E 图像。(c) 大鼠中低度不典型增生、高度不典型增生和癌组织的组织学比率。(d)大鼠的组织病理学诊断的 H&E 评分。(e) 大鼠中 CD8、PD-1、CD11b 和 IL-1β 的代表性 IHC 染色图像。(f) 大鼠 OSCC 肿瘤中 CD8、PD-1、CD11b 和 IL-1β 的 IHC 评分。
08
KYNA 介导的代谢重编程与 OSCC 患者的抗肿瘤免疫活性受损和生存率低下相关
最后,他们分析了 KYNA 诱导的 OSCC TME 重编程是否具有临床意义。与 OLK(非肿瘤)组织相比,OSCC 中存在更多的 CD11b +、PD-1 +、PD-L1 + 和 IL-1β+ 细胞(图 8 A)。此外,IF 染色显示 OSCC 组织中 CD11b 与 PD-L1 和 CD8 与 PD-1 的空间共定位细胞比 OLK(非肿瘤)组织中更多(图 8 B)。IHC 染色表明 AHR 主要在 OSCC 中表达,而在 OLK 组织中几乎不存在(图 8 C)。这些数据共同表明口腔粘膜的恶性转化与 CD11b+细胞浸润增加和高度免疫抑制特征有关。
然后,他们探讨了 TCGA 中 TCE 表达与免疫活性之间的相关性。IDO1、IDO2 和 TDO2 的表达与 CD274 的表达显著相关,并呈现出强烈、中等和轻度的正相关性。同时,HNSCC 中的 AHR 与 CD274 表达水平呈正相关(图8D)。他们进一步研究了TCGA、GSE41613 和 GSE65858 中 OSCC 患者的FCGR3B (CD16)、IL-1β、CD274 (PD-L1) 和AHR的临床预后相关性。Kaplan–Meier 分析表明,FCGR3B、IL-1β、CD274和AHR的表达越高,预后越差(图8E)。KYAT1 高表达患者的 OS 比 TCGA 中 KYAT1 表达低的患者更差,KYAT1 是犬尿氨酸转化为 KYNA 的关键。
总的来说,这些数据提出了一种 OSCC 的新致病机制,即肿瘤定植的变形链球菌增加了 KYNA 的产生,这主要扩增中性粒细胞并重塑中性粒细胞的功能,促进 TME 中 CD8+ T 细胞的免疫抑制或耗竭,并进一步推动 OSCC 的发展、进展和不良预后(图 8F)。
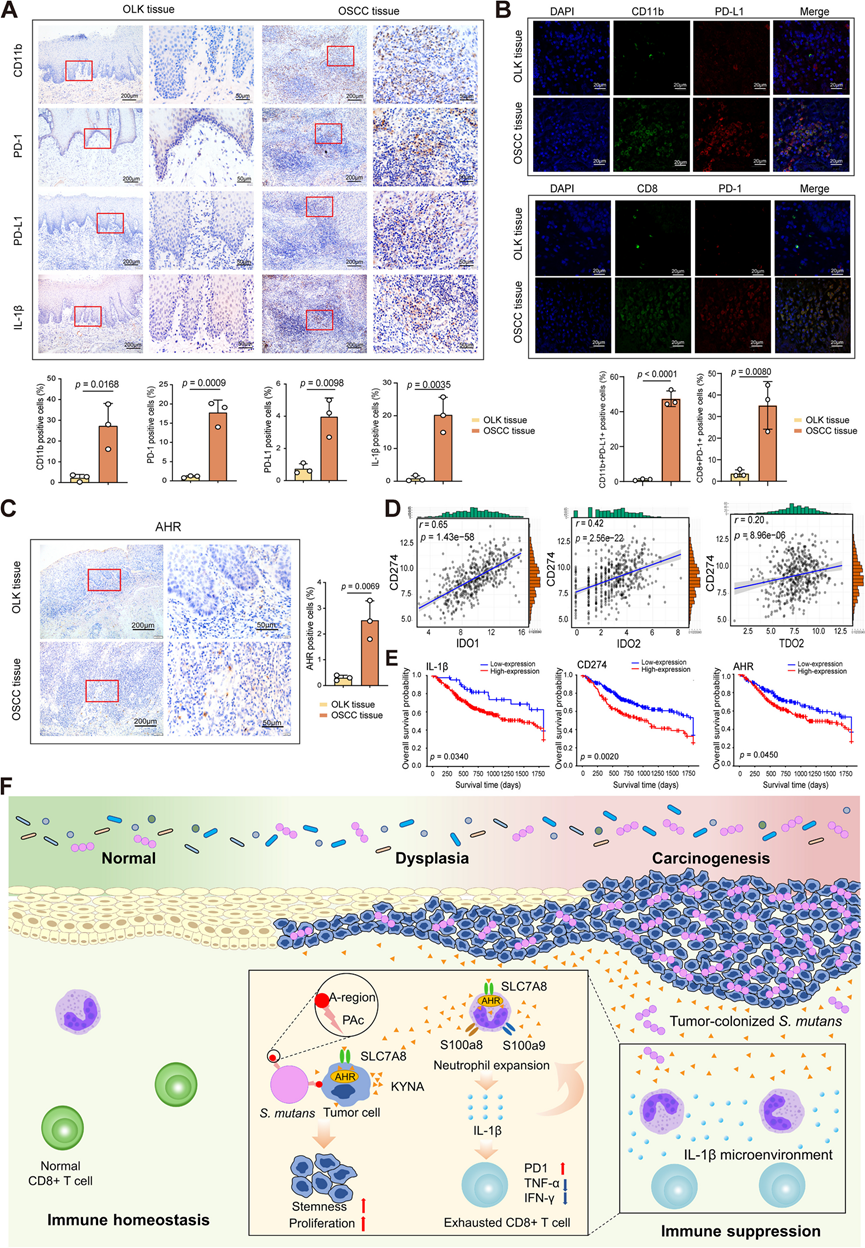
图8. KYNA 介导的信号通路与 OSCC 患者的抗肿瘤免疫力受损和生存率低相关。
(a) 代表性 IHC 图像(上)和定量分析(下)。(b) 空间共定位的代表性 IF 图像(上)和定量分析(下)。(c) 人类OLK 和 OSCC 组织中 AHR 的代表性 IHC 图像和定量分析。(d) TCGA 数据集中 CD274 与 IDO1、IDO2 和 TDO2 之间的相关性分析。(e) TCGA 数据集中 IL-1β、CD274 和 AHR 高表达和低表达的 OSCC 患者的总体生存率的 Kaplan–Meier 生存曲线。(f)机制示意图。
+ + + + + + + + + + +
结 论
本研究通过多组学分析,发现口腔微生物群的异常和特定口腔细菌(如变形链球菌)的肿瘤内定植可能会增加癌代谢物的产生,加剧口腔粘膜致癌作用,重编程高度免疫抑制的TME,并促进OSCC,凸显了干扰口腔微生物群和微生物代谢对OSCC预防和治疗的潜力。
+ + + + +



 English
English


