文献解读|Cell Rep(9.995):α1 抗胰蛋白酶杂合性的人 iPSC 肝细胞模型揭示了代谢失调和细胞异质性
✦ +
+
论文ID
原名:Human iPSC-hepatocyte modeling of alpha-1 antitrypsin heterozygosity reveals metabolic dysregulation and cellular heterogeneity
译名:α1 抗胰蛋白酶杂合性的人 iPSC 肝细胞模型揭示了代谢失调和细胞异质性
期刊:Cell Reports
影响因子:9.995
发表时间:2022.12.6
DOI号:10.1016/j.celrep.2022.111775.
背 景
Alpha-1 抗胰蛋白酶 (AAT) 缺乏症是慢性肝病的常见遗传原因,由错误折叠的蛋白质聚集体的积累和相关的有害影响驱动。最常见的致病变异,称为“Z”突变,是SERPINA1基因内的点突变,会导致氨基酸取代 (Glu342Lys),从而使新生的 Z alpha-1 抗胰蛋白酶 (ZAAT) 蛋白容易错误折叠和在肝细胞的内质网 (ER) 内聚合。以往的研究侧重于Z 突变纯合子(ZZ)个体患慢性肝病的风险增加,但现在逐渐聚焦Z 突变杂合子 (MZ) 的个体患临床显着肝病的风险适度增加。但是缺乏有效的模型来表征ZAAT 杂合性是否会导致人类肝细胞损伤以及与ZAAT 纯合性造成的肝损伤相比较,鉴于 Z 突变杂合子个体约占美国人口的 2%,所以迫切需要建立能够捕获遗传多样性并且同样能够表征人类肝细胞杂合子的模型。因此,本项研究建立了 ZZ 患者特异性诱导多能干细胞 (iPSC) 衍生的肝细胞 (iHeps) 模型来验证ZAAT 相关肝病发病机制的细胞特征。
实验设计
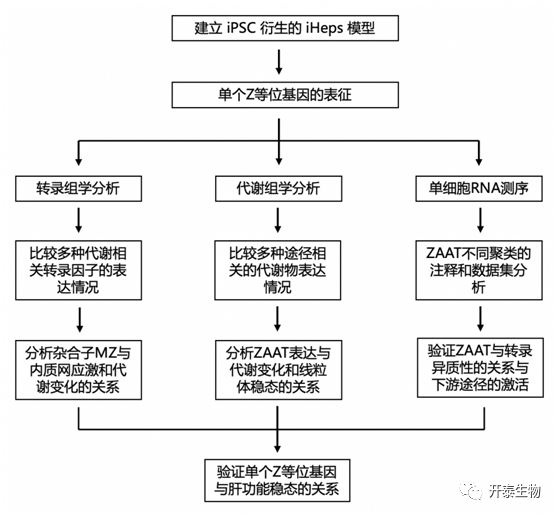
结 果
01

单个Z 等位基因的表征
研究者团队将 CRISPR-Cas9技术与单链寡脱氧核苷酸 (ssODN) 供体模板结合使用,引入了一个或两个包含 Z 或野生型 (M) 序列的 ssODN 供体,成功地靶向了 3 个遗传上不同的 ZZ iPSC 系 (PiZZ1、PiZZ6 和 PiZZ100), 建立了 3 个同基因组的 ZAAT 纯合子 (ZZ)、杂合子 (MZ) 和野生型 (MM)的 iPSC,之后成功定向分化为iHeps (图1A-B)。通过流式细胞术、抗体染色的平均荧光强度 (MFI) 和脉冲追踪35S-Met/Cys 放射性标记,以表征新生AAT蛋白的合成和分泌动力学,结果显示,与基因匹配的 MM 对照相比,MZ iHeps 表现出异常的 AAT 合成、保留和分泌 (图1C-K)。

图1. 来自 CRISPR-Cas9 编辑的 ZZ iPSC 的同基因 MZ 和 MM iHeps 的表征。
(A) 建立AAT模型。(B) iHeps 的定向分化。(C) ZZ、MZ 和 MM iHeps 的流式细胞术图。(D) ZZ、MZ 和 MM iHeps 中细胞内 AAT 蛋白的平均荧光强度。(E/F)免疫染色。(G/H) ZZ、MZ 和 MM iHep 上清液中分泌的总AAT 和ZAAT 蛋白。(I) 浓缩 iHep 上清液中抗中性粒细胞弹性蛋白酶抑制的测定。(J/K) 对35S-Met/Cys 标记AAT 蛋白分泌动力学的量化。
02

杂合子 MZ iHeps 中的转录组学分析
使用高通量 RNA 测序,研究者团队分析了源自亲本系“PiZZ6”的同基因 ZZ、MZ 和 MM iHeps 的转录组。主成分分析 (PCA) 显示了三个不同的AAT基因型聚类(图2A),在三组两两比较中,差异表达基因(DEGs)的总数显示,与MM iHeps相比,ZZ(1308)或MZ(736)之间的DEGs多于彼此之间的DEGs (图2B)。之后又比较已知调节脂质稳态的转录因子的相对表达,发现与 MM iHeps 相比,ZZ iHeps 中包括HNF1A、HNF4A、CEBPA、PPARA、CREB3L3和RXRA在内的多种因子显著下调 (图2C)。而接下来又通过基因集富集分析(GSEA)发现在 MZ 和 ZZ iHeps 组中,与血管生成、细胞凋亡、转化生长因子 β (TGF-β) 和上皮间质转化 (EMT)相关的基因显著富集 (图2D-E)。相反,MM iHeps 组富集了与传统肝细胞生物学相关的通路,包括胆汁酸代谢、外源性代谢、凝血和脂肪酸代谢。
鉴于正常稳态线粒体和 ER 功能在蛋白质合成和肝细胞代谢调节中的重要性,研究者团队研究了与 ER 或线粒体功能障碍相关的通路,发现 ZZ 和 MZ iHeps 都在 GO 分析中发生了富集 (图2F),例如参与线粒体功能通路和 PERK 介导的未折叠蛋白反应 (UPR),表明两种细胞器的功能障碍。这些数据证明 AAT 的Z单等位基因表达足以扰乱整体肝转录组并引起代谢失调。

图2. RNA-seq 表明单个 Z 等位基因能引起整体转录组失调
(A) 主成分分析 (PCA)。(B) ZZ、MZ 和 MM iHeps 之间的差异表达基因 (DEG)的火山图。(C) 肝脏脂类代谢转录因子的热图。(D) 基因集富集分析 (GSEA),包括已发布的 ZZ 与 MM iHeps 数据集,用于比较 (FDR < 0.1)。(E) ZZ 和 MZ iHeps 的前 5 个上调和下调最多的基因集与 MM iHeps 相比,按归一化富集分数 (NES) (FDR < 0.05) 排序。(F) NES (FDR < 0.25)前 5 的 ER 和线粒体相关的 GO 分析。
03

ZAAT的代谢组学分析
研究者团队接下来对代谢组进行表征,发现与 MM iHeps对照组相比,MZ 和 ZZ 组中的支链氨基酸 (BCAAs) 和短链酰基肉碱均有所升高,而 ATP、乳酸、还原型谷胱甘肽 (GSH)、氧化型谷胱甘肽 (GSSG) 和长链酰基肉碱均下降,且参与尿素生成的多种代谢物包括亚精胺、N-乙酰谷氨酸、谷氨酰胺、瓜氨酸和精氨酸在 MZ 和 ZZ 中的积累有差异(图3A)。
之后使用代谢物集富集分析 (MSEA) 和代谢途径分析 (MetPa) 分析了差异表达的代谢物,发现在表达 ZAAT 的 iHeps 中与能量密集型途径相关的多种代谢物发生了显著减少(图3B-D),包括丙氨酸和硫胺素代谢、尿素循环和精氨酸生物合成,以及烟酸盐和烟酰胺代谢产物 (NAD/ NADH)。重要的是,通过代谢组学分析发现了在MZ 和 ZZ iHeps中富集了其他途径相关的代谢物(图3C-D),包括将乙酰基转移到线粒体和氨酰-tRNA 生物合成,以及支链氨基酸 (BCAA) 生物合成和还原型谷胱甘肽(GSH) 的变化,这些都与诱导ER 应激或慢性肝病相关。总之,代谢组学分析表明 ZAAT 引起的的 ER应激和线粒体损伤会改变稳态肝功能过程,包括尿素循环和氧化还原途径,并改变 MZ 和 ZZ iHeps 中的蛋白质合成。

图3. 代谢组学分析发现 ZAAT 表达细胞中代谢途径失调。
(A) 酰胺和脂质组分前 50 种差异积累代谢物的热图。(B) ZZ 与 MM iHeps 的代谢物集富集分析汇总图显示按 P 值排名的前 5 的代谢途径。(C) ZZ 与 MM iHeps 通路富集分析的代谢组预测。(D) 尿素循环相关酶的 RNA 表达热图。
04

ZAAT iHeps 单细胞RNA测序
为了确定杂合表达ZAAT的细胞在转录水平上是否存在异质性,研究者团队对来自PiZZ1供体的同基因ZZ、MZ和MM iHeps以及来自PiZZ6供体的额外ZZ样本(PiZZ6ZZ)进行了单细胞RNA测序(scRNA-seq)。他们应用均匀流形近似和投影 (UMAP)以及 Louvain聚类(Louvain clustering) 并鉴定了6个簇,其中四个由 ZZ 和 MZ 细胞的混合物组成,一个几乎完全由 MM 细胞组成(图4A-B)。他们将每个簇的前 50 个 DEGs 与Hallmark 基因集的富集进行了比较(图4D-E), 并且将表达ZAAT的簇注释为纤维化(cluster 0); 分泌性(cluster 1); 增殖性(cluster 3); 线粒体的 (cluster 4); 酶促的 (cluster 5)。这些数据表明在表达突变体 ZAAT 的 iHeps 中存在转录异质性,其特征是在 MZ 和 ZZ 细胞集中表达促纤维化基因(如COL4A1和COL4A2) (图5D-F),这种异常表达模式进一步伴随着未折叠蛋白反应 (UPR) 的三个分支(ATF6 和 IRE1/XBP1s)的相对下调以及纤维化相关PERK 效应基因的上调(图5G,5J-K)。
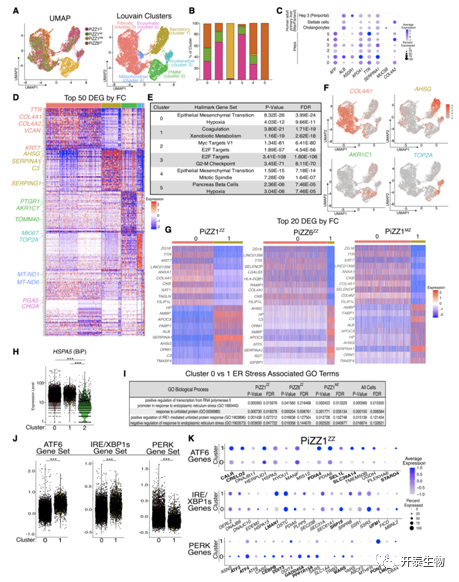
图4. scRNA-seq 展示了表达 ZAAT 的 iHeps 中具有分支特异性 UPR 激活的转录异质性
(A) UMAP和 Louvain 聚类鉴定 6 个簇。(B) 6 个 Louvain 聚类的组成。(C) 6 个簇中选定的肝、胆管上皮和星状基因的平均表达和频率。与公开可用的人类肝脏 scRNA-seq 数据集进行了比较。(D) 按倍数变化 (FC) (FDR < 0.001) 排列的每个簇的前 50 个 DEG。(E)每个簇排名前两个 Hallmark 基因集。(F) 选择集群特定相关 DEG 的 UMAP。(G) 由 FC 排名的前 20 个 DEG。(H) HSPA5 (BiP) 簇表达的小提琴图。(I) GO 分析。(J) cluster 0 和 cluster 1 的 PERK、ATF6 和 IRE/XBP1s 模块分数的小提琴图。(K) PiZZ1ZZ的 UPR 分支特异性基因的点图预测。
+ + + + + + + + + + +
结 论
本项研究表明杂合子 MZ iHeps 表现出介于基因ZZ 和 MM之间的中间疾病表型。通过多组学分析,已经证明与杂合子MZ iHeps与纯合子 ZZ iHeps 具备同样的特点,包括 AAT 蛋白合成和下游多个代谢通路的紊乱,改变的内质网和线粒体形态,线粒体功能损伤,以及细胞亚群中未折叠蛋白反应的分支特异性激活,这些发现为 ZAAT 诱发的肝细胞损伤的机制基础提供了重要的理论依据,表明 Z 突变的杂合子和纯合子个体的临床肝病风险增加。
+ + + + +



 English
English

