文献解读|Nat Commun(14.7):综合多组学分析揭示肿瘤-免疫-肠道轴影响卵巢癌免疫治疗结果
✦ +
+
论文ID
原名:Integrative multi-omics analysis uncovers tumor-immune-gut axis influencing immunotherapy outcomes in ovarian cancer
译名:综合多组学分析揭示肿瘤-免疫-肠道轴影响卵巢癌免疫治疗结果
期刊:Nature Communications
影响因子:14.7
发表时间:2024.12.05
DOI号:10.1038/s41467-024-54565-8
背 景
上皮性卵巢癌、输卵管癌和原发性腹膜癌(统称为 OC)是最致命的妇科恶性肿瘤。该病的五年生存率仍然不到 50%,因为大多数女性最终都会死于难治性疾病2。虽然最佳细胞减灭术和一线铂类-紫杉烷类化疗的生存益处已得到充分证实,但对于复发性疾病患者,仍然需要有效、持久的治疗方法,同时保持良好的生活质量 (QoL)。
实验设计
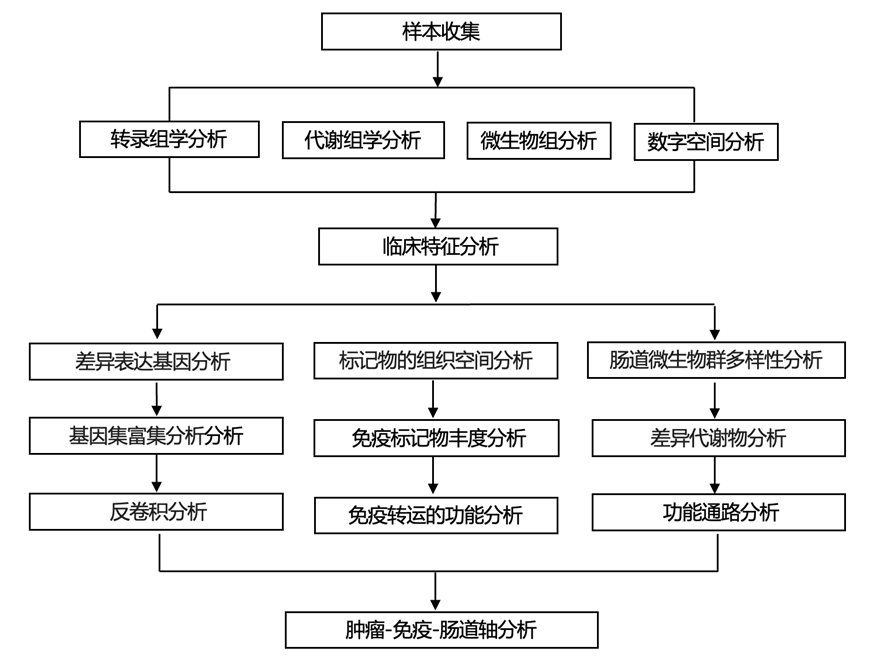
结 果
01
联合使用单抗可改善患者预后
最近开展了一项临床试验(NCT02853318),该试验招募了 40 名复发性 OC 患者,平均年龄为 62.2岁。此外,30 名参与者(75.0%)患有铂类耐药性疾病,平均既往化疗次数为 3.4。研究团队安全地将抗 PD-1 帕博利珠单抗(pembrolizumab)与抗 VEGF 贝伐单抗(bevacizumab)(以防止新的肿瘤血管生长并增强 T 细胞向 TME 的浸润)和口服环磷酰胺(旨在消耗免疫抑制调节性 T 细胞或 Treg)联合使用。本研究中没有参与者曾接触过免疫检查点阻断 (ICB)疗法,因为这种治疗仅获准用于微卫星不稳定性(MSI-H)、错配修复缺陷(dMMR)或高突变负担(TMB-H)的患者,而这些情况仅占 OC 患者群体的约 3%(图1)。
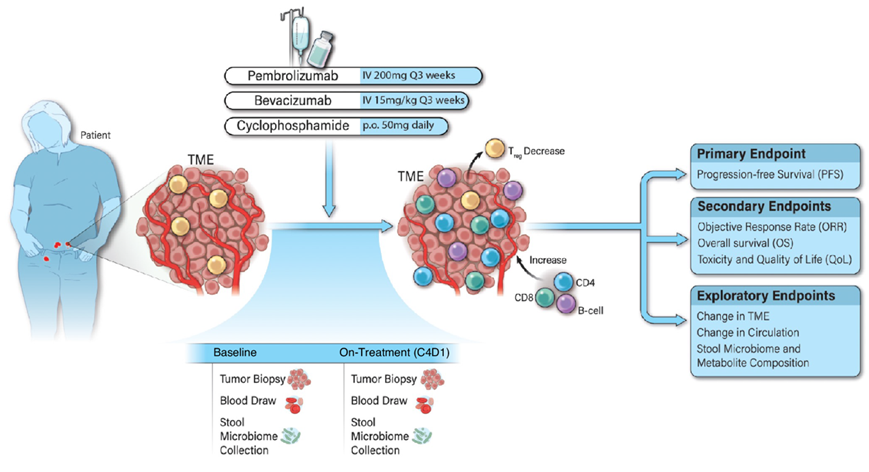
图1. 临床队列概览。
该试验的中位无进展生存期 (PFS)为 10.2 个月(主要终点),客观缓解率 (ORR)为 47.5%(次要终点),毒性有限,且通过 EORTC 生活质量问卷分析的生活质量良好。联合疗法在 95.0% 的患者中显示出临床益处(完全或部分缓解或病情稳定)。除了临床试验中根据 iRECIST 标准达到确认的部分缓解或完全缓解的患者外,PFS 中位数超过 10.2 个月的个人在相关性分析中归类为 DCB 患者。这一决定源于这样的认识:在免疫治疗试验中维持持久、稳定的病情意味着相当大的临床益处,特别是对于这群患者而言,二线化疗的预期中位 PFS 为 3-4 个月,而帕博利珠单抗单药治疗的预期中位 PFS 为 1.9-2.1 个月。与涉及该患者群体的类似试验中通常观察到的平均 PFS 相比,这些结果代表了 2 到 3 倍的改善。这表明本研究的方法为复发性 OC 提供了一种有前景的治疗策略,NCCN 卵巢专家指南小组现已将其列入 2024 NCCN 指南,作为铂类耐药 OC 的二线治疗方案。
他们将患者分为持久临床益处 (DCB)组和临床益处有限的患者 (LCB)组。还标明了每组的 BRCA 和 PD-L1 状态。BRCA 变异状态与 PFS 之间没有显著相关性。但是,BRCA 阳性患者的 ORR 为 71.4%,而 BRCA 阴性患者的 ORR 为 30.4%。基线肿瘤活检样本中 PD-L1 的表达与 ORR 或 PFS 无关。单变量分析显示,DCB 组和 LCB 组在年龄、BRCA 状态、PD-L1 状态、既往治疗暴露或对铂类的初始敏感性方面没有显著差异。然而,在免疫组织化学 (IHC) 上发现与肿瘤浸润淋巴细胞 (TIL) 有显著关联,在 DCB 组中观察到更多的“3”分数(图S1a)。
生存结果表明,在最初的 18 个月后仍有显著的反应,在初始治疗后 30 个月(48% 的 DCB)和 40 个月(29% 的 DCB)仍可观察到 DCB(图S1b-c)。此外,Kaplan-Meier 分析显示 DCB 和 LCB 之间的中位 PFS 相差三倍多,DCB 的 PFS 为 20.2 个月,而 LCB 为 5.72 个月(图S1c)。这些数据证实并扩展了从最初停止日期14开始的原始临床观察结果,表明一些患者可能会体验到比典型 LCB 持续时间长达五倍的益处。考虑到两组之间观察到的临床结果存在显著差异,他们研究了进一步的探索性终点,例如 TME 变化和粪便微生物组或代谢物谱变化。
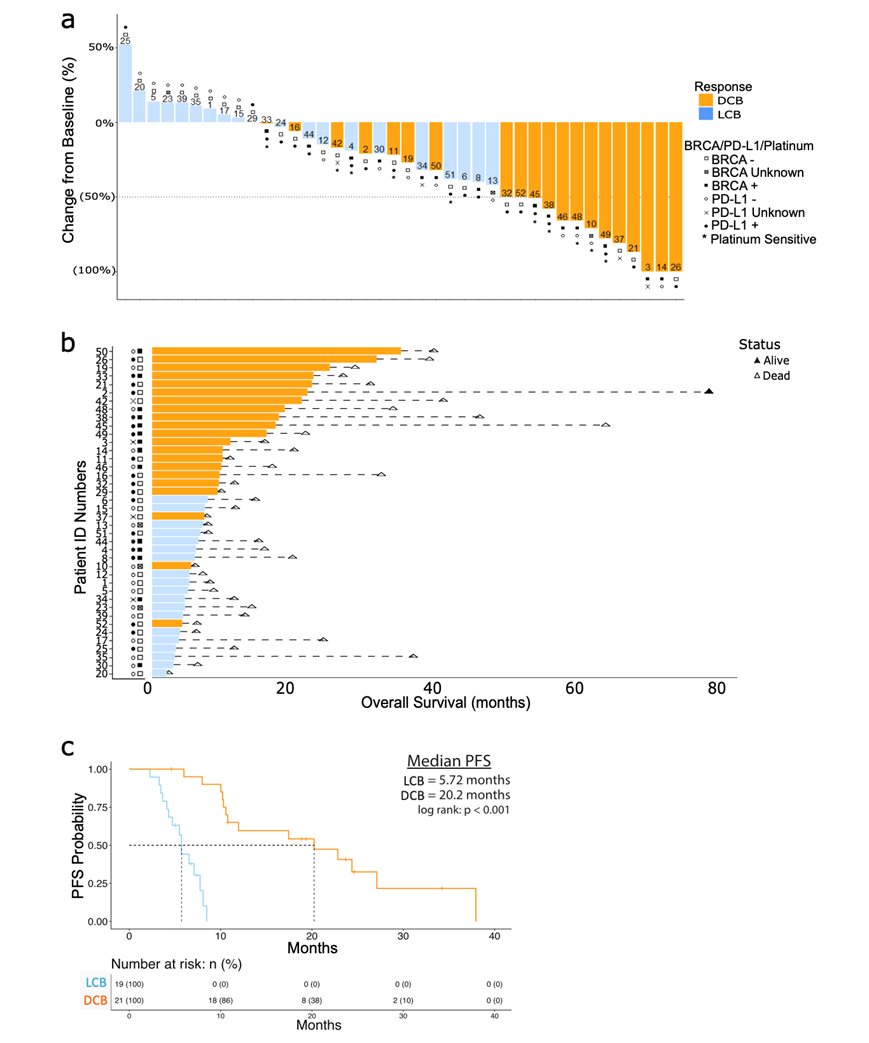
图S1. 根据临床结局更新临床试验结果,以及具有持久临床获益和有限临床获益的患者分布情况。
(a)瀑布图显示持久临床获益(DCB)和有限临床获益(LCB)患者人群中肿瘤大小相对于基线的变化。(b) Swimmer的图详细说明了这些患者人群的无进展生存期(PFS)差异及其BRCA1和PD-L1状态,表明仍存活的患者(黑三角)和已死亡的患者(白三角)。(c) Kaplan-Meier曲线显示DCB(橙色,中位PFS = 20.2个月)和LCB(蓝色,中位PFS = 5.72个月)人群的PFS差异。
02
ICB 联合治疗的出色反应与高度功能性和多样性的免疫肿瘤微环境(TME)相关
他们对 29 名高质量试验患者连续收集的基线和治疗中(On.TX)(在第 4 周期第 1 天进行 3 个周期治疗后)肿瘤活检样本进行了转录组分析 (RNA-seq),以表征对 ICB 联合治疗有不同临床反应的肿瘤的分子差异,旨在识别基线(Baseline_DCB vs. Baseline_LCB)和治疗中(On.TX_DCB vs. On.TX_LCB)DCB 与 LCB 中的差异表达基因(图 2a)。此外,他们发现了 DCB(On.TX_DCB vs. Baseline_DCB)和 LCB(On.TX_LCB vs. Baseline_LCB)内与治疗相关的变化 (图S2a)。肿瘤转录组的基因集富集分析 (GSEA) 显示,与 LCB 相比,基线 DCB 中的 T 细胞和 B 细胞活化、分化和增殖特征有所增加,仅在 DCB 中接受治疗后这些特征进一步增强(图 2a-b)。此外,在基线和 On.TX 时,DCB 患者的肿瘤富含与 CD40、抗原呈递、细胞因子产生和信号传导以及 TLS相关的免疫特征。相反,MYC 和神经元特征主要在基线和On.TX时的 LCB 肿瘤中表达。
微环境细胞群 (MCP) 计数器反卷积分析证实了与 DCB 相关的高免疫原性活性特征。基线和 On.TX 与免疫群体估计值升高相关,包括 CD8+ T、B、树突状细胞 (DC) 和巨噬细胞/单核细胞(图 2c-d)。MCP 计数器的结果与来自另外 5 种反卷积评分方法的估计值高度一致(图S2b)。这些发现表明,与对 ICB 联合疗法反应良好的患者相比,在基线和治疗后都有升高且复杂的肿瘤免疫细胞浸润。为了更好地分析“免疫热”和“免疫冷” 患者的不同表型,他们进一步评估了 TME 中的免疫群体。
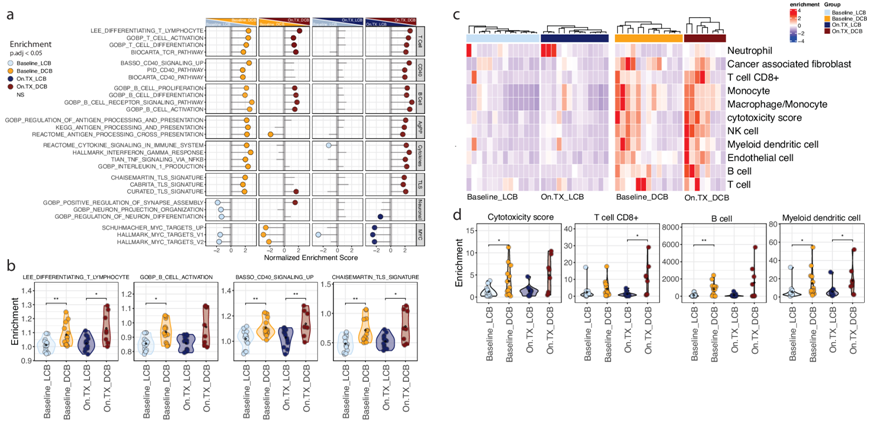
图2. 肿瘤转录组分析表明,与临床益处有限的患者相比,具有持久临床益处的患者表现出更高的免疫激活。
(a) 过对肿瘤转录组数据进行基因集富集分析 (GSEA),发现免疫群体变化在持久临床益处 (DCB) 组中富集,并且与有限临床益处 (LCB) 组相比,这种富集在治疗期间 (On.TX) 进一步放大。(b-d) 基于GSEA的免疫特异性特征分析。
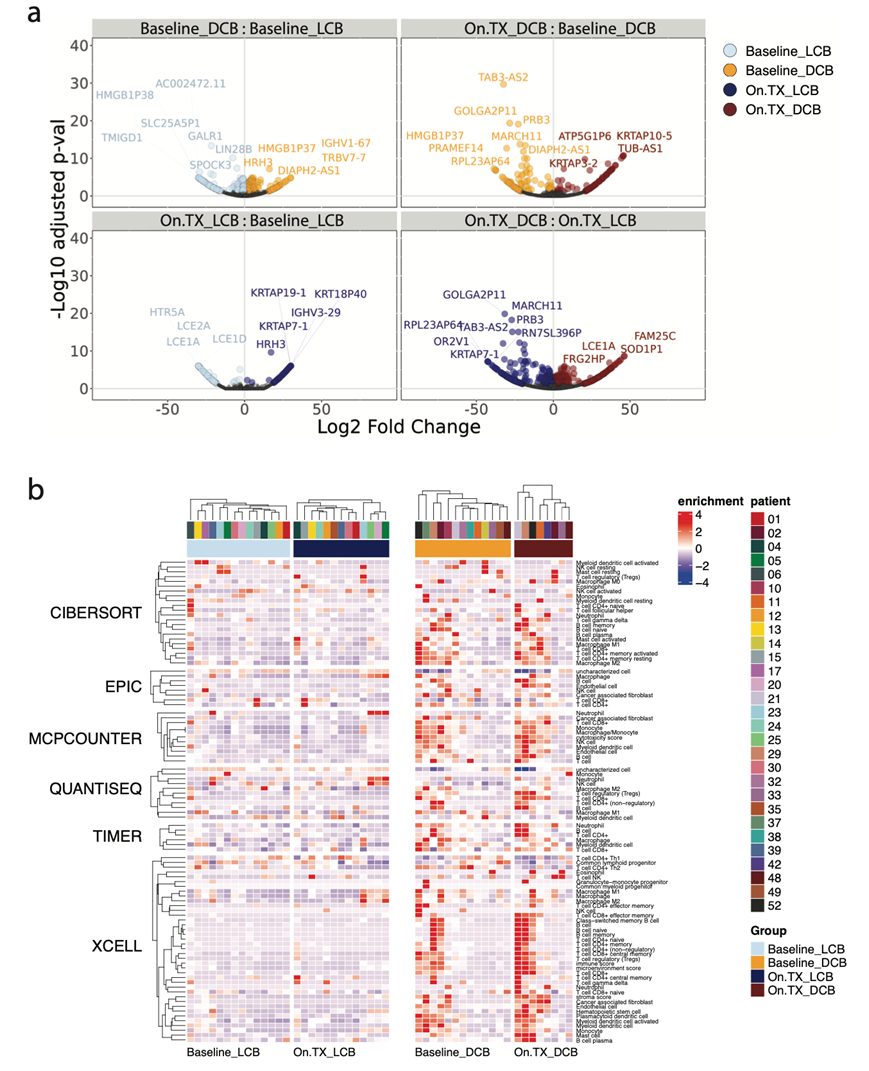
图S2. 反卷积分析。
(a)火山图显示显著差异表达基因(DEG)。(b) 与LCB患者相比,DCB患者人群在基线和On-TX时6种不同的免疫反卷积特征的富集。
03
免疫球蛋白B联合疗法可诱导对免疫疗法有反应的患者发生基质至肿瘤的免疫转运
他们对 14 名患者的系列活检材料进行了 52 种不同肿瘤和免疫肿瘤学标志物的数字空间分析 (DSP) 。从每个活检切片中,从病理定义的肿瘤和基质区室中选择 3 个感兴趣区域 (ROI),总共有 168 个 ROI 可用于跨患者分析。患者基线和 On.TX 的 ROI 代表性成像显示,DCB 和 LCB 患者基线和 On.TX 的基质区域均存在 CD3+ 聚集体,但这些特征在基线的肿瘤区域有限,表明治疗前存在主动淋巴样浸润排除(图 3a)。值得注意的是,在 DCB 中的 On.TX 中通常观察到肿瘤区域的 CD3+聚集体,这表明免疫运输增强到肿瘤区域与对联合 ICB 的持久反应有关。
对免疫标志物的定量评估显示,ROI 内存在相当大的免疫原性异质性(图 3b)。在基线时,肿瘤区域可通过丰富的卵巢上皮标志物与基质区域区分开来,包括上皮细胞粘附分子(EPCAM)、雌激素受体 α(ERα)、孕酮受体 (PR)、人表皮生长因子受体 2 (HER2) 和增殖标志物 Ki-67(图 3b)。相反,基质区域与大量谱系定义免疫标志物(CD3、CD8、CD4、CD20、CD14、CD11C)相关,证实大多数患者在治疗前都存在复杂但排除肿瘤的免疫环境(图 3b)。
差异丰度分析显示,在 LCB 中,治疗并未引起标志物丰度或定位在肿瘤或基质区域的显著变化(图 3c-e)。相反,在 DCB 中,许多免疫标志物在治疗后升高,尤其是在确定的肿瘤区域。这些包括谱系定义标志物(CD3、CD11C、CD20),还有细胞毒性效应物(GZMB)、共刺激物(CD40、CD27)和免疫检查点(PD-L1、VISTA)蛋白。相反,DCB 中的 Ki-67 因治疗而降低。On.TX DCB 与 LCB 的比较同样揭示了增强的肿瘤和基质区室的免疫原性,表明反应与治疗诱导的免疫细胞浸润 TME 和向肿瘤区域的运输有关。在 ROI 中,CD20、CD3 和 CD11C 之间存在强相关性,表明 T、B 和树突状细胞(DC) 同时出现,分别支持 三级淋巴结构(TLS)的形成。使用这些组合标记丰度来定义 TLS 评分,发现基线和 On,TX 时 DCB 显著富集(图 3e),验证了转录组分析中 TLS 评分富集的观察结果。这些结果表明基线和 On.TX 时 DCB 和 LCB 中的免疫细胞浸润、运输和活动模式发生了改变;然而,这种差异背后的生物学病因在很大程度上尚不清楚。
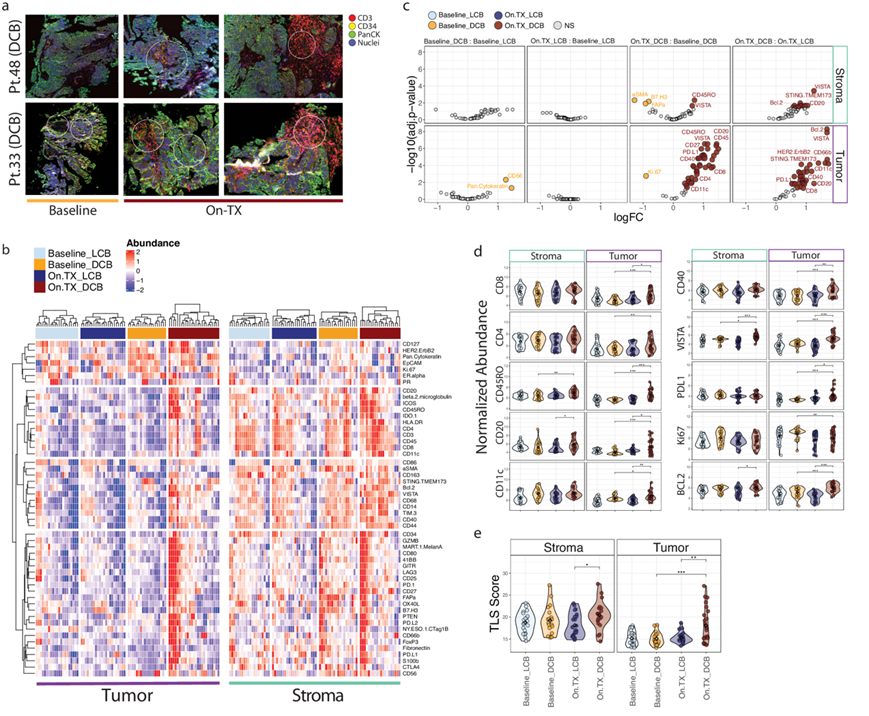
图3. 对肿瘤和基质区域内的数字空间分析。
(a) 两名 DCB 患者的代表性图像显示 On.TX 期间形成大量 CD3+ 聚集体。(b) 热图表示在肿瘤和基质区室中 DSP 检测中检测到的所有标记物。(c) 火山图显示了 Baseline 和 On.TX DCB 和 LCB 患者群体之间这些标记物的差异表达。(d) 对免疫和增殖标志物进行定量分析。(e) 与基线 DCB 和 On.TX LCB 相比,On.TX DCB 患者的 TLS 评分显著升高。
04
对联合 ICB 的反应和结果与微生物组的改变相对应
通过 16s-rRNA 测序分析了基线和 On.TX 时连续收集的粪便样本。微生物组成显示反应组之间没有显著的 α 或 β 细菌多样性差异。然而,比较基线 DCB 和 LCB 中在物种水平上汇聚的操作分类单元 (OTU) 丰度的差异分析显示微生物群落组成的显著差异(图 4a)。与肿瘤转录组学和 DSP 分析的观察结果一致,DCB 患者在基线和 On.TX 时的细菌与 LCB 不同,这表明特定的微生物组组成可能与联合 ICB 反应有关。他们发现了几种与 LCB 相关的菌种,如粪肠球菌和产气荚膜梭菌,它们与免疫疗法耐药性有关。相反,他们在 DCB 中发现了几种含量丰富的细菌,如丁酸产肠单胞菌和丙酸梭菌 (Clostridium propionicum),这些结果表明这些产丁酸细菌与免疫疗法反应增强有关。他们还发现了一些细菌,如Dielma fastidiosa(一种新发现的细菌属),它们在 DCB 样本中也大量存在。
此外,几种菌种的存在在接受治疗后发生了改变,例如与 LCB 相比,在 DCB 中 On.TX 中检测到的 瘤胃梭菌属细菌含量更高。值得注意的是,与基线和 On.TX 时的 LCB 相比,DCB 中的几种细菌种类仍然持续升高(图 4b),例如Dielma fastidiosa、瘤胃球菌属和消化球菌属。鉴于这些菌种在 DCB 的整个治疗过程中始终以高水平丰富(图 4b),它们可能作为预后指标或治疗靶点,帮助患者通过益生菌补充剂对联合 ICB 敏感。
他们评估了连续收集的粪便生物样本的整体代谢,以更好地了解 DCB 和 LCB 之间不同细菌组成对功能的影响。差异代谢物分析显示,在基线和 On.TX 时,DCB 和 LCB 患者的粪便样本中存在几种特定的代谢物(图 4c-d)。许多关键代谢物与影响免疫细胞功能的途径有关,如细菌产生的代谢物[吲哚和三甲胺-N-氧化物(TMAO)、脂肪酸(FA:18:1)、酰基肉碱(C3-OH)、嘌呤生物合成(黄嘌呤、次黄嘌呤)和氨基酸(丝氨酸和谷氨酸)]。此外,DCB 患者的粪便谷氨酸水平明显高于 LCB On.TX(图 4d)。
相反,治疗同样降低了 DCB 和 LCB 中的吲哚水平(图 4d),表明谷氨酸在治疗反应中具有潜在作用,这可能代表一种可利用的生物学现象。一些血清代谢物水平显示出与粪便样本中观察到的水平相反的模式,例如与基线时的 LCB 相比,DCB 血清中的磷脂酰胆碱降低,这可能表明这些代谢物的排泄增加。此外,与 LCB 相比,DCB 中通过吲哚形成的血清色氨酸代谢物(3-IAA)增加。总体而言,许多将 DCB 与 LCB 区分开来的代谢物属于与免疫功能相关的通路,尤其是那些由细菌产生的代谢物(TMAO和吲哚),这促使他们更详细地探索代谢组、微生物组和 TME 之间的关联。
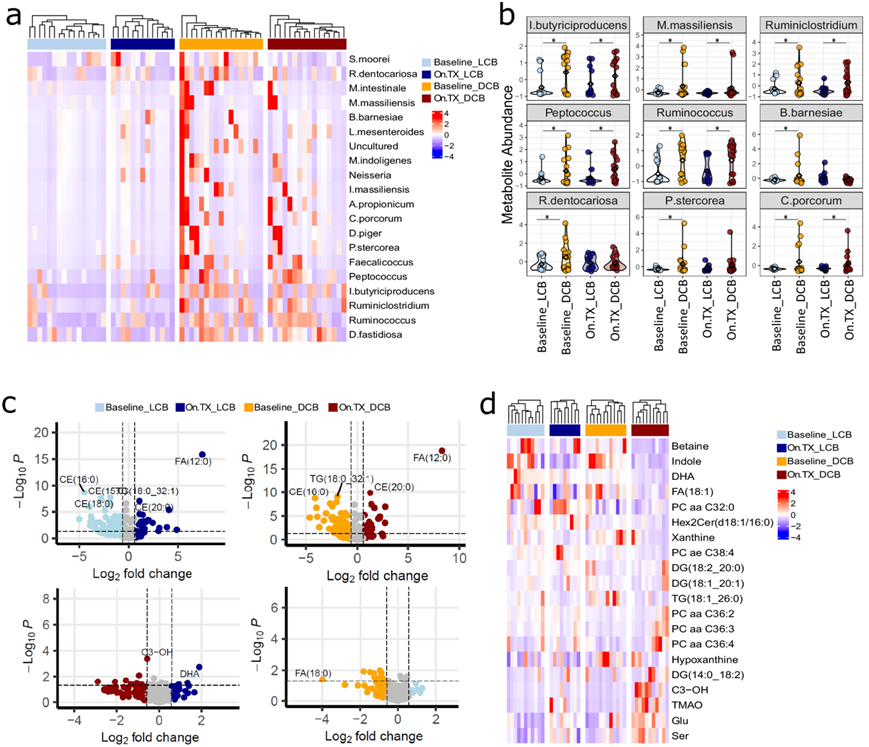
图4. 肠道微生物群多样性和代谢特征与免疫疗法的持久反应相关。
(a) 热图中显示了 Baseline_DCB 和 Baseline_LCB 之间前20 种差异丰度微生物。(b) 小提琴图定量了所选细菌种类在所有四组中的 OTU 丰度。(c) 差异丰度代谢物分析。(d) 根据欧几里得距离,在所有 4 个组中,20 种差异表达最高的代谢物的表达水平将 Baseline_DCB 和 Baseline_LCB 粪便样本在很大程度上分开。
05
并发模块分析确定了与治疗反应相关的肿瘤-免疫-肠道轴内的潜在关键因素
肿瘤代谢对肿瘤的生长和进展以及支持性细胞群功能至关重要。这包括基质和血管成分以及免疫细胞浸润和功能。为了在没有肿瘤代谢组学的情况下评估内在肿瘤代谢,他们使用了之前开发的生物信息学流程,根据转录组学水平数据确定 114 条代谢通路中哪条失调最严重。来自肿瘤转录组数据的代谢预测分析(图 5a)揭示了在基线和 On.TX时 DCB 和 LCB 之间严重失调的几种代谢通路,包括色氨酸代谢和犬尿氨酸代谢,以及从粪便代谢组学中观察到的几种脂质相关通路,与吲哚和磷脂酰胆碱的失调一致。为了识别连接肠道和TME的融合代谢通路,他们将来自肿瘤转录组的代谢预测与粪便代谢组学的代谢物集富集分析(MSEA)(图 5b)和16S测序的功能分类分析(Tax4Fun)(图 5b)相结合。粪便16S、粪便代谢组学和肿瘤转录组之间富集的代谢途径的重叠揭示了三条重叠途径(图 5c),包括脂质(甘油磷脂)和氨基酸相关途径(尿素/谷氨酸和色氨酸代谢)。与粪便16S类似,从基线DCB和LCB的比较中差异丰度微生物的功能富集导致尿素循环和氨基酸以及炎症功能的富集。
粪便代谢物和微生物组丰度分成几个聚类,与从肿瘤转录组数据得出的免疫反卷积评分呈正相关和负相关,表明肠道特征可能与TME的特征和对联合ICB的反应在功能上相关。谷氨酸就是这样一种代谢物,它参与氨基酸代谢,通过尿素循环处于氨基酸和碳水化合物代谢的关键位置,与TME中的CD8+T细胞估计值密切相关。为了识别反映生物学汇聚点的全局共现模块,这些模块可能解释对联合ICB的反应差异,他们建立了一个相关网络,将TME特征评分、粪便代谢物水平和粪便细菌丰度联系起来(图 5d)。该网络揭示了代谢物、细菌种类和肿瘤浸润免疫群之间的显著相关性。例如,他们发现了一个高度相关的模块,该模块将肠道中的Dielma fastidiosa 的丝氨酸和谷氨酸与 TME 中的 CD8 + T 细胞联系起来,这似乎是由联合 ICB 驱动的,因为Dielma fastidiosa和 CD8+ T 细胞的估计值在 DCB On.TX 中最高,而其他免疫细胞群(如单核细胞)则没有观察到这种关系。因此,该模块代表了一个重要的收敛节点,可能突出治疗杠杆点,以增强联合 ICB 的疗效,特别是针对 CD8+ T 细胞适应性。
他们提出了一个全面的工作模型(图 5e),用于评估晚期 OC 患者对可耐受且高效的组合 ICB 的持久反应,该模型描述了肠道中的特定微生物群(如 D. fastidiosa 和 Ruminococcus)及其代谢产物(如吲哚和 DHA),塑造独特的 TME。这项研究提出,免疫环境和宿主微生物组可能紧密相关,并可在未来免疫疗法试验中进一步用于分层患者或增强抗肿瘤反应。
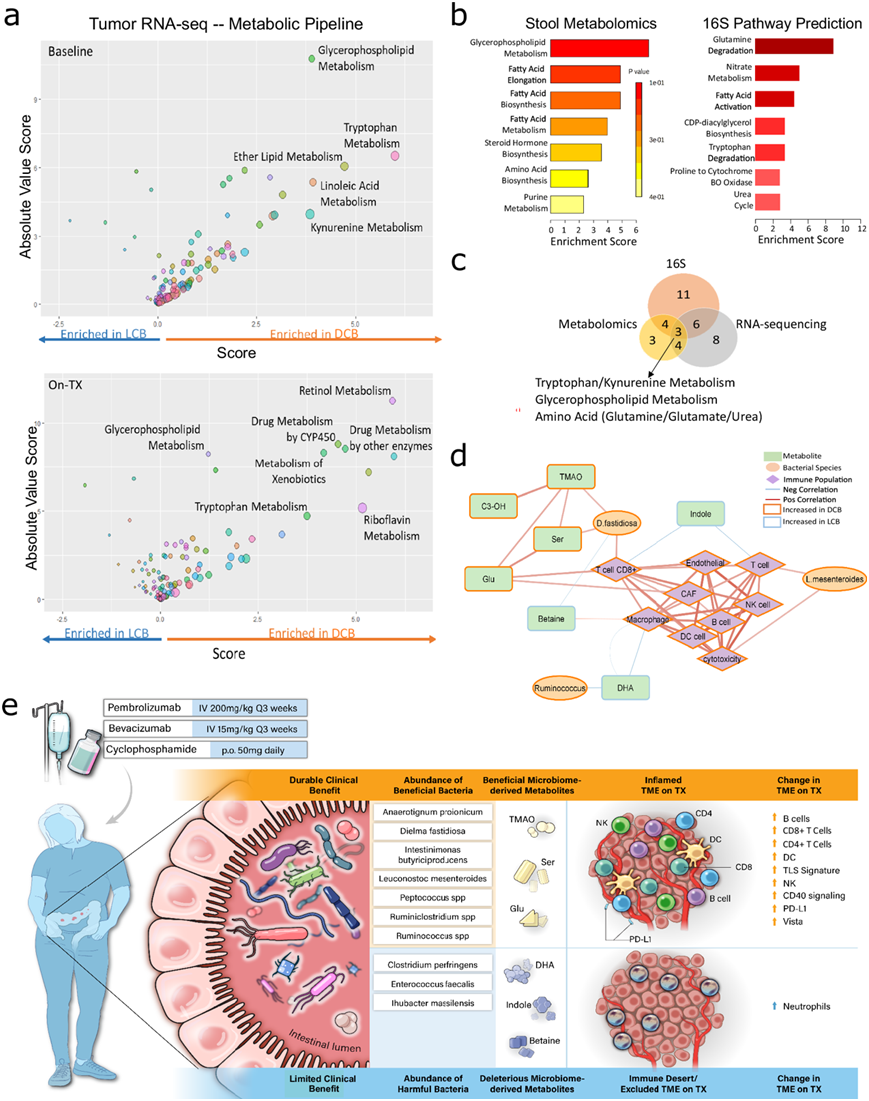
图5. 细菌种类、代谢物和免疫群体的整合确定了汇聚点。
(a) 肿瘤转录组数据用于代谢管道分析。(b) 来自相同基线比较的显著差异丰度代谢物用于代谢物组富集分析 (MSEA)。(c) 肿瘤RNA-seq、粪便代谢组学和粪便微生物组研究之间发现的显著失调通路重叠,揭示了所有分析共有的 3 条改变通路。(d) 相关网络分析。(e) 模型展示了对 ICB 反应的微生物(微生物组和代谢组)和免疫变化
+ + + + + + + + + + +
结 论
本项研究进行了一项 2 期临床试验 (NCT02853318),将派姆单抗与贝伐单抗相结合,以增加 T 细胞在肿瘤中的浸润,并口服环磷酰胺,以减少调节性 T 细胞的数量。该试验招募了 40 名接受过大量治疗的复发性卵巢癌患者。主要终点无进展生存期延长至中位数 10.2 个月。次要终点显示客观缓解率为 47.5%,30% 的患者在一年以上内疾病得到控制,同时保持了良好的生活质量。本研究对试验患者的样本进行了全面的分子、免疫、微生物组和代谢分析,表明 T 细胞和 B 细胞聚类的增加以及具有氨基酸和脂质代谢的不同微生物模式与出色的临床反应有关。这项研究表明,可以利用免疫环境和宿主微生物组来改善未来免疫治疗试验中的抗肿瘤反应。
+ + + + +



 English
English


