文献解读|Cell Rep(8.8):成年小鼠脑内皮细胞的综合多组学分析及其对阿尔茨海默病的潜在影响
✦ +
+
论文ID
原名:Integrative multi-omic profiling of adult mouse brain endothelial cells and potential implications in Alzheimer's disease
译名:成年小鼠脑内皮细胞的综合多组学分析及其对阿尔茨海默病的潜在影响
期刊:Cell Reports
影响因子:8.8
发表时间:2023.11.04
DOI号:10.1016/j.celrep.2023.113392
背 景
血脑屏障(BBB)具有脑内皮细胞(EC)的多种生理特性,并受到周围细胞外基质、壁细胞、神经胶质细胞和神经血管单元 (NVU) 内神经元的严格调节,但这些特性的分子基础仍不完全清楚。
实验设计
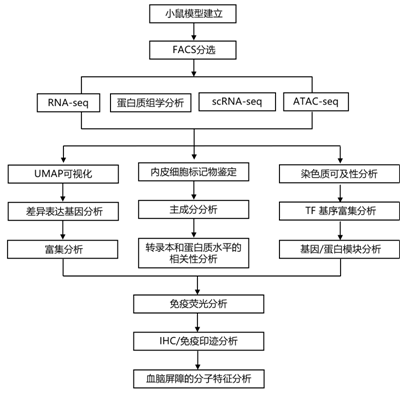
结 果
01
使用多组学方法对成年小鼠大脑 EC 进行分析
已有研究证明BBB 高度依赖于体内中枢神经系统(CNS)微环境,并且脑 EC 在体外培养过程中会发生不同程度的去分化。为了最大程度地保留 BBB 特性和相关分子成分,研究者团队从成年雄性 C57BL/6J 小鼠的脑组织以及肺和肝组织中纯化了 EC(CD31+ CD45 - PDGFRβ-活细胞)荧光激活细胞分选(FACS)(图1A)。然后立即对纯化的ec进行转录组分析 (RNA-seq)、定量蛋白质组学分析和转座酶可及染色质测序(ATAC-seq)(图1A)。内皮标记(Pecam1、Cdh5、Tek、Cldn5和Kdr)的mrna水平较高,而相应组织中其他细胞类型的标记基因的mrna水平最低,进一步证实了分离的内皮细胞的纯度。主成分分析(PCA)显示,来自不同小鼠组织的 EC 在转录组、蛋白质组和染色质可及性方面均表现出显著差异(图1 B),表明不同血管床的内皮异质性存在多基因组水平。
接下来,他们对小鼠脑、肺和肝 EC 进行了比较分析,以确定成人脑 EC 中特别富集的转录本和蛋白质。RNA-seq 检测到 14644 个基因转录本,而蛋白质组学分析检测到 4346 个蛋白质。在转录本水平上,与肺 EC 相比,439 个基因在脑 EC 中富集;与肝 EC 相比,744 个基因在脑 EC 中富集(图1C-D)。这两组共有的 221 个基因称为脑 EC 富集 mRNA_221(模块 R_221)(图 1D)。在蛋白质水平上,与肺 EC 相比,脑 EC 中富集了 255 种蛋白质;与肝 EC 相比,脑 EC 中富集了 236 种蛋白质(图 1C -D)。这两组共有的 78 种蛋白质归类为Protein_78(模块 P_78)(图 1D)。
在模块R_221中,检测到来自64个基因的蛋白质,未检测到来自其他157个基因的蛋白质(图1E)。在模块 P_78 中,检测到了 76 个蛋白的转录本,而其余两个蛋白(阳离子通道精子相关蛋白亚基 gamma 2,由 Catsperg2 编码;蛋白spire 同源物 2,由Spire2编码)的转录本未通过 RNA-seq 检测到(图 1 E)。维恩图分析发现,R_221模块和P_78模块仅存在23个共有基因,这些基因定义为脑EC标记模块RP_23(图1E)。
RP_23 的最大子集对应于跨膜转运蛋白和Bsg,其编码basigin(一种用于单羧酸转运蛋白膜靶向的重要跨膜蛋白)(图 1 F)。有趣的是,RP_23的其他功能亚群包括酶注释基因、囊泡运输过程和膜动力学、TJ/细胞骨架组织和膜受体(图1F)。他们还发现Tsc22d1是亮氨酸zipper 转录因子(TF)家族的成员,也是转化生长因子β (TGF-β)信号的调节因子,在转录和蛋白质水平上都富集于脑EC。
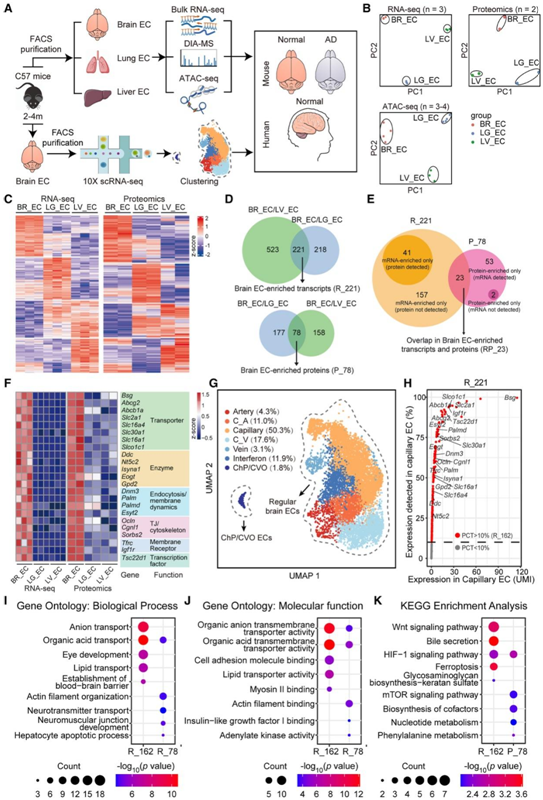
图1. 综合转录组学和蛋白质组学分析鉴定出成年小鼠脑内皮细胞中富集的转录本和蛋白质。
(A) 实验流程。对内皮细胞 (EC) 进行bulk RNA -seq、数据独立采集质谱 (DIA-MS) 和 ATAC-seq以及scRNA-seq。(B)主成分分析 (PCA)。(C) 分别通过 RNA-seq 和蛋白质组学鉴定的脑 (BR_EC)、肺 (LG_EC) 和肝 (LV_EC) EC 中的差异表达基因 (DEG)。(D)通过RNA-seq和蛋白质组学技术分别鉴定了相对于肺或肝内皮细胞,选择性富集于脑内皮细胞的基因转录本和蛋白质的数量。(E) 维恩图显示了大脑 EC 中在转录本和蛋白质水平上富集的基因数量。(F) 热图描绘了小鼠大脑 EC 中在转录本和蛋白质水平上富集的基因 (RP_23)。(G) 急性纯化的小鼠大脑 EC 的 8088 个单细胞转录组的 UMAP 可视化图。(H) 毛细血管 EC 亚群中成年小鼠脑 EC 富集转录物 (R_221) 的表达。(I–K) BBB转录模块R_162和蛋白质模块P_78的GO和KEGG富集分析。
02
成年小鼠脑内皮细胞异质性的单细胞转录组分析
在 scRNA-seq 的 UMAP 图上(图 1 G),脑 EC 明显分为两种主要类型:常规脑 EC和源自脉络丛和室周器官的 EC 群体(ChP/CVO EC)。这些大脑区域缺乏血脑屏障的特性,因此可以在大脑和血液之间迅速进行信号分子交换。事实上,这些非血脑屏障ChP/CVO ec表达低水平的血脑屏障标志物(Slc2a1和Cldn5 mrna,GLUT-1蛋白),但表达高水平的网状血管标志物(Plvap和Plpp3 mrna, Plvap蛋白)(图2A-B)。
为了揭示ChP/CVO ECs与常规脑EC在屏障功能方面存在明显差异的分子基础,他们进一步研究了脑毛细血管EC (BBB)与ChP/CVO EC(非BBB)中转录本的差异表达。与ChP/CVO细胞相比,脑毛细血管细胞中有177个基因富集,165个基因缺失(图2C)。177个脑-血管-ec富集基因中有90个存在于BBB转录模块R_162中,包括典型的BBB标记(如Abcb1a、Slc2a1、Slco1c1、Slc7a1、Mfsd2a、Ocln、Lsr、Tfrc等)和Wnt信号靶点(Axin2、Apcdd1、Lef1、Spock2等)。在脑毛细血管内皮细胞中,缺失最多的基因包括标志物(Plvap)、磷脂磷酸酶(Plpp3、Plpp1)、磷脂跨双分子层迁移调节剂Plscr2、胰岛素样生长因子结合蛋白(Igfbp3)、自身免疫相关基因Cd24a、促血管生成基因Esm1和炎症介质Tcim(图2D)。GO分析表明,BBB毛细血管内皮细胞富含与跨膜运输、BBB维持、细胞-基质粘附和神经肌肉接头发育相关的基因;相比之下,ChP/CVO ECs 高度富集与 EC 迁移、细胞粘附正向调节、上皮细胞增殖和防御反应正向调节相关的基因,所有这些在 BBB 毛细血管 EC中均受到抑制(图2E)。
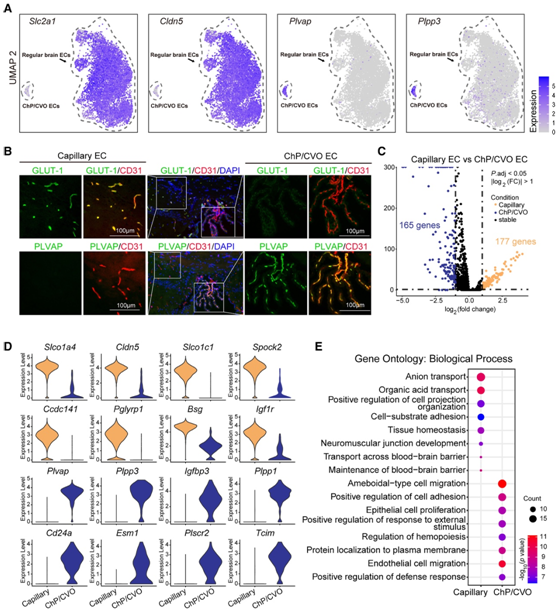
图2. 成年小鼠脑内皮细胞异质性的单细胞转录组分析。
(A) UMAP 用于 BBB EC 标记(Slc2a1、Cldn5)和非 BBB ChP/CVO EC 标记(Plvap、Plpp3)的表达。(B) BBB EC 标记 GLUT-1、ChP/CVO EC 标记 PLVAP 和 EC 标记 CD31 的代表性免疫荧光染色图像。(C) 火山图显示脑毛细血管 EC 和 ChP/CVO EC 之间的 DEG。(D) 小提琴图显示脑毛细血管 EC(上)和 ChP/CVO EC(下)中代表性标记基因的表达水平。(E) GO分析显示 (C) 中 DEG 的代表性通路。
03
通过表观基因组学分析鉴定脑 EC 特异性开放染色质区域和相关 TF
他们进行了 ATAC-seq 来分析大脑 EC 中可接近的染色质区域(表现为 ATAC-seq 峰),以识别 BBB 特异性 CRE 和相关的反式作用因子(即TF)。他们确定了 3919 个 ATAC-seq 峰,与肺和肝 EC 相比,这些峰在脑 EC 中特别富集(图 3 A)。大多数脑ec特异性峰位于转录起始位点(TSS)远端的区域,这一比例略高于肺或肝特异性峰(图3A)。重要的是,他们发现BBB转录模块R_162中的基因位于TSS附近的ATAC-seq峰值信号明显更强(图3B),这表明TSS周围较高程度的染色质可及性可能有助于bbb特异性转录。
使用基序富集超几何优化 (HOMER) 进行的 TF 基序富集分析表明,来自 TCF/LEF、SOX 和 ETS TF 家族的基序的脑 EC 特异性峰发生强烈富集(图3C)。他们使用来自RNA-seq数据确定存在于脑EC中的家族成员。分析显示,Lef1、Tcf7、Sox7、Sox13、Sox17、Sox18、Erg、Ets1、Ets2、Elf1和Fli1在脑ec中大量表达(图3D),其中Lef1、Tcf7和Sox17表现出脑ec特异性富集。
接下来,他们分别以Lef1、Sox17和Erg作为TCF/LEF、SOX和ETS TF家族的代表成员,分析了它们可能的靶点和可能调控的生物学功能。脑EC中LEF1、SOX17和ERG基序周围的染色质可及性明显强于肺和肝EC(图3E)。当LEF1(972个基因)、SOX17(793个基因)和ERG(1309个基因)附近的峰含有这些TF基序,他们确定了这些基因作为假定的靶点(图3F)。将这些靶基因列表与BBB转录模块R_162进行比较,发现大量富含BBB的基因是LEF1、SOX17和ERG的靶基因:LEF1有74个基因,SOX17有64个基因,ERG有82个基因,三个tf共有113个基因。有趣的是,这三种tf之间存在明显的BBB靶点重叠:LEF1和SOX17之间有40个基因重叠,LEF1和ERG之间有50个基因重叠,SOX17和ERG之间有49个基因重叠。R_162中的32个基因在3个tf的靶标之间共同存在,包括典型的Wnt信号靶标和一些典型的BBB标记(图3F)。成年小鼠组织免疫荧光(IF)染色进一步验证LEF1、SOX17和ERG蛋白表达(图3H)。
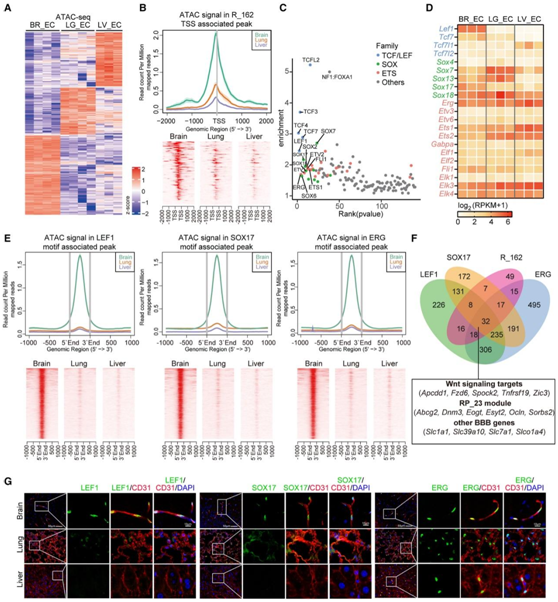
图3. 表观基因组学分析确定了成年小鼠大脑 EC 中富集的转录因子及其靶标。
(A) 脑 (BR_EC)、肺 (LG_EC) 和肝 (LV_EC) EC 中的差异开放染色质区域(峰)。(B) 脑、肺和肝 EC 中 BBB 转录模块 R_162 中基因的转录起始位点 (TSS) 周围的 ATAC-seq 信号富集。(C) (A) 所示脑 EC 特异性 ATAC-seq 峰中转录因子 (TF) 基序的富集。(D) 热图显示了 TCF/LEF、SOX 和 ETS 基因家族的转录水平。(E) 分别与脑、肺和肝 EC 中的 LEF1、SOX17 或 ERG 基序相关的峰周围的 ATAC-seq 信号富集。(F) 维恩图比较脑 EC 富集 TF (LEF1、SOX17) 和泛 EC TF ERG 的靶基因以及脑 EC 富集转录模块 R_162 中的基因。(G) 成年小鼠组织(大脑皮层)中富含脑 EC 的 TF(LEF1、SOX17)和 EC TF ERG 与 EC 标记 CD31 的免疫荧光染色。
04
成年小鼠组织中富含脑 EC 的蛋白质的验证
接下来,他们进行 IF 染色来验证蛋白质模块 P_78 的脑 EC 富集数据。正如预期的那样,GLUT-1 和 TfR 这两种典型的 BBB 标记物在脑 EC 中特异性表达,但在肺或肝 EC 中不表达。然后他们重点验证之前未报道过的富含脑 EC 的蛋白质,选择了 9 种蛋白[AFAP1L2、CAPG、CGNL1、EPS8L2、IGF1R、PALMD、PDXK、SORBS2 和肿瘤蛋白 D52 (TPD52)]进行进一步研究。其中四种抗体(AFAP1L2、IGF1R、PALMD 和 SORBS2)已在体内敲除小鼠中或在体外过表达细胞中得到广泛验证。其他五种蛋白(CAPG、CGNL1、EPS8L2、PDXK 和 TPD52)的抗体特异性在过表达这些蛋白的 HEK293T 细胞中得到验证。染色结果证实了它们在脑EC中的表达以及它们在肺和肝EC中的缺失或低表达(图4)。
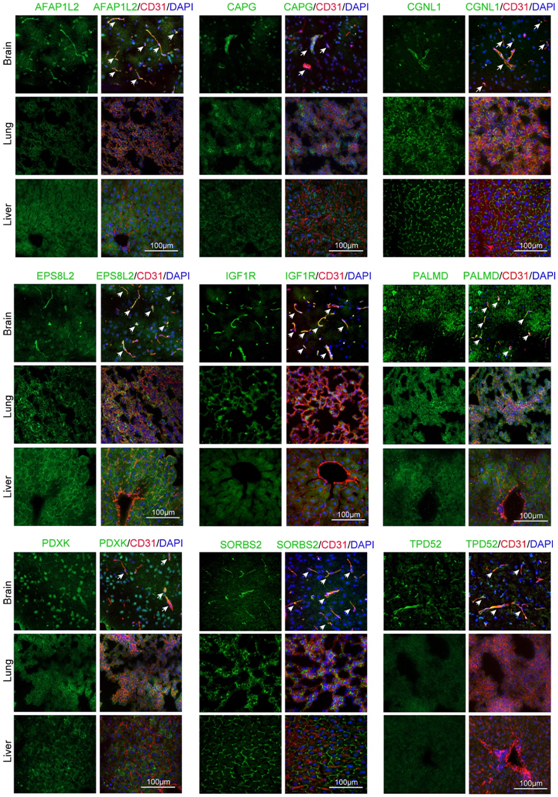
图4. 小鼠脑内EC富集蛋白(P_78)的验证
为了检测脑-EC富集蛋白标记物在毛细血管内皮细胞中的特异性,他们在成年小鼠脑组织中分别用CD31(EC标记物)、ACTA2(动脉/动脉平滑肌细胞标记物)、PDGFRβ(周细胞和平滑肌细胞均表达的壁细胞标记物)或AQP4(星形胶质细胞标记物)对这些蛋白进行共聚焦共if染色。AFAP1L2、CGNL1、EPS8L2、IGF1R、PALMD、PDXK、SORBS2和TPD52在毛细血管内皮细胞中表达(图5A),提示它们可能在血脑屏障功能中发挥作用。相比之下,CAPG仅在动脉EC中表达,而在毛细血管EC中不表达,因此可以作为脑动脉EC的标记物(图5A)。AFAP1L2、PDXK和SORBS2也存在于脑壁细胞中(图5A-C)。他们鉴定了8种选择性富集于小鼠脑EC的蛋白,并证实了毛细管表达。
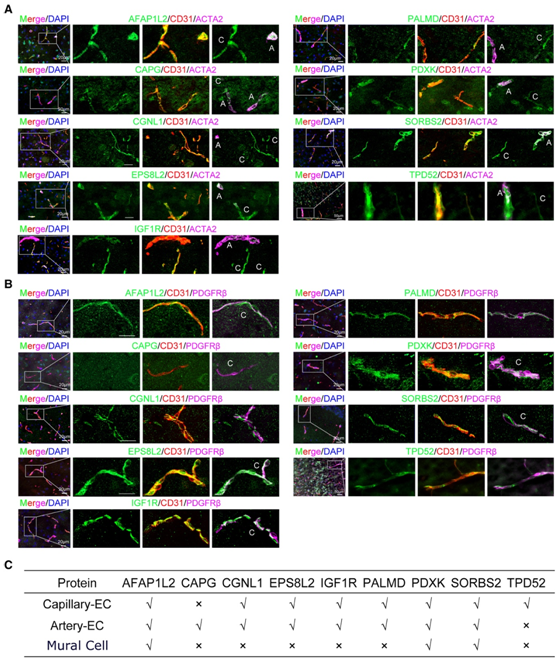
图5. 成年小鼠大脑中脑EC富集蛋白的血管位置。
(A-B) 通过与 EC 标记物 CD31、动脉/小动脉平滑肌标记物 ACTA2或壁细胞标记物进行免疫荧光共染色来确定所鉴定的脑 EC 富集蛋白的毛细血管表达水平和特异性成年小鼠脑组织(大脑皮层)中的 PDGFRβ。(C) 染色结果总结。
05
富含小鼠脑 EC 的蛋白质在人脑中的表达
为了检测富含小鼠大脑 EC 的蛋白质在人类中是否保守,他们分析了来自人类蛋白质图谱 (HPA)(https://www. Proteinatlas.org/) 的免疫组织化学 (IHC) 染色数据。HPA 中提供了来自 P_78 的 68 种蛋白质的 IHC 数据,其中 51 种在人类大脑皮层的 EC 中表达。此外,根据HPA的EC表达评分,与人类的肝脏和肺EC相比,所有这51种蛋白质在大脑皮层EC中表现出选择性富集,证明BBB分子特征从小鼠到人类的保守性(图6A)。P_78中其余17个蛋白,包括小鼠RP_23模块蛋白SLC16A4和DDC,在人类大脑皮层ECs中未检测到,提示存在物种特异性血脑屏障特征。
在8个已鉴定的脑ec富集蛋白中,EPS8L2或SORBS2在HPA中没有表达,而AFAP1L2、CGNL1、IGF1R、PALMD、PDXK和TPD52在大脑皮层毛细血管中表达(图6A)。值得注意的是,IGF1R在人脑非血管细胞中也大量表达(图6A),而在小鼠大脑中,与非血管细胞相比,IGF1R在EC中的表达更显著(图4)。
由于内皮细胞与壁细胞或星形胶质细胞的距离很近,IHC无法明确区分它们,因此他们进一步进行了共聚焦co-if染色,以确定它们在正常人脑组织中的内皮表达。与小鼠数据相似,AFAP1L2、CGNL1、EPS8L2、IGF1R、PALMD、PDXK、SORBS2和TPD52均在毛细血管内皮细胞中表达。小鼠脑- ec富集的TF LEF1和SOX17也在人脑内皮细胞中特异性表达,而ec TF ERG在人脑、肝脏和肺内皮细胞中普遍表达(图6A-B)。
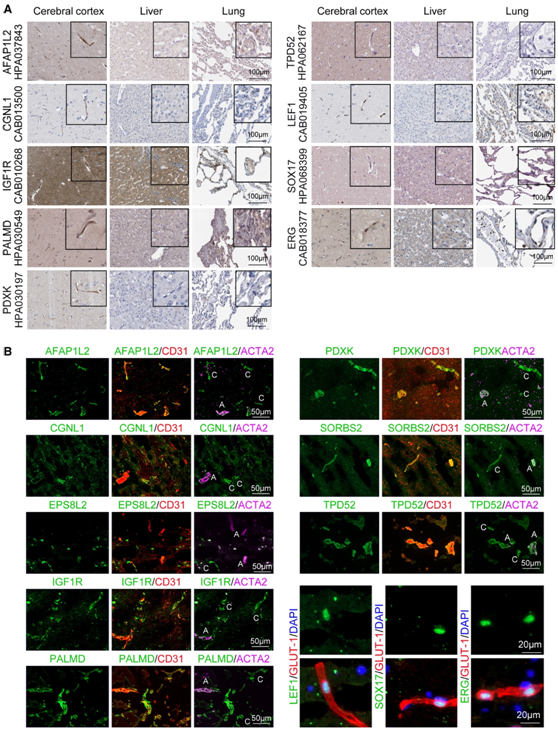
图6. 成人大脑中小鼠脑EC富集蛋白和TF的鉴定。
(A) 成年小鼠脑内富含 EC 的蛋白 (AFAP1L2、CGNL1、IGF1R、PALMD、PDXK、TPD52)、脑内富含 EC 的 TF (LEF1、SOX17) 和成年小鼠 EC TF ERG 的蛋白水平通过免疫组织化学(IHC)染色测定人脑组织。(B) 在成人正常人脑切片(大脑皮层)中,通过与 EC 标记物 CD31 或动脉/小动脉平滑肌标记物 ACTA2 进行共免疫荧光染色,进一步确定脑 EC 富集蛋白和 TF 的毛细血管表达和 EC 特异性。
06
AD 小鼠模型中富含脑 EC 的蛋白和 TF 表达的变化
为了表征 BBB 的疾病相关分子特征,他们检测了5xFAD小鼠及其野生型 (WT) 同窝对照小鼠(9 个月大,雄性)中典型和鉴定的脑 EC 富集蛋白的表达水平。在5xFAD小鼠的海马和皮质区观察到大量淀粉样β斑块的积累和血白蛋白和免疫球蛋白G (IgG)的血脑屏障渗漏,而在WT小鼠中这些现象要么不存在,要么不明显(图7A-B)。
脑切片的 IF 染色和分离脑微血管的免疫印迹共同证明5xFAD小鼠的皮质和海马血管系统中 AFAP1L2、EPS8L2 和 LEF1 显著减少,而与 WT 对照相比, IGF1R 仅在5xFAD小鼠海马脉管系统中显著减少(图7C-E)。

图7. 阿尔茨海默病小鼠脑内EC富集蛋白和TF的变化。
(A)分别对野生型 (WT) 或5xFAD小鼠(9 个月大,雄性)的大脑皮层 (Ctx) 和海马 (Hipp) 中淀粉样蛋白-β 积累进行免疫荧光染色和定量。(B) WT 或5xFAD小鼠中代表性脑 EC 富集蛋白(AFAP1L2、EPS8L2、IGF1R)和 TF LEF1 的免疫荧光染色和定量。(C-D) 免疫印迹和蛋白定量。
+ + + + + + + + + + +
结 论
本项研究使用RNA-seq和蛋白质组学分析,鉴定了大脑 EC 中选择性富集的转录本和蛋白质,并证明它们是部分相关的。使用scRNA-seq,他们剖析了脑 EC 功能异质性的分子基础。通过综合表观基因组学和转录组学分析,他们确定 TCF/LEF、SOX 和 ETS 家族是调节 BBB 的顶级转录因子。然后,他们在正常小鼠和人类脑组织中验证了已识别的富含脑 EC 的蛋白质和转录因子,并评估了它们在患有阿尔茨海默病的小鼠中的表达变化。
+ + + + +



 English
English


