文献解读|Aging Cell(11.005):单细胞RNA-Seq揭示原始卵泡形成过程中小鼠生殖细胞中高度协调的转录程序
✦ +
+
论文ID
原名:Single-cell RNASeq reveals a highly coordinated transcriptional program in mouse germ cells during primordial follicle formation
译名:单细胞RNA-Seq揭示原始卵泡形成过程中小鼠生殖细胞中高度协调的转录程序
期刊:Aging Cell
影响因子:11.005
发表时间:2021.06.26
DOI号:10.1111/acel.13424
背 景
全世界约有 1%–2% 的女性患有原发性卵巢功能不全 (POI),这是一种与卵巢过早衰老相关的卵巢功能障碍,其特征是 40 岁前的闭经。卵泡池建立期间卵泡不足会导致 POI,在某些情况下,POI 患者的基因突变负责形成原始卵泡和初始募集。在人类中,原始卵泡形成在妊娠中期开始。在卵泡形成之前,生殖细胞通过同步的、不完全的有丝分裂形成生殖系囊泡。减数分裂开始之前,这些囊泡通过部分分裂成更小的包囊逐渐丧失同步性。随后的步骤减数分裂启动、囊泡分解 (CBD) 和卵泡组装,这些步骤以时间和空间异步的方式在卵巢中发生。CBD 和卵泡组装过程中转录调控重要且复杂,目前尚不清楚转录网络如何在如此关键的发展窗口中协调整个过程。基于此,作者想要探究卵母细胞中的分子级联反应,并确定卵泡形成和发育过程中的基因和分子通路,描绘卵母细胞的发育轨迹和调控机制。
实验设计
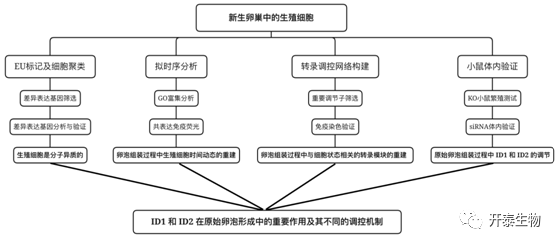
结 果
01

生殖细胞是分子异质的
新生儿(P0.5)卵巢中生殖细胞的异质性可以通过 EU 标记来反映,这表明生殖细胞之间的不同转录状态(图 1A)。在这样一个特定的发育阶段,所有三种生殖细胞(囊泡中的生殖细胞、经历 CBD 的生殖细胞和卵泡中的生殖细胞)共存于新生卵巢中,这代表了两个阶段的转变,即 STI(从囊泡到 CBD )状态和 STII(从 CBD 到卵泡状态)(图 1B)。
为了揭示卵泡组装过程中生殖细胞发育的亚群,将细胞聚类为三个亚型(簇 1、2 和 3)。在卵母细胞发育中重要的基因(图 1C),Sycp2、Stag3 和 Taf7l 是在胎儿减数分裂生殖细胞中高表达的基因。Sohlh1、Nobox和 Lhx8 是对卵泡形成重要的基因。Kit、Gdf9和 Zar1 是众所周知的卵母细胞和早期胚胎发育的母体基因,这些基因在簇中显示出差异分布(图 1D)。与相邻簇之间的比较,作者发现了更多的差异表达基因(DEG)(图 1E)。总的来说,在簇 1 和簇 2 之间鉴定出 141 个上调基因和 71 个下调基因,在簇 2 和簇 3 之间分别识别出 433 个上调基因和 492 个下调基因(图 1F)。GO分析揭示了从簇1到簇3的下调基因中的雄性减数分裂和突触条目(图1G)。
三个细胞簇对应于新生卵巢中的三种生殖细胞类型,称之为状态 1,囊泡中的生殖细胞;状态 2,生殖细胞经历 CBD;状态3,生殖细胞形成卵泡。小提琴图揭示了DEGs在状态之间的分布,通过原位杂交、qPCR和WB,一些具有代表性的基因被筛选出来(图 1H,图 2A-B)。在 E17.5、P0.5 和 P2.5的卵巢中也观察到 MVP、AURKB 和 UBE2C 的动态表达,形成卵泡的卵母细胞急剧增加(图 2C)。然后从卵巢制备细胞悬浮液并在状态转换之间识别选定的 DEG(图 2D),PCA分析发现,根据这些基因的表达水平,细胞可以清楚地聚集成三个簇(图2E)。
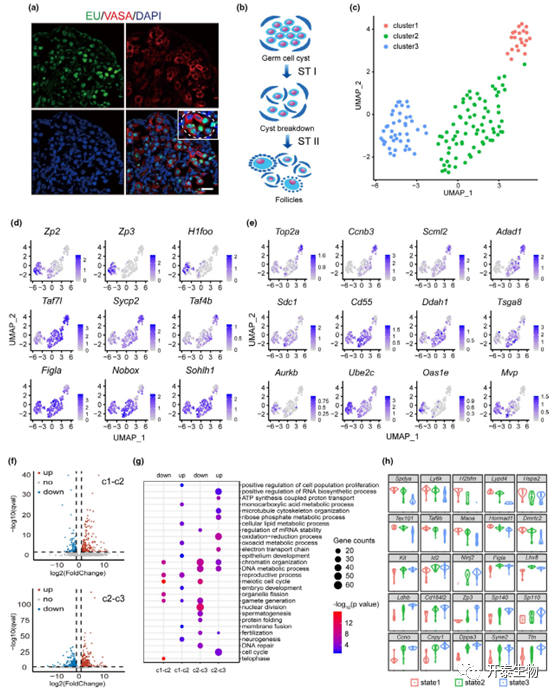
图 1. 单细胞分析揭示新生儿卵巢生殖细胞的异质性

图 2. 新生儿卵巢中的代表性基因表达(E17.5:胚胎期 P0.5:新生0.5天 P2.5:新生2.5天)
02

卵泡组装过程中生殖细胞时间动态的重建
为了描绘卵泡形成过程中生殖细胞的时间动态,将单个细胞重新排序为伪时间线,结果清楚地证明了生殖细胞从囊泡(状态 1)到卵泡期(状态 3)的均匀发育(图 3A)。如图 3B所示,绘制了每个簇中单个基因的趋势。簇 1 和簇 2 中的基因沿伪时间线呈现潮波趋势。GO分析中胞吐作用和高尔基囊泡运输条目显著富集,这与卵泡组装过程中剧烈细胞器运动和卵母细胞-体细胞相互作用一致(图 3D)。作者检测CD55和SDC1与GM130的共表达模式,GM130用于标记注定要形成卵泡的卵母细胞。同时,KIT染色作为对照组,因为它在CBD期间调节卵母细胞和体细胞之间的串扰中起关键作用。结果显示它们与GM130阳性生殖细胞的共定位(图 3E)。簇3基因沿伪时间线显示出不断下调的趋势,并且GO条目与减数分裂细胞周期调节有关。簇4的基因在DNA代谢过程、受精或有丝分裂细胞周期中发挥重要作用,包括许多对排卵或早期胚胎发育很重要的卵母细胞特异性基因,例如Zp1、Zp3、和Ooep(图 3C-D)。
从沿着伪时间线的动态基因表达,作者重新捕获了生殖细胞发育的顺序和逐步轨迹,并确定了一系列可能在原始卵泡形成和卵泡发育过程中起作用的伪时间依赖性基因。
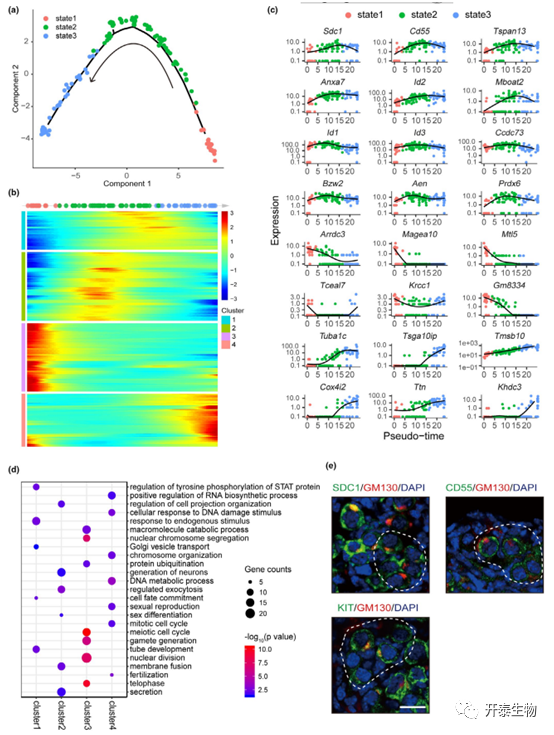
图 3. 重建生殖细胞发育的时间动态
03

卵泡组装过程中与细胞状态相关的转录模块的重建
为了确定卵泡形成的主要调节因子,构建具有转录调节因子及其靶基因的转录调控网络。作者鉴定了包含 868 个基因的 18 个重要调节子(图 4A)。每个调节子的大小从 10 到 375 个基因不等,平均大小为 44 个基因(图 4B)。引人注目的是,使用RAS将细胞很好地分成三种状态,并且细胞显示出与先前集群高度重叠的分布(图 4C)。在富集的调节子中,Nelfe 和 Chd2 基因在状态 1 和状态 2 细胞中表现出相似的表达模式(图 4D),并且它们富集的靶基因彼此高度重叠。
转录因子 ID2 的活性在状态 2 和状态 3 细胞中富集,显示在CBD卵巢的生殖细胞/卵母细胞中的核定位(图 4D-E)。ID2 及其靶基因的调控网络如图 4F所示,这些靶基因中的大多数都是转录因子,包括已鉴定的调节子 Bhlhe41和 Egr1,还包括卵母细胞特异性转录因子 Sohlh1 和 Figla。结果表明,ID2 可能通过对目标 TF 的调节在卵母细胞发育中发挥作用。需要注意的是,其他两个 ID 家族成员 ID1 和 ID3 也作为阶段过渡之间的 DEG 被富集。正如通过在不同发育阶段(E17.5、P0.5 和 P2.5)(图 4E)对卵巢进行免疫染色所验证的,三个 ID 在卵泡形成过程中经历了差异和动态的表达变化。
这表明,三个ID的动态表达暗示了它们对卵泡形成的差异调节。此外,结果突出了 ID2 在此过程中的作用。

图 4. 转录调控网络分析
04

原始卵泡组装过程中 ID1 和 ID2 的调节
研究表明,ID3敲除(KO)雌性小鼠表现出正常的卵泡发育,并且小鼠在 6 个月的繁殖测试中具有生育能力。当 P0.5 卵巢与 ID1 siRNA 孵育 4 天时,观察到囊泡破裂和卵泡形成延迟(图 5A-C)。RT-PCR 结果显示卵母细胞发育基因 Figla、Nobox 和 Gdf9 显著减少(图 D)。
构建ID2-KO模型发现,与 P0.5卵巢中的正常卵巢形态相比,在 P2.5卵巢中观察到卵泡形成延迟(图 5E-F)。随后的观察显示在 P5.5 持续形成卵泡,仅留下少量生殖细胞KO 卵巢囊泡(图 5E)。在 P7.5卵巢中,虽然卵泡激活和发育不受影响,但在卵巢皮质中观察到较少的原始卵泡(图 5E)。来自 4W KO 小鼠的卵巢进一步显示总卵泡数显著下降(图 5G)。然而,两组之间的卵泡分布不受影响。交配试验结果表明,KO 小鼠表现出生育能力低下,产程间隔更长,产仔率降低 (图 5H),卵巢大小显著减小(图5I)。组织学分析表明在 WT 和 KO 卵巢中存在不同发育阶段的卵泡,除了多卵母细胞卵泡偶尔出现在 KO 卵巢中(图 5I)。卵泡计数结果再次显示 KO 小鼠的总卵泡数显著减少(图 5I)。结果表明卵泡数量的急剧减少导致了生育力低下的表型。
与ID2 KO小鼠相比,ID1 siRNA的添加进一步损害了CBD的过程,处理后更多的生殖细胞保留在囊泡中(图6A-B)。当进行 RT-PCR 以检查由 ID1 siRNA 调节的基因的表达时,没有发现协同效应(图 6C)。特异性抑制剂LDN193189 对卵泡组装的抑制表现在卵巢形态和卵泡计数结果明显下降(图 6G-H)。然而,RT-PCR 结果仅显示 ID2 和 ID3 mRNAs 显著降低(图 6D)。同时,在 LDN193189 处理的卵巢中也观察到 PI3K/mTOR 信号通路的抑制(图 6E-F)。由于 PI3K/mTOR 信号通路在卵泡形成中的关键作用,作者得出结论,BMP 通过激活 PI3K/mTOR 信号通路来调节 ID2。
总之,ID1 和 ID2 都参与了卵泡形成的过程,但在不同的调节机制中发挥作用(图 6I)。
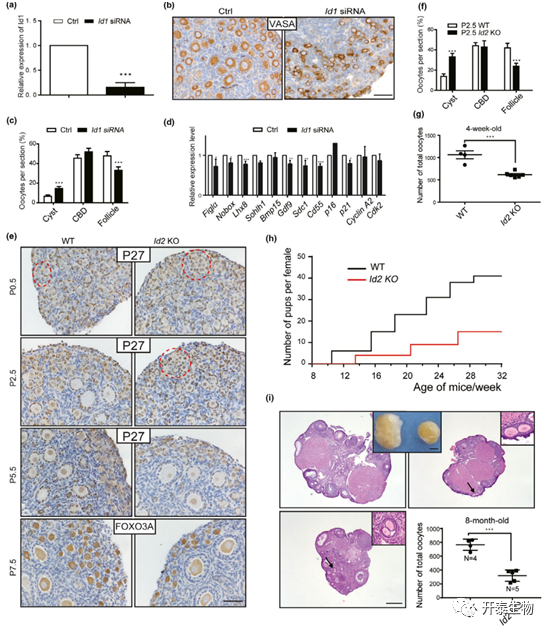
图 5. ID1 或 ID2 对原始卵泡形成的影响
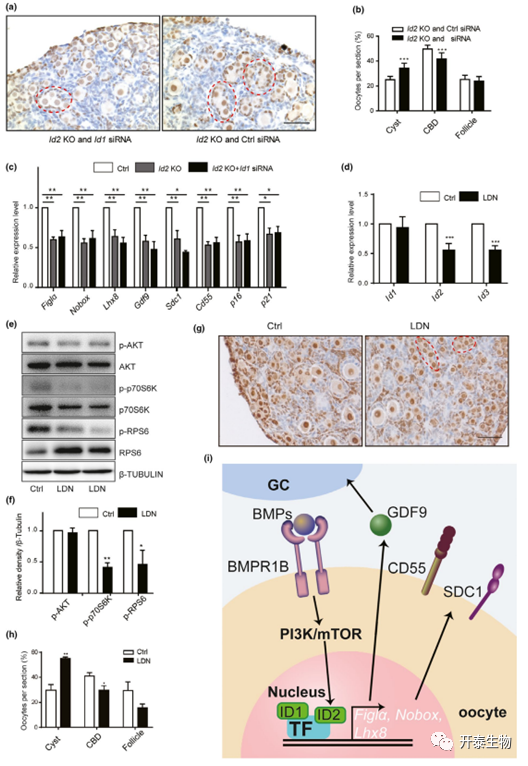
图 6. ID1和ID2对卵泡组装的差异调节
+ + + + + + + + + + +
结 论
综上所述,研究对新生儿卵巢中的三种细胞状态的三个细胞簇进行了分类,系统地重建了卵母细胞中的分子级联,并鉴定了卵泡形成和发育中的一系列基因和分子途径。在囊泡分解和卵泡组装过程中,生殖细胞在严格的转录控制下被精心编排,以促进功能性卵母细胞的发育。除了TF 及其调控网络外,作者阐明了 ID1 和 ID2 在原始卵泡形成中的重要作用及其不同的调控机制。这项研究将有助于描述原始卵泡储备的遗传基础,并有助于确定导致 POI 的致病基因或基因。
+ + + + +



 English
English

