文献解读|Nat Genet(30.8):BCR-ABL1淋巴细胞白血病的转录组分类
✦ +
+
论文ID
原名:Transcriptomic classes of BCR-ABL1 lymphoblastic leukemia
译名:BCR-ABL1淋巴细胞白血病的转录组分类
期刊:Nature Genetics
影响因子:30.8
发表时间:2023.06.19
DOI号:10.1038/s41588-023-01429-4
背 景
在BCR-ABL1淋巴细胞白血病中,酪氨酸激酶抑制剂 (TKI) 的治疗异质性,特别是在BCR-ABL1不存在激酶结构域突变的情况下,人们知之甚少。
实验设计
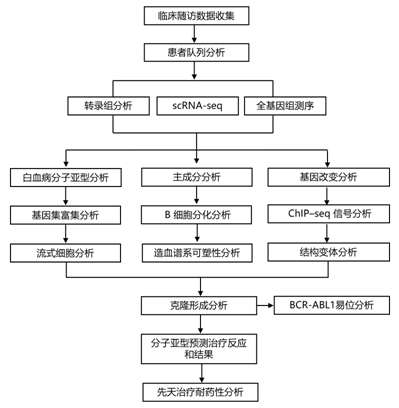
结 果
01
BCR-ABL1淋巴细胞白血病的独特转录组聚类
本项研究收集了两个跨越 20 年(1992-2019)的患者队列以及临床随访数据(图S1a)。第一个队列的 57 例样本来自 53 名患者,其中46例为初诊BCR-ABL1急性B淋巴细胞白血病(B-ALL), 5例为慢性髓系白血病(CML),2例为混合表型急性白血病(MPAL)(图S1b)。非负矩阵分解(NMF)和一致聚类发现了三个不同的转录组聚类,最初标记为C1、C2和C3(图1a)。
他们首先使用基因集富集分析(GSEA)来检测这些转录组聚类。C1以干细胞和髓系基因(如KIT、CSF3R和MECOM)的异常表达为特征(图1b),富含与先天免疫(TNFα,炎症反应)相关的途径。C2显示髓系(CSF2RA和CSF1R)和淋巴系基因(MS4A1/CD20和IL7R)的部分表达,并富集与ERK信号通路、未折叠蛋白反应(UPR)和其他与造血无关的通路[肌发生、上皮向间质转化(EMT)]。C3表达最多的是与B细胞分化相关的基因,如IL7R、MS4A1、BACH2和TCL1A,并且在细胞周期通路(E2F靶点、G2M检查点)和B细胞受体信号通路中富集。
然后,他们将这些转录组聚类与流式细胞数据进行比较。8种抗原在集群间存在差异表达(图1c)。髓系抗原CD13、CD33和细胞质髓过氧化物酶(cyMPO)以及T细胞抗原CD7在C1中表达水平最高,而T细胞抗原CD10、CD19和CD20在C3中表达水平最高。值得注意的是,成熟的T细胞抗原CD20在C1和C2中经常缺失,但在C3中经常表达。这暗示了使用单克隆CD20抗体(如利妥昔单抗)进行靶向治疗的潜能。C1聚类中干细胞抗原CD34的表达也最高。C1经常表达髓样抗原和淋巴样抗原,而C3则表现出淋巴样抗原的限制性表达。
尽管有表面髓系抗原的表达,但cyMPO的水平低于10%的MPAL诊断阈值。然而,C1的cyMPO水平仍明显高于C2和C3(图1c)。与流式细胞分析相比,RNA-seq检测低水平MPO的动态范围更大。目前的诊断指南可能低估了混合谱系表型的BCR-ABL1淋巴细胞白血病的数量。
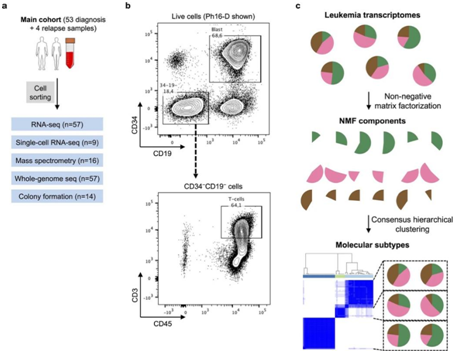
图S1.实验流程。
(a)主要队列的研究设计。(b)白血病母细胞和 T 细胞的荧光激活细胞分选方案示例。(c)结合非负矩阵分解(NMF)和一致层次聚类的RNA-seq聚类方法。
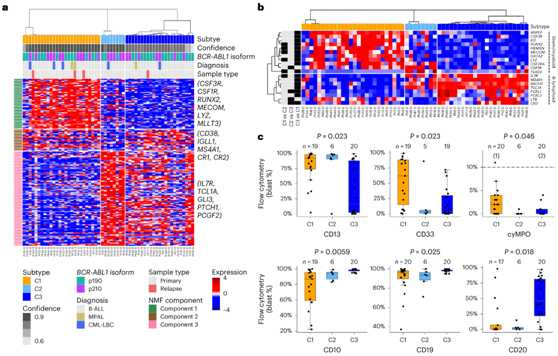
图1. BCR-ABL1淋巴细胞白血病的三种分子亚型。
(a) 通过共识层次聚类鉴定的BCR-ABL1淋巴细胞白血病中三种分子亚型的基因表达热图。 (b) 干细胞/骨髓细胞和 B 淋巴细胞程序中所选差异表达基因的热图。 (c) 按亚型划分的髓系(上)和 B 淋巴系(下)谱系抗原呈阳性的母细胞的比例。
02
转录组聚类与 B 细胞分化阶段一致
他们将转录组聚类与人类脐带血中的正常对应物进行比较,包括 HSC、多能祖细胞 (MPP)、骨髓祖细胞[共同骨髓祖细胞 (CMP)、巨核细胞-红系祖细胞 (MEP)、粒细胞/巨噬细胞祖细胞 (GMP)]和八种不同的淋巴细胞和B细胞祖细胞[淋巴激活MPP(LMPP)、多淋巴细胞祖细胞(MLP)、早期pro-B、pro-B、pre-B I、pre-B II、未成熟B和成熟B细胞]。主成分分析(PCA)显示,C1白血病与早期前体B细胞密切相关(图2a),尽管它们具有很强的干细胞/髓系基因表达模式。早期的前体B细胞是B细胞发育的第一步,并保留髓系和T淋巴系的潜能。为了进一步描述C2和C3白血病的分化程度,他们评估了免疫球蛋白重链和轻链的表达。重排重链(IGH)的表达在所有聚类中相似,而重排轻链(IGK或IGL)的表达在C3中最常见(图2b)。C3白血病也表现出B细胞转录因子EBF1和PAX5以及B细胞受体信号基因的显著上调(图2c-d)。这表明C3的分化阻滞较C2晚。这些结果证明C1, C2和C3白血病在早期B细胞发育的不同阶段发生阻断。总之,他们标记的转录组亚型如下:C1,早期B细胞祖细胞('early - pro');C2:中间B细胞祖细胞(Inter-Pro);C3:晚期B细胞祖细胞('late - pro') (图2e)。
然后,他们进行了单细胞转录组分析(scRNA-seq),在4个Late-Pro样本中,95.3%的白血病细胞分配为pro-B细胞或pre-B I细胞(图2f)。Inter-Pro样本显示对pro-B细胞和pre-B I细胞的分配减少,对早期pro-B细胞的分配增加,分化阻滞更早。与Inter-Pro和Late-Pro样本相比,Early-Pro样本显示出更多的谱系异质性(图2g)。
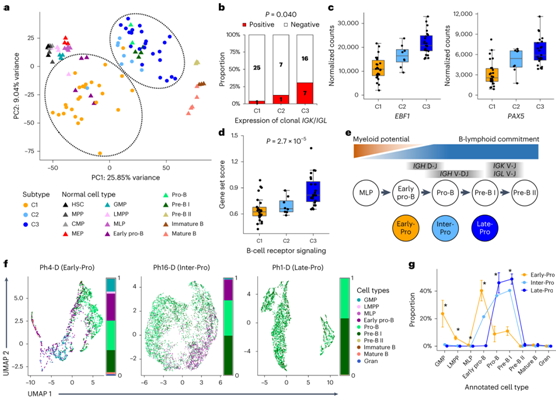
图2. 分子亚型停滞在 B 细胞分化的不同阶段。
(a) 主成分分析(PCA)。 (b) 克隆重排免疫球蛋白轻链基因(IGK、IGL)表达和不表达的各亚型白血病的比例。(c) B细胞发育基因EBF1和PAX5按亚型归一化计数。 (d) B细胞受体信号转导的基因集评分。(e) 与B细胞分化阶段相关的分子亚型的大致定位。 (f) 来自scRNA-seq的单细胞与最接近的正常细胞对应物进行注释,并使用UMAP进行可视化。 (g) 每个亚型中细胞类型注释的比例。
03
不同的基因改变定义了每个分子亚型
对第一队列中的57例患者进行全基因组测序(WGS)。发现了已知的复发性亚型如IKZF1(77%)、PAX5(42%)、CDKN2A/B(38%)、SLX4IP(25%)、HBS1L(23%)、BTG1(19%)、RB1(15%)、EBF1(15%)、MEF2C(15%)、RUNX1(15%)(图3e)。在转录组亚型中,EBF1的改变仅限于早期白血病(图3a)。在B细胞参与的初始阶段,EBF1抑制髓系和T细胞谱系,在早期白血病中发现,EBF1的缺失会抑制这些谱系程序。
尽管在所有转录组亚型中都存在IKZF1改变,但在Inter-Pro白血病中双等位基因损失显著增加(图3a)。Inter-Pro白血病也因IKZF1的显性Ik6的缺失而富集,IKZF1缺乏DNA结合域。IKZF1的失活激活了基质基因,因此,Inter-Pro样品中这些基因的异常表达显著富集。
重组激活基因(RAG)内切酶(RAG1/2)在淋巴祖细胞V(D)J重组过程中,在称为重组信号序列(RSS)的特定基序上引入DNA双链断裂。在抗原受体基因外的结构变异(SV)上存在RSS基序表明脱靶RAG活性,这在淋巴性白血病中很常见。这些SV中有19%与BCR-ABL1易位相关,其余81%与协同事件相关(例如IKZF1、PAX5和CDKN2A/B的缺失)(图3b)。与BCR-ABL1易位相关的SV相比,RSS基序中与合作事件相关的SV显著富集(图3c-e)。只有与协同事件相关的SV断点频率随与RSS基序距离的减小而减小(图3f)。有趣的是,SLX4IP缺失的白血病中含有更多的RAG介导的SV(图3g)。
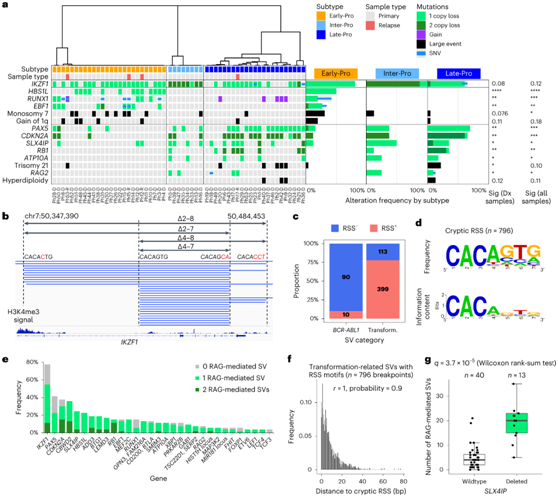
图3. 不同的协同遗传改变定义了每种分子亚型。
(a) 每个亚型中丰富的基因改变的Oncoprint。 (b) 反复出现的IKZF1缺失(蓝线)是由RAG介导的重组产生的。 (c) 具有和不具有RSS基序的BCR-ABL1相关和转化相关(Transform.) SV的比例。 (d) 使用WebLogo生成的转换相关SV中隐式RSS七聚体的序列标识。 (e) 每个基因发生改变的白血病的频率。(f) 在转换相关的SV中,SV断点与最近的RSS基元(黑色)之间的距离形成负二项分布(灰色)。 (g) SLX4IP缺失状态下原发性白血病中RAG介导的重组数量。
04
BCR-ABL1易位独立发生
他们对来自14名患者(6名Early-Pro, 2名Inter-Pro和6名Late-Pro)的造血干细胞和祖细胞(CD34 +CD19 - CD45RA -)进行了分类,并进行了克隆形成实验,该实验可以去除残留的原细胞并促进干细胞/祖细胞分化为髓细胞(图4a)。14例患者中有4例在粒细胞/巨噬细胞(GM)和红系克隆中检测到CR-ABL1易位(图4b)。4例患者有诊断和复发的配对样本。其中3例在诊断后2年内复发(图4c)。在这些患者中,大多数在诊断时存在的变异在复发时发现(图4d)。在诊断和复发之间,转录组亚型、免疫表型和抗原受体重排也保持不变(图4e)。这表明复发出现在主要的诊断克隆在这三个病人。第4例患者(Ph53)在缓解4年后复发。虽然相同的BCR-ABL1易位是共有的,但只有14%的诊断性突变在复发时出现(图4d)。从RNA-seq中,诊断性白血病分类为Late-Pro,而复发性白血病分类为Early-Pro,表明转录组亚型的转换(图4e)。复发样本含有与Early-Pro亚型一致的RUNX1突变(图4g)。
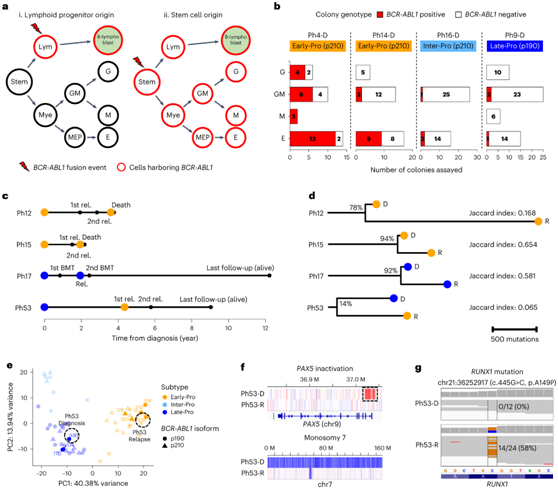
图4. 多能细胞中BCR-ABL1淋巴细胞白血病的起源。
(a) B 淋巴细胞的简化谱系层次和四种克隆类型。 (b) 四名具有BCR-ABL1阳性克隆的患者样本。(c) 四对诊断和复发白血病患者的临床事件时间表。(d) 基于点突变的四个白血病对的系统发育关系。(e) 使用 NMF 成分基因对白血病转录组进行 PCA。(f) PAX5失活(框)和单体 7 是 Ph53-D 专有的。红色和蓝色部分分别表示拷贝数的增加和缺失。(g) RUNX1突变是Ph53-R特有的。
05
分子亚型影响患者的治疗结果
主要分子缓解(MMR)定义为残留病灶减少≥3个对数(≤0.1%转录本)(图5a)。诱导治疗期间,Early-Pro患者和Inter-Pro患者达到MMR的患者明显少于Late-Pro患者。Early-Pro、Inter-Pro和Late-Pro患者诱导治疗后的中位对数减少分别为1.4、2.2和3.5(图5b)。深度分子学缓解(DMR)(定义为降幅≥4个对数)是结局良好的预测因素,仅限于Late-Pro患者(图5b)。因此,Late-Pro亚型的总生存率(OS)和无事件生存率(EFS)明显更高(图5c)。Late-Pro患者的OS率为73%,与低风险B-ALL患者相似。引人注目的是,HBS1L的缺失是早期白血病独有的(图3a),与极差的预后相关。Early-Pro患者仅接受伊马替尼治疗,与改用第二代或第三代TKI治疗的患者相比,预后明显较差(图5d)。使用多变量Cox相互作用比例风险模型,Inter-Pro和Early-Pro亚型在使用第二代或第三代TKI治疗时,风险比(HR)显著降低(图5e)。
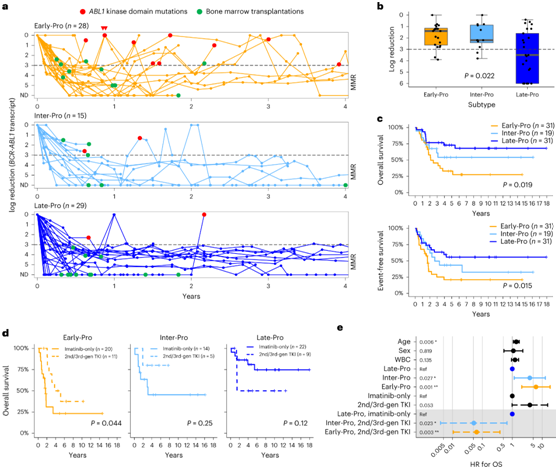
图5. 分子亚型预测治疗反应和结果。
(a) 每个亚型的BCR-ABL1转录物水平对数减少的残留疾病图。 (b) 诱导治疗后(诊断后最多60天)的首对数降低水平按亚型(20例Early-Pro, 12例Inter-Pro和25例Late-Pro患者)区分。 (c-d)生存分析。(e) 多变量Cox比例风险模型。
06
Early-Pro 和 Inter-Pro 白血病的先天治疗耐药性
激酶结构域突变导致了本项队列中的治疗耐药性和生存率低下,尤其是早Early-Pro 白血病患者(图5a)。晚期前白血病的细胞周期相关程序富集。相比之下,细胞静止基因组在早前期白血病中显著富集(图6a-b)。在scRNA-seq数据中,Late-Pro白血病包含更多的G1/S和G2/M期细胞,而Early-Pro白血病和Inter-Pro白血病(图6c-d)。
除了细胞静止,早期白血病也富含BCR-ABL1信号及其下游靶点STAT5(图6e-f),免疫检测证实在Early-Pro样品中STAT5有较高的磷酸化。相比之下,Inter-Pro白血病表现出UPR和ERK信号通路的显著上调(图6e)。
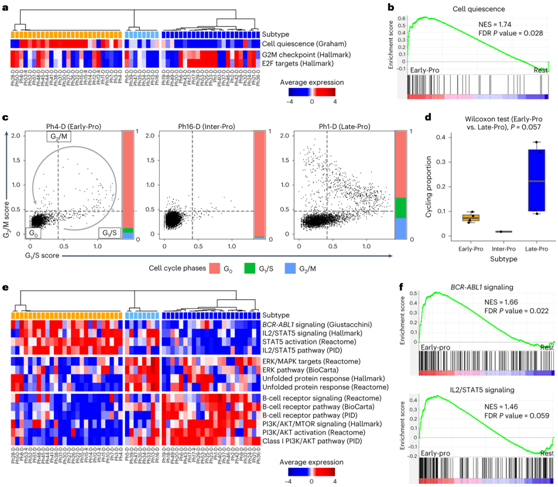
图6. 独立于激酶结构域的治疗抵抗机制。
(a) 细胞静止和细胞周期基因集的平均基因表达热图。(b) Early-Pro 亚型中细胞静止基因集的富集。 (c) 单细胞中G 1 /S和G 2 /M期基因组的表达。 (d) 每个样品中按亚型分类的循环细胞(非G 0期)的比例。 (e) 各种信号基因集的平均基因表达热图。(f) Early-Pro 亚型中BCR-ABL1信号传导和 IL2/STAT5 信号传导基因集的富集。
+ + + + + + + + + + +
结 论
本项研究发现了BCR-ABL1淋巴细胞白血病的三种转录组亚型,每种亚型都代表 B 细胞祖细胞分化阶段的成熟停滞。每次成熟停滞都以控制 B 细胞发育中不同转变点的特定基因组事件为标志。有趣的是,无论亚型如何,从患者体内分离的BCR-ABL1 +白血病前期干细胞中均不存在这些事件,这证明转录组表型是在白血病起始事件下游确定的。
+ + + + +



 English
English


