文献解读|Cell Metab(27.7):肿瘤糖酵解的早期下调可预测三阴性乳腺癌患者对模拟禁食饮食的反应
✦ +
+
论文ID
原名:Early downmodulation of tumor glycolysis predicts response to fasting-mimicking diet in triple-negative breast cancer patients
译名:肿瘤糖酵解的早期下调可预测三阴性乳腺癌患者对模拟禁食饮食的反应
期刊:Cell Metabolism
影响因子:27.7
发表时间:2024. 12. 17
DOI号:10.1016/j.cmet.2024.11.004
背 景
在临床前实验中,周期性禁食模拟饮食 (FMD) 与化疗联合使用显示出广泛的抗癌作用。在不同的肿瘤类型中,三阴性乳腺癌 (TNBC) 对 FMD 极其敏感。然而,周期性 FMD 在 TNBC 患者中的抗肿瘤活性和疗效仍不清楚。
实验设计
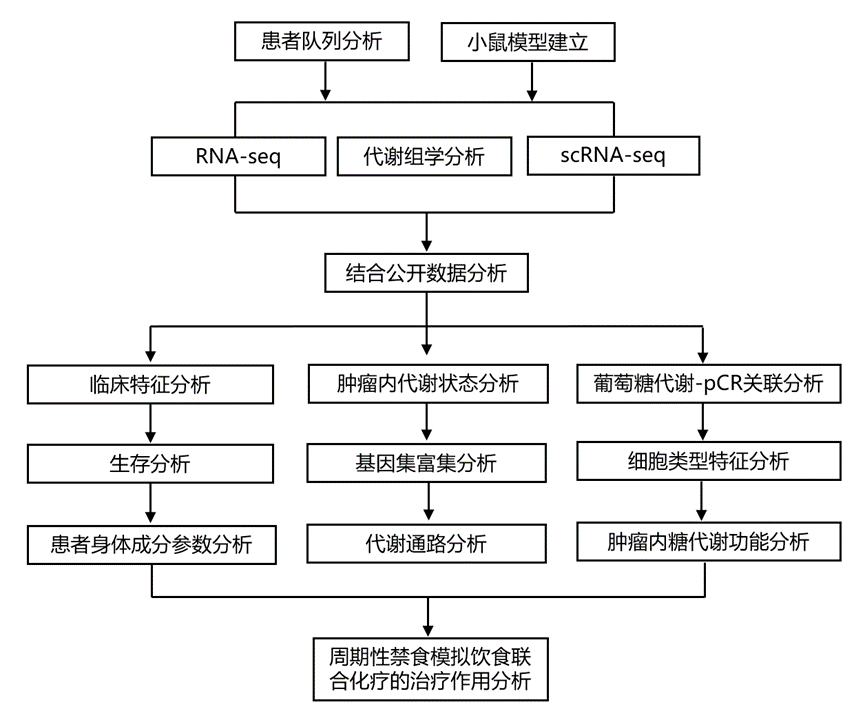
结 果
01
周期性 FMD 与化疗与二甲双胍联合使用是安全的
患者招募于 2020 年 6 月开始,并于 2022 年 2 月提前中断,当时 KEYNOTE 522 试验的结果确立了化学免疫疗法作为 II 期和 III 期 TNBC 患者的新标准新辅助治疗。2020 年6月至 2022 年 2 月期间,研究团队招募了 30名患者,其中 13 名随机分配至 A 组(不使用二甲双胍),17 名随机分配至 B 组(使用二甲双胍)(图 1)。患者和肿瘤特征在两个治疗组中均匀分布。
严重不良事件 (AE)(3 级或 4 级)发生率为 70%。FMD 导致的严重不良事件和严重不良事件 (SAE) 分别占所有患者的 3% 和 6.7%,所有 SAE 均由发热性中性粒细胞减少症事件组成(B 组患者为 12%,A 组患者无此情况)。二甲双胍组患者任何级别的腹泻都更常见,而其他不良事件在两个治疗组中的分布情况相似。在蒽环类药物化疗期间,没有患者出现明显的左心室射血分数 (LVEF) 下降,这与机构中接受蒽环类药物化疗而未进行 FMD 治疗的 33 名 TNBC 患者的独立回顾性对照 (CTRL) 队列中观察到的情况相似。
大多数患者能够成功完成方案允许的最大 FMD 周期数。关于 FMD 依从性,19 (63.3%) 名患者在每个 FMD 周期中都完全依从,88.9% 的 FMD 周期均成功完成,没有出现重大或轻微偏差。患者对 FMD 的依从性不受同时使用二甲双胍的影响。早熟 FMD 停药的最常见原因(8 名患者中有 7 名)是患者在后续 FMD 周期前无法恢复最低体重指数 (BMI) 20 kg/m2,而只有一名患者因出现 2 级疲劳而中断 FMD。在 B 组患者中,二甲双胍总体耐受性良好,只有 4 名患者(23.5%)需要减少剂量,2 名患者(11.8%)停用二甲双胍( 1 名患者因肝毒性,1名患者因体重减轻)。
BREAKFAST 试验的所有患者均能在接受手术前完成新辅助药物治疗。整个研究队列的完全缓解 (pCR) 率为 56.6%,A 组和 B 组患者之间的 pCR 率无显著差异(图 2 A)。由于 BREAKFAST 试验没有包括仅接受化疗的 CTRL 组患者,他们将本研究中观察到的 pCR 率与先前在早期 TNBC 患者中采用类似新辅助化疗方案的研究中报告的肿瘤pCR率进行了比较,以及他们研究所内接受蒽环类-环磷酰胺-紫杉烷新辅助化疗治疗的早期 TNBC 患者的独立回顾性队列(INT 92/20 研究)。BREAKFAST 试验中入组患者的特征总体上与这些 CTRL 队列中患者的特征相似,唯一的例外是与这些 CTRL 队列相比,BREAKFAST 试验中淋巴结阴性疾病(cN0)患者的比例更高。然而,多项研究表明,在接受新辅助化疗或化学免疫治疗的早期 TNBC 患者中观察到的 pCR 率在 N0 与 N1 疾病患者中并没有显著差异(在 BRIGHTNESS 试验的蒽环类-紫杉醇组中,N0 与 N1 疾病分别为 33% 与 29%;在 KEYNOTE-522 试验中,采用化学免疫疗法的 N0 与 N1 疾病分别为 64.9% 与 64.8%。
值得注意的是,BREAKFAST 试验中观察到的 pCR 率高于先前研究报告的 pCR 率,这些研究包括接受类似新辅助蒽环类-紫杉烷方案(包括剂量密集方案)治疗的 TNBC 患者。这些研究报告的 pCR 率范围广泛(14%-48.5%)可能归因于患者或化疗方案的异质性,范围从低效的每三周一次的基于紫杉醇的方案(pCR 率:14% 21 )到强化剂量密集的蒽环类-紫杉烷化疗,例如 GeparOcto GBG84 试验(pCR 率:48.5% 25)。当关注采用与 BREAKFAST 试验类似的化疗方案的三项研究时,报告的 pCR 率在 30%-39%区间内变化。
中位随访时间为 39.3 个月,共发现 4 次肿瘤复发事件(13.3%),18、24 和 36 个月无事件生存率 (EFS) 分别为 90%、86.7% 和 86.7%(图 2 B)。两个治疗组的 EFS 在统计学上没有显著差异(图 2 C)。同样,在无复发生存率 (RFS) 和总生存率 (OS) 方面也观察到了有希望的结果。另一方面,机构单独接受蒽环类-紫杉烷化疗的 76 名早期 TNBC 患者的长期临床结果比 BREAKFAST 试验报告的更差,3 年 EFS 和 OS 分别为 65.8% 和 78.9%。
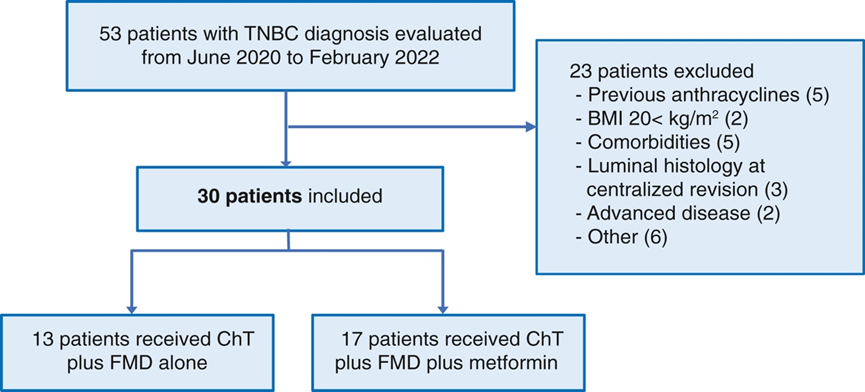
图1.研究设计图。
图2. 病理肿瘤反应和无事件生存期。
(A) 整个患者队列或根据治疗组的 pCR 率。(B-C) Kaplan-Meier 曲线表示整个研究队列或根据治疗组的 EFS。
02
FMD 会导致 BMI 和身体成分的短期和长期改变
每次 FMD 周期后,患者的 BMI 都会显著降低,并且在重新进食期间几乎恢复但并未完全恢复,因此导致在约 6 个月的研究治疗后 BMI 显著降低(图 3 A)。诊断时超重/肥胖的患者(BMI ≥ 25 kg/m2)与基线时体重正常的患者相比,其长期 BMI 下降更为明显(中位相对下降幅度:分别为 11.3% vs. 3.7%,p = 0.033)(图3B)。无论 pCR 结果如何,患者的 BMI 在研究治疗期间均有所降低。尽管与 BMI 正常的患者相比,基线时 BMI 高的患者实现 pCR 的概率在数值上更高(分别为 72.7% vs. 47.4%;p = 0.33),但这种差异并未达到统计学意义,可能是因为患者人数少。在机构单独接受新辅助化疗的 76 名早期 TNBC 患者的独立 CTRL 队列中,患者的 BMI 在新辅助治疗过程中均没有改变,无论是基线体重正常的患者还是超重或肥胖。这些数据表明,BREAKFAST 试验中观察到的 BMI 降低可能归因于 FMD(加/减二甲双胍),或归因于 FMD 与化疗的结合。此外,CTRL 队列中高基线 BMI 患者和正常基线 BMI 患者的 pCR 率在数值上相似(分别为 39.3% 和 35.4%)。
然后,他们分析了在基线(T0)、手术时(T2)和后续时间点(T3:手术后随访期间平均 12 个月)进行的计算机断层扫描 (CT) 扫描,以测量反映脂肪组织和骨骼肌的身体成分参数,并评估它们在实验治疗期间的变化(图 3C)。基线测量的总脂肪组织 (TAT)、内脏脂肪组织 (VAT)、皮下脂肪组织 (SAT) 和骨骼肌指数 (SMI) 与基线 BMI 呈现强烈的正相关。所有这些参数在实验治疗期间均有所降低(图 3C-D),但仅在基线超重/肥胖(BMI ≥ 25 kg/m2)的患者中,它们的降低才达到统计学意义。虽然 TAT、SAT 和 SMI 的减少在较长时间的随访(T3)中得到部分恢复,但 VAT 的减少保持稳定(图 3 D)。
总之,这些数据表明,基线 BMI 会影响 FMD 联合化疗期间 BMI 和身体成分参数的变化,并且超重/肥胖患者可能从周期性 FMD 联合化疗中获得更大的益处。
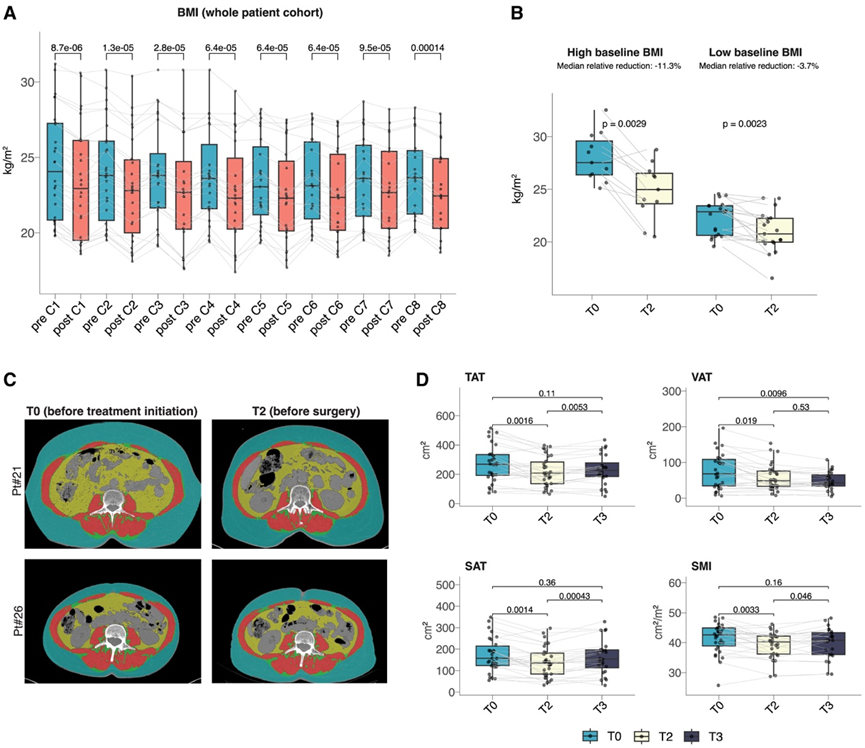
图3. 患者BMI及身体成分参数变化。
(A) 箱线图表示患者在实验治疗期间的短期 BMI 变化。(B) 箱线图表示超重/肥胖患者或基线体重正常的患者在实验治疗期间的长期 BMI 变化。(C) 两名代表性患者(患者 #21,诊断时体重正常,患者 #26,诊断时肥胖)在基线(T0)和手术前(T2)进行的 L3 水平代表性 CT 扫描图像。(D) 箱线图表示在基线(T0;n = 30)、手术前(T2;n = 30)和手术后 3-12 个月(T3)收集的匹配 CT 扫描图像中测得的身体成分参数。
03
周期性 FMD 联合化疗重塑肿瘤内代谢
为了研究实验治疗对肿瘤内代谢的影响,他们对基线(T0:治疗开始前)和第二个治疗周期前(T1:治疗开始后约 14-20 天)收集的新鲜冷冻肿瘤活检标本进行了转录组分析(RNA-seq)。为了验证转录组数据的生物学可靠性,在 T0 肿瘤标本中,他们应用了先前发表的基于肿瘤转录组谱的人类 TNBC 标本分类。根据“内在亚型分类”、“Lehman 分类”和“代谢分类”分类的 TNBC 亚型百分比与先前发表的人类TNBC 系列研究中这些生物亚型的比例一致(图S6A)。此外,转录组数据的反卷积分析表明,在研究治疗早期,几种肿瘤内免疫细胞群有所增加(图 S6 B)。有趣的是,他们发现仅在达到 pCR 的患者采集的肿瘤标本中,几种肿瘤浸润免疫细胞(如树突状细胞、T 辅助 (Th) 1 细胞、自然杀伤 (NK) 细胞、NKT 细胞、CD8+和 CD4+中枢和效应记忆 T 细胞)有增加的趋势(图 S6 C)。
然后,他们开始研究实验治疗对癌症代谢的影响,通过使用转录组数据在肿瘤标本中评估该影响。为了研究转录组数据是否可靠地反映禁食期间发生的肿瘤内代谢变化,他们使用了已知对周期性禁食/FMD 敏感的 TNBC 小鼠模型,即在雌性 BALB/c 小鼠乳腺脂肪垫中注射的原位鼠 4T1 细胞。由于血糖降低在介导周期性禁食/FMD 在 TNBC 模型中的抗癌作用中起着至关重要的作用,在本实验中,他们研究了代谢组学和转录组学分析是否同样能够捕捉到禁食引起的肿瘤内葡萄糖代谢的下调。当乳腺肿瘤肿块变得可触及时,小鼠随机分配到自由饮食(CTRL) 或 48 小时仅饮水禁食,并周期性重复(每 1 周)。如之前报道的,3 个周期性禁食减缓了肿瘤进展(图 S7 A-B)并延长了动物存活期(图 S7 C)。在同一个实验中,他们使用了另外数量的暴露于 CTRL 或禁食的动物,并在第二个禁食周期结束时提前处死这些动物以收集血液样本和肿瘤块,以进行基于质谱的代谢组学分析和RNA-seq。禁食动物的血液(图 S7 D)和肿瘤(图 S7 E)中的葡萄糖浓度显著降低,同时根据KEGG和 Hallmark分类(图 S7 F-G),葡萄糖代谢相关通路活性也减少了。
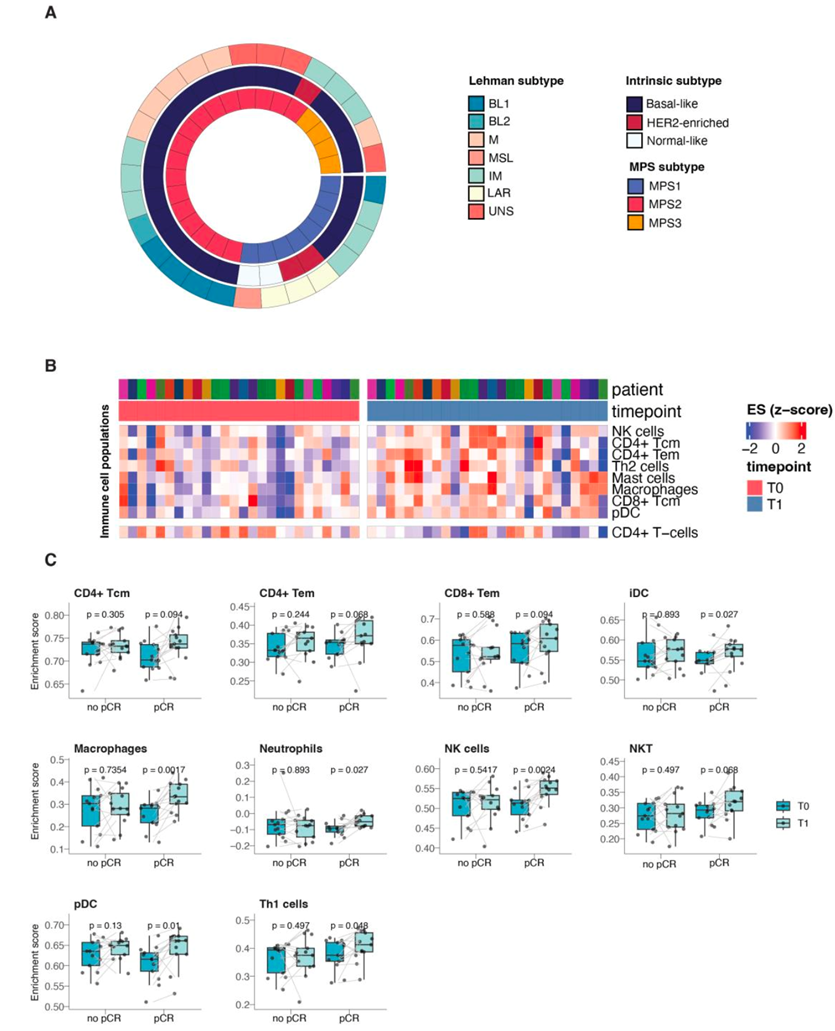
图S6. 实验治疗期间肿瘤内免疫的调节。
(A) “ Lehmann ”(外圆)、“内在亚型”(中圆)和“代谢分型”(内圆)的个体基线肿瘤标本来自BREAKFAST试验。(B) 代表白细胞群体得分的热图。(C) 箱线图表示选定白细胞群的分数。
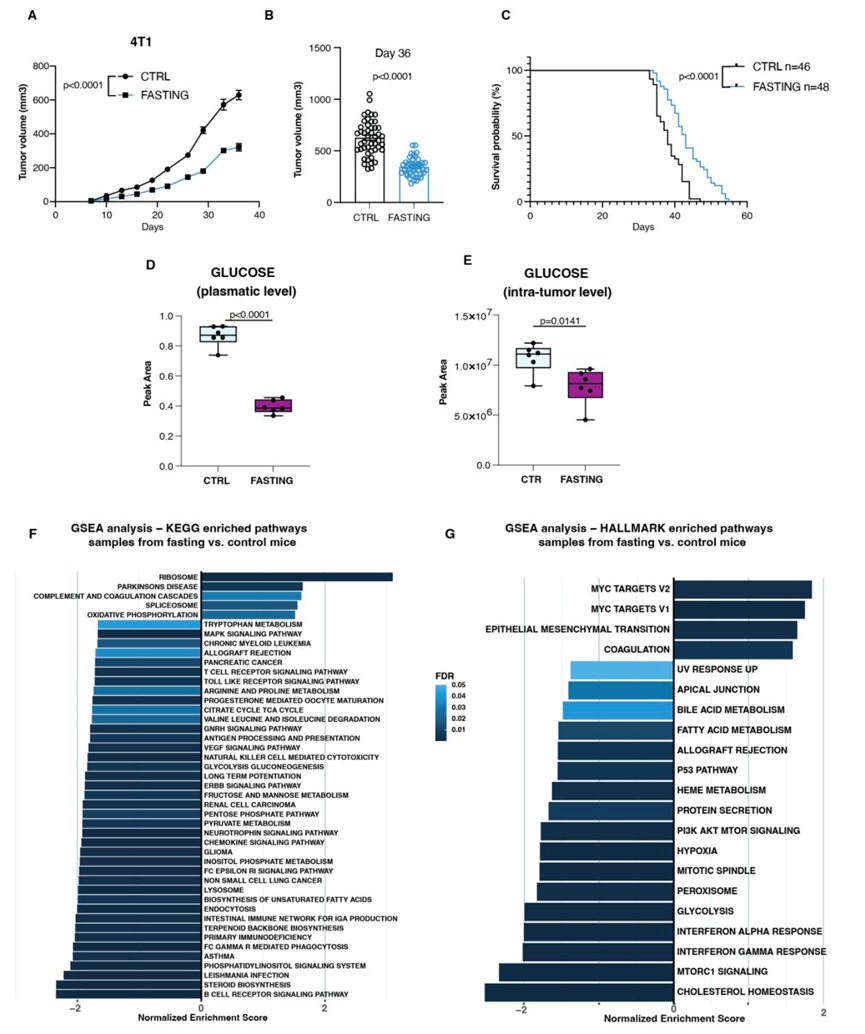
图S7. 同基因TNBC小鼠模型中肿瘤内葡萄糖代谢的调节。
(A) 4T1-luc(组成性表达荧光素酶)细胞移植在7周龄雌性BALB/c小鼠乳房脂肪垫中的生长。(B)肿瘤体积。(C)生存曲线分析。(D-E) 通过代谢组学分析测定4t1荷瘤BALB/c小鼠血浆葡萄糖和肿瘤内葡萄糖水平的峰面积。(F-G) 使用KEGG和HALLMARK基因集进行基因集富集分析(GSEA),在比较禁食组和对照组的差异表达分析后对基因进行排序。
在确定RNA-seq数据能够可靠地反映对营养饥饿敏感的 TNBC 模型中禁食期间肿瘤内葡萄糖代谢的变化后,他们开始研究 BREAKFAST 试验患者的肿瘤标本中代谢途径和单个代谢基因表达的变化。根据 KEGG或 Hallmark数据显示,与葡萄糖代谢、糖酵解、三羧酸 (TCA) 循环和 OXPHOS 相关的途径早期呈负向富集(图 4 A)。反映 mTORC1 活性、蛋白质合成和核糖体生物合成的生物通路也发生下调。为了证实和扩展这些发现,他们进行了单样本水平的基因集变异分析 (GSVA),评估了从 Reactome 基因集集合中提取的 231 条精选的代谢通路。该分析显示反映葡萄糖、丙酮酸、TCA 循环和 OXPHOS 代谢的通路下调(图 4 B)。值得注意的是,根据代谢性 TNBC 分类,葡萄糖代谢相关通路仅在“糖酵解”(MPS2)肿瘤中下调,而线粒体 OXPHOS 和电子传递链 (ETC) 通路仅在 MPS1/3(脂肪形成或混合)肿瘤中下调。
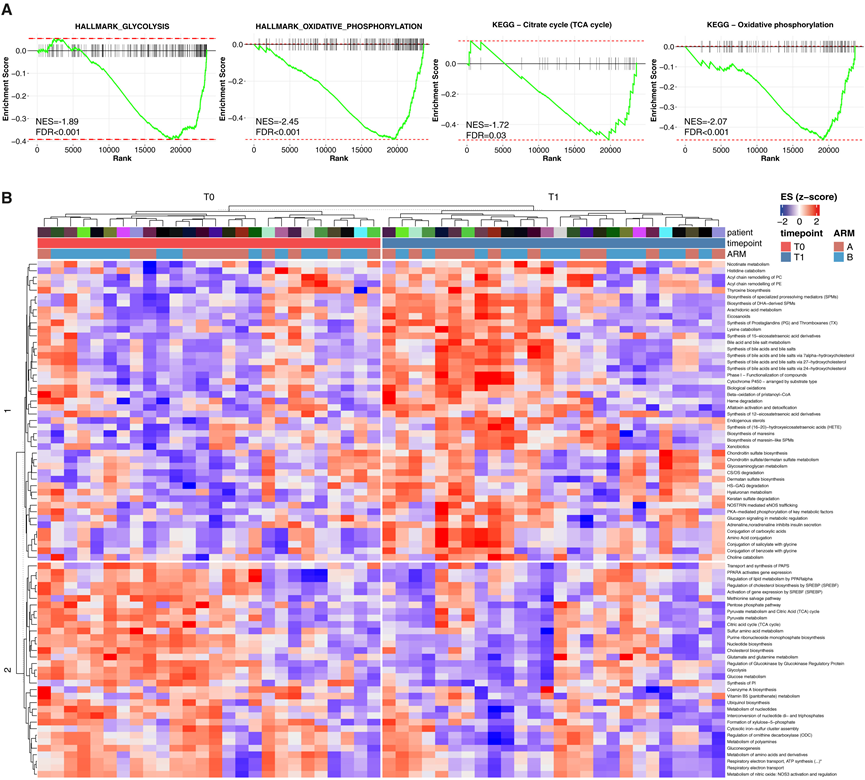
图4. 肿瘤内代谢途径的早期调节。
(A) 选定的代谢 KEGG 和 Hallmark 通路的富集图。(B) 热图表示富集的代谢通路。
04
抑制肿瘤内葡萄糖代谢可预测 pCR
在小鼠 TNBC 模型中,他们发现 FMD 诱导的血糖浓度和肿瘤内糖酵解降低是营养饥饿抗肿瘤作用的关键决定因素。他们试图探究全身和肿瘤内代谢的变化是否与 pCR 结果相关。与未达到 pCR 的患者相比,达到 pCR 的患者在第一个 FMD 周期后血液 LDH 水平的早期降低更为明显(图 5 A)。此外,在调整临床相关协变量(例如 T 和 N 分期、Ki-67 和治疗组)后,较高的 LDH 降低与较高的 pCR 率独立相关(图 5 B)。在肿瘤水平上,反映葡萄糖、丙酮酸和 TCA 循环代谢的通路的早期下调仅在接受 pCR 的患者中观察到,并且它与更高的 pCR 概率相关(图 5 C-D)。与化疗加 FMD 中添加二甲双胍没有临床益处(图 2)和额外的全身代谢影响一致,使用二甲双胍未导致额外的代谢变化,并且在使用或未使用二甲双胍治疗的患者中,第一个治疗周期后,与糖酵解、葡萄糖和丙酮酸代谢相关的几种肿瘤内途径没有差异富集。只有在达到 pCR 的患者中,第一个治疗周期后,属于葡萄糖、丙酮酸和 TCA 循环代谢途径的几种个别基因才会发生调节,其中绝大多数发生下调(图 5 D-E)。值得注意的是,在多变量分析中,葡萄糖转运蛋白、糖酵解和 TCA 循环基因表达的降低幅度越大,与更高的 pCR 概率独立相关(图 5 F)。
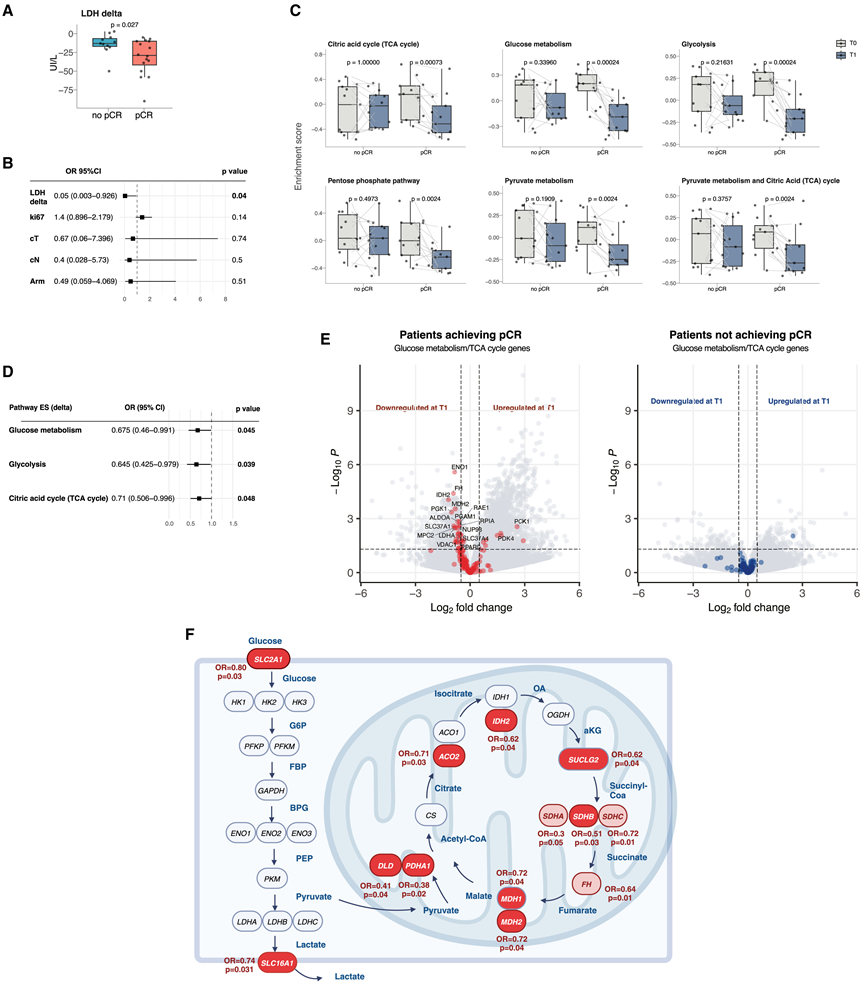
图5. 全身/肿瘤内葡萄糖代谢早期下调与 pCR 概率之间的关系。
(A) 箱线图表示根据 pCR 状态血液 LDH 浓度的绝对增量。(B) pCR 的多变量逻辑回归模型分析。(C) 箱线图表示匹配样本在治疗开始之前(T0)和一个治疗周期之后(T1)根据 pCR 状态的葡萄糖代谢途径的 GSVA ES。(D) 单变量逻辑回归模型评估选定的代谢通路的早期下调(以 T1 与 T0 肿瘤样本中 GSVA ES 的增量来衡量;OR 指每增加 0.1 ES)与 pCR 概率之间的关联。(E) 使用负二项分布(Deseq2 算法)比较 T1 与 T0 基因水平 RNA 测序数据的火山图显示差异表达基因。(F) 图表突出显示了参与葡萄糖转运、糖酵解、丙酮酸代谢和 TCA 循环的基因。
05
FMD 下调 TNBC 细胞和高度糖酵解的肿瘤内细胞中的糖酵解
为了研究癌细胞和肿瘤微环境 (TME) 细胞群中葡萄糖相关代谢途径的调节,他们进行了单细胞转录组分析(scRNA-seq),该分析是在基线 (T0;n = 13) 和一个治疗周期后 (T1;n = 11) 收集的新鲜肿瘤样本中进行的。总体而言,T他们从 177981 个活细胞中获得了转录组谱,随后对其进行注释并分类为主要细胞类型(上皮细胞、成纤维细胞、T 细胞、B 细胞、浆细胞、髓细胞、内皮细胞、周细胞和脂肪细胞)(图 6 A)。在 26013 个上皮细胞中,他们根据其拷贝数变异 (CNA) 谱鉴定出 18055 个癌细胞(占所有测序细胞的 10.1%)。与葡萄糖/丙酮酸代谢途径相关的基线 GSVA 评分显示,肿瘤内髓样细胞、肌上皮细胞、癌细胞和周细胞是糖酵解最活跃的细胞亚型,这与已发表的数据一致(图6 B)。值得注意的是,在经历pCR的肿瘤中,癌细胞、髓样细胞和周细胞的与葡萄糖代谢相关的通路活性(“糖酵解”、“葡萄糖代谢”、“戊糖磷酸途径”、“柠檬酸循环 (TCA)”、“丙酮酸代谢和柠檬酸 (TCA) 循环”)显著减少,而在未经历 pCR 的肿瘤中,相同途径在相同细胞亚群中富集(图 6 C-D)。另一方面,基线糖酵解代谢较低的细胞,如非肿瘤上皮细胞、T 淋巴细胞和 B 淋巴细胞,在研究治疗期间没有经历这些代谢途径的显著调节(上调或下调)。
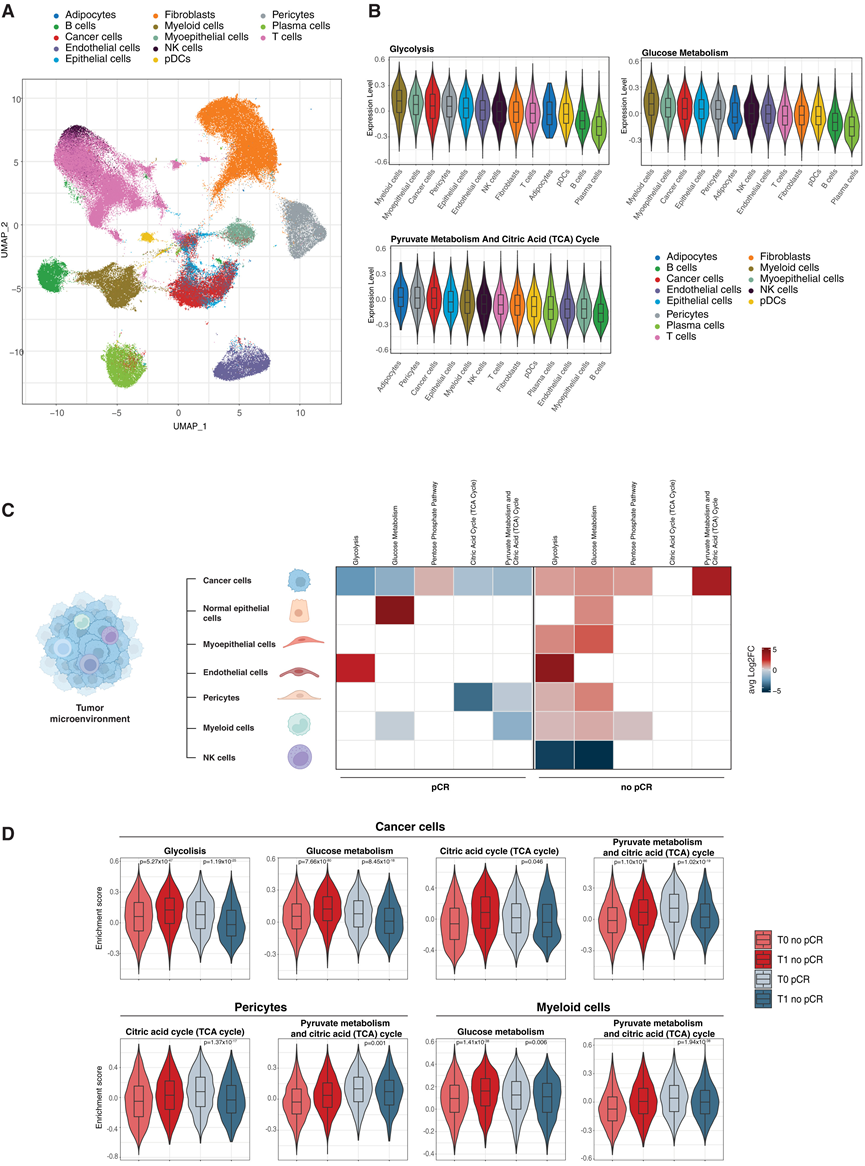
图6. 不同肿瘤浸润细胞的肿瘤内葡萄糖代谢调节。
(A) UMAP 可视化。(B) 与葡萄糖代谢、糖酵解和 TCA 循环活性相关的 GSVA ES。(C) 热图显示特定细胞类型中特定葡萄糖代谢相关通路。(D) 小提琴图和箱线图表示所选葡萄糖代谢相关通路在癌细胞、髓系细胞和正常上皮细胞中的 GSVA ES 分布。
+ + + + + + + + + + +
结 论
本研究表明,在 2 期试验 BREAKFAST 中招募的 30 名早期 TNBC 患者中,与术前化疗联合使用严格限制卡路里、每三周一次、为期 5 天的 FMD 方案可获得出色的病理完全缓解率(主要终点)和长期临床结果(次要终点)。多组学分析显示,达到 pCR 的肿瘤中高度糖酵解的癌细胞、髓细胞和周细胞会经历与糖酵解和丙酮酸代谢相关的途径的显著早期下调。本研究结果为开展更大规模的临床试验奠定了基础,以研究周期性 FMD 对早期 TNBC 患者的疗效,并验证肿瘤内糖酵解的早期变化作为营养限制临床益处的预测指标。
+ + + + +



 English
English


