文献解读|Nat Aging(16.6):转录和表观遗传失调会损害大脑衰老过程中增殖性神经干细胞和祖细胞的生成
✦ +
+
论文ID
原名:Transcriptional and epigenetic dysregulation impairs generation of proliferative neural stem and progenitor cells during brain aging
译名:转录和表观遗传失调会损害大脑衰老过程中增殖性神经干细胞和祖细胞的生成
期刊:Nature Aging
影响因子:16.6
发表时间:2024.1.04
DOI号:10.1038/s43587-023-00549-0
背 景
干细胞的衰老是一种自然且不可避免的生物过程,其特征是受干细胞生态位内细胞内在途径和外在因素影响的退行性变化。衰老过程中干细胞功能的下降可能会影响哺乳动物有机体的再生能力;然而,这种下降背后的基因调控机制仍不清楚。
实验设计

结 果
01
衰老大脑中增殖性 NSPC 的生成效率降低
为了研究大脑中神经干细胞和祖细胞 (NSPC) 功能与年龄相关的衰退,研究者团队分析了年轻(2 个月)和老年(18 个月)雄性小鼠 SVZ 中 NSPC 的增殖情况。与年轻小鼠相比,老年小鼠SOX2阳性细胞中BrdU和SOX2双阳性NSPC的百分比下降,表明衰老大脑中活跃NSPC数量的减少(图1a) 。与年轻细胞相比,衰老的 NSPC 形成的神经球更少且更小(图1b-c),并且这种趋势在后续世代(P1、P2 和 P3)中持续存在。这表明衰老过程中 NSPC 的自我更新可能受到独立于体内生态位的细胞内在衰老机制的控制。5-乙炔基-2'-脱氧尿苷(EdU)标记表明活跃增殖的老化NSPC显著减少,这种趋势在体外持续一段时间(图1d-e)。
为了在分子水平上研究 NSPC 的激活状态和谱系进展中与年龄相关的变化,以及识别导致衰老过程中 NSPC 增殖减少的基因,他们进行了单细胞转录组分析(scRNA-seq)。通过对差异表达基因 (DEG)、NSPC 静止状态的综合分析,在年轻和老年 NSPC 中鉴定了四个不同的聚类(早期 B1a 型细胞、晚期 B1a 型细胞、早期 C 型细胞和晚期 C 型细胞)和激活标记以及细胞类型标记(图1f)。与C型细胞相比,活化的B1型细胞(B1a型)对激活标记物(Top2a、Mki67和Mcm2)的表达水平相对较低,而B1型细胞标志物(Slc1a3和Fabp7)的表达水平较高。B1a型细胞的两种激活状态也鉴定出来,与晚期状态相比,早期状态显示出更高的静止标记(Atp1a2、Aldoc、Apoe和Cd9)的表达水平(图1g)。
C型细胞,特别是处于活化晚期状态的细胞,表现出活化标记物以及C型细胞标记物Ascl1的表达水平升高。基于轨迹的静止和激活标记基因表达分析,以及使用 Monocle3 的伪时间分析,显示年轻和衰老细胞群中从慢周期 B1 型细胞到快速周期 C 型细胞的转变(图1h)。与年轻组相比,老年组中晚期B1a细胞比例较高,早期C细胞比例较低。然而,最静止和最活跃的 NSPC 比例,包括早期 B1a 型和晚期 C 型细胞,在衰老细胞和年轻细胞之间是相似的(图1i)。与其他聚类相比,早期 B1a 型具有最多的 DEG 标记(图1j)。Aldoc和Atp1a2基因(与NSC静止状态正相关)在衰老的NSC群体中上调,与细胞衰老表型一致。下调的基因,如Nrn1和Trf,促进神经再生和细胞存活(图1k)。
GO分析显示,与晚期B1a细胞DEG标志物相关的通路包括微管结合(Map1b)、细胞色素c氧化酶活性(Cox6a2)、核苷酸结合(Elavl3)、DNA结合转录因子活性(Atf5)、氧化还原酶活性(Moxd1)和碳水化合物结合(Cntn1)。与早期C型细胞相关的通路包括信号受体结合(Lpl)和染色质结合(Hes5)。与晚期C型细胞相关的通路包括DNA结合转录因子活性(Mef2c和Pttg1)和GTP结合(Arl4c)。进一步使用DEG标记物Hes5对早期C型细胞进行分析发现,与年轻细胞相比,老年细胞群中Hes5阳性的早期C型细胞比例较低,老年组top2a阳性早期C型细胞比例降低(图1l-n)。这些结果表明,在细胞和分子水平上,在衰老过程中,增殖性NSPC的生成效率持续下降。
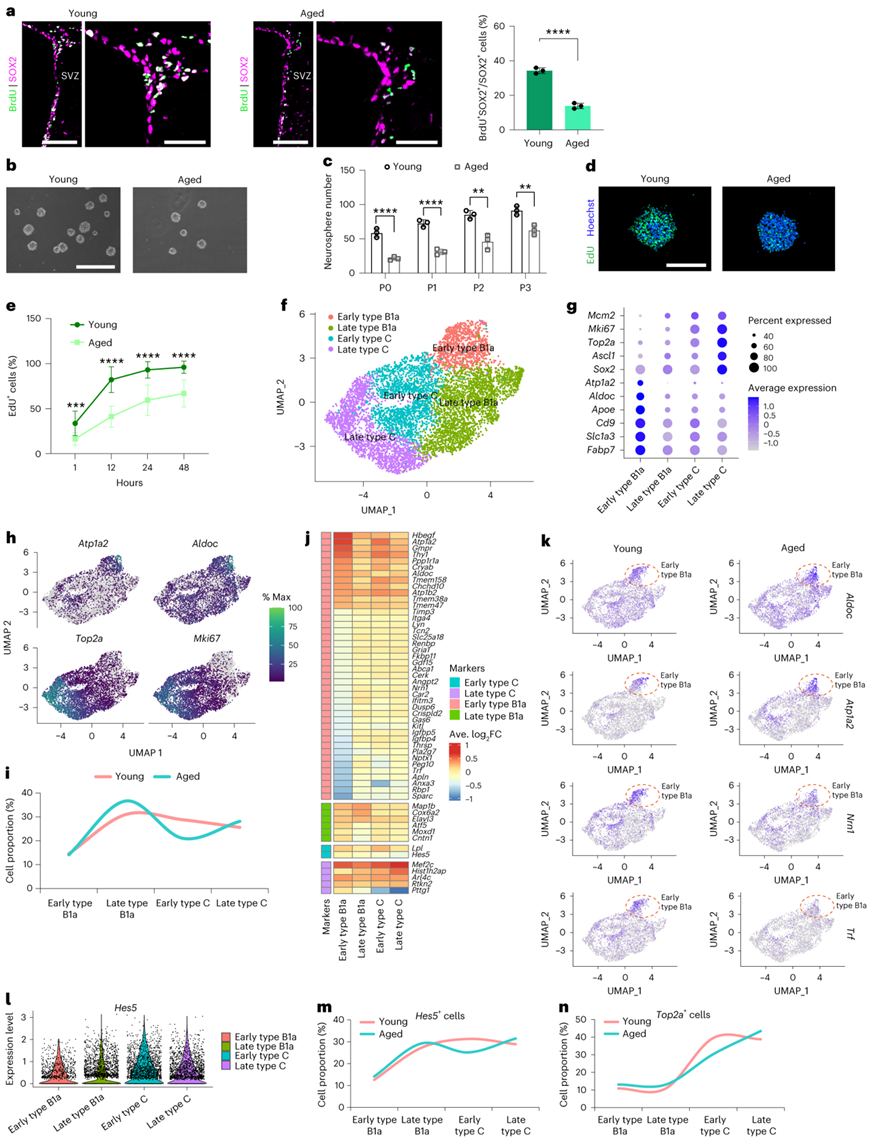
图1. 老化大脑中 NSPC 增殖的生成效率降低。
(a) 共聚焦显微镜图像显示年轻和老年小鼠大脑 SVZ 中 BrdU 和 SOX2 的免疫荧光共标记。(b) 分别从年轻和老年小鼠的 SVZ 中分离出的原代 NSPC 形成的神经球的代表性图像。(c) NSPC不同通道形成的神经球的定量。 (d) 年轻和老年 NSPC 衍生神经球的 EdU 标记分析。 (e) 年轻组和老年组中 EdU 标签的时间进程量化。(f) 年轻和老年小鼠 NSPC 的 UMAP 图。(g) 点图显示 NSPC 激活和静止标记以及谱系标记的表达。 (h) 在 UMAP 图上可视化的静止标记(Atp1a2和Aldoc)和激活标记(Top2a和Mki67 )的基因表达。(i) 每个年龄组从早期 B1a 型细胞到晚期 C 型细胞的细胞群百分比。 (j) 每个 NSPC 聚类中标记基因的热图以及老年 NSPC 群体与年轻 NSPC 群体中表达分析。(k) 年轻和老年 NSPC 中早期 B1a 型代表性 DE 标记的 UMAP 图。(l) 四个 NSPC 聚类中Hes5基因表达的小提琴图。 (m-n) Hes5阳性百分比和Top2a-每个年龄组的四个 NSPC 聚类内的阳性细胞群。
02
年龄依赖性基因的下调导致 NSPC 衰老
为了揭示导致 NSPC 衰老的转录机制,他们首先进行了bulk RNA 测序 (bulk RNA-seq) 来分析从大脑 SVZ 中分离出的年轻和老年 NSPC 之间的转录组变化。差异表达分析发现,与年轻的 NSPC 相比,老年 NSPC 中有 215 个下调基因和 208 个上调基因(图2a)。GO分析显示NSPC衰老中的许多DEG参与发育过程和细胞分化(图2b)。值得注意的是,有 42 个与神经系统发育相关的基因下调,例如Dmrta2、Dlx2、En2和Gjc1,这些基因参与调节早期大脑发育中的 NSPC 增殖和分化,并可能与 NSPC 衰老表型相关。
接下来,他们假设 NSPC 的功能下降可能是由于上述转录组分析中发现的年龄依赖性基因失活所致。为了检验这一假设,他们使用三种针对每个年龄依赖性下调基因的序列独立小干扰 RNA (siRNA) 进行了功能性 RNA 干扰 (RNAi) 筛选。总共设计了 156 个 siRNA 序列,这些序列特异性针对在GO 分析中鉴定的52个发育基因,抑制它们的表达。将每种 siRNA 转染至原代年轻 NSPC 中,观察其对细胞活力的影响。与阴性对照组相比,82 个 siRNA 显著降低了细胞活力,而只有 12 个 siRNA 增加了细胞活力(图2c-d)。
为了研究年龄依赖性基因的沉默是否会影响NSPC自我更新,他们在转染10个基因的siRNA后2天进行了神经球形成实验,这些基因包括Barhl2、Dmrta2、Hlx、Igf2bp2、Igf2bp3、Lix1、Nkain2、Tmem28、Trf和Twist1。在敲除这些基因后,各组神经球的数量显著减少(图2e)。进一步用EdU标记实验分析表明,这些基因的沉默导致活跃增殖的NSPC的产生减少,与衰老细胞的特征非常相似(图2f-g)。
在年轻 NSPC 中转染 siRNA 3 小时后,进行腺病毒介导的Igf2bp2转导。转导2天后的EdU标记显示,鼠Igf2bp2敲低细胞中人Igf2bp2基因表达的增强挽救了活跃增殖的NSPC的数量(图2h-i)。总体而言,这些数据证明了年龄依赖性基因的下调会导致 NSPC 衰老。
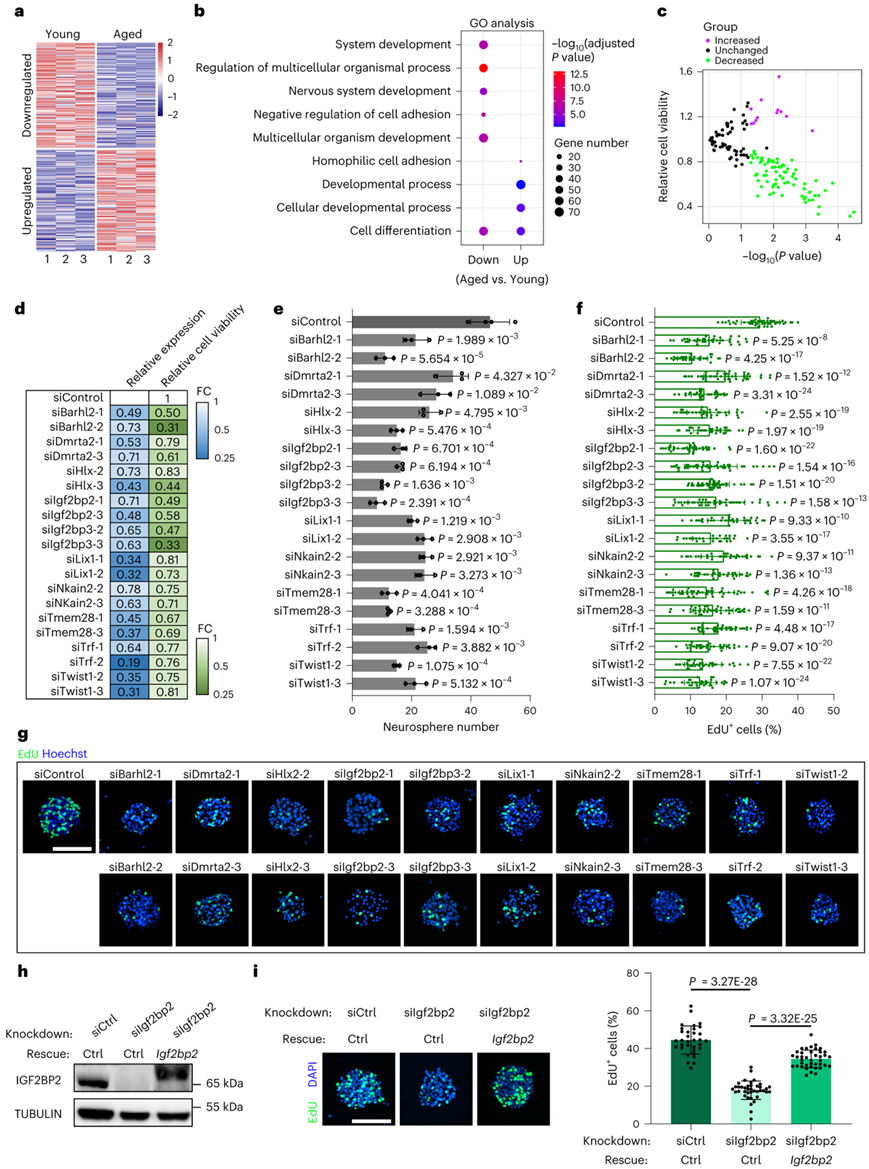
图2. 年龄依赖性基因的下调导致 NSPC 衰老。
(a) 老年 NSPC 与年轻 NSPC 中下调和上调基因的热图。 (b)GO分析。(c) 相对细胞活力的点图。 (d) 显著降低靶基因表达和 NSPC 细胞活力的代表性 siRNA 的热图。 (e) 单个 NSPC 形成的神经球的定量。(f) EdU 标记分析。(g) 代表图像NSPC 衍生的神经球的 EdU 标记。(h)免疫印迹分析。(i) 用Igf2bp2敲低处理处理的神经球的代表性图像。
03
年龄依赖性基因是衰老 NSPC 恢复活力的潜在靶点
接下来,他们检测了 SVZ 中 IGF2BP2、IGF2BP3 和 BARHL2 表达的年龄相关变化。原位免疫荧光染色分析显示,与年轻小鼠相比,老年小鼠SVZ中SOX2阳性细胞群中IGF2BP2和SOX2双阳性细胞的百分比显著降低(图3a)。在衰老大脑的 SVZ 中观察到 SOX2 阳性细胞群中IGF2BP3+ SOX2+和 BARHL2+ SOX2+细胞百分比的类似减少(图3b-c)。免疫荧光染色显示,与年轻小鼠相比,老年小鼠 EGFR 阳性 NSPC 群体中IGF2BP2+ EGFR+、IGF2BP3+ EGFR+和 BARHL2+ EGFR +细胞的百分比显著降低(图3d-f)。
他们重点研究腺病毒介导的基因转导对 SOX2 鉴定的原代 SVZ 细胞群的恢复作用。首先评估了 SOX2 阳性 NSPC 中基因的转导效率,与抗FLAG和抗SOX2抗体的免疫荧光共标记表明大多数NSPC由这些基因转导(图3g)。接下来,通过与BrdU和SOX2共标记病毒转导后,分析了SVZ中NSPC的激活情况。通过定量BrdU和SOX2双阳性细胞鉴定活性NSPC。结果显示,与对照组相比,Igf2bp2、Igf2bp3和Barhl2的过表达显著增加了老年SVZ中活性NSPC的数量(图3h-j),进一步检测SVZ中EGFR阳性细胞,证实Igf2bp2、Igf2bp3和Barhl2表达增强后,活性NSPC数量显著增加(图3k-m)。通过EdU标记实验,与对照组相比,腺病毒介导的Igf2bp2、Igf2bp3和Barhl2的转导增加了活跃增殖细胞的比例,从而使衰老的NSPC恢复活力(图3n)。
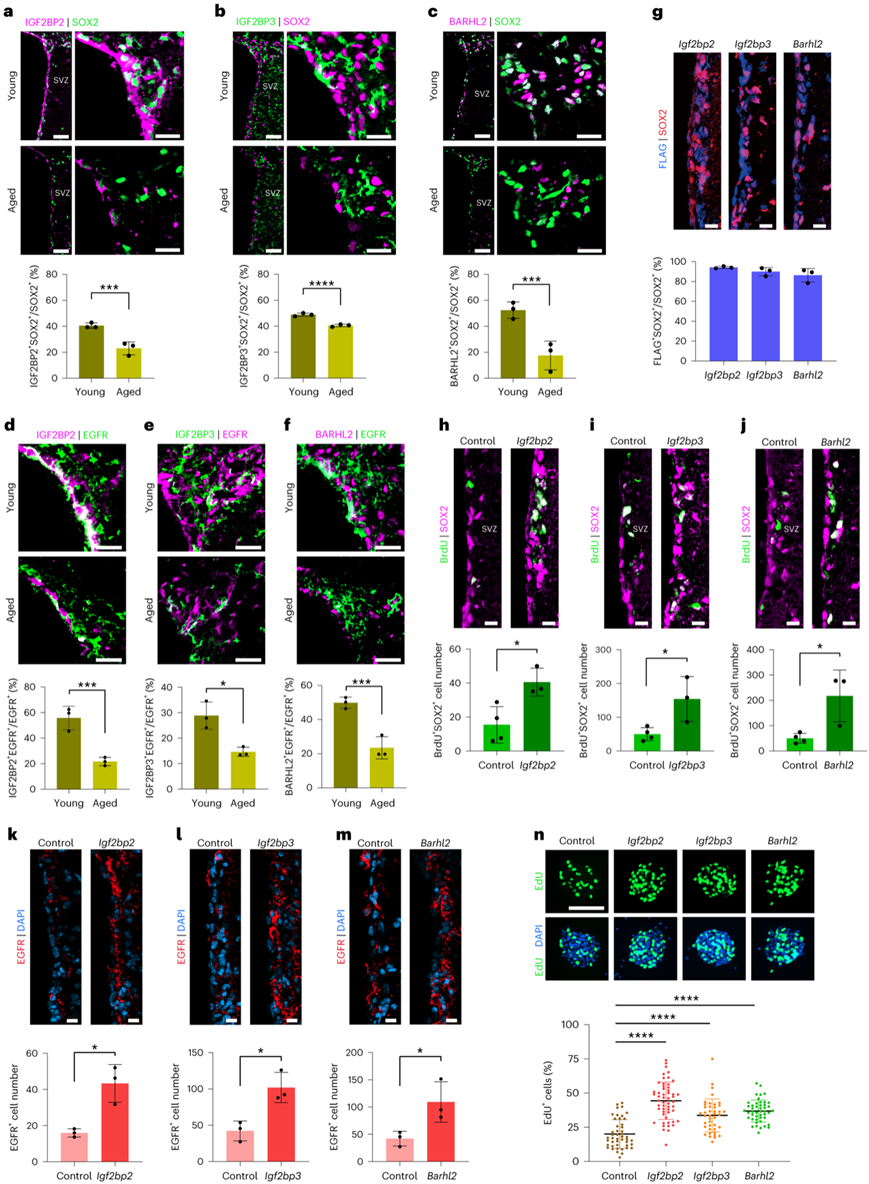
图3. 年龄依赖性基因是衰老 NSPC 的潜在恢复活力的靶标。
(a-m)免疫荧光分析及定量。(n) 分别在转导编码Igf2bp2、Igf2bp3和Barhl2的腺病毒后 48 小时对老化 NSPC 形成的神经球进行 EdU 标记。
04
基因调控元件组蛋白修饰的变化与 NSPC 衰老的转录失调有关
顺式调控元件的组蛋白修饰在基因转录的表观遗传调控中发挥着重要作用。为了研究表观遗传机制是否可能导致 NSPC 衰老中的转录失活,他们使用染色质免疫沉淀和测序 (ChIP-seq) 分析了年龄依赖性基因的启动子和增强子的主要调控组蛋白标记。在老化 NSPC 的下调基因启动子处发现了与基因抑制相关的 H3K27me3 信号增加(图4a)。同时,他们观察到老年 NSPC 与年轻 NSPC 相比,26 个下调基因启动子处的 H3K4me3 信号减少,17 个上调基因启动子处的信号增加(图4b-c)。年轻 NSPC 中衰老依赖性下调基因启动子处的 H3K4me3 平均信号较高(图4d)。
H3K27ac 是在活性增强子中发现的组蛋白修饰。具有较低 H3K27ac 信号的基因增强子可能在转录中失活或处于平衡状态。在 13 个年龄依赖性下调基因的增强子处可以观察到 H3K27ac 的位点特异性减少,而在 8 个上调基因的 H3K27ac 信号增加(图4c)。一致地,与老年 NSPC 相比,年轻 NSPC 中下调基因增强子处的 H3K27ac 平均信号显著较高(图4e)。接下来,他们分析了与组蛋白修饰变化正相关的年龄依赖性基因的分子功能,并确定了三个分子类别:转录因子、信号传导因子和膜蛋白(图4f)。有趣的是,增加的H3K27me3和减少的H3K4me3信号同时出现在Igf2bp2、Igf2bp3、Fam155a和Flt1以及编码转录因子的四个基因(Barhl2、Nkx3-2、Otx2和Twist1)的启动子处(图4g)。他们确定了6个下调基因(Igf2bp2、Nuak1、Fam155a、Nkain2、Barhl2和Dmrta2),它们在启动子处的H3K27me3增加,在增强子处的H3K27ac减少(图4h),以及在这些区域表现出H3K4me3和H3K27ac减少的其他4个下调基因(图4i)。值得注意的是,NSPC的年轻化靶点,包括Barhl2和Igf2bp2,与NSPC衰老过程中组蛋白修饰的动态变化高度相关(图4j),这表明它们是表观遗传调控因子的潜在靶点。
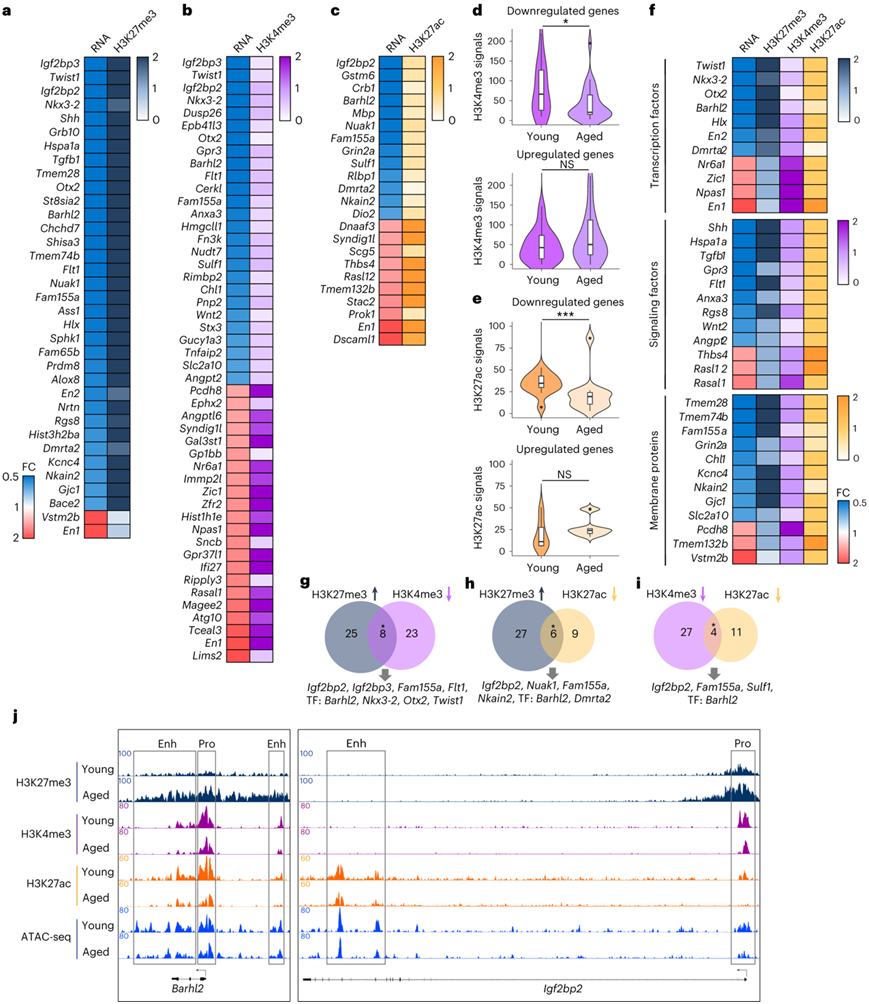
图4. 基因调控元件组蛋白修饰的变化与 NSPC 衰老的转录失调有关。
(a-b) 热图显示年龄依赖性基因启动子处 H3K27me3 和 H3K4me3 的平均 ChIP-seq 信号的 FC 及其 RNA 水平的变化。 (c) 热图显示年龄依赖性基因增强子处平均H3K27ac信号的FC及其RNA水平的变化。 (d) 年轻和老年 NSPC 中 26 个年龄依赖性下调基因和 22 个上调基因启动子处 H3K4me3 的平均信号。 (e) 年轻和老年 NSPC 中 13 个年龄依赖性下调基因和 10 个上调基因增强子处 H3K27ac 的平均信号。(f) 年龄依赖性基因的功能分类,其中基因启动子(H3K27me3 和 H3K4me3)和增强子(H3K27ac)的组蛋白修饰发生变化。 (g-i) 维恩图显示年龄依赖性基因的重叠,显示老年 NSPC 与年轻 NSPC 的启动子和增强子处的组蛋白修饰同时发生的变化。
05
鉴定 MLL 复合物作为衰老 NSPC 功能衰退的关键表观遗传调节因子
接下来,他们的目标是确定在衰老过程中导致 NSPC 功能衰退和转录失调的表观遗传调节因子,使用针对 16 个表观遗传调节因子的 48 个 siRNA 进行功能性 RNAi 筛选,以检查基因敲除后的细胞活力。这些表观遗传调节因子参与组蛋白 H3 赖氨酸 4 甲基化(包括Kmt2a、Kmt2b、Kmt2c、Kmt2d、Ash2l、Dpy30、Rbbp5、Wdr5、Kdm1a和Kdm5a)、组蛋白 H3 赖氨酸 27 甲基化(包括Ezh2、Jmjd3、Utx和Uty )的调节)和组蛋白 H3 赖氨酸 27 乙酰化(包括P300和Hadc1)。结果表明,MLL复合体亚基(KMT2D、RBBP5和WDR5)的敲低会降低细胞活力(图5a-d)。为了验证Kmt2d、Rbbp5和Wdr5对衰老NSPC功能衰退的作用,他们分析了年轻NSPC中敲低这些基因后的神经球形成,发现转染后2天神经球数量显著减少(图5e)。EdU标记实验进一步分析表明,KMT2D、RBBP5和WDR5的敲除减少了神经球中活跃增殖的NSPC的数量(图5f-g)。与老年NSPC相比,KMT2D、RBBP5和WDR5的表达在年轻NSPC中保持不变,与在衰老NSPC中观察到的H3K4me3的整体效应一致(图5h)。
与年轻的 NSPC 相比,年龄依赖性基因的 15 个启动子处的 MLL 复合物富集度降低,伴随着 H3K4me3 信号的降低,而大多数启动子处的 CBX3 富集度保持不变或略有改变(图5i-j)。CBX3的相对稳定的结合和MLL复合物的结合减少表明MLL复合物和CBX3之间的相互作用可能在NSPC老化过程中受到影响。

图5. 鉴定出 MLL 复合物是衰老 NSPC 功能衰退中的关键表观遗传调节因子。
(a) 点图显示siRNA转染后48小时NSPC的相对细胞活力。 (b-d)免疫印迹分析。(e) NSPC 形成的神经球的定量。 (f) siRNA 转染后 48 小时,年轻 NSPC 衍生神经球的 EdU 标记的代表性图像。 (g) 转染 siRNA 后 48 小时,对年轻 NSPC 衍生的神经球中的 EdU 标记进行定量。(h) 免疫印迹分析。(i) 热图显示老年与年轻 NSPC 中年龄依赖性基因每个启动子处的 H3K4me3、MLL 复合体亚基和 CBX3 的 ChIP-seq 信号的 FC。 (j) 年轻和老年 NSPC 中Barhl2、Igf2bp2和Igf2bp3 TSS 区域以及 MLL 复合物和 CBX3 的 ChIP-seq 信号。
06
MLL 复合体启动子处的表观遗传失调导致年龄依赖性基因的转录失活
接下来,他们探讨了 MLL 复合物对 NSPC 衰老过程中年龄依赖性基因的转录和表观遗传失活的作用,重点关注Barhl2、Igf2bp2和Igf2bp3基因,因为它们在上面观察到的 NSPC 衰老中发挥重要作用(图2和3)。ChIP-qPCR 分析证实了这些基因启动子处 MLL 复合物富集的减少(图6a-f)。MLL复合体亚基的敲低降低了Barhl2、Igf2bp2和Igf2bp3的表达水平(图6g-l),并且与对照组相比,在MLL复合体敲低中,其启动子处的H3K4me3信号也降低了(图6m-r)。细胞功能分析表明, KMT2D敲低和RBBP5敲低细胞中Barhl2和Igf2bp2基因的表达分别增加,挽救了活跃增殖的NSPC的数量(图6s)。总的来说,这些结果证明了启动子处 MLL 复合物的表观遗传失调会导致 NSPC 年龄依赖性基因的转录失活。
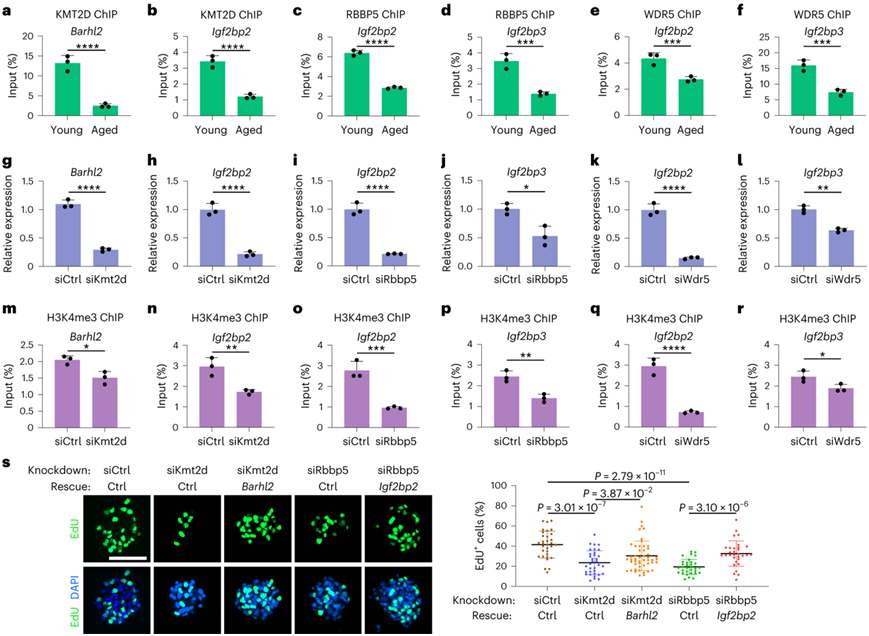
图6. MLL 复合体功能丧失会导致年龄依赖性基因的转录和表观遗传失活。
(a-f) ChIP-qPCR 数据显示年轻和老年 NSPC 中Barhl2、Igf2bp2和Igf2bp3启动子处 MLL 复合物的富集。 (g-l) MLL 复合物敲低与对照细胞中基因相对表达的实时 qPCR 分析。 (m-r) ChIP-qPCR 数据显示,与对照组相比,年轻 NSPC 中 MLL 复合物敲低后,Barhl2、Igf2bp2和Igf2bp3启动子处的 H3K4me3 信号发生变化。(s)基因表达分析。
+ + + + + + + + + + +
结 论
本项研究发现雄性小鼠大脑中NSPC的衰老特征是增殖性NSPC的生成效率下降,而不是NSPC谱系特异性的变化。NSPC 中年龄依赖性基因的下调通过减少活跃增殖的 NSPC 数量同时增加静止标记的表达来驱动细胞衰老。启动子处MLL复合物的表观遗传失调会导致年龄依赖性基因的转录失活,这凸显了组蛋白修饰剂和基因调控元件之间动态相互作用在调控衰老细胞转录程序中的重要性。本项研究揭示了通过表观遗传调节因子驱动干细胞衰老的关键内在机制,并确定了可以恢复衰老干细胞功能的潜在靶标。
+ + + + +



 English
English


