文献解读|Cell Rep(8.8):基因调控网络分析预测 FLT3-ITD+ AML 生长所需的协作转录因子调节子
✦ +
+
论文ID
原名:Gene regulatory network analysis predicts cooperating transcription factor regulons required for FLT3-ITD+ AML growth
译名:基因调控网络分析预测 FLT3-ITD+ AML 生长所需的协作转录因子调节子
期刊:Cell Reports
影响因子:8.8
发表时间:2023.12.15
DOI号:10.1016/j.celrep.2023.113568
背 景
当信号基因、转录因子 (TF) 和表观遗传调节因子的突变导致正常分化程序受时,就会发生癌症。急性髓系白血病 (AML) 也不例外,由于该疾病的克隆性质,癌症的不同驱动突变会导致 AML 细胞中出现不同的基因调控模式。具有内部串联重复 FLT3 受体 (FLT3-ITD+ AML) 的 AML,将配体反应性受体转化为组成型活性分子,是一种高度侵袭性的 AML 亚型,一线治疗通常难以治愈。目前迫切需要为每种不同的 AML 亚型确定可药物靶点,以便根据个体情况制定治疗方案。
实验设计
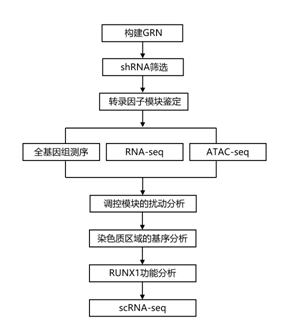
结 果
01
构建完善的 FLT3-ITD+ AML 的基因调控网络 (GRN)
细胞类型特异性基因表达主要编码在与其同源启动子物理相互作用的远端增强子元件中。研究者团队开发了一个新的开放获取的计算程序,并使用公开发布的数据构建完整的GRN,其中包含所有基因的所有顺式调控元件(包括所有基因的启动子)之间的全部调控相互作用(图1A)。通过分析高读长深度 DNaseI-seq 数据来确定 AML 特异性的开放染色质区域。通过这些位点内的数字足迹(digital footprinting)确定占用的转录因子(TF)结合基序,然后将其分配到TF家族。这些区域使用先前确定的启动子捕获HiC (CHiC)相互作用从FLT3-ITD AML样本或最近的基因(两者都在启动子200 kb以内)分配给启动子。他们将这些数据绘制成一个网络,显示了FLT3-ITD AML中TF家族与其靶基因之间的特定相互作用。许多靶标本身就是TF编码基因,这里显示的就是这些靶标(图1A)。
因此,他们合并了两个突变组的数据,并构建了一个共有的GRN(图1B)。为了验证的构建的GRN,他们确定了9例患者的完整FLT3-ITD+ AML特异性GRN,并与健康的CD34+动员的外周血干细胞(PBSC)进行了比较。图1B显示了患者之间共有的TF基因之间FLT3-ITD AML特异性的百分比。分析结果表明,超过50%的患者共有特定的连接。共有的核心 FLT3-ITD+ AML 特异性 GRN 显示多个高度连接的节点,其中包含 FLT3-ITD+ AML 特异性上调的 TF 基因,例如 KLF、RUNX、C/EBP、FOX 家族和 NFIX,所有节点都显示与其他 TF 连接的多个边缘编码基因。该分析表明,连接 RUNX、ETS 和 AP-1 节点在网络中占据中心位置。
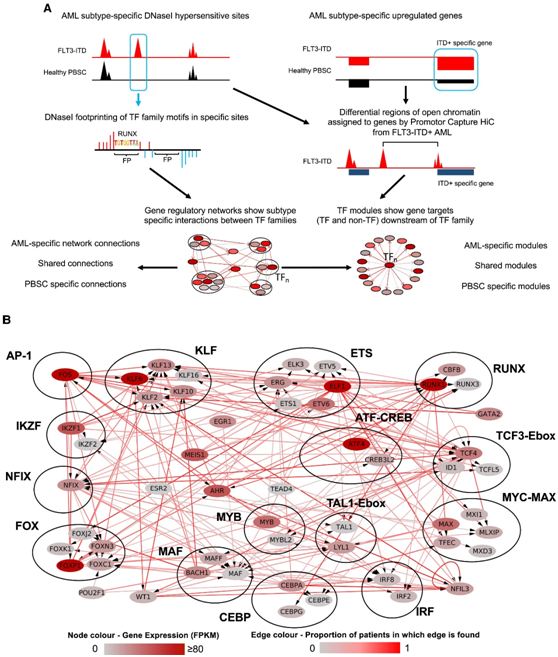
图1. FLT3-ITD和FLT3-ITD/NPM1 AML的精细基因调控网络。
(A) 转录因子 (TF) 网络和调控模块生成方案。(B) FLT3-ITD/FLT3-ITD NPM1 TF 网络,通过整合来自 DHS 的数据而生成,该数据针对 特异性 DNaseI 超敏感位点 (DHS) 中鉴定的 FLT3-ITD/FLT3-ITD NPM1 AML,与健康 PBSC 进行比较。
02
精细化的FLT3-ITD AML特异性GRN预测AML维持所需的基因
接下来他们提出了假设:精细化的 GRN 内的高度连接的节点及其一些目标对于维持 FLT3-ITD+ AML 非常重要。为此,他们针对选自 FLT3-ITD GRN 和 TF 模块的 161 个基因进行了 shRNA 筛选(图2A)。
他们的靶向清除筛选显示,靶标之间有显著的重叠(图2B),而且重要的是,命中率非常高,大多数选定的靶标发生清除,其中近50%的靶标在体外和体内生长中都很重要(图2B-E)。他们将所有的结果与DepMap项目(DepMap.org)的结果进行了比较,DepMap项目在全基因组CRISPR筛选中测试了相同的FLT3-ITD细胞系。大多数重叠的DepMap点的基因效应大于-0.3,也是本项研究中通过shRNA筛选中的点。
总而言之,本项研究的实验表明,基于原代 AML 细胞数据构建疾病特异性 GRN 对于识别 FLT3-ITD+ AML 细胞生长所需的高度连接的网络节点具有高度预测性。
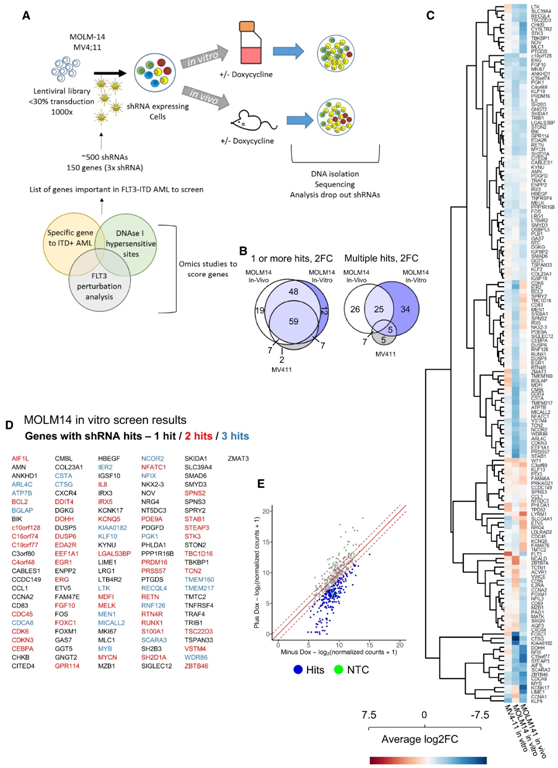
图2. FLT3-ITD 和 FLT3-ITD/NPM1 的 GRN 为高效 shRNA 筛选提供信息。
(A) shRNA体外和体内筛选策略方案。(B) 维恩图分析。(C) 热图显示三个屏幕中 shRNA 丰度的平均 差异倍数(FC)。(D) MOLM14体外筛选结果和 shRNA 命中的基因列表。(E) MOLM14体外筛选后的 shRNA 丰度绘制为散点图。
03
FLT3-ITD特异性重叠转录因子模块的鉴定
他们通过使用数字足迹和ChIP分析来识别AML特异性和共有TF模块,将上述TF与更广泛的患者衍生的GRN联系起来。这些分析是针对单个TF(C/EBP、RUNX、EGR)和先前研究的TF家族(AP-1、FOXC1、NFIX),这些TF家族与FLT3-ITD/NPM1细胞中特异性上调的下游基因相关(图3A)。他们还纳入了与正常细胞共有的占用结合位点,因为它们通常包含信号响应TF的基序,可以在异常信号环境中刺激AML特异性基因的表达。
他们还观察到模块之间的交叉调节,例如FOXC1是NFI模块的一部分。FOXC1和NFIX是异常表达的TF。而FOXC1是真正的异常表达,NFIX在造血和造血干细胞存活中发挥作用,然后下调,但在FLT3-ITD+ AML细胞中,它发生上调。因此,它们的异常表达是FLT3-ITD/NPM1白血病表型的一部分。
为了检测AML和正常细胞之间的节点共有程度,他们计算了它们的相似性(图3B)。该分析表明,与健康PBSC不同的是,FLT3-ITD-AML特异性GRN(图3C)包含TF模块TCF3-Ebox、ETS、RUNX、AP-1、MEIS、NFI、C/EBP/NFIL3、IKFZ和MYB的重叠节点的中央集群,这些节点也在共有位点中存在(图3D)。健康的PBSC特异性中心模块聚类(图3E)包含类似的基序,但其特征是额外存在GATA基序,表明细胞处于更不成熟的状态。接下来,他们检测了整个FLT3-ITD AML GRN的所有模块,并分析哪些模块富含FLT3-ITD AML特异性基因(图3F)。该分析再次显示,特异性模块在FLT3-ITD AML特异性表达基因中过度表达,包括AP-1、C/EBP、NFI和RUNX1模块。综上所述,该分析表明FLT3-ITD AML特异性基因受不同的重叠TF模块组调控。
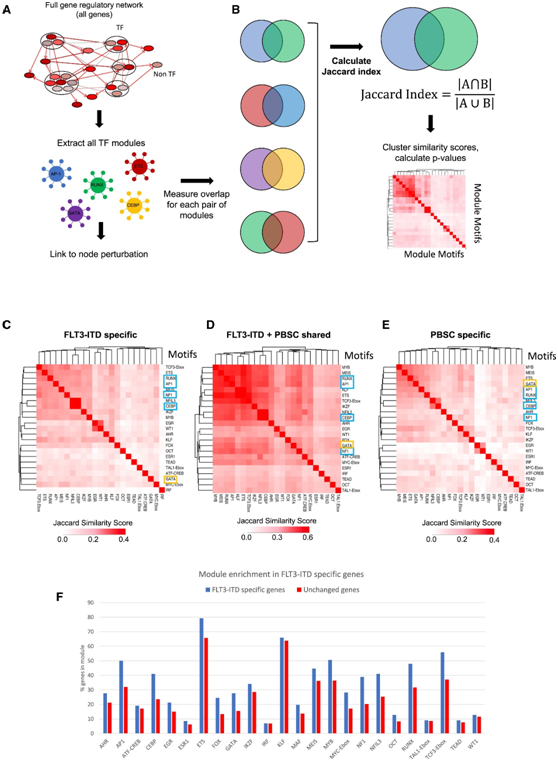
图3. 调节TF模块的鉴定和比较。
(A) 模块鉴定方案。(B) 与 PBSC 相比,鉴别 FLT3-ITD 特异性 DHS 中 TF 调节模块的 Jaccard 相似性的方案。(C) 与 PBSC 相比,FLT3-ITD 特异性 DHS 中 TF 调节模块的 Jaccard 相似性。(D) DHS 中与 PBSC 共享的 TF 调节模块的 Jaccard 相似性。(E) PBSC 特异性 DHS 中 TF 调节模块与 FLT3-ITD 相比的 Jaccard 相似性。(F) 直方图显示与 PBSC 相比,FLT3-ITD 中与上调 mRNA 相关的位点中的模块富集。
04
原代细胞中 FLT3-ITD+ AML 特异性 TF 模块的扰动凸显了基于组合 TF 作用的调节关系
为了检测不与健康细胞共有的 FLT3-ITD+ AML 特异性模块的扰动如何影响原代 FLT3-ITD+ AML 细胞的活力,他们通过全基因组分析检测了选定 TF 模块之间的相互作用。
他们通过 shRNA 以及更大的 C/EBP 和 AP-1 家族来分析RUNX1 和 NFIX 模块,在原代 PDX 细胞中表达其显性失活对应物,然后进行转座酶染色质可及测序 (ATAC -seq)和转录组分析(RNA-seq)。
对ATAC-seq数据的分析表明,每次扰动都对染色质景观产生强烈影响,有数千个位点打开和关闭,表明因子扰动不仅影响生长,而且还改变了细胞的GRN(图4A-D)。然而,尽管获得或丢失了位点,但这些位点中富集的基序组成并没有显著变化,PU.1、RUNX、C/EBP和AP-1基序占主导地位,这表明系统使用相同的TF模块重组。
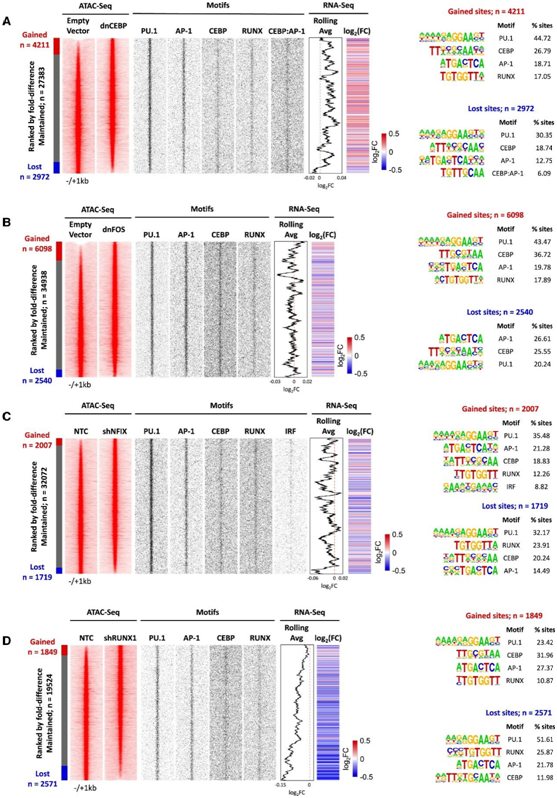
图4. TF 调控模块的扰动改变了 FLT3-ITD 原代 AML 细胞的染色质景观。
(A–D) 密度图显示与空载体对照或 shNTC 相比,在 dnCEBP、dnFOS、shNFIX 或shRUNX1 表达后 ATAC 位点发生变化。
基因表达分析显示模块之间存在复杂的调控关系,所有 TF 扰动都会导致基因的上调和下调(图5A-G)。对 NFIX 和 RUNX1 敲低作出反应的基因的分析表明,NFIX 与 RUNX1 处于相同的调节途径,其中RUNX1在 NFIX 敲低后与其他 56 个基因一起强烈下调。RUNX1 耗竭影响驱动巨噬细胞分化的直接 RUNX1 靶位点,例如CSF1R和IRF8和多种炎症基因。
RUNX1下调的间接影响也可以在NFIX敲低中看到,尽管许多基因的差异倍数(FC)没有达到显著水平。dnFOS表达后出现另一种跨模块反应,下调NFIX及其同源物NFIA。AP-1 (JUN)和C/EBP家族成员可以相互作用来驱动巨噬细胞分化,本项研究数据表明,他们可以共同调节许多基因。有趣的是,在dnC/EBP表达后缺失的开放染色质区域中富集的基序之一是C/EBP/AP-1复合基序(图4A),这表明这两个因子存在协调效应。
综上所述,这几个例子表明不同模块之间存在广泛的相互影响。一个模块的扰动会导致其他模块的复杂响应。
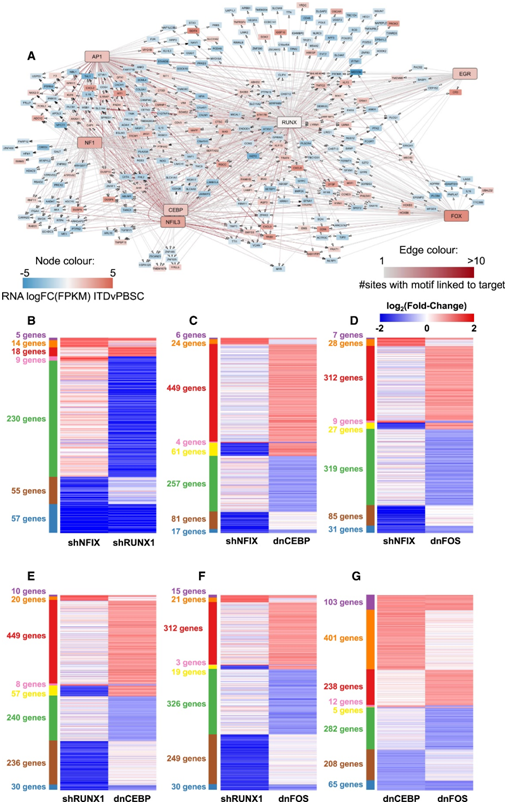
图5. 扰动分析揭示了调控模块之间的相互作用。
(A) 网络显示与 PBSC 相比,RUNX1 模块与其他所示基因上调(红色)或下调(蓝色)的模块的连接。(B-G)热图显示了分别与空载体对照(dnCEBP、dnFOS)或shNTC (shRUNX1、shNFIX)相比,TF敲低的原代FLT3-ITD+ AML细胞(ITD-12)中差异表达基因log2FC RNA (CPM)的比较。
05
RUNX1是FLT3-ITD特异性基因表达程序建立的重要因子,参与细胞周期调控
他们集中研究了RUNX1模块,各种AML亚型,特别是核心结合因子AML,依赖于RUNX1的野生型拷贝的存在。他们首先使用邻近连接测定来确定检测 RUNX1CBFβi 完全解离的最佳时间点(图6A),该时间点为 8 小时,表明该复合物在细胞内相当稳定。用小分子 AI-10-91 (CBFβi)处理的原代细胞进行的 ChIP 实验证实了基因组中 RUNX1 的广泛缺失(图 6 A)。该抑制剂对 FLT3-ITD/NPM1 和 FLT3-ITD+ AML 细胞的活力和克隆形成能力具有深远影响,但对培养中的健康细胞没有影响(图 6 B)。CBFβ 抑制剂在 6 天后有效杀死了大多数细胞。此外,来自具有双重 RUNX1 突变 (RUNX1(2x)) 的患者的细胞对抑制剂没有反应,除非使用非常高的剂量,这再次证明抑制是通过 RUNX1 模块发挥作用的。
从基因组中敲除RUNX1不仅会导致开放染色质区域的缺失,还会导致开放染色质区域的增加和基因表达的变化(图 6 C)。RUNX1抑制改变了多个TF基因的表达(图6D),这表明除了CBFβi对细胞生长的影响外,GRN在处理后也发生了重组。他们从抑制剂处理后获得的开放染色质位点和缺失的位点构建了GRN(图6E-F)。与RUNX1和其他TF节点(如CEBP节点)的多个连接丢失,但获得了其他连接,如从AP-1家族和到AP-1家族的连接(图6E-F),这表明不仅与RUNX1的连接,而且与其他TF的连接也发生了改变。因此,为了结束这个循环,他们探究了CBFβi处理如何影响属于其他五个模块的基因(NFI、 AP-1、FOX、EGR、C/EBP)(图6G)。对处理后下调基因的分析(图6G)表明,RUNX1活性的抑制对其他模块中组织的基因产生了深远的影响,即使它们与RUNX1模块不重叠。
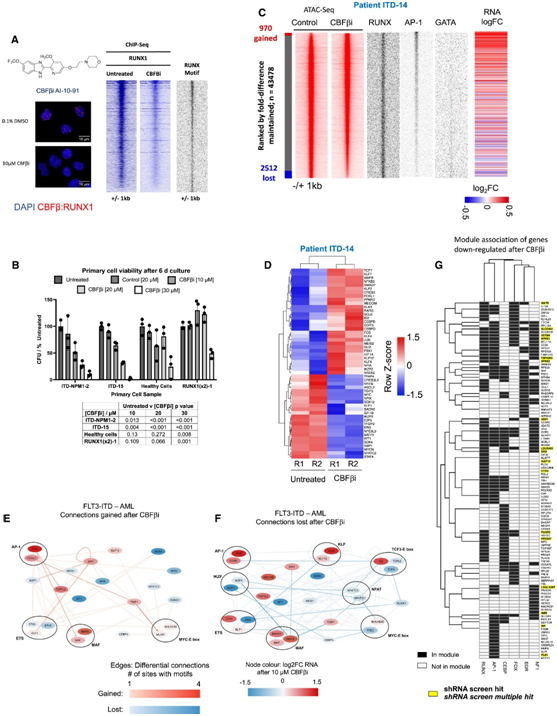
图6. RUNX1调控模块对于FLT3-ITD特异性基因表达至关重要。
(A) CBFβi 的结构以及经过和未经 10 μM CBFβi 处理的原代 FLT3-ITD+ AML 细胞 (ITD-14) 的邻近连接测定的代表性图像。(B) 对用浓度增加的 CBFβi 处理的指定原代细胞类型进行活力测定。(C) 使用和不使用 10 μM CBFβi 的原代 FLT3-ITD+ 患者细胞 (ITD-14) 的 ATAC-seq 分析(红色)密度图。(D) 使用和不使用 CBFβi 的原代 FLT3-ITD+ 患者细胞的转录因子基因表达的无监督聚类。(E-F) CBFβi 治疗前后 FLT3-ITD 特异性 GRN 中获得的和失去的连接。(G) 两名或两名以上接受 CBFβi 处理的患者的 RNA-seq 数据中的基因下调。
他们在存在和不存在 CBFβi 的情况下培养原代 FLT3-ITD+ AML 细胞,并进行单细胞转录组分析 (scRNA-seq) 。未经处理的培养物含有早期前体细胞以及不同分化阶段的骨髓细胞和红细胞的混合物(图7A)。抑制剂处理减少了早期前体细胞的数量,其中骨髓细胞是受影响最严重的细胞类型(图7B)。对抑制前后细胞周期特异性表达基因的分析显示,G1 期的阻断影响了所有细胞类型(图 7B)。对早期祖细胞中下调基因的检查揭示了细胞周期调节因子和核糖体基因的强烈下调(图7C),这与细胞周期阻断一致。同样在该实验中,细胞周期阻断之后是细胞死亡(通过活性染料测定来测量)。
靶向包含 AML 亚型特异性 GRN(例如 RUNX1)内高度连接节点的重要 TF 会对其他 TF 模块产生深远影响,从而使AML 细胞的 GRN重组,从而导致细胞-循环阻滞,最终导致细胞死亡(图7D-E)。
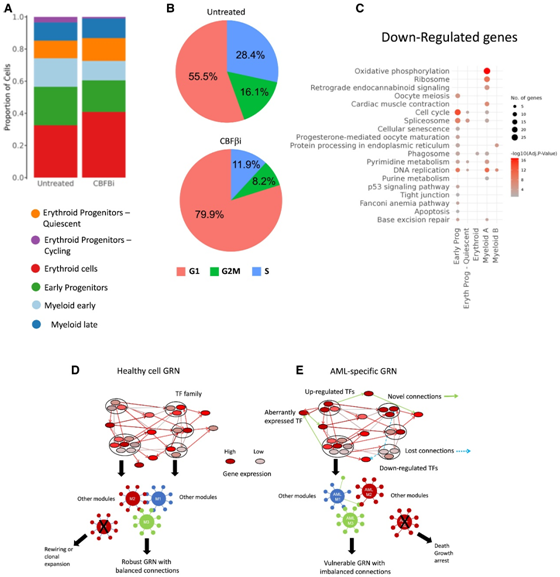
图7. RUNX1失活阻碍血液祖细胞的细胞周期进展。
(A) 条形图显示经过和未经 CBFβi 处理的群体中指定细胞类型的比例。(B) 饼图显示未(上图)和经过(下图)CBFβi 处理的指定细胞周期阶段的细胞比例。(C) CBFβi 治疗后基因下调的GO分析。(D-E) 模型描述了血液祖细胞中强大的健康 GRN与恶性细胞中发现的 GRN之间的差异。
+ + + + + + + + + + +
结 论
每种突变亚型都会发展出其特定的GRN,其中转录因子在多个基因模块内相互作用,其中许多基因模块本身就是转录因子基因。本项研究假设此类网络中高度连接的节点构成了 AML 维护的关键调节器。他们使用 FLT3-ITD 突变的 AML 作为模型来检验这一假设,并根据该分析进行 shRNA 筛选。本项研究表明,AML 特异性 GRN 可以预测 AML 增长所需的关键监管模块。此外,本项研究表明所有模块都高度关联并相互调节。通过 shRNA 和化学抑制对一个 (RUNX1) 模块的作用进行仔细的多组学分析表明,该转录因子及其靶基因稳定了 FLT3-ITD+ AML 的 GRN,并且其去除会导致 GRN 崩溃和细胞死亡。
+ + + + +



 English
English


