文献解读|Nat Commun(16.6):中性粒细胞活化和克隆性CAR-T再扩增支持细胞因子释放综合征在西他他烯治疗多发性骨髓瘤
✦ +
+
论文ID
原名:Neutrophil activation and clonal CAR-T re-expansion underpinning cytokine release syndrome during ciltacabtagene autoleucel therapy in multiple myeloma
译名:中性粒细胞活化和克隆性CAR-T再扩增支持细胞因子释放综合征在西他他烯治疗多发性骨髓瘤
期刊:Nature Communications
影响因子:16.6
发表时间:2024.01.08
DOI号:10.1038/s41467-023-44648-3
背 景
细胞因子释放综合征 (CRS) 是嵌合抗原受体重定向 T 细胞 (CAR-T) 疗法最常见的并发症。然而,过度的 CRS 会导致重要器官损伤,并常常使患者处于危险之中。因此,有必要深入了解 CRS 的作用机制,以正确管理严重的免疫反应。
实验设计
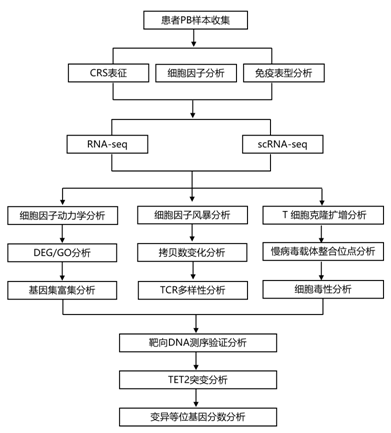
结 果
01
患者特征、临床反应和研究设计以及CRS 的表征
本项研究的样本来自26例接受Cilta-cel (Cilta-cel是一款针对BCMA抗原的双表位CAR-T产品)治疗的患者,其中26例患者的总有效率为88.5%,其中80.8%获得完全缓解(CR)。3年无进展生存期(PFS)为39.2%,5年为26.1%;3年总生存率为53.1%,5年总生存率为45.5%。研究者团队在给定时间点采集外周血(PB)样本。从PB中分离血清进行细胞因子谱分析。纯化的PB单个核细胞(PBMC)分配到三个实验队列(图1a)。
Cilta-cel 给药后 30 天内,所有患者均观察到 CRS,中位发病时间为 6 天(范围为 1~10 天)。65.4% 的病例最早出现发烧信号,平均最早出现 6 天。其余34.6%的患者在CRS爆发时,低血压、低氧血症或器官功能障碍早于发热出现。34.6%的患者患有1~2级CRS,65.4%患有3级或更严重(图 1b)。根据临床症状,调整CRS分级,CRS分级的变化与循环Cilta-cel的动力学量一致(图 1b-c)。随着CRS的进展,CAR-T的CD8:CD4比率逐渐升高,在第16~20天达到峰值(图 1d)。基于两种典型的 T 细胞免疫表型标记 CCR7 和 CD45RA,CRS 中的细胞毒性 CAR-T 富集效应记忆 (CCR7−CD45RA−) 和效应记忆 T 细胞重新表达 CD45RA (CCR7−CD45RA+),特别是在第10~12天(图1e)。
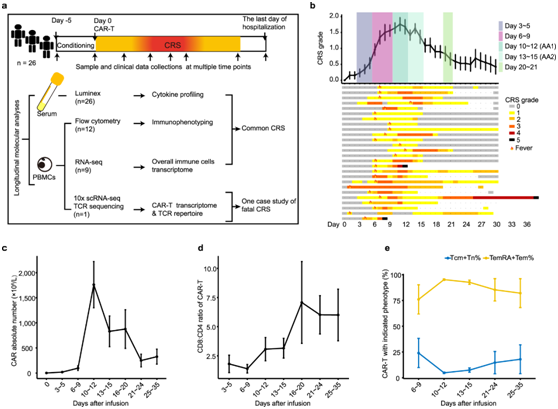
图1. CAR-T动力学的研究设计和动态变化概述。
(a) 实验设计概述,包括样本和临床数据收集、细胞因子分析、CAR-T 免疫表型、转录组测序和 TCR 谱分析。 (b) 图表(上)显示了所有 26 名患者在 Cilta-cel 输注后几天的 CRS 等级平均值。swimmer图(下)显示了输注后一个月内每位患者 CRS 严重程度的动力学。 (c)外周血中Cilta-cel的增殖。(d) 该图表显示了 CAR-T 的 CD8:CD4 比率。(e) 图表显示了外周血中 CAR-T 的免疫表型特征。
02
细胞因子谱的动态变化
为了深入了解CRS的发展情况,患者的临床表现将整个21天的炎症反应分为5个时段,包括基线(输注前)、潜伏期(第3~5天)、发热(第6~9天)、急性加重(第 10~15 天,AA)和解决期(第 20~21 天)。由于AA期间细胞因子分泌旺盛,他们收集了两次个体样本(第10~12天和第13~15天),分别表示为AA1和AA2。
与基线相比,炎症分子在发热后期明显上调,在急性加重期达到较高水平(图 2a)。一些研究充分的细胞因子,如IL-6、颗粒酶B、IL-10、G-CSF和CXCL10,在峰值时飙升了50~100倍,表明在第6天至第15天期间存在高度活跃的炎症反应(图 2b)。通过无监督聚类,他们确定了5个细胞因子聚类(CC),其中CC3、CC4和CC5与平均CRS分级呈正相关,而CC2则呈负相关(图2c)。值得注意的是,在与CRS严重程度呈正相关的细胞因子中,sIL-2Rα、sTNF RII(均属于CC4)和Granzyme B(属于CC5)的相关性最强(图2d)。
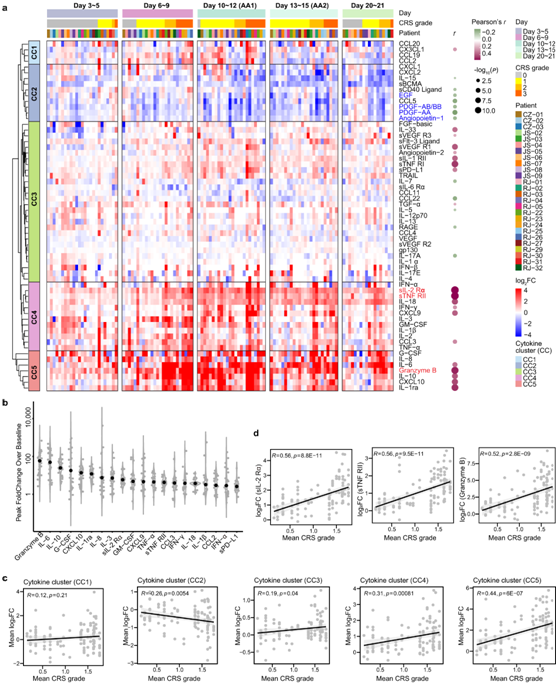
图2. 细胞因子的动态变化。
(a) 热图展示了 26 名患者在 CAR-T 治疗后不同时间段(X 轴)内 61 种细胞因子(Y轴)的动态变化。(b) 图中显示了排名前 20 名的每种细胞因子的中位峰值 FC。 (c-d) 散点图显示平均 CRS 等级与细胞因子平均 log2 FC 变化之间的相关性,以及平均 CRS 等级与细胞因子水平之间的相关性。
为了分析细胞因子表达与CRS水平的相关性,他们采用CONNECTOR计算方法将26例患者分为两组:组1和组2(图3a-b)。进一步分析细胞因子的平均log2FC,发现Group1与Group2具有不同的细胞因子动力学模式(图3c-d)。组1患者CC3、CC4、CC5细胞因子及整体峰值水平均高于组2。基于此分组,他们可以清楚地区分治疗过程中CRS评分的时间变化。第1组患者CRS较重,在第12天左右达到高峰;第2组患者CRS较轻,在第9天左右达到高峰(图3e)。无论个体差异如何,细胞因子分泌的时间动态与CRS分级高度一致。
这些结果表明,细胞因子产生的时间与临床症状一致,揭示了car -t肿瘤接触后高度规律性的全身炎症反应。
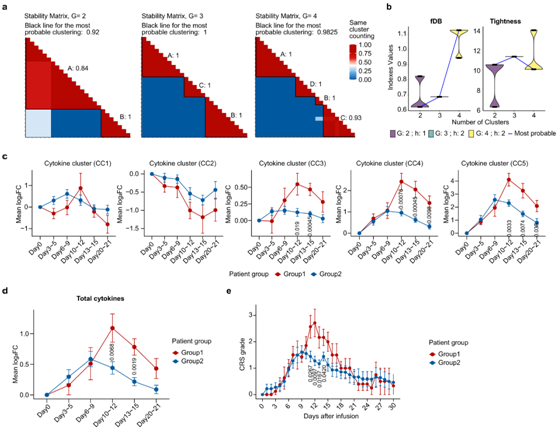
图3. CONNECTOR显示细胞因子表达与CRS水平之间的动态相关性。
(a) 参数G的稳定性矩阵。(b) 针对每次运行和不同数量的聚类 G 计算的 fDB(函数 Davies-Bouldin)小提琴图(左)。每次运行和不同数量的聚类 G 计算的总紧密度 (T) 的小提琴图(右)。(c-d)不同观察时间各聚类中细胞因子的平均 log2FC 变化与总细胞因子之间的动态变化。(e)该图显示了Cilta-cel输注后两组CRS分级的动态变化。
03
免疫细胞介导的细胞因子释放信号调节
为了探索负责细胞因子调节的上游信号传导,他们对不同时期的 PBMC 进行转录组分析(RNA-seq)。通过三种算法总共鉴定了10917个差异表达基因(DEG), 使用软聚类方法将其分配到表达趋势一致的八个聚类中(图 4a)。在早期阶段(第3-9天)激活的信号传导聚类2和7,在中性粒细胞、T淋巴细胞、血小板、单核细胞/巨噬细胞活化、细胞因子信号传导上调以及过度氧化应激等多种生物过程中显著富集(图4-b)。此外,B细胞相关基因在聚类6中显著富集,并且随着淋巴细胞减少和Cilta-cel治疗,基因转录水平逐渐下调。此外,相关分析显示,以T细胞活化和细胞周期为特征的聚类1和聚类5与CRS严重程度呈正相关,聚类7与CRS严重程度呈负相关。
为了更好地了解免疫细胞激活级联的时间,他们进行了基因集富集分析(GSEA),将每个时间点与基线进行比较。有趣的是,中性粒细胞早在第3~5天(潜伏期)反应最强,而巨噬细胞和T细胞的免疫反应从潜伏期开始,并在第6~9天的发热期变得强烈(图4c),表明中性粒细胞在启动炎症反应中起着突出的先锋作用,而巨噬细胞和T淋巴细胞更多地参与随后的细胞因子级联反应的中心。随着免疫细胞的应答,关键的炎症信号通路TNF、IL-6/JAK- stat3、JAK/STAT、IL-2/STAT5和补体/凝血级联反应相应显著上调(图4c)。
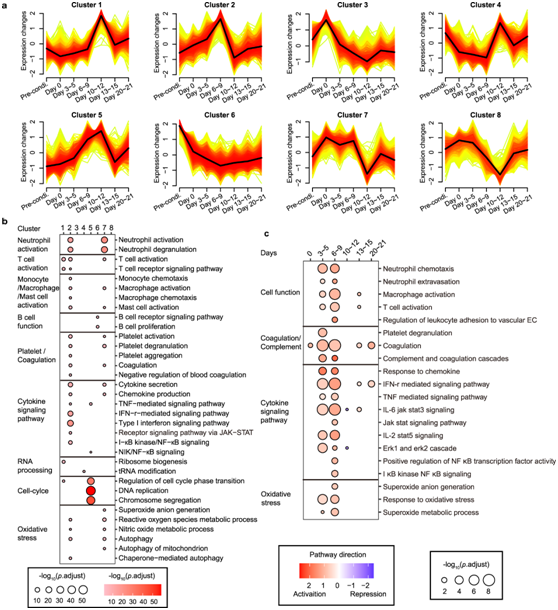
图4. 通过 RNA 测序涉及 CRS 的信号转导。
(a) 通过转录组测序生成的 DEG 的聚类。 (b) GO分析。(c) 基因集富集分析 (GSEA) 。
04
三名患者的 CAR-T 重新扩增
大多数患者经历过一次 CAR-T 扩增,但 3 例(RJ-25、27 和 31)在第一个 CAR-T 峰值后出现了 Cilta-cel 的重新扩增。就RJ-31而言,该患者在第二次CAR-T扩增期间因致命的CRS而死于肝衰竭。为了深入了解RJ-31中CRS超标的根源,他们对这一特殊案例进行了详细分析。
RJ-31 是一名 61 岁男性,在第 9 天出现首次严重 CRS (1st _CRS),并在给予托珠单抗后很快缓解。肝损伤(3级)和凝血功能障碍(2级)的不良事件(AE)在初次免疫反应期间是短暂的,并在第12天缓解(图 5a)。第二次CRS (2nd_CRS)出现在第20天,伴有进行性黄疸(图5a),持续18天,直到患者死于肝功能衰竭和肝性脑病,尽管在初始阶段没有发烧、低血压。血流中的Cilta-cel分别在第11天和第26~28天出现两个峰值,第二次发作时CD8+与CD4+循环CAR-T的比值明显高于第1次发作时(图 5b)。细胞因子分析证实,RJ-31连续发生两次严重炎症风暴。1st_CRS主要表现为颗粒酶B、IL-6、IL-10的短暂性升高,而2nd_CRS则表现为更多细胞因子的持续和强劲升高,如IL-8、IFN-γ、CX3CL1、sIL-1 RII、sVEGF R1、Ang-2(图 5c)。
与第8天的普通信号激活相比,GSEA途径富集在第22天表现出更强的T细胞免疫活性、血小板脱颗粒和包括Erk、IKK/NF-κB、toll样受体途径和氧化应激、线粒体损伤在内的各种炎症信号的强度,同时伴有高活性的糖酵解、丙酮酸代谢和脂肪酸代谢过程(图5d)。从第26天开始,细胞因子转录信号的广泛下调可能是由皮质类固醇干预引起的(图5d)。第38天行肝活检,肝脏中Cilta-cel的转基因拷贝数比第38天的配对PB高9.5倍(图5e)。
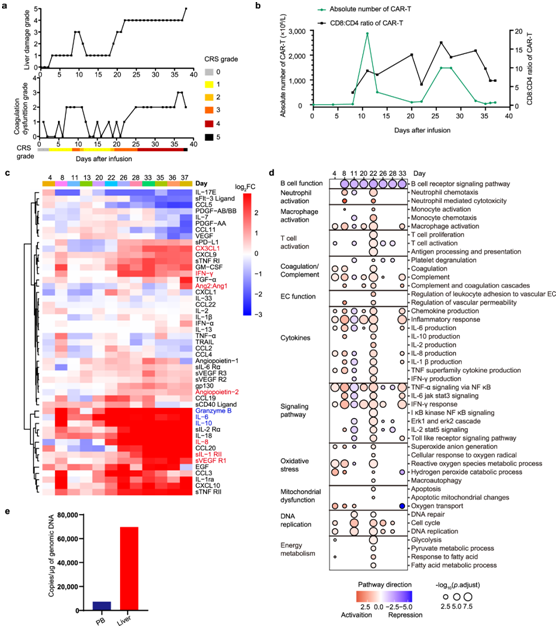
图5. 第一次 CRS 后 RJ-31 中的致命细胞因子风暴。
(a) 在 RJ-31 的双 CRS 过程中,根据肝损伤和凝血功能障碍对不良事件 (AE) 进行分级。 (b) RJ-31 中循环 Cilta-cel 的动力学。(c) 细胞因子概况如相对于基线的细胞因子水平的log 2 FC所示。 (d) 在指定时间段进行 RNA 测序的 GSEA。(e) 第 38 天通过 qPCR 检测肝脏和外周血 (PB) 中外源转基因的 DNA 拷贝数。
05
在RJ-31的2nd_CRS上发现了Cilta-cel的优势克隆
出乎意料的是,RJ-31中PBMCs的RNA-seq发现TCR库明显偏向于TRAV13-1~J20/TRBV12-5~J2-1的优势,在第28天占整个TCR库的89%(图6a)。TCR多样性(逆辛普森指数)和克隆性(克隆性指数)表明,RJ-31自第22天起,TCR多样性显著降低,T细胞克隆性显著增加(图6b)。其他病例均表现出短暂的、轻微的TCR多样性和克隆性变化,随后迅速恢复到原始状态(图6b),与前面描述的常见结果相似。慢病毒载体整合位点分析进一步发现,在ETS1基因下游(近14 kbp)存在高丰度的单等位基因整合克隆,且未影响其转录,定量PCR证实了这一点(图6c),排除了Cilta-cel优势建立和慢病毒插入的关联。
为了从功能上评估优势克隆的特性,在第2nd_CRS(第28天)收集纯化的car-阳性细胞,并在第1st_CRS(第11天)收集匹配的对照,进行单细胞RNA转录组分析(scRNA-seq)。总的来说,CAR-T在2nd_CRS中由细胞毒性CD8+效应物富集(图6d)。作为可比性对照,他们选择了1st_CRS中的一个CAR-T小显性克隆TRAV19~J34/TRBV4-1~J2-7(简称Major_A)与2nd_CRS中鉴定73%的TRAV13-1~J20/TRBV12-5~J2-1(简称Major_B)进行比较(图6e)。结果表明,无论裂解细胞成分如何,Major_B都具有较强的细胞毒能力和较高的毒性评分(图6f-g)。此外,Major_B中显著的deg参与toll样受体信号通路、线粒体凋亡改变和钙铁相关过程(图6h),这与PBMCR的NA-seq结果一致。
有趣的是,PBMC 转录组测序显示,从第 20 天起, TET2基因出现杂合突变。这一新发现的异常现象通过靶向DNA测序进行了验证,结果证明TET2的变异(C>T)位于Chr4:106197167基因组位点,导致TET2蛋白催化结构域(简称为Chr4:106197167)的早期翻译终止(称为TET2mut)(图6i)。TET2突变是克隆造血的起始事件,TET2蛋白功能障碍导致免疫炎症加剧,特别是以IL-6升高为特征。为了准确确定在2nd_CRS之前是否存在低丰度的TET2mut,他们进行了ddPCR,发现在预处理时pmcs中确实存在一个小的TET2mut克隆,并且主要集中在CD3阳性宿主T细胞中(图6j)。这种变异在第11天的CAR-T中也能检测到,变异等位基因分数(VAF)低,为0.40%,而在第28天,通过ddPCR检测到VAF较高,为38.07%(图6j)。
总之,病毒激活、罕见的TET2体细胞突变以及RJ-31肝脏中的血浆抗原刺激可能共同促成了Cilta-cel的克隆扩增,从而引发第二次严重的CRS,并导致过度炎症和对肝功能的致命损害。
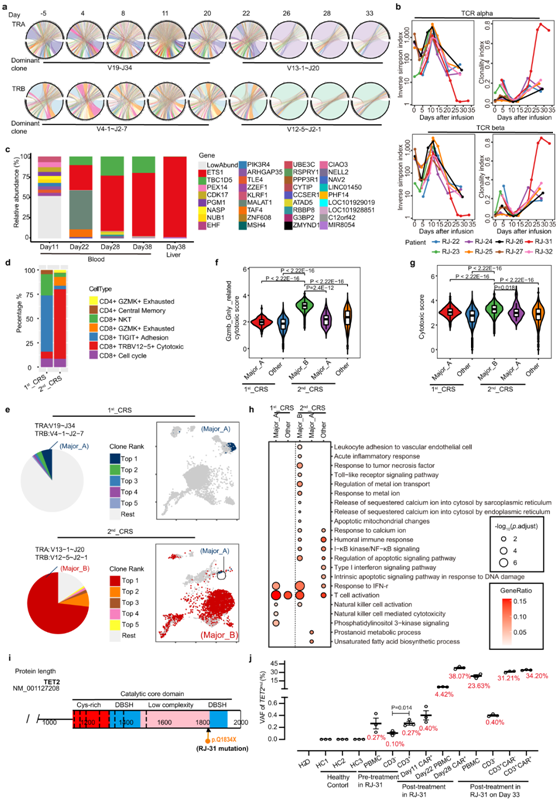
图6. RJ-31 中显性 CAR-T 克隆的鉴定。
(a) 圆形图显示 TCR α 链 (TRA) 和 β 链 (TRB) 的遗传 VDJ 重排类型。(b) Cilta-cel 治疗后 8 名患者的 TCR 多样性(逆辛普森指数)和 T 细胞克隆扩增(克隆性指数)。(c) 整合位点的丰度标志着RJ-31血液和肝脏中的CAR-T克隆。 (d) 分别在第一次和第二次 CRS 攻击时纯化的 CAR-T 群体中 CD4 或 CD8 亚型的比例。 (e) 饼图显示了纯化的 CAR-T 群体中排名前 5 的克隆的频率。(f-g) 小提琴图显示了两个 CRS 中分别源自 CAR-T 的两个优势克隆的细胞毒性免疫表型。 (h)GO分析 (i) TET2 催化结构域图。(j) RJ31 中TET2 的变异等位基因分数 (VAF) 的统计图.
+ + + + + + + + + + +
结 论
本项研究发现T 淋巴细胞和单核细胞/巨噬细胞是CRS 中主要的总体细胞因子来源,且中性粒细胞激活在严重症状出现之前更早达到峰值。细胞内,以JAK/STAT通路为主的信号激活发生在细胞因子级联之前,并表现出规律的动力学变化。CRS 的严重程度可以通过时间细胞因子分泌特征进行预测。值得注意的是,在三名患者中发现了 CAR-T 重新扩增,其中包括一例致命病例,其特征是体细胞TET2突变、克隆扩增的细胞毒性 CAR-T、细胞因子谱扩大和不可逆的肝毒性。总之,本项研究结果表明,在明显的 CRS 之前存在一个具有明显免疫学变化的潜伏期,为 CRS 治疗干预提供了最佳窗口和潜在目标,并且 CAR-T 重新扩展需要密切的临床关注和实验室研究,以减轻致命风险。
+ + + + +



 English
English


