文献解读|Cell Rep(8.8):单核多组学分析鉴定与心外膜冠状动脉相关的人心脏淋巴内皮细胞
✦ +
+
论文ID
原名:Single-nuclei multiomic analyses identify human cardiac lymphatic endothelial cells associated with coronary arteries in the epicardium
译名:单核多组学分析鉴定与心外膜冠状动脉相关的人心脏淋巴内皮细胞
期刊:Cell Reports
影响因子:8.8
发表时间:2023.09.12
DOI号:10.1016/j.celrep.2023.113106
背 景
心脏淋巴管在心脏的液体稳态、炎症、疾病和再生中发挥重要作用。人类胎儿心脏中正在发育的心脏淋巴管与冠状动脉密切相关,类似于斑马鱼心脏中的冠状动脉(CA)。最近的研究揭示了心脏淋巴管在促进心脏病理不同方面的有益作用,包括心脏水肿、肥厚性心肌病和瘢痕形成。目前尚不清楚成人心脏病是否由心脏淋巴发育缺陷导致,以及心脏淋巴血管的差异是否可能导致心肌梗死后的不同反应。
实验设计

结 果
01
单细胞核多组学(snMultiomic)分析揭示了心脏内皮细胞的亚群
为了确定人类心脏发育中心脏淋巴管的潜在祖细胞,研究者团队检测了捐赠用于研究的胎儿心脏样本。两个主要的CA,包括右CA(RCA)和旋支动脉(CXA),在受孕后第9周(9PCW)之前发育。ACTA2+血管平滑肌细胞(VSMC)的募集是渐进的,并在胎儿期与血管丛扩张持续进行。此阶段的 CA 已经获得了其动脉特性,如 NOTCH1 活性呈阳性的 EC(NOTCH1 胞内结构域 [N1ICD]),并由 VSMC 包围(图 1 A)。
他们发现 CA 中 EC 的动脉特性与人类心脏中血流的时间-空间起始相关(图 1 A)。在 10PCW 时,RCA 和 CXA 在近端和远端节段均显示明显的 ACTA2染色,而静脉几乎看不到 ACTA2 染色(图 1 B)。PROX1是一种已知的淋巴分化所需的主同源盒转录因子,在人类淋巴管内皮细胞 (LEC) 中表达,在10PCW时,沿着CA的主要分支并获得管状结构(图1C)。心室的外层更广泛地由这些与 11PCW 的 CA 相关的淋巴管覆盖(图 1 C),他们也观察到与一些冠状静脉 (CV) 的关联。
接下来,他们使用 snMultiomic 方法来确定人类胎儿心脏 EC 的转录组学和染色质景观,整合了从相同细胞收集的单细胞核转录组分析(snRNA-seq) 和单细胞转座酶-染色质可及性测序 (snATAC-seq) 的数据,可以提高细胞聚类的分辨率。对心脏外层进行了显微切割,以富集心脏淋巴管所在的心外膜。(图 1 D)。10PCW snRNA-seq 的均匀流形近似和投影 (UMAP) 显示人类胎儿心脏中有 26 个细胞聚类(图 1 E)。他们在聚类9、10、14、16、17、21和25中鉴定出了与内皮相关的聚类,包括所有的动脉、静脉和淋巴内皮(图 1 F)。聚类 0、2 和 5 显示出相似的转录组谱,以 MYH6 和 EPHA4 标记为特征。相反,聚类 3 心肌细胞 (CM) 的特征是 MYH7 和 PRDM16 标记,这表明心肌细胞的特定细胞群可能专门位于心室皮质层。
对 snRNA-seq(图 1 E)和 snATAC-seq(图 1 F)多模态整合进行的“加权最近邻”(WNN)分析增强了所有聚类在转录和表观基因组水平上的分辨率(图 1G)。snRNA-seq结果显示, LEC 和巨噬细胞聚类之间的基因表达谱有很大不同(图1E)。
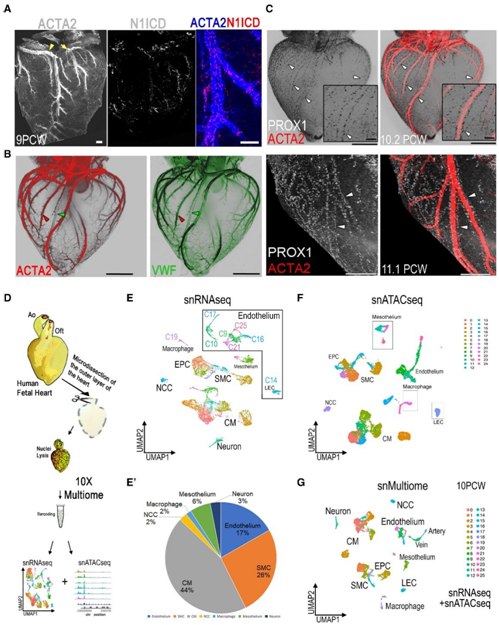
图1. 主要与冠状动脉相关的人体心脏淋巴管的snMultiomic分析。
(A) 9PCW 人胎心脏的整体背面视图,进行 ACTA2 和 N1ICD 免疫染色。(B -C) 10.2PCW和11PCW 人胎儿心脏背侧整片光片图像染色为平滑肌标记物ACTA2(红色)、内皮细胞标记物VWF(绿色)和表达LEC的PROX1(灰色)。(D)实验流程示意图。(E) 10PCW 心脏所有细胞的 snRNA-seq 数据的 UMAP。(E') 饼图显示 snMultiome 分析中所有细胞聚类的百分比。(F) 染色质可及性的 UMAP 标记为 snATAC-seq。(G) 使用 WNN 计算基因表达和染色质可及性的 UMAP。
02
人类心脏 LEC 与表达 VEGFC 的冠状动脉和心外膜细胞相关
他们发现FLT4基因表达在聚类14中最高(图2A-B)。PROX1、PDPN、LYVE1和MRC1显示出更广泛的表达模式,表明它们在此阶段的表达不具有特异性(图 2A-B)。与LEC 的聚类14 中淋巴标记物的内皮特异性表达相反(图 2B),PDPN在间皮(聚类7 和 23)中显示出高表达,而MRC1和LYVE1均共表达位于巨噬细胞聚类 19 中(图 2A -B)。GO分析揭示了 VEGF 信号传导和透明质酸结合活性(图 2C-D)。PROX1 标记 LEC 在心外膜中形成管状结构可能是 VEGF 通路激活的结果(图 2D)。此外,他们验证了 LEC 中 KDR/VEGFR2 的表达,LEC 是沿着心外膜中的主要 CA 延伸而形成的(图 2E-E')。
N1ICD、PROX1 和 ACTA2 的免疫染色进一步证实了 11PCW 时 LEC 与人心脏上的 CA 的优先关联(图 2 F)。VEGFC 的整体免疫染色(图 2G-G')显示 CA 周围有高表达。对 VEGFC 基因座的分析,发现只在动脉聚类中存在增强子特异性激活的现象,而在内皮细胞或心外膜细胞中不存在该现象。(图 2 H)。这与他们通过特征图在计算机中预测的动脉 EC 中的 VEGFC 表达模式一致(图 2 I)。除了动脉 EC 之外,在心外膜和 SMC 聚类中也发现 VEGFC 表达(图 2 I)。
在斑马鱼胚胎中,Cxcl12 趋化因子向 LEC 中表达的 Cxcr4 受体发出信号,并在躯干淋巴管发育过程中指导动脉结合。然而,他们仅在动脉内皮细胞(EC) 中发现 CXCR4 表达,而在 LEC 中未发现(图 2 I),这与斑马鱼心脏中心脏淋巴发育的发现一致。
这些数据表明,VEGFC 是 CA 内皮和心外膜衍生细胞中发现的参与淋巴管生成的已知因子,其高表达揭示了新生心脏淋巴管与人胎儿心脏中 CA 的关联。
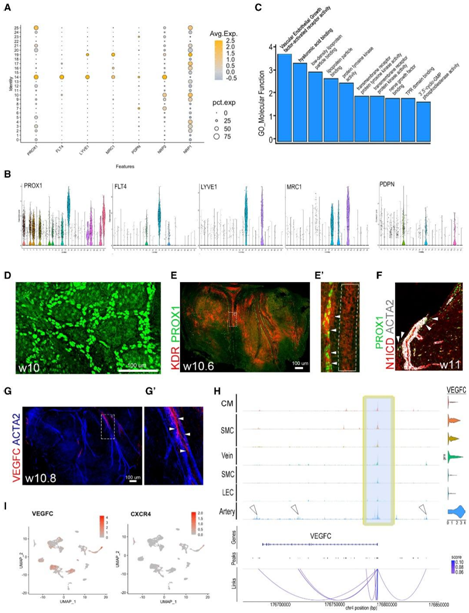
图2. 人心脏LEC与表达VEGFC的冠状动脉和心外膜细胞相关。
(A) 点图显示PROX1、FLT4、LYVE1、MRC1、PDPN、NRP2和NRP1。(B) 小提琴图显示了数据集中PROX1、FLT4、LYVE1、MRC1和PDPN的分布。(C) 对聚类 14 的分子功能进行 GO 分析。(D) 人心室背侧 PROX1 的免疫染色显示管状结构形成。(E) 10PCW 人胎心脏的整体背视图,进行 PROX1(绿色)和 KDR(红色)免疫染色(下)。(E')(E)中的放大区域。(F) 11PCW 人心脏横切面上 N1ICD(红色)、PROX1(绿色)和 ACTA2(白色)的免疫组织化学分析。(G) 10PCW 人胎心脏的整体背面视图,进行 VEGFC(红色)和 ACTA2(蓝色)免疫染色。(G') 放大视图表示检测到 VEGFC 的区域。
03
染色质可及性分析鉴定了心脏 LEC 中 ETS 转录因子的富集结合基序
为了定义人类胎儿心脏中心脏 LEC 的基因表达特征并确定重要的调控途径,他们分析了 LEC 聚类中的前 500 个差异表达基因(DEG)。对转录因子 (TF) 扰动和 DEG 表达数据进行GO分析,结果显示早期淋巴内皮分化中超过 80 个红细胞转化特异性(ETS)变体2 (ETV2) 的下游靶标发生激活(图 3 A)。有趣的是,对可及性和基因表达改变的区域进行基序富集分析还鉴定了 ETV2 TF 和其他 ETV TF、ETS1 和 ETS2(图 3B)。
ETS 家族在胚胎造血、血管生成和血管生成中发挥重要作用。ETV2 是一种高度进化保守的 ETS TF,对于血管分化至关重要,可以通过直接促进主静脉内flt4 / vegfr3的表达来调节斑马鱼的淋巴管生成。聚类 14 中 ETS1、ETS2 和 ETV2 TF 基序富集的存在表明该群体具有类似于静脉内皮的潜在祖细胞性质。在聚类 14 中发现的 ETV2 结合基序富集在 EC 和巨噬细胞组中也同时很高(图 3 C)。通过进行 TF 印迹进一步检测了 ETV2 结合基序位点附近 Tn5 插入整合过程的富集,与间皮细胞组相比,LEC 和巨噬细胞组上游和下游 200 bp 中结合基序侧翼的整合过程的富集程度更高(图3C ')。
基序富集分析揭示了独特的染色质谱(图 3C-3C'),与巨噬细胞和间皮细胞不同,这表明它们具有潜在不同的基因组调控。PROX1基因组位点的伪批量 ATAC-seq 分析显示聚类 14 和其他 EC 聚类中存在开放染色质状态,但心肌细胞聚类中没有(图 3 E)。PROX1 和 MEF2 的联合免疫染色验证了 PROX1 在心肌细胞中的广泛表达,并表明只有较高水平的 PROX1(LEC 中发现的增强子峰值)才能诱导特定的淋巴分化级联(图 3E-F)。
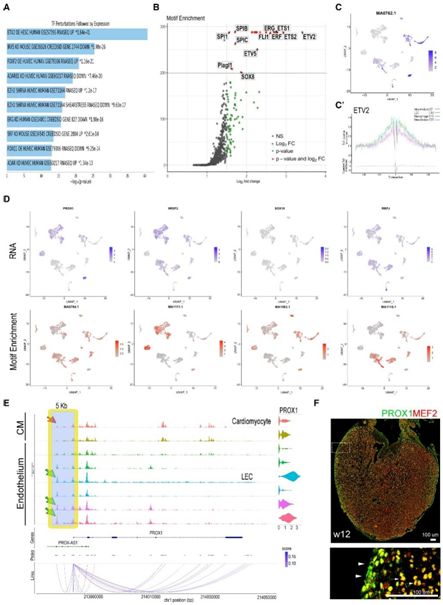
图3. 人心脏 LEC 的染色质分析显示 ETS 转录因子的丰富结合基序。
(A) TF 扰动以及 LEC 聚类中前 500 个 DEG 的表达(GO 分析)预测早期 ETV2 激活。(B) 火山图显示 LEC 聚类 14 中基序的富集。(C) 特征图显示 ETV2 的基序富集。(C') 以预测的 ETV2 结合基序为中心的 Tn5 插入整个基因组的概率。(D) 说明PROX1、NR2F2、SOX18和RBPJ的 WNN 分析的 RNA 表达的特征图(上) ,以及显示 PROX1、NR2F2、SOX18 和 RBPJ 的基序富集的特征图(下)。(E) 来自多组的选定聚类的 PROX1 基因座的基因组可及性的伪批量,以及峰的可及性和基因的 RNA 表达之间的相关系数,显示 PROX1 基因的 5 kb 增强子和启动子之间呈正相关。(F)免疫组织化学分析。
04
PROX1、RELN 和 ETV 结合基序定义了人类心脏 LEC
接下来,他们将 EC 分为 7 个亚聚类(图 4 A -B)。亚聚类2显示PROX1、NRP2、RELN、STAB2、STON2、VAV3和CD36的基因表达模式高度相似,因此定义了一个真正的心脏LEC群体,而ETV2的表达非常有限(图4C)。此外,他们使用针对RELN分泌形式的抗体进行免疫染色,在CA周围检测到高水平的可溶性RELN(图4D-D')。同样,他们发现 RELN 主要在心外膜中的 PROX1+ LEC 核周围表达(图 4 E)。这些结果验证了本研究的测序数据,并表明这种淋巴管分泌素在进化上可能具有保守的作用。
Spearman 相关分析揭示了 PROX1 和 ETV2 的 RNA 水平之间以及 NR2F2 和 ETV2 的结合基序之间存在显著相关性(图 4F)。LEC 的亚聚类分析进一步促进了 PROX1 和 FLT4/VEGFR3 不同表达水平的检测(图4G),这一结果表明 LEC 是异质的。
他们假设 LEC 的异质性可能取决于其他 TF,在典型 LEC 分化级联的上游发挥作用。在LEC亚聚类的分析中发现ETV TF(ETV1、ETV2、ETV4、ETV5)或其他ETS TF与PROX1、NR2F2和RBPJ之间的表达水平相反的趋势,表明这些因素之间可能存在拮抗关系(图 4H)。
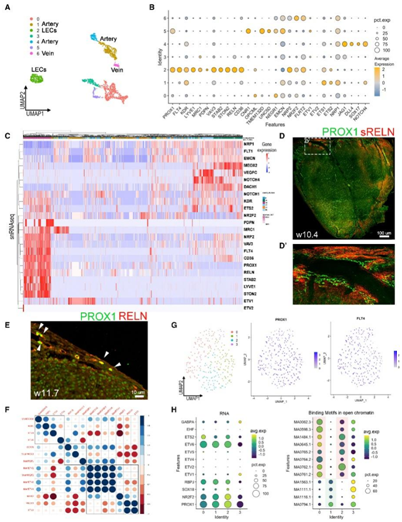
图4. 在人类胎儿心脏中鉴定出的真正的心脏 LEC群。
(A) 由细胞数据集的 EC 亚聚类生成的 UMAP。(B) 点图显示表达 EC 聚类和淋巴标志物中选定基因的细胞的表达水平和百分比。(C) 从 EC 聚类生成的热图显示了 snRNA-seq 的基因表达和定义真正淋巴聚类的基因。(D) 10PCW 人胎心脏的整体背视图 z 投影,经过 PROX1(绿色)和分泌形式的 RELN(蓝色)和 ETV2(红色)免疫染色。(D')(D)中虚线框中区域的放大图。(E)免疫组织化学分析。(F) 选定 TF 的平均 RNA 表达和内皮细胞和淋巴细胞开放染色质中结合基序存在的 Spearman 相关图。(G) 通过对图 1G (左)中 snMultiome 聚类 14 的 LEC 进行子集群而生成的 UMAP 。(H) 点图说明 RNA(左)和结合基序(右)。
05
11PCW 的单细胞核多组学分析显示结果与 10PCW 一致
为了确定 11PCW 是否进一步分化心脏 LEC,他们使用相同的策略进行了单细胞核多组学分析,发现 11PCW 的聚类数和细胞数组成与 10PCW 的数据非常相似(图 5 A-5C)。与 10PCW 数据集一样,FLT4表达仅限于聚类 12(图 5 C),而PROX1、PDPN、LYVE1和MRC1显示更广泛的表达(图 5 C)。他们还检测到淋巴聚类 12 中 ETV2 和其他 ETS TF 的基序富集(图 5D-G)。这些数据表明,11PCW 时心脏 LEC 的细胞状态与 10PCW 时的细胞非常相似,并且它们的分化尚未发生显著进展(图5 H)。

图5. 11PCW的snMultiomic分析。
(A) 11PCW 心脏所有细胞的 snRNA-seq 数据的 UMAP,显示多个内皮聚类。(B) 染色质可及性的 UMAP 在 11PCW 标记为 snATAC-seq。(C) 使用 WNN 计算基因表达和染色质可及性的 UMAP,并标记为 snMultiome。(D) 小提琴图显示11PCW 数据集中的PROX1、FLT4、LYVE1、MRC1和PDPN的分布。(E) 基序富集分析显示 11PCW 的 LEC 聚类中前 6 个位置权重矩阵 (PWM) 的富集。(F) 火山图显示 LEC 聚类中基序的富集。(G) 由 11PCW 数据集的 EC 亚群生成的 UMAP。(H) 点图描绘了表达 EC 聚类和淋巴标志物中选定基因的细胞的表达水平和百分比。
+ + + + + + + + + + +
结 论
本项研究对人类胎儿心脏的单细胞核多组学分析揭示了心脏内皮的可塑性和异质性,发现VEGFC在动脉内皮细胞和心外膜衍生细胞中高表达,为心脏淋巴管发育的动脉关联提供了分子基础。使用细胞类型特异性综合分析,本研究鉴定了一组由 PROX1 和淋巴管分泌 RELN 标记的心脏淋巴内皮细胞,并且富含ETV转录因子的结合基序。本项研究报告了人类心脏淋巴管的体内分子特征,并为了解胎儿心脏发育提供了新的理论依据。
+ + + + +



 English
English


