文献解读|J IMMUNOTHER CANCER(13.751):通过高通量单细胞测序从肿瘤中直接鉴定新生抗原特异性T细胞受体
✦ +
+
论文ID
原名:Direct identification of neoantigen- specific TCRs from tumor specimens by high- throughput single- cell sequencing
译名:通过高通量单细胞测序从肿瘤中直接鉴定新生抗原特异性T细胞受体
期刊:Journal for ImmunoTherapy of Cancer
IF:13.751
发表时间:2021.7.16
DOI:10.1136/ jitc-2021-002595
背 景
目前的免疫检查点抑制剂、CAR-T疗法均证明癌症免疫疗法对特定类型的癌症患者有效。而这些免疫策略的机制研究都表明有效的癌症免疫治疗与新生抗原反应性T细胞的激活密切相关。因此,研究并适当改造新生抗原反应性T细胞可能会给免疫治疗无应答患者带来新的转机。因此,该研究团队建立临床试验(NCT03412877),从癌症患者切除的肿瘤中分选新生抗原特异性T细胞受体(TCRs),随后转导的自体外周血T细胞,最终进行回输治疗。
使用这种方法需要解决的技术难题就是鉴定获得的新生抗原特异性TCRs的能力。由于TCR具有极高的多样性和复杂程度,多达三分之一的成熟T细胞还可能表达两个功能TCRα链,传统的T细胞克隆和Sanger测序人工成本高、耗时长,技术难度大。此外,用于治疗的TCRα和β链必须完全正确配对,以减少脱靶效应。因此,该研究旨在开发一种更加高效、准确的方法,直接从肿瘤标本中分离新生抗原特异性TCRs。
该研究使用illumina NextSeq 550测序系统,该系统更加快速、简约和经济,能快速、完整实现外显子组和全基因组测序。单细胞测序使用10X Genomics Chromium Controller获得TCR组库信息,并从测序数据中直接拼接TCR全长。
实验设计
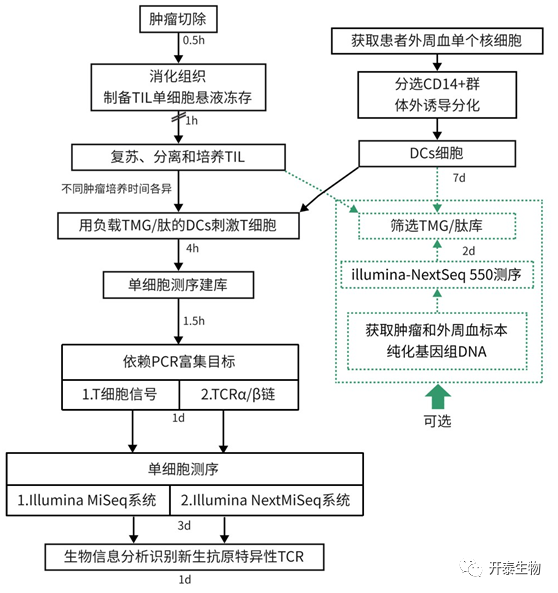
结 果
01

对于既往研究进行方法学改进
本研究开发了从肿瘤标本中直接识别新生抗原特异性TCRs的新方法。之前的方法:(1)肿瘤组织切小块,在较高浓度IL-2的培养基中培养约4周,以扩增肿瘤浸润淋巴细胞(Tumor infiltrating lymphocytes,TILs)的数量;(2)进行了大规模筛选,以确定新生抗原特异性的TIL和相应的新生抗原;(3)基于阳性筛选结果,用负载新生抗原的树突状细胞(Dendritic cells,DCs)特异性刺激对应TILs,然后进行低通量的单细胞全转录组分析;(4)从单细胞全转录组测序数据中分离出TCR部分序列。
与之前的方法相比,本研究改进了以下关键步骤:(1)从肿瘤标本中直接分离TILs;(2)为降低单细胞测序相关的成本,先进行了新生抗原特异性筛选,以减少用于后续分析的新生抗数量;(3)用负载新生抗原的DCs刺激TILs,并进行高通量单细胞测序分析;(4)为了提高敏感性,富集目的T细胞后进行单细胞测序。
02

转移性黑色素瘤患者标本中识别新生抗原特异性TCRs
切除晚期黑色素瘤患者体内的转移瘤制备TILs细胞悬液,并按方案培养。负载给DCs的新生抗原肽为64种非同义突变,通过测量IFN-γ初步筛选阳性的新生抗原肽。基于初筛阳性结果,对特异性T细胞进行单细胞测序,同时获得IFN-γ和IL-2的表达水平,以及TCR序列。如图1所示黑色素瘤1号患者,经抗原肽刺激后,共有26个单细胞表达高水平IFN-γ。进一步分析单细胞测序数据,从这些IFN-γ+单细胞中识别出6种不同的TCRs(图1)。
为了鉴定这些TCRs的特异性,需要合成全长TCRs,然后将其转导到患者外周血中分离的自体T细胞中。TCR转导T细胞与含有14个25mer突变肽的自体DC共培养,通过IFN-γ ELISA检测,所有6个TCR都无法识别野生型抗原肽,但是可以识别纯化的突变肽。
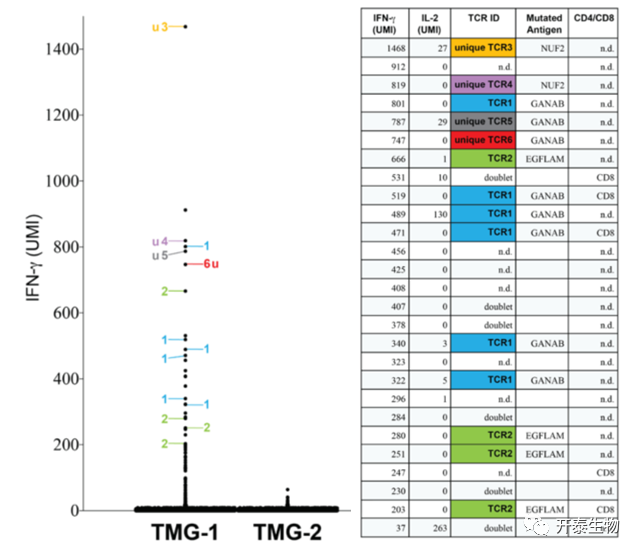
图1 从黑色素转移癌瘤患者切除的转移瘤中分离新抗原特异性TCRs
03

转移性结直肠患者肿瘤标本中分离新生抗原特异性TCRs
切除转移性结直肠癌患者的转移瘤,将肿瘤标本分离成单细胞悬液并冷冻保存。由于从标本中测序得到的非同义突变较少,没有初筛肽库阳性的T细胞。分选CD4+PD-1+和CD8+PD-1+ T细胞群,使用相同的方法学与负载新生抗原肽的DCs共培养后进行单细胞测序。转移性结直肠癌1号患者TILs经过不同新生抗原肽库刺激后,表现出不同程度IFN-γ分泌,并且有一个T细胞刺激后高水平表达IL-2。
根据单细胞测序结果,共获得4个共有的TCR和36个独特的TCR,将其中全部共有TCR和前7个独特TCR合成全长检测对于肽段的反应性,检测的所有TCR均表现出对突变肽具有更高的反应性,而对野生型基本无反应性(图2)。
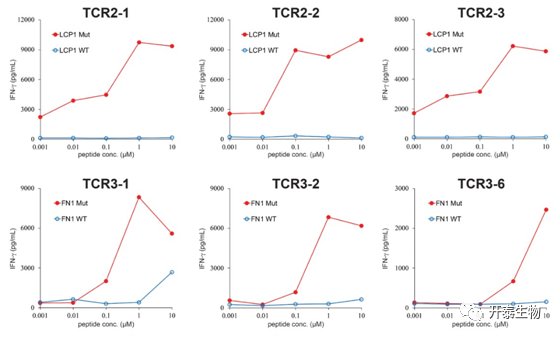
图2 ELISA测定T细胞分泌IFN-γ
04

新生抗原特异性TCR克隆型在肿瘤浸润T细胞特征
TILs的TCR克隆型具有高度多性,通常只有很少有T细胞可以被检测到。因此在既往单细胞研究中,为了更准确地评估TCR克隆型的频率,多个来源的T细胞测序数据会组合分析。
将每个患者的单细胞测序数据合并,获得该患者所有的TCR特征绘制饼图。其中高频的TCR克隆型(>1%)用彩色标记,其余频率较低的TCR均为灰色,同时文字标出新生抗原特异性TCR的编号及频率。新抗原特异性TCR克隆型只占整TILs的一小部分(0.01% ~ 0.30%)。TCR1是最常见的克隆型,但其频率仅为0.30%,在该患者单细胞测序数据中分离出15个细胞,其中只有5个在TMG-1刺激分泌IFN-γ。虽然该TCR为新生抗原特异性克隆型,但具体到每一个细胞,可能存在多种分化和表型特征,尤其是其中处于“耗竭”状态的细胞,无法对特异性刺激做出正常免疫反应。
与之前低通量的研究方法相比,分泌IFN-γ的新生抗原反应T细胞的频率在四个肿瘤标本中从更高。但是需要强调,在长期的肿瘤片段培养过程中,一些新抗原反应T细胞可能扩增更加明显,因此原有方法可能具有更高的新抗原反应T细胞的比例。
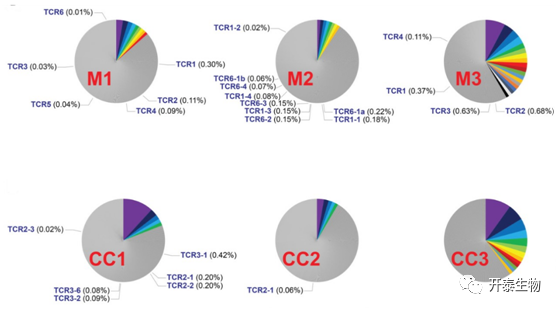
图3 新抗原特异性TCR克隆型的频率
+ + + + + + + + + + +
结 论
改良方法能够从6个肿瘤样本中识别新抗原特异性TCRs。与以前使用长期TIL培养后检测的方法相比,改良方法时间显著缩短、人力成本降低、敏感性提高。另外,改良法的主要限制在于,更多的TILs需要用于患者回输治疗,因此用于实验的细胞数量较少,限制了更加全面的肽库筛选。
尽管本研究筛选到新抗原特异性T细胞,但是在肿瘤微环境中,这类细胞比例很低,并且可能呈现无法发挥作用的表型。本文使用PD-1作为富集marker,目前有其他文献表明CD39、CD103等可能拥有更好的富集效果,待进一步验证。由于近年来对单细胞基因组学的深入研究,单细胞测序技术的质量、灵敏度和成本都有了显著的提高,这是对这一领域的一大促进因素。
+ + + + +



 English
English

