文献解读|:Cell Rep(8.8):深层空间蛋白质组学揭示了与 COVID-19 相关的严重肺损伤的区域特异性特征
✦ +
+
论文ID
原名:Deep spatial proteomics reveals region-specific features of severe COVID-19-related pulmonary injury
译名:深层空间蛋白质组学揭示了与 COVID-19 相关的严重肺损伤的区域特异性特征
期刊:Cell Reports
影响因子:8.8
发表时间:2024.01.18
DOI号:10.1016/j.celrep.2024.113689
背 景
作为严重急性呼吸综合征冠状病毒 2 的主要靶标,肺部在感染后表现出异质的组织病理学变化。然而,对其蛋白质基础和空间分辨率的全面了解仍然不足,这阻碍了对 2019 年冠状病毒病 (COVID-19) 相关肺损伤的进一步了解。
实验设计
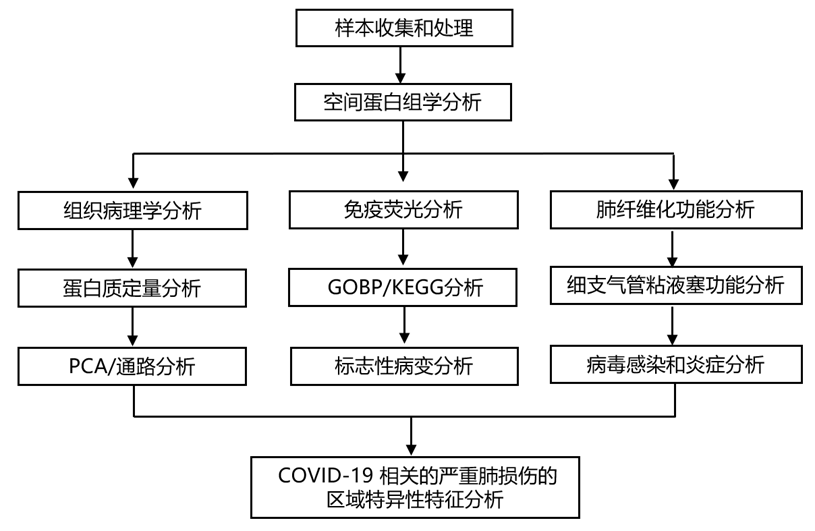
结 果
01
生成 COVID-19 肺部病理学指导的深入空间蛋白质组图谱
本项研究进行了全面的严重 COVID-19 相关肺损伤的蛋白质组分析,该研究团队开发了一个特定于项目的工作流程以提高灵敏度(图 1 A)。他们还收集了其他三名交通事故或冠心病受害者的健康肺部的福尔马林固定石蜡包埋 (FFPE) 标本。经过彻底的肺部组织病理学分析后,他们选择并解剖了十个感兴趣区域 (ROI)(图 1B-C)。其中包括来自 COVID-19 样本的三种基本肺部结构,即肺泡上皮 (AE)、支气管上皮 (BE) 和血管 (VE),以及配对的形态正常的非 COVID-19 样本,即非AE(N-AE)、非BE(N-BE)和非(N-VE)。 此外,他们还收集了四种关键的病理改变,即 细支气管粘液栓 (BMP)、肺纤维化 (PF)、空腔炎症 (ASI) 和增生性肺泡 2 型细胞 (HAT2),用于随后的空间蛋白质组分析。
他们对来自 10 个区域的 71 个样本的 10075 个蛋白质进行了定量(图 1 D)。在 10 个肺部区域中鉴定的蛋白质的无标记定量 (LFQ) 强度跨越了近 6 个数量级,并显示出中等高度的区域内相关性(图 1E-F)。
总的来说,这些结果证明了他们的空间蛋白质组工作流程的有效性。
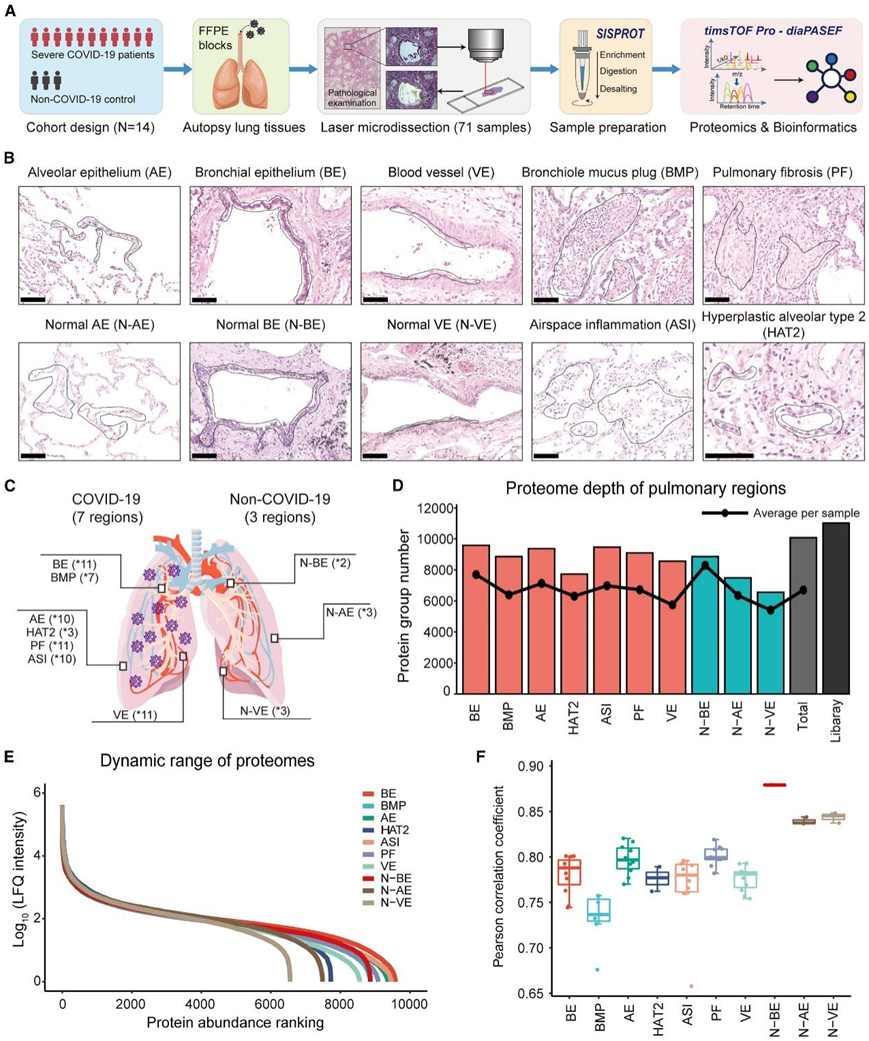
图1. COVID-19 尸检中肺损伤的空间蛋白质组分析。
(A) 示意性工作流程,包括队列设计、尸检标本采集、病理引导 LMD、集成样品制备、基于 MS 的深度蛋白质组分析和生物信息学分析。(B) 用于空间蛋白质组分析的选定区域的代表性 H&E 图像。(C) 人体肺部结构示意图。(D) 每个区域和特定项目光谱库的已识别蛋白质组的总数(作为条形图)和平均数(作为黑点)。(E) 基于平均蛋白质 LFQ 强度的十个区域内蛋白质组的动态范围。(F) 分别在十个解剖区域中Pearson相关系数的箱线图。
02
比较分析揭示了三种基本肺部结构中蛋白质和相关通路的失调
为了表征死后肺部中由 COVID-19 引起的区域特异性蛋白质组变化以及相关功能和途径的失调,他们对 COVID-19 之间的三种基本肺结构(即 AE、BE 和 VE)进行了比较蛋白质组分析。正如预期的那样,在所有三个区域的主成分分析 (PCA) 中,可以很好地区分 COVID-19 样本与非 COVID-19样本(图 2A),表明不同的蛋白质组特征。与非 COVID-19 组相比,在 COVID-19 组的 AE、BE 和 VE 区域中分别鉴定出 397、487 和 437 个显著上调的蛋白质和 1089、345 和 475 个显著下调的蛋白质(图 2 B)
AE 构成肺部气体交换的薄壁,在 COVID-19 尸检中广泛观察到肺泡损伤。最近的研究发现了肺泡上皮细胞的过渡群体,其特征是 KRT8、CLDN4 和 IL1R1 表达升高,在动物模型中,这些细胞对肺损伤的反应急剧增加。有趣的是,他们还在 COVID-19 AE 中检测到这三种蛋白标记物的上调(图 2 B),证实了受影响患者肺部中所谓的“前肺泡 1 型过渡细胞状态 (PATS)”的存在受新冠肺炎 (COVID-19) 影响。
此外,由于细胞数量的积累和DNA损伤,PATS细胞是癌细胞样细胞。在 COVID-19 AE 中,NKX2-1(也称为 TTF1)(肺腺癌中的一种重要癌基因)有所增加,他们通过免疫荧光(IF)染色验证了蛋白质组学发现(图 2C-D),证实了 COVID-19 AE 区域中 KRT8 和 NKX2-1 的表达增加。他们还观察到四种人肺泡 1 型 (AT1) 细胞标记物 AGER、CAV1、CAV2 和 CLIC5 减少,表明 COVID-19 中正常肺泡功能丧失。
BE 由基底细胞、纤毛细胞和分泌细胞组成,作为气道的防御屏障,使其成为吸入病原体的主要目标。在COVID-19肺部的BE中,他们观察到重要趋化因子的上调,例如CXC基序趋化因子配体1和CC基序趋化因子19,这与之前的转录组学研究一致,表明炎症组织损伤、肺损伤和呼吸衰竭加剧(图2B-D),抑制这些通路可以抑制重症 COVID-19 病例中的免疫过度激活。此外,他们还发现了 Toll 样受体 5(先天免疫反应的关键组成部分)以及蛋白酶 FURIN(与 SARS-CoV-2 入侵有关)的上调。对于下调的蛋白,他们鉴定了几种参与脂质代谢的载脂蛋白,包括 APOA1、APOB、APOC1、APOC3、APOE 和 APOM。在重症 COVID-19 患者的血清中也发现了类似的载脂蛋白减少。
VE 在血液循环中发挥着关键作用,包含多种细胞类型。本研究中解剖的 VE 区域包括血管内皮和周围的弹性壁。COVID-19尸检中肺血管的组织病理学分析显示广泛的血栓形成、内皮炎和血管生成。他们观察到 COVID-19 VE 中活化的急性期蛋白 SAA1 和 SAA2 的上调(图 2 B-D)。这些蛋白质还在重症 COVID-19 患者的血清中富集,并显示出作为病毒感染生物标志物的潜力。此外,他们观察到几种已知与SARS-CoV-2侵袭相关的蛋白上调,包括SIGLEC10(受体结合域相互作用蛋白)、IFI44 (SARS-CoV-2的免疫逃逸生物标志物)和PTX3(COVID-19死亡率的预测因子)。
在单独分析差异表达蛋白后,他们使用 Metascape 平台对六个区域独特的失调蛋白质组进行了基因本体生物过程 (GOBP) 富集分析(图2E-F)。他们观察到由 COVID-19 在三个肺部结构中引起的独特和共同的功能障碍。这些发现表明 SARS-CoV-2 可导致广泛的组织损伤和正常肺功能的丧失。更重要的是,一系列与免疫反应相关的通路显著富集。
总体而言,COVID-19肺部的淋巴细胞活化和适应性免疫反应呈负向调节,而炎症反应则上调。这与重症 COVID-19 患者淋巴细胞减少、适应性免疫反应受损以及细胞因子和趋化因子表达紊乱的临床报告一致,进一步强调针对免疫系统疾病进行靶向治疗的重要性,免疫系统疾病会导致 COVID-19 致命病例中的多器官衰竭。
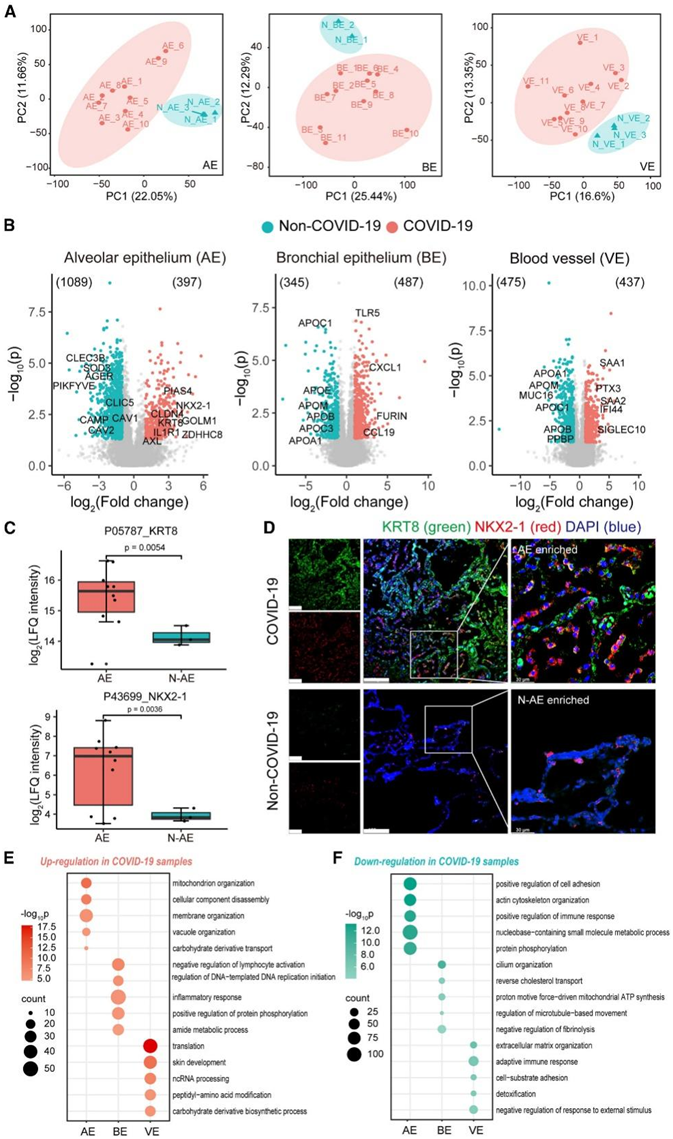
图2. COVID-19肺部三种基本肺结构中蛋白质表达的区域特异性失调。
(A) 重症 COVID-19 患者和非 COVID-19 对照个体肺部三种基本结构的蛋白质组谱的 PCA。(B) 显示了三种基本肺部结构的 COVID-19 样本与非 COVID-19 样本的火山图。(C) COVID-19 肺部和非 COVID-19 肺部 AE 区域中 KRT8 和 NKX2-1 蛋白表达的箱线图。(D) 来自 COVID-19 肺部和非 COVID-19 肺部的 AE 区域中 KRT8 和 NKX2-1 的免疫荧光图像。(E-F) 点图显示了 COVID-19 肺部中 AE、BE 和 VE 区域显著上调的蛋白质富集的前 5 个 GOBP 和 KEGG通路。
03
COVID-19肺部七个区域的空间蛋白质组和功能特征
在对三种基本肺部结构进行比较分析后,他们继续研究了 COVID-19 肺部的其他四个标志性病理区域(包括 BMP、PF、ASI 和 HAT2)的蛋白质组学特征。通过进行方差分析 (ANOVA) 和 GOBP 富集,他们确定了七个具有不同功能的表征 COVID-19 肺部不同区域的蛋白质聚类(图 3 A),包括 BE 聚类 1(1678 个蛋白质)、BMP聚类 2(659 个蛋白质),AE聚类3(139 个蛋白质),HAT2聚类 4(749 个蛋白质),ASI聚类5(22 个蛋白质),PF聚类6(148 个蛋白质),VE聚类7(800 个蛋白质)。
正如预期的那样,气道上皮标志物 TP63、CLIC6、TPPP3 和 SCGB1A1 在聚类1 (BE) 中富集;骨髓细胞标记物 MPO、ELANE、CD14 和 ITGAM 以及粘蛋白 MUC5B 和 MUC4 在聚类2 (BMP) 中富集;AT1细胞标记物EMP2和AQP1在聚类3(AE)中富集;肺泡 2 型 (AT2) 细胞标记物 SFTPA2、SFTPD、ABCA3 和 LRRK2 在聚类4 (HAT2) 中富集;巨噬细胞标记物 CD163、MARCO 和 MRC1 在聚类5 (ASI) 中富集;成纤维细胞标记物 FAP、FN1、LUM、MMP2 和 MMP14 以及胶原沉积标记物 COL1A2、COL3A1、COL5A1 和 COL12A1 在聚类 6 (PF) 中富集;血管内皮标记物 VEGFD、VWF、BMX 和 DKK2,以及血管周围基质标记物 PDGFRB、ACTA2、TAGLN 和 MYH11 在聚类7 (VE) 中富集。此外,GOBP 分析揭示了每个区域特有的富集过程(图 3 C)。例如,聚类1(BE)参与纤毛的组织和运动;聚类3 (AE) 参与气体运输和细胞群增殖;聚类7(VE)参与VE的发育和血液循环。另一方面,他们利用CellPhoneDB平台推断了区域间的通信(图3D)。
值得注意的是,聚类5 (ASI) 在七个聚类中蛋白质数量最低,表明其蛋白质成分的独特性相对较低(图 3 A)。ASI 是 COVID-19 肺炎 DAD 的一个标志,可以通过胸部计算机断层扫描反映为毛玻璃样混浊。此外,他们还鉴定了该聚类中增殖的肺泡巨噬细胞的三个标记物,包括CD163、MARCO和MRC1,证实了受损肺泡中巨噬细胞的浸润。MRC1 在 COVID-19 肺部的 ASI 和 PF 区域显著富集,而在非 COVID-19 样本中显示出最小信号(图3E-F)。在COVID-19感染者的肺中,不仅有纤维化巨噬细胞的富集,还有一个相关的潜在治疗靶点,如VSIG4的富集。
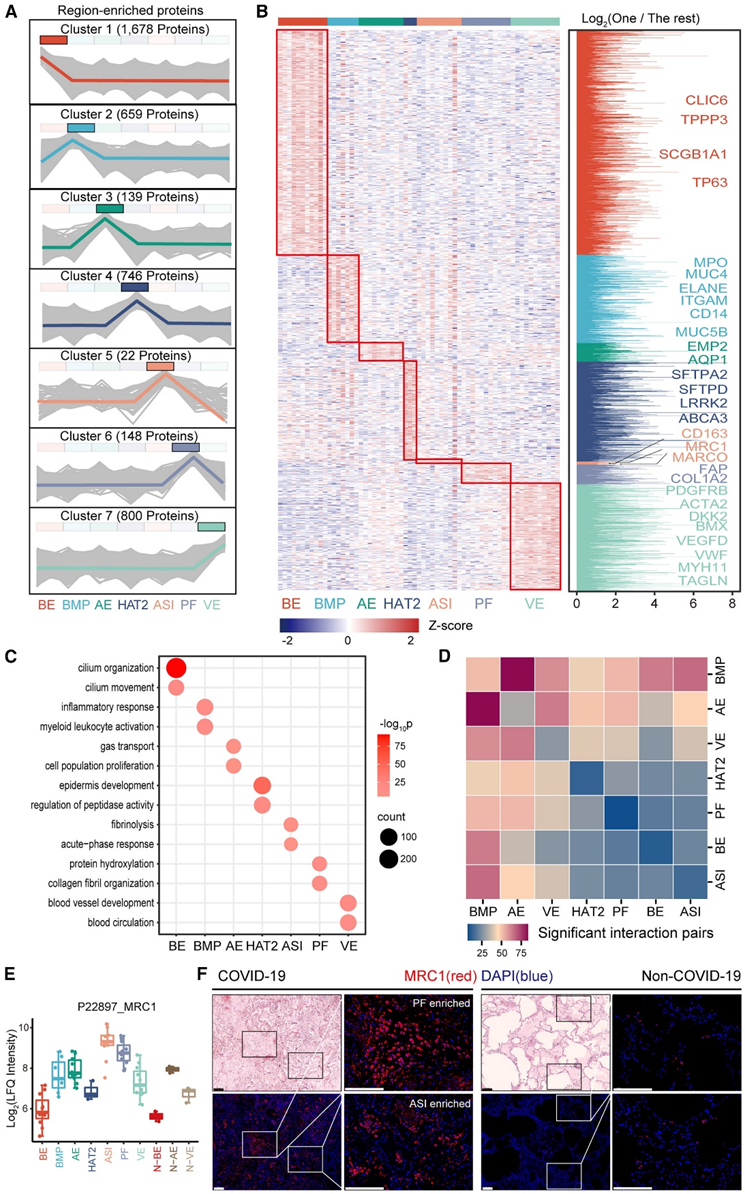
图3. COVID-19 肺尸检中标志性病变的蛋白质组学和功能特征。
(A)共表达分析。(B) 七个聚类中区域富集蛋白的共表达模式。(C) 点图显示每个区域富集的蛋白质聚类的选定 GO分析。(D) 热图显示七个 COVID-19 区域之间推断的相互作用对。(E) 箱线图显示了来自 COVID-19 和非 COVID-19 肺部的 10 个区域中 MRC1 的蛋白表达。(F) COVID-19 肺和非 COVID-19 肺中 MRC1 的免疫荧光图像。
04
COVID-19 肺中 PF、BMP 和 HAT2 的蛋白质组学和功能特征
纤维化是许多肺部疾病的常见现象,例如特发性肺纤维化(IPF)和肺癌,可导致肺结构损伤、进行性呼吸衰竭和致命的低氧血症。导致PF的主要原因之一是肺损伤修复失败。它与过度胶原蛋白沉积和细胞外基质(ECM)产生相关的一系列生物过程和信号传导通路显著相关(图4A-B)。
为了识别 PF 中潜在的重要蛋白质调节因子和标记物,他们选择了五个代表性 GOBP ,并对相关蛋白质进行排名。在前 30 种蛋白质中(图 4 C),发现了胶原蛋白 COL1A2、COL12A1、COL3A1 和 COL5A1,胶原蛋白羟化酶 P3H4、P3H1、P3H3 和 P4HA2,肽基脯氨酰异构酶 FKBP7、FKBP10 和 FKBP11,以及已知的 ECM组件和调节器包括所有七种情况下的 LUM、AEBP1、DCN、ECM2、THY1、FAP、PLOD2 和 THBS3。有趣的是,他们在此列表中鉴定出了高强度的转化生长因子-β 诱导蛋白 ig-h3 (TGFBI) 和上皮间质转化 (EMT) 标记物纤连蛋白 FN1(图 4 D)。TGFBI 是一种 ECM 糖蛋白,与多种发病机制和生物过程有关。
接下来,他们对组织切片上的 FN1、TGFBI 和肌成纤维细胞标记物 ACTA2(以定位 PF 区域)进行共染色。所有这三种蛋白质在 COVID-19 PF 中富集并共定位,而在对照样本的肺泡区域中显示出最小的信号(图4E)。
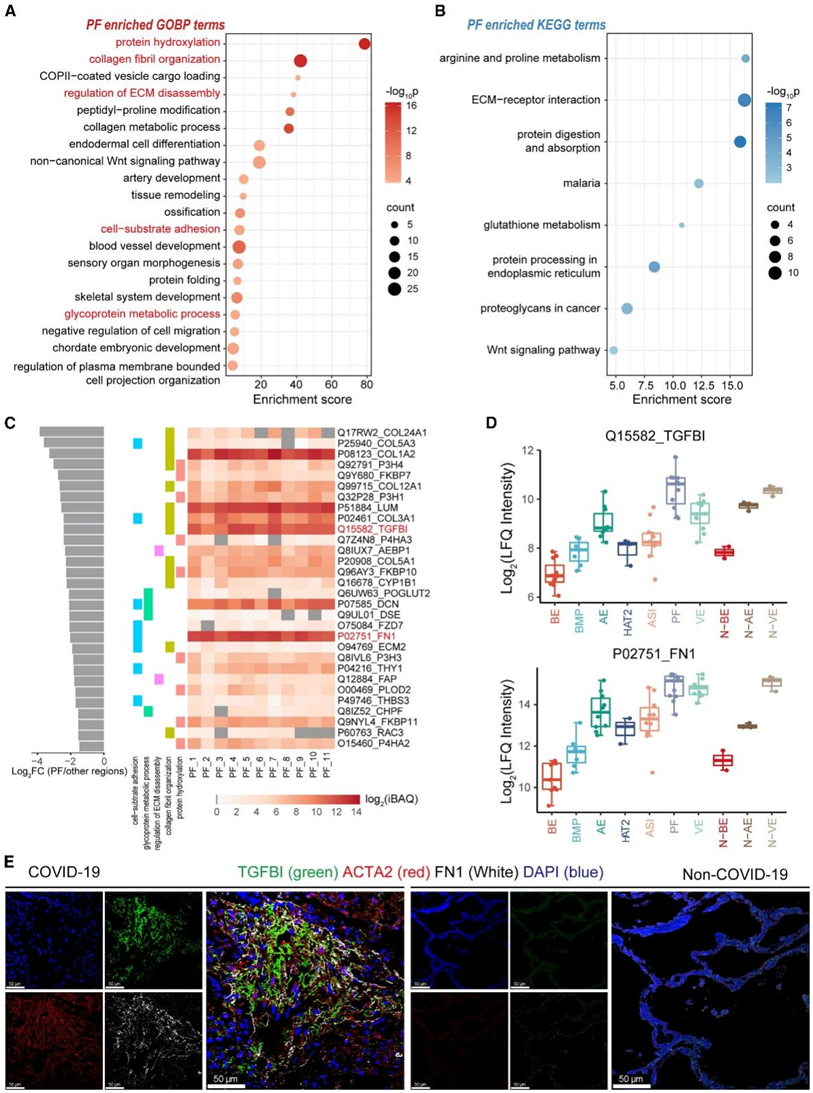
图4. 基于蛋白质组学的COVID-19肺部肺纤维化功能分析。
(A) 点图显示富含 PF 的蛋白质聚类的前 20 个重要 GOBP分析。(B) 点图显示 PF 富集蛋白聚类的所有显著 KEGG 通路。(C) 所选 GOBP 的蛋白质表达模式。(D) COVID-19 和非 COVID-19 肺部 10 个区域中 TGFBI 和 FN1 蛋白表达的箱线图。(E) COVID-19 PF 区域和非 COVID-19 肺泡区域中 TGFBI 和 FN1 的免疫荧光图像。
气道粘液的正常功能是捕获和排出吸入的病原体和毒素,以保护呼吸系统。过多的粘液积聚和清除功能受损会导致肺功能异常。他们表征了 COVID-19 肺部的 BMP,BMP 聚类相对其他区域富集了 659 种蛋白质(图 3 A)。接着,他们进行了 GOBP 和 KEGG 分析以确定 BMP 中的功能富集。与之前的发现一致,一系列与免疫反应相关的通路显著富集,例如白细胞激活、防御反应的调节、免疫效应过程和先天免疫反应(图5A-B)。
在前 30 个列表中(图 5 C),他们鉴定了几种中性粒细胞标记物,包括 MPO、ELANE、DEFA3 和 NCF2,以及与中性粒细胞相关的多种功能蛋白,包括 AZU1、PRTN3、CTSG、PADI4、S100A8、S100A12、所有七例中均存在 LILRB2,表明 BMP 中存在高丰度的中性粒细胞。此外,他们观察到与中性粒细胞胞外陷阱 (NET) 形成相关的信号通路显著富集(图 5 B)。
COVID-19 患者的血液和肺部中针对病毒感染而形成和释放的 NET 失调,可能导致过度炎症和血栓形成。为了验证本项研究的蛋白质组图谱,他们对 MPO 和 NET 形成标记瓜氨酸组蛋白 H3 (Cit-H3) 进行了共染色。两种标记物在 COVID-19 BMP 区域中高度富集并共定位,而在对照样本的支气管区域中显示出最小信号(图5E)。这些结果表明中性粒细胞和 NET 过程显著参与 BMP 的形成以及在 COVID-19 中观察到的失调炎症反应。因此,抑制 NET 的形成可能会缓解 COVID-19 的严重症状。
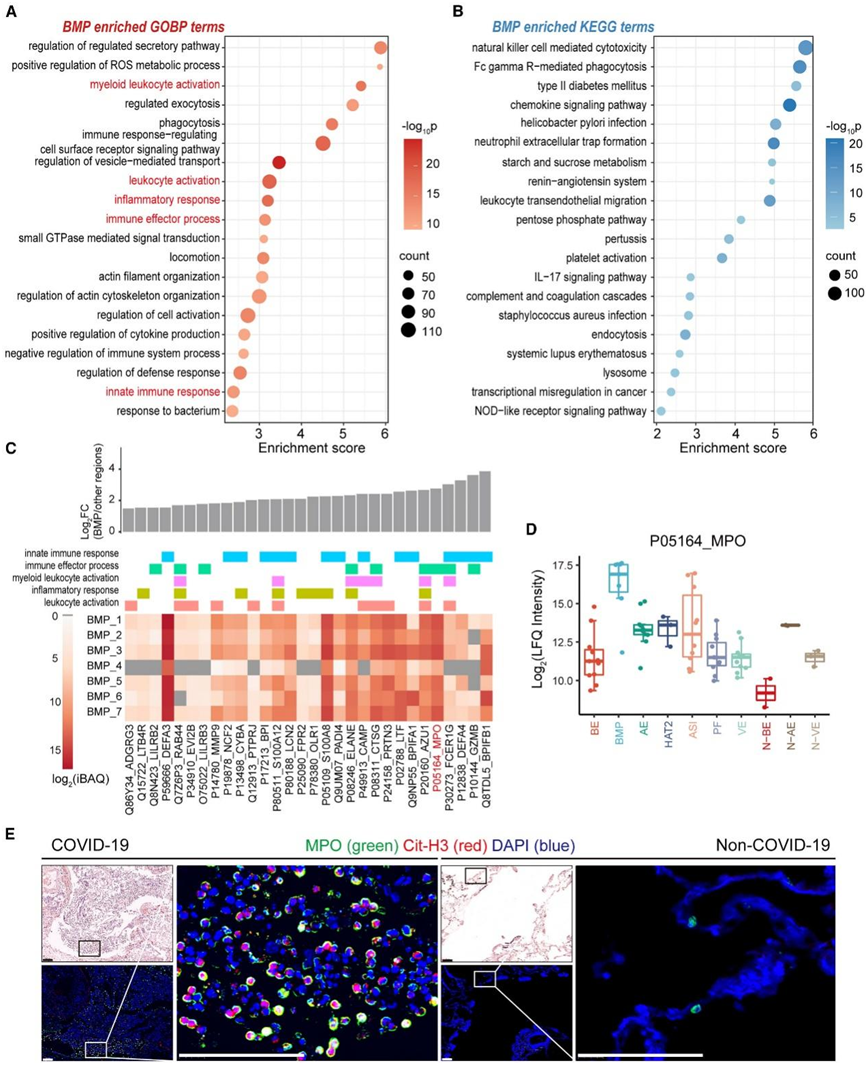
图5. 基于蛋白质组学的 COVID-19 肺部细支气管粘液塞功能分析。
(A) 点图显示富含 BMP 的蛋白质聚类的前 20 个重要 GOBP通路。(B) 点图显示富含 BMP 的蛋白质聚类的前 20 个显著KEGG通路。(C) 所选 GOBP 通路的蛋白质表达模式。(D) COVID-19 和非 COVID-19 肺部 10 个区域中 MPO 蛋白表达的箱线图。(E) COVID-19 BMP 区域和非 COVID-19 细支气管区域中 MPO 和 Cit-H3 的免疫荧光图像。
05
与病毒进入和炎症反应相关的蛋白质的多区域失调
接下来,他们根据报告和预测的数据集构建了一个数据库,其中包含与 COVID-19 发病机制相关的蛋白质,包括病毒受体、病毒进入辅因子、病毒进入相关蛋白酶以及参与紊乱炎症的蛋白质,在该数据库的 273 种蛋白质中,他们鉴定了数据中的 128 种蛋白质,其中 34 种蛋白质在 COVID-19 区域显著上调(图 6 A)。
COVID-19 感染者肺部中几种病毒感染相关蛋白的上调,包括 IFITM3、TMPRSS2、CTSB、FURIN、NPC2、LILRB2、CD209 和 SIGLEC9。在病毒进入过程中,IFITM3可以与SARS-CoV-2刺突(S)蛋白相互作用并受到劫持,从而实现高效的病毒感染。此外,蛋白酶TMPRSS2和FURIN可能参与S蛋白的激活和裂解。
他们的数据强调了这些蛋白在COVID-19发病机制中的重要性。有趣的是,他们还观察到oncostatin-M-特异性受体OMSR的上调,OMSR参与肿瘤生长过程中受干扰的炎症和成纤维细胞重编程。为了验证这个发现,他们对COVID-19和非COVID-19肺进行了IFITM3、FURIN、HGF和OSMR染色,免疫组化结果与蛋白质组图谱一致(图6B-C)。
在所有63份COVID-19样本中,共鉴定出2448种蛋白表达(图6D)。根据分别对2448个交叉蛋白和其中前200个蛋白进行KEGG和GOBP分析(图6E -6G),观察到“冠状病毒疾病-COVID-19”通路的显著富集。另一方面,在排名靠前的通路中也发现了与炎症紊乱相关的几种通路,例如“体液免疫反应”和“炎症反应”。这些结果进一步证实了 COVID-19 肺部多个区域的病毒进入和炎症反应相关蛋白的富集。
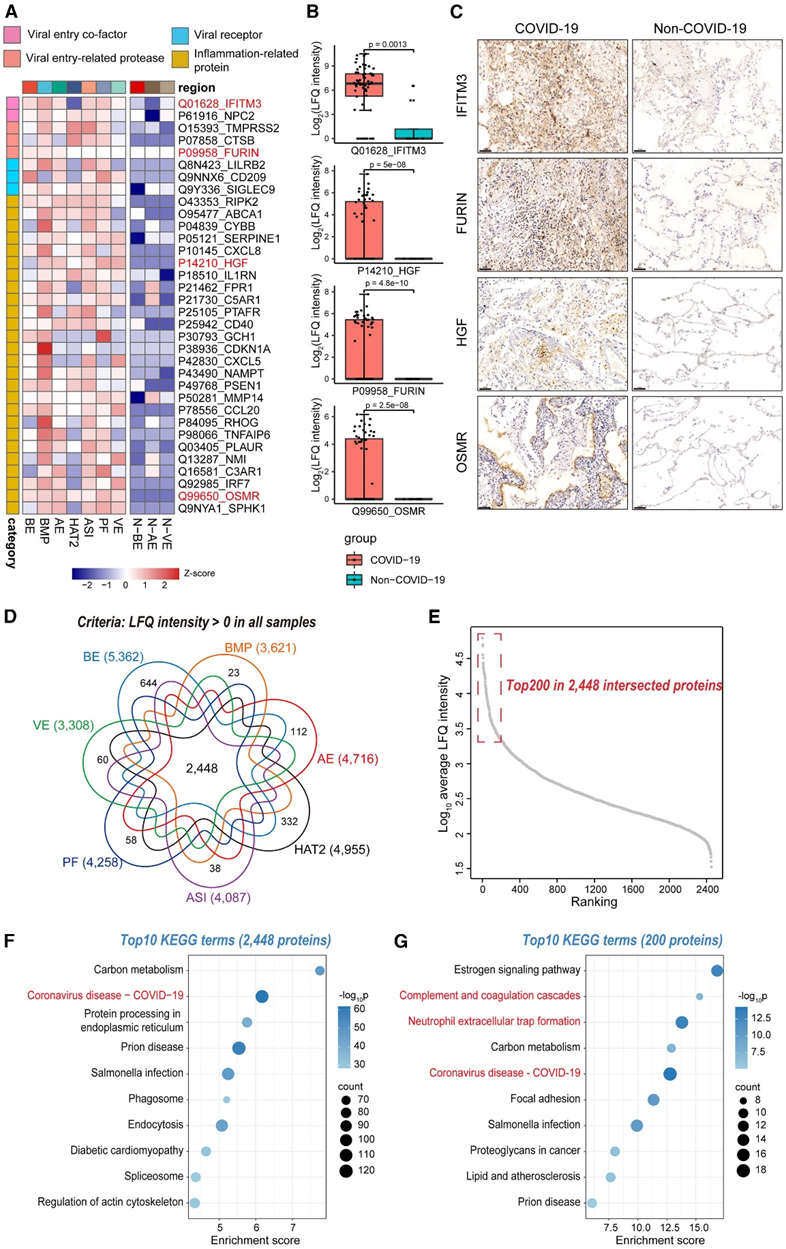
图6. COVID-19 肺部的多区域失调。
(A) 热图显示了涉及 COVID-19 和非 COVID-19 肺部 10 个区域的病毒进入、宿主限制和炎症反应的显著上调蛋白质的Z评分归一化强度。(B) 来自 COVID-19和非 COVID-19 肺部的所有样本中 IFITM3、HGF、FURIN 和 OSMR 蛋白表达的箱线图。(C) COVID-19 肺和非 COVID-19 肺中 IFITM3、HGF、FURIN 和 OSMR 的免疫组织化学图像。(D) 维恩图显示七个 COVID-19 区域的蛋白质组交叉点。(E) 散点图显示 2448 个交叉蛋白质的强度排名。(F-G) 点图显示显著 KEGG 通路。
+ + + + + + + + + + +
结 论
本项研究通过整合组织学检查、激光显微切割和超灵敏蛋白质组学,生成了标志性病理性肺部结构的区域分辨蛋白质组图谱。对 71 个尸检样本中的 10000 多种蛋白质进行了定量。与非 COVID-19 对照相比,本项研究确定了肺泡上皮、支气管上皮和血管中的一系列通路失调,为过渡态肺细胞增生提供了证据,本项研究揭示了细支气管粘液栓、肺纤维化、空腔炎症和肺泡 2 型细胞中功能标记的区域特异性富集,揭示了它们的独特特征。此外,还检测到多个区域与病毒进入和炎症反应相关的蛋白质表达增加,这表明了潜在的治疗靶点。总的来说,这项研究为通过空间蛋白质组学解读 COVID-19 引起的肺功能障碍提供了独特的视角。
+ + + + +



 English
English


