文献解读|Nat Commun(14.7):临床生酮饮食中的膳食纤维含量会改变小鼠的肠道微生物群和抗癫痫能力
✦ +
+
论文ID
原名:Dietary fiber content in clinical ketogenic diets modifies the gut microbiome and seizure resistance in mice
译名:临床生酮饮食中的膳食纤维含量会改变小鼠的肠道微生物群和抗癫痫能力
期刊:Nature Communications
影响因子:14.7
发表时间:2025.01.24
DOI号:10.1038/s41467-025-56091-7
背 景
低碳水化合物、高脂肪生酮饮食 (KD) 用于治疗对现有抗癫痫药物无积极反应的儿童癫痫。虽然 KD 疗法已很好地融入了医疗保健体系,但它在减少癫痫发作方面的效果各不相同,在依从性较高的婴儿和儿童中,癫痫发作的发生率为 45% 至 85%,而在成人中,癫痫发作的发生率要低得多。肠道微生物群调节生酮饮食的抗癫痫作用,但具体饮食配方如何以不同的方式改变肠道微生物群,从而影响癫痫发作的结果,这一点尚不清楚。
实验设计
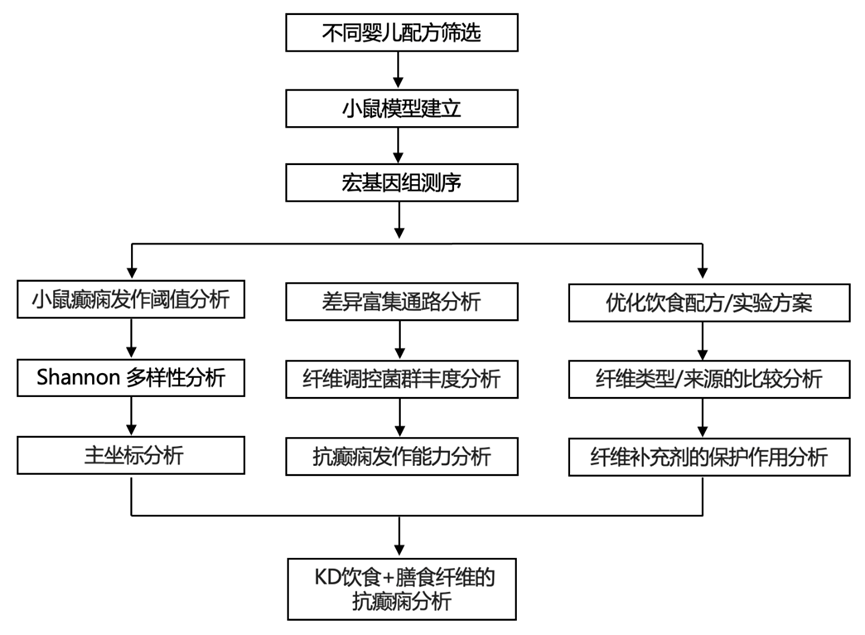
结 果
01
不同临床 KD 婴儿配方奶粉在小鼠中引发不同的癫痫反应
KD 对癫痫发作抵抗力的机制研究通常依赖于为实验室动物配制的商用 KD 饲料,与用于人类癫痫的医学 KD 疗法无直接关系。同时,临床 KD 方案的营养成分差异很大,并且通常根据特定个体的需求和耐受性量身定制,因此很难确定标准方案。为了研究临床相关的 KD 配方如何对癫痫发作结果产生不同的影响,研究团队重点研究了 3 种常用的商用 KD 婴儿配方奶粉—KD4:1、KD3:1 和中链甘油三酯(MCT)2.5:1 —因为它们具有可重复的成分、直接的临床相关性、频繁的处方以及对婴儿和幼儿的重要性,他们是难治性癫痫患者中特别脆弱的亚群,需要改进干预措施。与作为对照饮食 (CD) 的标准婴儿配方奶粉相比,3 种 KD 婴儿配方奶粉的脂肪含量均高于碳水化合物和蛋白质,但它们的配方存在细微差别(图 1a)。除了脂肪比例不同外,不同配方的脂肪来源也不同,其中 KD4:1 含有大豆卵磷脂,但缺乏椰子油(MCT 来源)和亚油酸,KD3:1 含有亚油酸,但缺乏大豆卵磷脂和椰子油,MCT2.5:1 含有椰子油,但缺乏大豆卵磷脂和亚油酸。碳水化合物含量也存在差异,KD4:1 和 MCT2.5:1 都含有玉米糖浆固体、高直链玉米淀粉、菊苣根菊粉、阿拉伯胶、纤维素、低聚果糖 (FOS)、大豆纤维和麦芽糊精,而 KD3:1 仅含有乳糖和玉米糖浆固体,不含任何膳食纤维。CD 含有乳糖和不到 2% 的由低聚半乳糖组成的膳食纤维,这与 KD4:1 和 MCT2.5:1 中包含的纤维类型不同。
为了确定不同的 KD 配方如何影响癫痫发作易感性,他们给传统的 4 周龄小鼠群喂食 KD4:1、KD3:1、MCT2.5:1 或 CD 配方作为流质饮食 1 周,然后测试对 6 Hz 精神运动性癫痫发作的易感性(图 1b)。选择幼鼠来模仿 KD 治疗儿童癫痫的典型用途,使小鼠大脑发育的时间与人类早期大脑发育的时间相一致,并排除断奶前治疗的影响,因为饮食对母体行为和生理的影响会混淆其对后代的直接影响。根据之前的纵向表征选择 1 周的喂养,这表明 KD 食物会改变肠道微生物群并在小鼠治疗第 4 天内提供癫痫保护。最后,6 Hz 癫痫发作试验作为难治性癫痫的基准模型,用于筛选新的抗癫痫药物,并涉及低频角膜刺激以诱发与人类颞叶癫痫相关的复杂部分性癫痫。 KD饮食可预防 6 Hz 癫痫发作,这通过增加 50% 的受试者发生癫痫发作所需的电流强度(CC50,癫痫发作阈值)来表明。
与喂食 CD 婴儿配方奶粉的对照组相比,喂食临床 KD4:1 婴儿配方奶粉的小鼠癫痫发作阈值有所升高(图 1c)。MCT2.5 :1 也提高了癫痫发作阈值,但是程度不及 KD4:1,这可能是因为其脂肪比例相对较低或脂肪来源不同。然而,与所有其他组(包括喂食 CD 的对照组)相比,KD3:1 婴儿配方奶粉的癫痫发作阈值有所降低,这表明 KD3:1 配方增加了小鼠对 6-Hz 癫痫发作的敏感性。癫痫发作阈值与不同 KD 消耗的平均卡路里或通过血清 β-羟基丁酸水平评估的酮症程度没有相关性。为了进一步评估癫痫发作结果的差异是否会因提供液体形式饮食的细微差别(例如密度差异或奶瓶泄漏)而受到干扰,他们通过在脱水后提供固体形式的婴儿配方奶粉饮食重复了该实验。与之前的结果一致,固体 KD4:1 和 MCT2.5:1 相对于喂食固体 CD 的对照组提高了癫痫发作阈值,而固体 KD3:1 降低了对 6-Hz 癫痫发作的抵抗力,与总饮食消耗无关。这些数据表明,临床 KD 配方的变化会以不同的方式改变小鼠宿主对 6-Hz 癫痫发作的抵抗力与易感性。
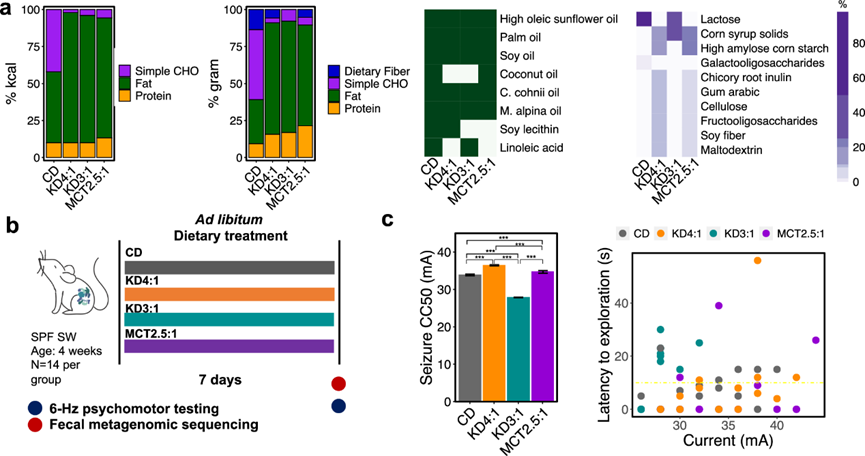
图1. 不同配方的医学生酮饮食(KD)对小鼠的 6-Hz 癫痫发作产生不同的反应。
(a)不同营养素组成。(b) 实验设计。(c) 以流质饮食喂养 KD或 CD 的小鼠的 6- Hz癫痫发作阈值(左)和探索潜伏期(右)。
02
临床 KD 婴儿配方奶粉对小鼠肠道微生物组产生差异性改变
经典的 KD 诱导的小鼠和人类微生物组变化是小鼠抵抗 6 Hz 癫痫发作的必要和/或充分条件。为了确定不同的临床 KD 婴儿配方奶粉如何影响肠道微生物组,他们对喂食 KD4: 1、KD3:1、MCT2.5:1 或 CD 一周的小鼠的粪便微生物组进行了宏基因组测序。与CD 对照相比,KD4:1 和 MCT2.5:1 显著增加了微生物组的 α 多样性,Shannon 多样性指数升高(图 2a)。然而,虽然所有 KD 配方奶粉组的粪便微生物组物种丰富度均有相当的增加,但 KD3:1 对 Shannon 多样性水平没有显著影响。这表明,KD 组之间 α 多样性差异的主要驱动因素是物种均匀度的差异改变——事实上,与 KD4:1 和 MCT2.5:1 组相比,KD3:1 产生的粪便微生物群的 Pielou 均匀度显著降低。基于Aitchison距离的肠道微生物群β多样性分析显示,KD3:1与CD对照组和KD4:1在主坐标分析(PCoA)2轴上明显分离,与MCT2.5:1在PCoA1轴上明显分离(图2b)。而Bray-Curtis相异性和加权Unifrac距离分析显示,KD样本与CD对照组在PCoA1轴上明显分离,其中KD4:1和MCT2.5:1样本比KD3:1样本与CD对照组分离得更远。特别是,与 CD 对照相比 ,所有 KD 组放线菌的相对丰度均显著下降,拟杆菌和未分类的细菌增加(图S2a)。然而,只有 KD4:1 和 MCT2.5:1 在丹毒菌中表现出统计学显著下降,在链球菌科、红蝽科和脱铁杆菌科中表现出统计学显著上升,而 KD3:1 与 CD 相比,这些分类群没有表现出显著变化(图S2a-c)。相反,与 CD、KD4:1 和/或 MCT2.5:1 相比,KD3:1 表现出变形菌门、大肠杆菌、粪肠球菌和松鼠乳头菌相对丰度显著增加(图S2a-c)。
易患癫痫的 KD3:1 组还表现出前 10 个最丰富的宏基因组通路的代表性下降(图 2c),这表明 KD3:1 限制了与普遍功能相关的微生物分类群。在前 10 名中,与氨基酸、碳水化合物、核苷和核苷酸生物合成相关通路的相对丰度在 KD3:1 中明显低于 MCT2.5:1、CD 和/或 KD4:1 组。相反,与其他组相比,与羧酸、脂肪酸和脂质以及次级代谢物降解相关通路在 KD3:1 中显著升高。当考虑更高分辨率通路水平上的具体改变时,与 CD 对照相比,所有三个 KD 都共有宏基因组变化的子集,其中 KD4:1 和 MCT2.5:1 比 KD3.1 有更大的重叠(图 2d)。与 CD 对照相比,KD4:1 和 MCT2.5:1(但不是 KD3:1)类似地诱导与碳水化合物生物合成(UDP-N-乙酰-D-半乳糖胺 II 和 UDP-N-乙酰-D-葡萄糖胺生物合成 II)、羧酸降解(生物素依赖性丙二酸降解)和辅因子、载体和维生素生物合成(生物素生物合成)相关通路的显著增加,并且与碳水化合物降解(己糖醇和半乳糖醇降解、蔗糖、乳糖、半乳糖降解和 Entner-Doudoroff 通路)、氨基酸生物合成(L-赖氨酸和 L-丙氨酸生物合成)、碳水化合物生物合成(UDP-N-乙酰-D-葡萄糖胺生物合成 I 和 UDP-葡萄糖衍生的-O-抗原构建块生物合成)和戊糖磷酸途径相关通路的减少(图 2e)。与 CD 相比,KD3:1 显示出最丰富的差异宏基因组通路,这些通路与其他 KD 组中观察到的通路不同(图S2d)。KD3:1 升高的大多数差异富集通路与酰胺、脒、胺和多胺降解、脂肪酸和脂质生物合成、羧酸降解和发酵有关(图S2d)。特别是,磷脂重塑、乳酸发酵和辛酰和肉豆蔻酸的生物合成以及赤藓酸、苏糖酸、半乳糖醇和尿囊素的降解途径均因 KD3:1 饮食显著增加,而因 KD4:1 和 MCT2.5:1 饮食而减少(图S2d),并且与低膳食纤维含量有关(图S2e)。唯一因 KD3:1 而降低,但因 KD4:1 和 MCT2.5:1 而升高的通路是 L-谷氨酸和 L-谷氨酰胺的生物合成(图S2d),这与膳食纤维呈正相关(图S2e)。综上所述,这些结果表明,对不同 KD 婴儿配方奶粉的 6 Hz 癫痫发作的抵抗力与易感性与肠道微生物组的组成和功能潜力的不同改变有关。
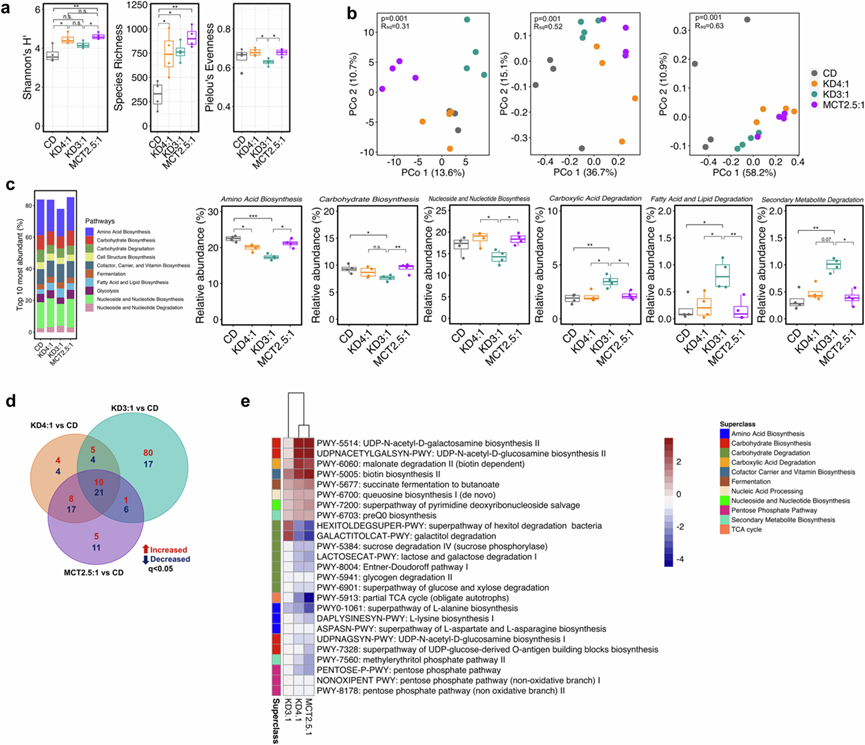
图2. KD饮食会引起肠道微生物群的差异改变。
(a) 粪便宏基因组测序数据的 Alpha 多样性。(b) 基于不同饮食后的粪便宏基因组测序数据。(c)通路分析。(d)差异宏基因组通路的维恩图 。(e) 共有的差异宏基因组通路。
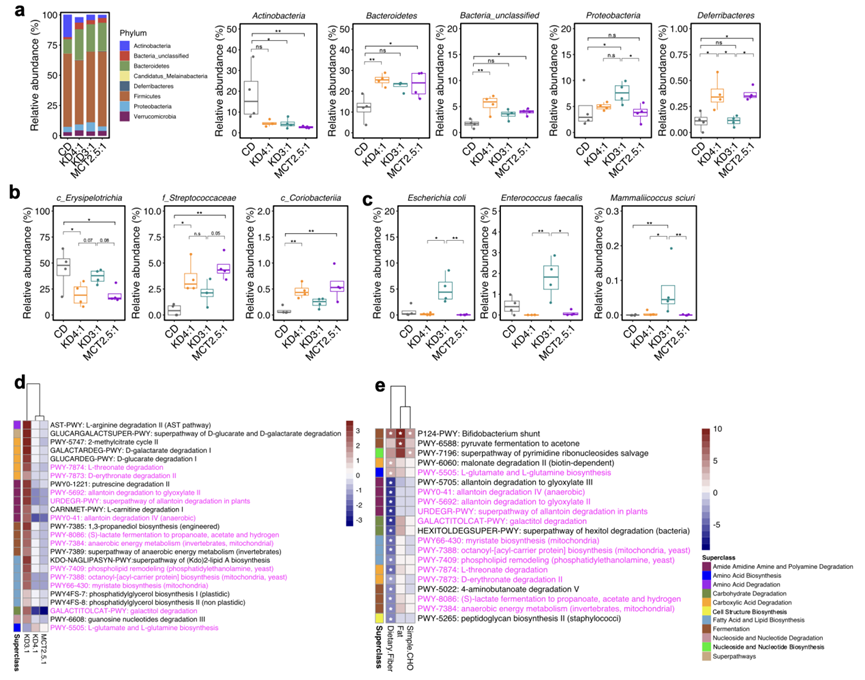
图S2. KD对小鼠粪便微生物组分类和宏基因组特征的影响。
(a) 液体KD和CD喂养小鼠粪便宏基因组数据中细菌门的分类分布。(b) KD4:1和MCT2: 5:1改变了细菌类群的相对丰度,但相对于CD,KD3:1没有改变。(c) 相对于CD, KD3:1改变了细菌类群的相对丰度,而KD4:1和MCT2:1没有改变。(d) 差异通路热图。(e) 与宏量营养素组成显著相关通路的热图。
03
KD 中的纤维含量可促进微生物改变并增强抗癫痫能力
肠道微生物群受宿主饮食变化的影响,可对饮食中常量营养素的存在、丰富度和来源作出反应。为了了解不同的临床 KD 配方如何差异化地改变肠道微生物群,他们筛选了各种饮食参数对人类婴儿微生物群模型的影响。根据在多项大型婴儿肠道微生物群研究中的普遍性和相对丰度,选择了 9 种细菌菌株(图S3a),证实所有群落成员在丰富的复合培养基中稳定地一起生长作为阳性对照(图S3b)。为检测KD脂肪比例对肠道菌群的影响,采用合成的KD培养基(KD4:1 ~ KD1.5:1)培养模型婴儿肠道菌群(图S3c)。对具有不同脂肪比例的 KD的分类学响应没有统计学上显著差异(图S3d)。为了研究KD脂肪来源的影响,他们使用不同饱和度的葵花籽油(6%的饱和脂肪)、大豆卵磷脂(23%的饱和脂肪,在KD4:1婴儿配方奶粉中占主导地位)或棕榈油(50%的饱和脂肪)作为脂肪来源,在合成的KD4:1,KD3:1或MCT2:1培养基中培养模型婴儿肠道微生物群落(图S3e)。用大豆卵磷脂制备的培养基增加了婴儿双歧杆菌、脆弱拟杆菌和产气荚膜梭菌的绝对丰度,导致沿 PCoA1 与葵花籽油和棕榈油组明显分离(图S3f)。这可能是由于与其他脂肪源相比,商业大豆卵磷脂中存在游离糖 (8%) 和/或大豆卵磷脂的乳化特性。 在所有培养基条件下,向日葵油组和棕榈油组之间没有统计学上的xianzhu 差异(图S3f),这表明大豆卵磷脂的差异效应是由脂肪源(而不是由饱和度)驱动的。
为了检测额外脂肪来源的效果,他们还在 KD 基培养基中添加了 MCT(在 MCT2:5:1 婴儿配方奶粉中占主导地位)或亚油酸(在 KD3:1 婴儿配方奶粉中占主导地位)(图S3g)。与相应的对照相比,添加 MCT 增加了B. breve、B. infantis和B. longum的绝对丰度,当添加到 KD4:1 和 KD3:1 培养基中时,多样性发生显著变化,但 KD2.5:1 培养基中没有发生这种变化(图S3h)。相反,添加亚油酸会降低B. infantis和B. vulgatus的绝对丰度,导致 PCoA1 相对于所有培养基组出现统计学上显著的变化(图S3h)。这引发了一个问题:亚油酸对微生物组的不同影响是否可能导致 KD3:1 婴儿配方奶粉无法预防 6 Hz 癫痫发作(图 1c)。
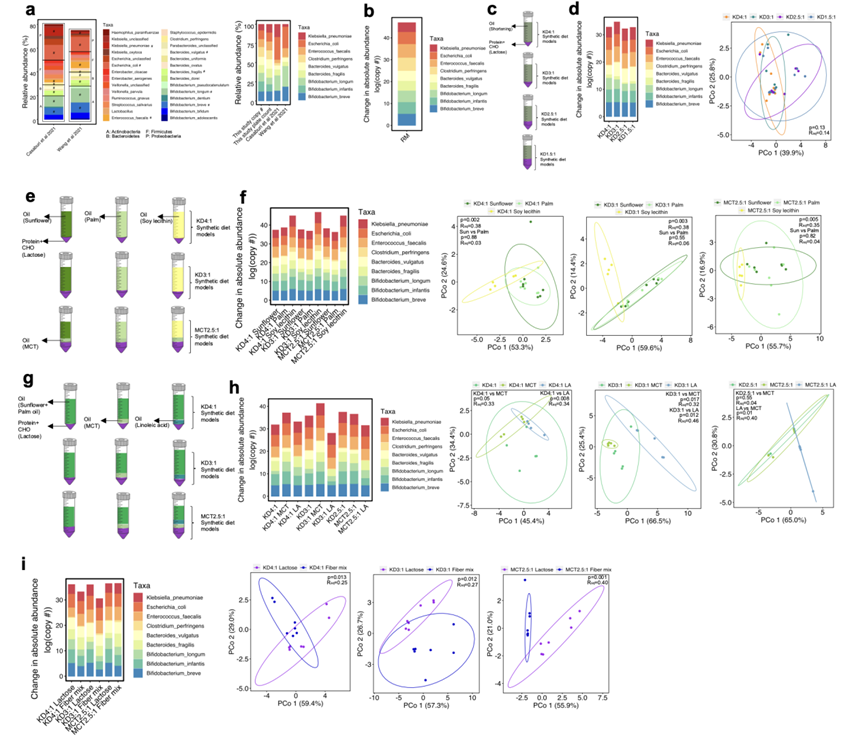
图S3. 脂肪比例,脂肪来源/类型和基于KD的合成培养基的碳水化合物来源对模型人类婴儿微生物群落宏基因组特征的影响。
(a)菌群丰度分析。(b) 在富复合培养基中培养24小时后细菌物种丰度的变化作为对照。(c) 实验设计:以KD为基础,配制不同脂肪比例的合成培养基,对模型婴儿肠道微生物群落进行厌氧培养。(d) 细菌种类丰度的变化(左)和微生物分类数据的PCoA分析(右)。(e) 实验设计。(f) 细菌物种丰度的变化(左)和微生物分类数据的PcoA分析(右)。(g)实验设计。(h-i) 细菌物种丰度的变化(左)和微生物分类数据的PcoA分析(右)。
为了评估碳水化合物类型的影响,他们在含有KD4:1、KD3:1和MCT2:1的合成培养基中培养了模型婴儿肠道微生物群落,这些合成培养基含有乳糖或纤维混合物(由等量的FOS、菊粉、纤维素和阿拉伯胶组成),作为区分KD4:1和mct2:1婴儿配方奶粉与KD3:1和CD配方奶粉的纤维来源(图 3a)。膳食纤维的存在导致模型婴儿肠道微生物群落在所有培养基条件下发生显著变化,特别是脆弱拟杆菌的增加,而短拟杆菌和B. infantis减少(图S3i)。PCoA 分析表明,纤维混合物组与乳糖对照组明显聚类(图 3b),其区分度比脂肪比例或来源的改变更大(图S3d-h)。特别是,纤维混合物在与氨基酸生物合成、核苷酸和核苷生物合成以及碳水化合物降解等有关的几种途径中产生了统计学上显著的下降(图 3c)。与乳糖相比,在用纤维混合物体外培养的模型婴儿微生物群落中,有 110 条宏基因组通路发生了显著改变,与用含乳糖的 CD 对照相比,在喂食含纤维的 KD4:1 和 MCT2.5:1 的小鼠的粪便微生物组中,有 15 条通路(13.6%)也发生了类似的显著改变(图 3c)。类似地,纤维诱导的磷酸戊糖途径、碳水化合物降解通路(蔗糖、葡萄糖、木糖和糖原降解)、碳水化合物生物合成(UDP-N-乙酰-D-葡萄糖胺生物合成和UDP-葡萄糖衍生的O-抗原构建块生物合成)、氨基酸生物合成(L-丙氨酸、L-赖氨酸和L-天冬氨酸和L-天冬酰胺生物合成)、部分TCA循环和甲基赤藓糖醇磷酸途径的减少也与KD4:1和MCT2.5:1组小鼠宏基因组相同(图 3c)。结果表明,膳食纤维比脂肪比例或来源更能对模型婴儿肠道微生物群落的群落结构和功能潜力产生重大影响。所选改变与小鼠微生物组中观察到的改变一致,这些改变是宿主食用含有纤维的临床 KD 婴儿配方奶粉(KD4:1 和 MCT2.5:1)后出现的,这些配方奶粉赋予了对 6-Hz 癫痫发作的抵抗力。结果表明,这些特定的宏基因组特征可能与癫痫发作抵抗力有关。
为了检测膳食纤维含量是否对抵抗6 hz癫痫发作有因果影响,他们在KD3:1婴儿配方奶粉中添加了混合纤维,以匹配KD4:1婴儿配方奶粉中报告的纤维水平,并在饮食处理后7天测试小鼠的癫痫易感性(图3d)。如前所述,与 CD 对照组相比,喂食液体 KD3:1 的小鼠癫痫发作阈值降低(图 3e)。值得注意的是,在 KD3:1 中添加纤维可使癫痫发作阈值升高到超过 CD 对照组的水平。他们进一步研究了在 CD 配方奶粉中添加过量纤维是否可以增强对癫痫发作的保护作用。给喂食 CD 的小鼠补充纤维仅导致非常微小的增加,这表明在食用 KD 的情况下补充纤维更有效。
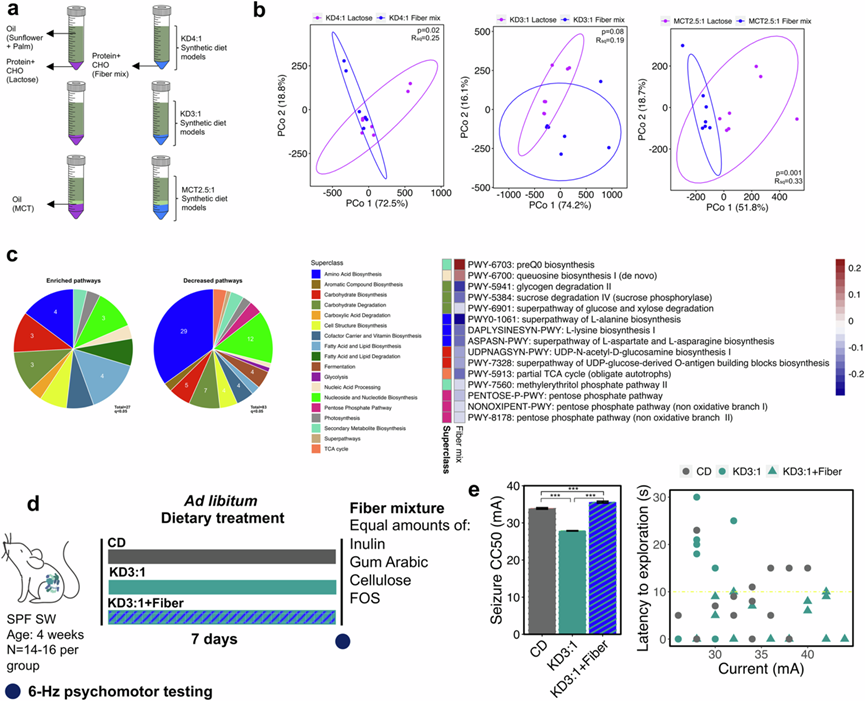
图3. 在 KD 中添加膳食纤维可丰富与人类婴儿肠道群落模型中癫痫保护相关的宏基因组特征。
(a) 实验设计。(b) 在含有纤维混合物与乳糖的基于 KD 的培养基中生长的人类婴儿微生物的宏基因组学途径丰度数据的主坐标图。(c)通路分析。(d) 实验设计。(e) 小鼠的6 -Hz 癫痫发作阈值(左)和探索潜伏期(右)。
04
不同的纤维类型和来源会引起不同的微生物改变和癫痫发作结果
为了确定膳食纤维补充剂是否可以增强对 KD 诱发的癫痫发作的保护,他们在含纤维的 KD4:1 婴儿配方奶粉中添加了已经存在于配方中的膳食纤维混合物,该配方奶粉产生了所有 KD 变体中最高的癫痫发作阈值,并在用流质饮食喂养 7 天后测试了小鼠对 6 Hz 癫痫发作的抵抗力(图 4a)。添加到 KD4:1 配方中的额外纤维使纤维含量从 5.3% 增加到 10.3%。膳食纤维补充剂显著提高癫痫发作阈值,达到超过单独使用 KD4:1 的水平(图 4b)。各组在饮食消耗方面没有显著差异。当以固体饮食而不是流质饮食的形式施用时,同样可以看到纤维补充剂进一步促进 KD4:1 的抗癫痫作用的能力,同样在食物消耗方面没有显著差异。短链脂肪酸 (SCFA) 是肠道微生物纤维在结肠中发酵的主要终产物,已证明会影响宿主的大脑活动和行为。为了进一步探究纤维补充剂是否通过短链脂肪酸(SCFA)促进抗癫痫发作能力,他们在 KD4:1 婴儿配方奶粉中添加了 SCFA 醋酸盐、丁酸盐和丙酸盐,其浓度预计与膳食纤维混合物发酵产生的浓度相匹配。无论是液体还是固体形式,SCFA 补充剂都无法模拟膳食纤维补充剂的表型效应,相反,与补充了载体溶液的对照组相比,小鼠对 6 Hz 癫痫发作的抵抗力略有降低。值得注意的是,他们检测到只有当糊状饮食中以固体形式补充 SCFA 时血清乙酸盐浓度才会升高,这可能归因于外源输送的 SCFA 的快速吸收、利用和分布。喂食补充纤维的 KD4:1 的小鼠的盲肠 2-羟基戊二酸水平显著增加,L-天冬氨酸、次黄嘌呤、黄嘌呤、肌苷和尿苷水平降低,这与 TCA 循环和 L-天冬氨酸生物合成相关基因的宏基因组改变相一致(图 3c),这些结果还表明腺苷和尿嘧啶代谢发生了改变。总体而言,这些数据表明,膳食纤维补充剂既可以恢复低纤维 KD3:1 的抗癫痫作用,又可以进一步增强含纤维的 KD4:1 的抗癫痫作用,其机制是口服 SCFA 补充剂无法重现的。
膳食纤维由精选的肠道细菌发酵,并决定肠道微生物组的组成和活性。为了了解特定的纤维类型或来源是否与 KD4:1 相互作用从而对婴儿肠道微生物组产生不同的改变,他们筛选了 13 种不同的纤维条件,包括市售的纤维产品或纯化的纤维类型,研究它们在 KD4:1 婴儿配方奶粉中直接生长时对模型婴儿微生物群落的额外影响(而不是像之前的实验那样在基于饮食的合成培养基中生长)(图 4c)。分类学概况显示,13 种纤维条件中有 8 种显著增加了脆弱拟杆菌的绝对丰度,11 种纤维条件显著降低了短拟杆菌的绝对丰度,这两个结果都与之前在合成培养基中添加纤维的体外结果一致(图S3i)。13 种纤维条件中有 7 种导致大肠杆菌减少,这与小鼠食用缺乏纤维的 KD3:1 时观察到的大肠杆菌增加相一致(图S2c)。接下来,他们针对 13 种纤维条件生成了合成宏基因组学谱,并筛选结果以优先考虑小鼠食用 KD4:1 和 MCT2.5:1(图 2e)之间共有的 15 种保护性特征以及模拟人类婴儿微生物群落对合成饮食培养基中纤维的反应(图 3c)。结果显示,模拟婴儿微生物对 KD4:1 婴儿配方奶粉中 13 种不同纤维的反应可分为 4 个亚组(图 4d)。组 1a 由纤维混合物、FOS 和橙子纤维组成,其特点是与 preQ0 生物合成和 L-丙氨酸生物合成相关的基因增加,而蔗糖降解和部分 TCA 循环减少(图 4d)。组 1b 由豌豆、金合欢和车前草壳纤维组成,与组 1a 聚在一起,表现出相似的宏基因组特征一般模式,但 L-丙氨酸生物合成减少,而 preQ0 生物合成和蔗糖降解的变化不太明显(图 4d)。组2由菊粉、纤维素和阿拉伯胶组成,其特点是与 5-7 条通路(糖原和蔗糖降解、L-丙氨酸、L-赖氨酸、L-天冬氨酸、L-天冬酰胺和 UDF-N-乙酰-D-葡萄糖胺生物合成、部分 TCA 循环和甲基赤藓糖醇磷酸通路)相关的基因显著减少,而 preQ0 生物合成基因显著增加(图 4d)。组3由燕麦、马铃薯、小麦和苹果纤维组成,其特点是L-丙氨酸生物合成和UDP-葡萄糖衍生的O-抗原构建块生物合成的表达显著增加,而queuosine生物合成减少(图 4d)。
根据饲喂含纤维 KD 的小鼠和在补充了纤维的培养基中培养的婴儿微生物群落中保留的关键宏基因组特征的微生物表征模式,他们从每个主要分组中选择了一种代表性纤维条件(组1a:纤维混合物,组2:阿拉伯胶,组3:燕麦纤维)来测试对癫痫发作抵抗力的因果影响。他们将每组的代表性纤维添加到 KD4:1 婴儿配方奶粉中,以将纤维含量从 5.3% 提高到 ~10.3%,并在以糊状形式喂食后第 7 天测试小鼠对 6 Hz 癫痫发作的抵抗力。如先前在液体和固体饮食形式中观察到的那样(图 4b),在 KD4:1 糊状物中添加纤维混合物可显著提高对 6 Hz 癫痫发作的抵抗力(图 4e)。相比之下,与 KD4:1 对照组相比,补充阿拉伯胶(组2)对癫痫发作阈值没有明显影响(图 4e)。此外,补充燕麦纤维(组3)具有不利影响,与 KD4:1 对照组和所有其他纤维条件相比,癫痫发作阈值显著降低(图 4e)。总体而言,这些数据表明,纤维补充剂增强 KD4:1 婴儿配方奶粉的癫痫发作保护作用的能力特定于特定来源和类型的纤维,这些纤维会改变肠道微生物组的关键宏基因组特征。
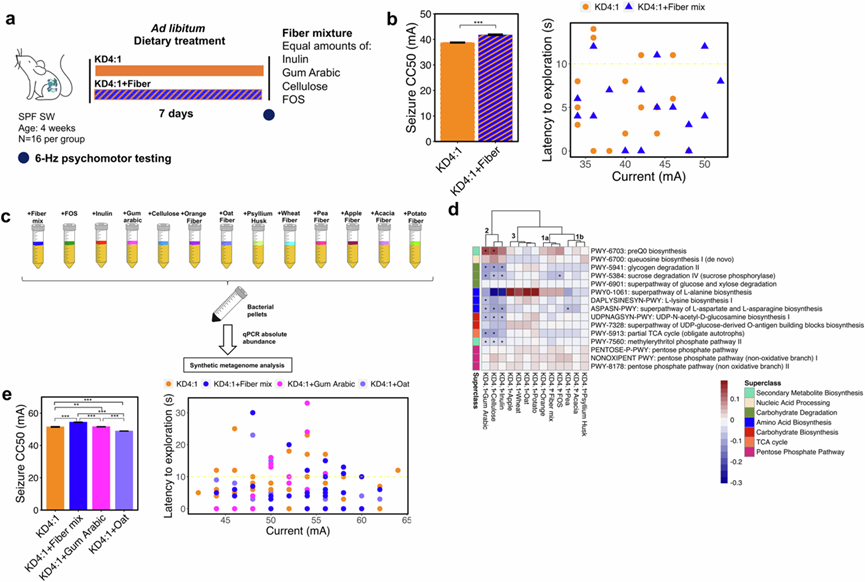
图4. 向含纤维的 KD4:1 中添加过量的膳食纤维可进一步增强抗癫痫能力。
(a) 实验设计。(b) 小鼠的 6-Hz癫痫发作阈值(左)和探索潜伏期(右)。(c) 实验设计。(d) 15 种纤维诱导的差异宏基因组学通路的热图。(e) 小鼠的 6-Hz 癫痫发作阈值(左)和探索潜伏期(右)。
+ + + + + + + + + + +
结 论
本研究发现,生酮婴儿配方奶粉在常量营养素比例、脂肪来源和纤维含量方面各不相同,并且对小鼠抵抗 6 Hz 癫痫发作的能力有不同程度的促进作用。膳食纤维,而不是脂肪比例或来源,推动了人类婴儿微生物群落模型中宏基因组学的重大转变。在缺乏纤维的生酮配方奶粉中添加纤维可恢复癫痫发作抵抗力,而用过量纤维补充保护性配方奶粉可增强癫痫发作抵抗力。通过筛选 13 种纤维来源和类型,本研究确定了模型群落中与癫痫发作抵抗力增加相对应的宏基因组学反应。补充抗癫痫纤维可丰富与奎辛生物合成和 preQ0生物合成相关的微生物基因,并减少与蔗糖降解和 TCA 循环相关的基因,这些基因也出现在喂食含纤维生酮配方的抗癫痫小鼠中。这项研究表明,不同配方的生酮饮食,尤其是膳食纤维含量,对小鼠的癫痫发作结果有不同的影响,这可能是通过改变肠道微生物群来实现的。了解饮食、微生物群和宿主对癫痫发作的易感性之间的相互作用可以为治疗难治性癫痫的新型微生物群指导方法提供信息。
+ + + + +



 English
English


