文献解读|Nat Med(50):接受猪肝异种移植的人类死者的免疫细胞景观
✦ +
+
论文ID
原名:Immune cell landscape in a human decedent receiving a pig liver xenograft
译名:接受猪肝异种移植的人类死者的免疫细胞景观
期刊:Nature Medicine
影响因子:50
发表时间:2025.07.30
DOI号:10.1038/s41591-025-03860-y
背 景
近年来,异种移植成为解决同种异体器官短缺问题的一种有效方法,为终末期肝病患者带来了新的希望。基因编辑的猪器官,包括肝脏、心脏和皮肤,目前是最适合临床移植的候选器官。大量的临床前和临床研究已经证明了异种移植的潜力,包括猪心脏和肾脏的移植。临床接受者的外周血和猪肝移植中的免疫细胞的转录组特征仍在很大程度上未曾探索,并且可能解释临床观察到的变化。多项研究已使用转录组测序分析(RNA-seq)研究了异种移植模型和临床患者的细胞动态。例如,在一项猪-人肾异种移植研究中,对猪肾和受体外周血单核细胞 (PBMC) 进行了纵向单细胞转录组分析(scRNA-seq)。这项研究确定了猪内皮细胞内的排斥特征,并观察到 PBMC 中两波不同的免疫反应,为改进基因编辑和免疫抑制策略提供了见解。此外,空间转录组分析研究发现了肾小球中与排斥相关的特征,揭示了效应免疫细胞和抗体介导排斥的介质的作用。鉴于这些发现,问题仍然存在:在猪肝移植过程中外周血和异种移植中人体免疫细胞的状况如何?
实验设计
结 果
01
术后期间 PBMC的总体变化
为了分析PBMC中的转录组变化模式,研究团队在器官移植手术当天[第 -1 天注射一剂抗人 T 淋巴细胞球蛋白 (ATG) 和 Solu-Medrol 后以及移植后 2 小时和第 1、3、5、8 和 10 天采集血液样本,分离 PBMC 并进行 scRNA-seq。在门静脉再灌注后 2 小时和手术后 10 天采集猪肝样本。使用人类基因组芯片进行 scRNA -seq和空间转录组分析(图1a)。此外,对接受者的全血和血清进行了常规血液检测、血清生化和免疫细胞分析(图1b)。他们检测了患者在移植前后的抗非半乳糖抗体水平,流式细胞技术评估血清 IgG 和 IgM 与猪 PBMC的结合,结果显示为相对几何平均值(rGM)。血清抗猪 IgM 和 IgG 水平没有升高,表明猪肝受体中没有产生升高的异种抗体(图1c)。鉴于不同数据在异种移植实验中的重要性,他们将 PBMC scRNA-seq 数据(第 10 天)映射到人类和猪的参考基因组。此外,他们根据已发表的猪到人心脏异种移植研究,通过流式细胞技术检测了受体 PBMC中的嵌合现象。这些结果表明,猪 CD45+ /人 HLA−细胞占 0.21%。
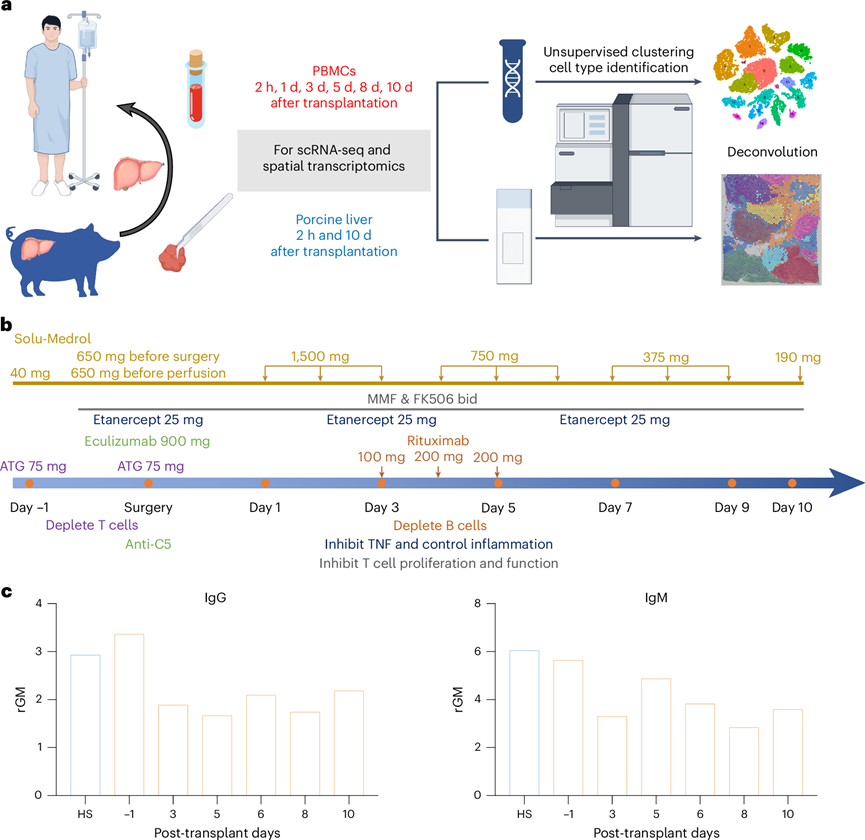
图1. 猪至人死后肝异种移植的转录组学分析示意图。
(a) PBMC和猪肝的采样策略。(b) 流程图显示了围手术期管理和免疫抑制方案给药的步骤。(c) 在指定时间点将抗体结合 IgG(左)和 IgM(右)到供体猪 PBMC。
02
术后期间 PBMC的总体变化
他们整合了不同时间点的scRNA-seq数据,并根据特定标志物确定了主要的PBMC类型(图2a-b)。确定了八种细胞成分,并在均匀流形近似和投影(UMAP)图中可视化了围手术期主要细胞类型的分布(图2c)。T细胞逐渐增加,而B细胞受到利妥昔单抗治疗的抑制(图2c)。在异种移植早期,单核细胞的丰度在最初增加之后下降(图2d)。这些变化与常规血液检测结果一致(图2e)。上述一些变化与肝同种异体移植中的变化相似,在移植后早期以先天免疫细胞(单核细胞和巨核细胞)为主,随后CD8 + T细胞,CD4 + T细胞和自然杀伤细胞扩增。值得注意的是,在 PBMC 条件下难以分离的中性粒细胞在第 1 天出现,并在异种移植随访期间逐渐增加,可能反映了低密度特征、未成熟中性粒细胞动员和脱颗粒(图2d)。
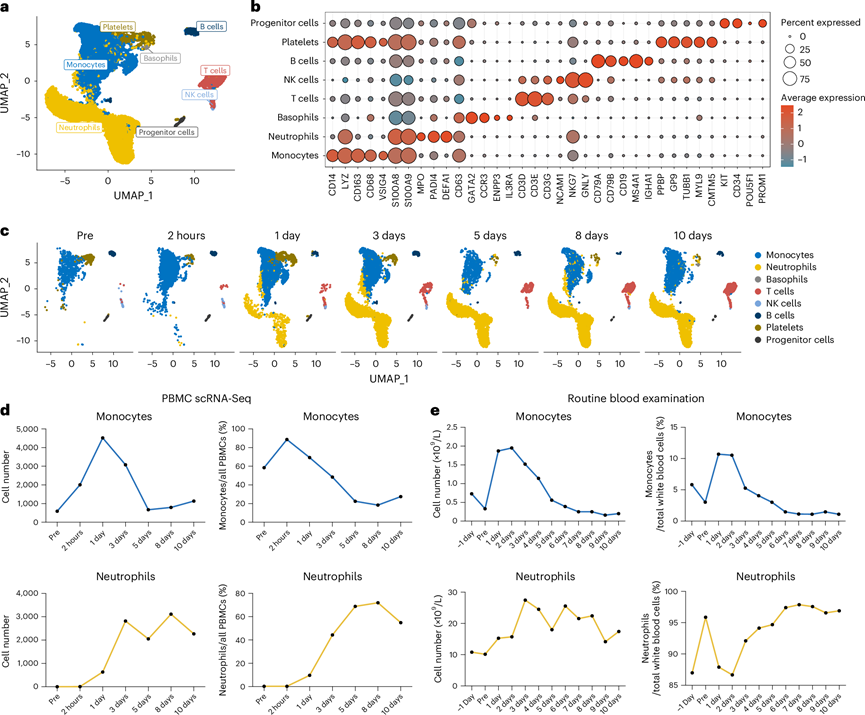
图2. PBMC 的单细胞转录组图。
(a) 基于UMAP图的scRNA-seq显示PBMC中的主要人体细胞成分。(b) 点图显示PBMC中每种细胞类型的特定标记的表达。(c) UMAP图显示监测期内主要细胞类型的分布。(d) 折线图显示由scRNA-seq数据确定的PBMC中的绝对细胞计数和单核细胞和中性粒细胞的百分比变化。(e) 折线图显示常规血液检查外周血样本中单核细胞和中性粒细胞的丰度。
03
受体 PBMC中的单核细胞模式分析
鉴于在异种移植早期阶段先天免疫细胞在细胞数量和比例上占主导地位,单核细胞(PBMC scRNA-seq 数据中的主要细胞类型)在先天免疫中起着至关重要的作用。进一步对 PBMC 中的单核细胞进行聚类,发现基于 FindAllMarkers 函数识别的特定标记物有 12 个不同的聚类(图3a)。聚类 3、6 和 7 代表非经典单核细胞,其特征是 CD16 表达高。PPBP+、JCHAIN+和 HBB+细胞可能分别代表粘附于血小板、免疫球蛋白和红细胞上的单核细胞。他们发现 GSR+单核细胞高表达谷胱甘肽二硫键还原酶(GSR),这与氧化应激有关;在所有单核细胞亚型中,这些单核细胞表现出相对较低的分化状态。同样,通过 CytoTRACE 技术分析,EGR1+单核细胞显示出相对较低的分化特征和生长因子反应特征(图3b),这两种单核细胞群体都可能在移植后的促炎环境激活。此外,IL-1B+单核细胞由于高 IL-1B 表达(众所周知的促炎因子)而表现出促炎特性。FLT3 参与细胞增殖和抗凋亡,反映了先天免疫细胞活化,而 LTF+单核细胞在衰老相关分泌因子途径中表现出富集(图3c),表明这两种单核细胞群体的增殖和衰老状态。最后,他们鉴定出 THBS1+单核细胞,它们高度表达参与血小板活化和脱颗粒的血小板反应蛋白-1。常见的巨噬细胞标志物VSIG4和C1QC具有巨噬细胞样表型,有异种移植浸润的潜力,与调节T细胞耗竭的PD-1信号有关(图3c)。轨迹分析显示,这三个单核细胞群(THBS1+、C1QC+和VSIG4+)代表了不同的细胞命运(图3d)。移植后早期,THBS1+单核细胞在外周血中占主导地位,而C1QC+和VSIG4+单核细胞在第3天和第5天左右出现。在后期,分化程度较低的单核细胞持续存在于外周血中,表明持续的先天免疫活动(图3a)。
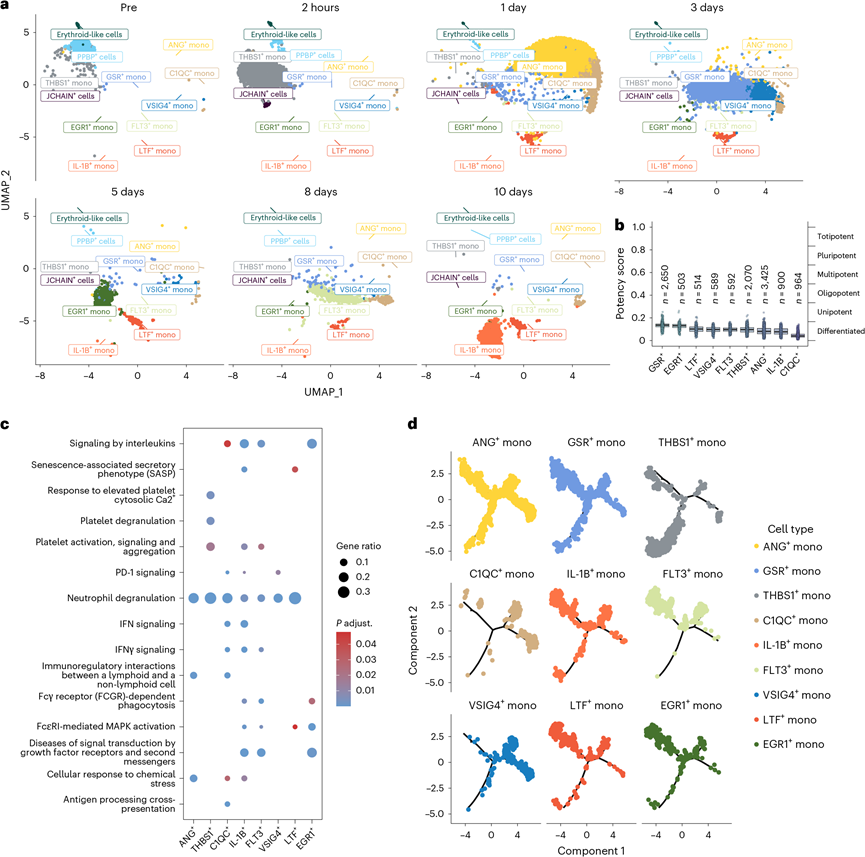
图3. PBMC 中的单核细胞聚类的鉴定。
(a) UMAP 图显示了监测期内单核细胞亚型的分布。(b) CytoTRACE 分析显示了单核细胞聚类的分化状态。(c) 使用双侧超几何检验对单核细胞亚型进行基因通路富集分析。(d) 使用 Monocle 2 对单核细胞聚类进行细胞轨迹分析。
04
猪肝中的浸润单核细胞分析
为了探索猪肝中功能性单核细胞亚型,他们首先分析了整合的 scRNA-seq 数据,在 UMAP 图中识别出主要的细胞成分,猪肝中的单核细胞来源于 THBS1+、 IL-1B +和 C1QC+单核细胞(图4a)。基因通路富集分析显示 THBS1+单核细胞与血小板活化有关;C1QC+单核细胞与抗原呈递和 PD-1 信号传导有关;IL-1B+单核细胞与促炎细胞因子产生潜力相关(图4b)。为了确定它们的空间分布,他们使用对 scRNA-seq 和空间 RNA-seq 数据进行了反卷积分析,这证实了 THBS1+单核细胞在 2 小时和 10 天样本的血管区域中的定位符合预期(图4c)。进一步研究 THBS1+单核细胞在血小板活化中的作用表明,活化部分凝血活酶时间 (APTT) 水平在手术当天迅速升高(图4d),与外周血 THBS1+单核细胞计数相关 (图4e)。这表明 THBS1+单核细胞可能导致凝血障碍。
CellChat 分析证实了 THBS1+单核细胞-血小板通过 THBS1-CD36 通路相互作用(图4f),而空间转录组分析显示 THBS1 和 CD36 共定位(图4g)。免疫荧光染色显示异种移植中 THBS1 和 CD14 共定位(图4h)以及 CD42b(血小板标志物)和 THBS1+有核细胞之间的粘附(图4i)。这些发现表明 THBS1+单核细胞浸润可能导致凝血障碍和随后的血管并发症。此外,对来自同种异体移植大鼠模型和临床患者的 scRNA-seq 数据的分析表明,THBS1高表达的单核细胞在排斥的同种异体移植肝脏中积聚,表明与移植物排斥有关。
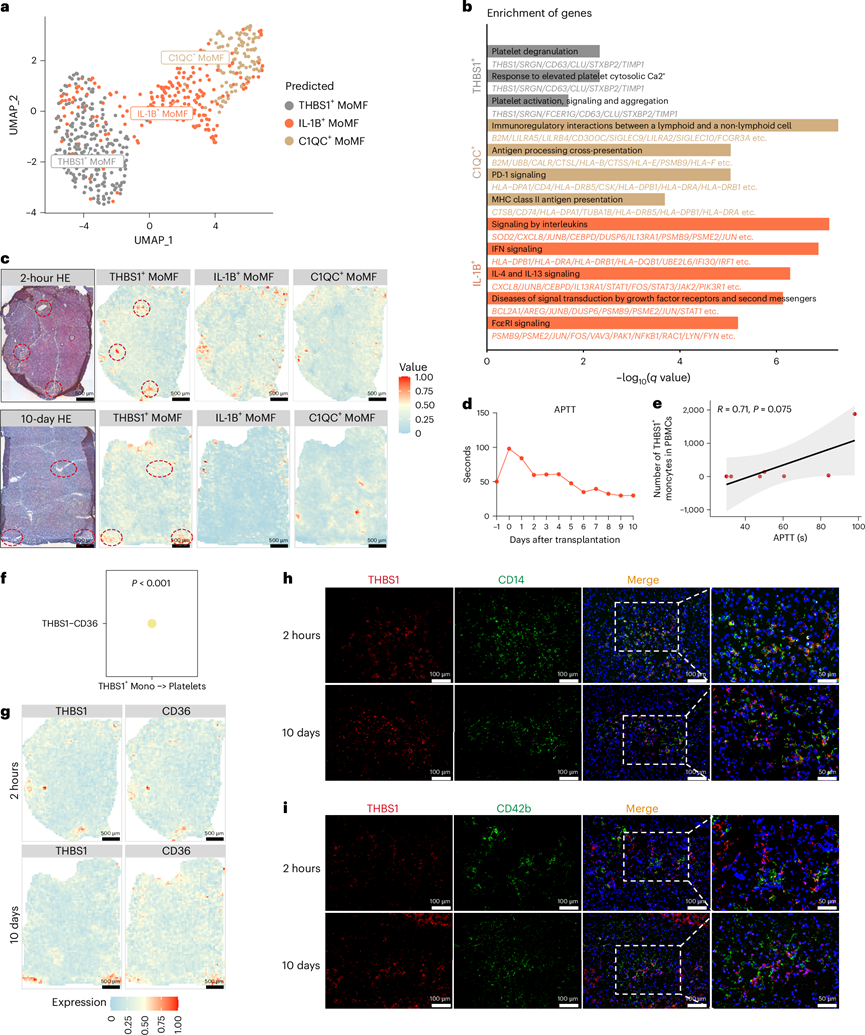
图4. 移植猪肝中单核细胞亚群的鉴定。
(a) UMAP 图显示移植猪肝中的单核细胞亚型。(b) 基因通路富集分析。(c) 猪肝样本中THBS1+、IL-1B+和 C1QC +单核细胞的空间分析。(d) 折线图显示监测期间的 APTT 水平。(e) PBMC中APTT 水平和 THBS1+细胞数量之间的相关性。(f) CellChat 分析用于预测 THBS1+单核细胞和血小板之间的配体-受体相互作用。(g) 通过空间转录组分析评估猪肝中 THBS1 和 CD36 表达的可视化。(h-i)免疫荧光染色代表性图像。
05
PBMC中T细胞的整体变化
接下来,他们检测了外周血中 T 细胞的转录组模式。无监督聚类确定了 10 个不同的 T 细胞聚类,其中两个CD4+聚类和七个 CD8+聚类。根据已建立的功能标记定义T 细胞亚型,并通过 CytoTRACE 和 Monocle 分析进行验证。T 细胞计数逐渐增加,可能由于持续的异种移植抗原刺激和对免疫抑制方案的耐受性(图2c,图5a-b)。移植后早期以耗竭的 CD8 + T 细胞为主,反映了有效的免疫抑制。 CD4+ T 细胞直到晚期才在外周血中检测到,与异种移植抗原驱动的细胞毒性和记忆性 T 细胞扩增相一致(图5a-b)。这些动态变化与同种异体肝移植相似。移植后 7 天内,CD4+和 CD8 + T 细胞均显著下降,原因是强化免疫抑制和手术应激,但由于持续的免疫抑制治疗和抗原暴露,从第 7 天到 1 年, CD4+和CD8+ T 细胞持续增加。流式细胞分析显示临床血液分析中辅助性 T 细胞频率和辅助性/抑制性 T 细胞比率升高(图5c),表明在晚期随访中适应性免疫激活逐渐增多。围手术期组织学分析显示猪肝仅有轻度窦状充血和炎症浸润,无排斥症状,这促使他们进一步研究肝内 T 细胞功能。
在整合的 scRNA-seq 数据中对 T 细胞群进行聚类和表征后,他们观察到浸润的 T 细胞与外周血中的 T 细胞相比表现出不同的模式。在移植肝脏中未检测到 CD4+ T 细胞;相反,46.8%表达高水平 TRDC/TRDV1/TRGC1/TRGC2 的 T 细胞鉴定为 γδT 细胞(图5d-e)。这一发现表明适应性免疫功能受损。γδT 细胞约占肝淋巴细胞总数的 3-5%19。对来自深度整合人类单细胞组学(DISCO)数据库的 scRNA-seq 数据的分析表明,γδT 细胞占所有肝脏 T 细胞的 3.11%。根据正常肝脏和临床同种异体移植肝脏的 scRNA-seq 数据,γδT 细胞在移植肝脏中扩增,但仍占 T 细胞群的较低百分比(3-5%)。他们认为这种 γδT 细胞扩增可能代表免疫抑制管理下的异种移植特异性现象。在健康肝脏中,耗竭的 T 细胞稀少,仅占所有肝脏 T 细胞的 0.41%。在肝同种异体移植者中也观察到耗竭 T 细胞的扩增。异种移植肝脏的空间转录组分析数据进一步证明耗竭 T 细胞的广泛浸润,即使在后期随访中仍然存在,但是外周血中 T 细胞明显活化(图5f)。总之,这些发现表明特定的肝细胞成分导致 T 细胞耗竭。
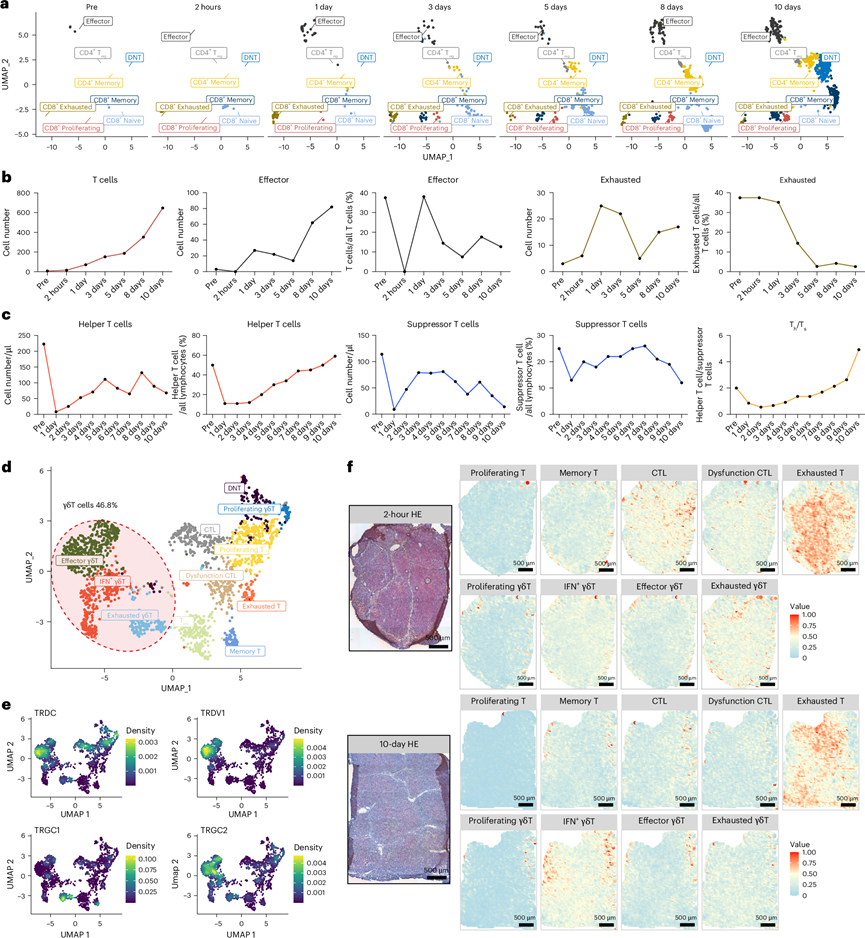
图5. 已渗入移植猪肝的 T 细胞的特征。
(a) UMAP 图显示了监测期间 PBMC 中 T 细胞亚型的分布。(b) 根据 scRNA-seq 数据确定的监测期间 T 细胞、效应 T 细胞和耗竭 T 细胞的绝对细胞计数和百分比的折线图。(c) 通过外周血样本流式细胞检测的辅助性 T 细胞和抑制性 T 细胞的绝对值和百分比的折线图。(d) UMAP 图显示了已渗入移植猪肝的 T 细胞亚型。(e) T 细胞聚类的 γδT 标志物表达水平的密度图。(f) 左图为移植后 2 小时和 10 天收集的猪肝样本的 HE 染色图像;右图为 CARD 包推断出的 2 小时和 10 天猪肝样本中所示 T 细胞亚型的空间位置。
06
单核细胞表达 PD-L1 并导致 T 细胞耗竭
为了研究细胞与T细胞的相互作用,他们进行了CellChat分析。结果表明T细胞、单核细胞和自然杀伤细胞之间存在相互作用(图6a)。进一步分析表明,C1QC+单核细胞与耗竭T细胞的相互作用最强(图6b)。使用NicheNet软件进行的配体-受体分析表明,与细胞毒性T淋巴细胞(CTL)相比,TGFB1和CD274(PD-L1)是导致耗竭T细胞标志物上调的主要配体(图6c)。PD-L1由C1QC+单核细胞特异性表达(图6d-e),其还表现出调节性巨噬细胞表型,如特异性标志物所示(图6f)。值得注意的是,与来自 PBMC的单核细胞相比,PD-L1 在肝脏浸润单核细胞中的表达上调(图6g)。免疫荧光染色进一步显示 PD-L1 表达与巨噬细胞标志物 CD68 共定位(图6h)。与空间转录组分析数据一致,发现 C1QC+单核细胞与 PD-L1 表达区域共定位,并且与 10 天猪肝样本中耗竭的 T 细胞微环境相邻(图6i)。这些结果表明 PD-L1 在浸润到异种移植瘤时上调,PD-L1高C1QC+单核细胞在 T 细胞耗竭中起关键作用。类似地,来自大鼠同种异体移植模型的scRNA-seq数据显示,PD-L1高表达单核细胞在未发生排斥反应的同种异体移植物中聚集,而在发生排斥反应的同种异体移植物中减少,其潜在机制值得进一步研究。
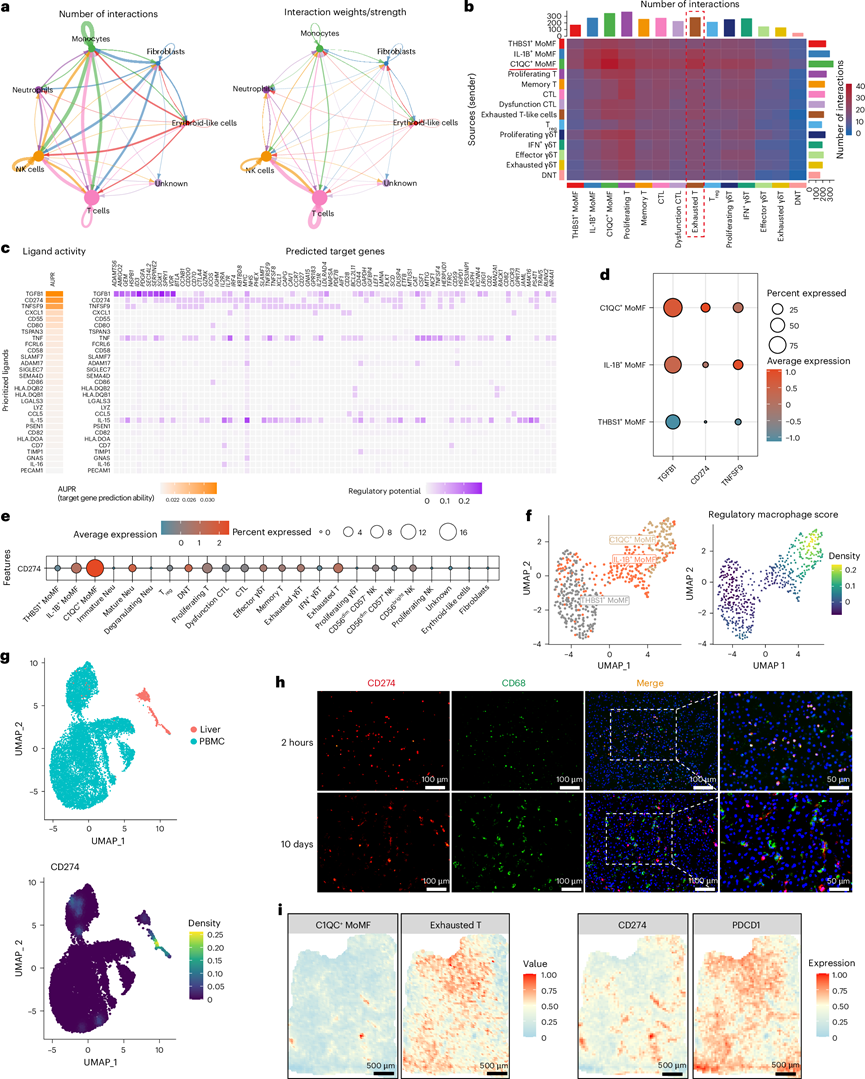
图6. 移植猪肝中的C1QC +单核细胞表达 PD-L1 并诱导 T 细胞耗竭。
(a) 对移植猪肝中浸润的细胞类型进行 CellChat 分析,以评估与 T 细胞相互作用的主要细胞类型。(b) CellChat 包预测的猪肝中不同细胞群之间相互作用数量的热图。(c) 热图显示由 NicheNet 包计算的配体活性和调节潜力,用于分析 CTL 向耗竭 T 细胞的转换。(d) 点图显示预测诱导 CTL 向耗竭 T 细胞转变的三种配体的表达情况,这些配体在浸润到猪肝的单核细胞中。(e) 点图显示移植猪肝中所有细胞类型中 PD-L1(CD274)的表达水平。(f) UMAP 图和密度图显示单核细胞聚类中的调节性巨噬细胞评分。(g) UMAP 图和密度图显示从 PBMC 或移植猪肝中获得的单核细胞中 PD-L1(CD274)的表达。(h) 移植后 2 小时和 10 天移植猪肝组织中 CD274(红色,PD-L1)和 CD68(绿色)的免疫荧光染色代表性图像。(i) 使用空间转录组分析可视化移植后 10 天移植猪肝中的 PD-L1(CD274)和 PDCD1 表达。
+ + + + + + + + + + +
结 论
本研究探究了接受猪肝异种移植的人类死者外周血和移植肝脏中的免疫细胞群细胞,并对其进行了为期 10 天的监测。使用scRNA-seq和空间转录组分析技术,发现 T 细胞在外周血中逐渐发生激活,而 γδT 细胞和耗竭的 T 细胞广泛渗入猪肝,表明适应性免疫受损。此外,本研究还发现了两个不同的单核细胞聚类,它们可能影响异种移植后的凝血和免疫反应。首先,在移植后的早期阶段,THBS1+单核细胞有可能通过 THBS1-CD36 信号通路与血小板相互作用来调节凝血。其次,在后期,C1QC +单核细胞渗入猪肝,可能通过诱导 CD274 (PD-L1) 表达促进 T 细胞耗竭。总之,本项研究阐明了先天免疫细胞如何影响肝异种移植后的血栓形成和免疫途径,并应促使进一步研究以阐明 THBS1+和 C1QC+单核细胞的作用。
+ + + + +



 English
English


