文献解读|Signal Transduct Target Ther(52.7):单细胞转录组分析确定催乳素受体是子宫腺肌病的治疗靶点
✦ +
+
论文ID
原名:Single-cell RNA sequencing identifies the prolactin receptor as a therapeutic target in adenomyosis
译名:单细胞转录组分析确定催乳素受体是子宫腺肌病的治疗靶点
期刊:Signal Transduction and Targeted Therapy
影响因子:52.7
发表时间:2025.08.13
DOI号:10.1038/s41392-025-02339-z
背 景
子宫腺肌病的特点是子宫内膜组织侵入子宫肌层,并伴有周围子宫肌层细胞增生肥大,导致子宫壁增厚和整个子宫增大。子宫腺肌病的临床表现包括痛经、月经过多、慢性盆腔痛和不孕症,严重影响妇女的生活质量。虽然由于诊断标准不一致,其患病率估计存在差异,但子宫腺肌病已是一种影响数千万至数亿育龄妇女的主要妇科疾病,因此,需要加强对它的认识和研究。
实验设计
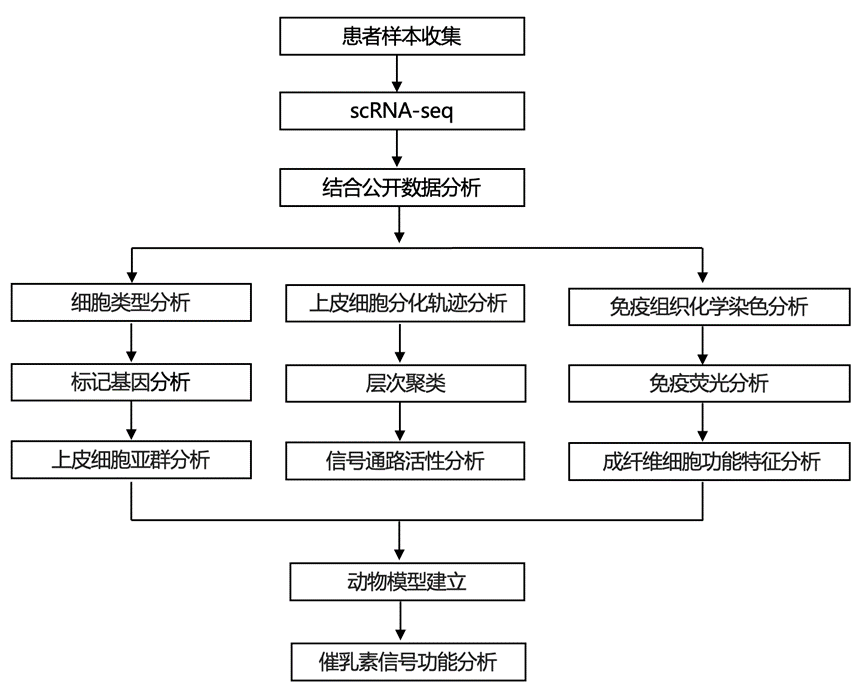
结 果
01
子宫内膜组织中 ECM 含量高的上皮细胞的鉴定
研究团队通过单细胞转录组分析(scRNA-seq)技术分析了13例接受子宫切除术的患者的子宫样本。为了最大程度地减少月经周期变异的影响,所有样本均在分泌期采集,以便全面了解子宫内膜的细胞组成。对照样本(Ctrl_EU)取自7例未患子宫腺肌病的患者的在位子宫内膜,而6例子宫腺肌病患者的样本则同时包含在位组织(AM_EU)和异位组织(AM_EC)(图1a)。所有参与者在手术或样本采集前至少3个月均未服用激素药物。
组织学检查通过发现子宫内膜腺体侵犯子宫肌层,确诊子宫腺肌病(图1b)。经过质量控制后,共分析了171489个细胞,并根据相应的标记基因注释为上皮细胞、成纤维细胞、壁细胞、内皮细胞或免疫细胞(图1c-e)。虽然在位和异位子宫内膜样本的细胞类型组成存在差异,但各组内均观察到一致性。
AM_EC 样本中内皮细胞占整个细胞群的比例显著增加,表明病变内有活跃的血管生成(图1d)。特别是在内皮细胞亚群中,包括毛细血管内皮细胞 (CapEC)、动脉内皮细胞 (AEC)、静脉内皮细胞 (VEC)、淋巴管内皮细胞 (LEC)、增殖内皮细胞 (增殖 EC) 和表达成纤维细胞标志基因的内皮细胞 (Fib_like EC),CapEC 在病变中尺寸增加最为显著。血管系统的另一个重要组成部分是壁细胞。根据先前的研究,壁细胞可分为血管周细胞(Prv_STEAP4)、血管平滑肌细胞(VSMC)、子宫平滑肌细胞(uSMC)和肌成纤维细胞(图 1c)。壁细胞和内皮细胞之间通过VEGF信号进行的串扰,尤其是 uSMC/VSMC 和 CapEC 之间的相互作用,在 AM_EC 中明显增强。这种增强的 VEGF 信号传导可能解释了病变中观察到的血管生成活性增强以及与子宫腺肌病相关的异常出血。
先前对人类子宫内膜基质细胞的研究已经发现了表达补体成分 7 (C7) 的成纤维细胞特殊亚群。这些 Fib_C7 细胞在子宫内膜基底层富集。有趣的是,在子宫腺肌病患者的异位子宫内膜组织中,成纤维细胞中这些 Fib_C7 的百分比增加(图1f)。除了 Fib_C7 之外,其余成纤维细胞进一步分为 3 个亚群:蜕膜基质细胞 1 (ds1)、蜕膜基质细胞 2 (ds2) 和蜕膜前基质细胞 (Pre-ds)。亚群 Pre-ds 以与细胞增殖相关的基因为特征,例如MKI67、TOP2A、CENPF、CDK1和CCNB1。ds1 细胞的特征是调节细胞增殖、凋亡和迁移的基因,例如MT2A、HMGA1、ETS2、GLIPR1和CAV1。ds2 细胞的特征基因是那些对生长或压力刺激作出反应的基因(例如EGR1、IER2、TXNIP、DNAJB1、ZFP36 和HSPA1B)。此外,ds1 细胞中DKK1和WNT4的表达最高,而类固醇受体的表达水平低于 ds2 细胞。同样,与 ds2 细胞相比,ds1 细胞中参与 TGFβ 和 IGF 信号传导的基因表达趋于降低,表明 ds1 细胞处于分化程度更高的状态。
与病理结果一致,scRNA-seq 证实了 AM_EC 样本中存在上皮细胞(图1d)。为了描述子宫腺肌病中上皮细胞的变化,他们将上皮细胞分为 6 种亚型:腺型、腺分泌型、纤毛型、增生型、免疫相关型和ECM-high上皮细胞(图1g)。子宫腺肌病患者和对照组上皮细胞最显著的差异是ECM-high群体的增加(图1g)。这些细胞表达上皮细胞(EPCAM)和成纤维细胞(DCN)标志物(图1h),它们的特征生物学过程和分子功能与组织或结合 ECM 有关。其他研究也发现了具有上皮细胞和成纤维细胞双重特征的类似细胞,并且在生理条件下存在于子宫内膜中。
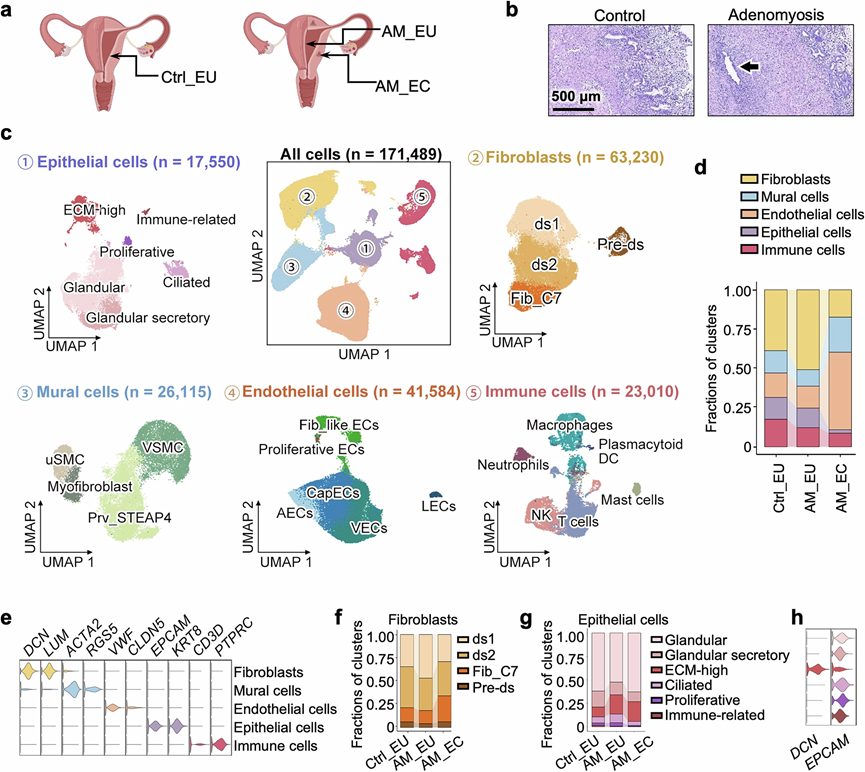
图1. 子宫内膜中ECM含量高的上皮细胞的鉴定。
(a) 图中显示了为进行scRNA-seq采集的子宫活检样本的位置,包括无子宫腺肌病患者的正常子宫内膜(Ctrl_EU)以及子宫腺肌病患者的正常子宫内膜(AM_EU)和异位子宫内膜(AM_EC)。(b) 未患子宫腺肌病(对照组)或患子宫腺肌病(子宫腺肌病组)的参与者子宫内膜的苏木精-伊红 (H&E)染色代表性图像。(c) 均匀流形近似和投影 (UMAP) 图显示来自正常和异位子宫内膜组织样本的 171489 个单细胞(中心 UMAP 图),这些单细胞分为 5 种细胞类型:上皮细胞、成纤维细胞、壁细胞、内皮细胞和免疫细胞。(d) 条形图显示Ctrl_EU、AM_EU 和 AM_EC 不同样本组中所有细胞中主要细胞类型的比例。(e) 小提琴图显示用于识别此 scRNA-seq 数据集中主要细胞类型的标记基因的表达。(f) 条形图显示不同样本组中成纤维细胞亚聚类的比例。(g) 条形图显示不同样本组中上皮细胞亚聚类的比例。(h) 小提琴图显示ECM含量高的上皮细胞同时表达 EPCAM 和 DCN。
02
子宫腺肌病中ECM含量高的上皮细胞的病理改变
通过Slingshot 对细胞分化轨迹的推断提示ECM-high细胞具有分化成多种上皮细胞亚型的潜力(图2a)。CytoTRACE分析也表明ECM-high细胞相对于其他上皮亚聚类表现出更高的分化潜能(图2b)。值得注意的是,在确诊患有子宫腺肌病超过2年的患者中,上皮细胞群中ECM-high细胞比例的增加更为明显(图2c)。随着病情进展,分化潜能和细胞群的扩大提示ECM-high上皮细胞可能在子宫腺肌病的进展中发挥重要作用。
层次聚类分析显示,在位子宫内膜中,对照组和病程较短(≤2年)患者的ECM-high上皮细胞与典型的上皮细胞聚类,而病程超过2年(>2年)患者的ECM-high上皮细胞与成纤维细胞聚类(图2d),提示随着病情进展,这些ECM-high细胞逐渐获得更像成纤维细胞的特征。与Ctrl_EU相比,AM_EU中抑制的基因持续参与上皮的形态发生和发育,而与应激反应和细胞增殖相关的过程发生激活。值得注意的是,上皮-间质转化(EMT)标志基因的表达在患者的在位子宫内膜中并没有持续变化。因此,CDH1下调,FN1上调,而CDH2和VIM的表达水平仅在病史较长的患者的 AM_EU 中增加(图2e)。此外,尽管一组成纤维细胞特征基因(例如DCN、COL3A1、COL6A1和TGFB1)上调(图2e ),但患者 ECM 丰富的上皮细胞中主要细胞角蛋白的表达并没有降低。这些观察结果与最近的子宫内膜异位症研究一致,这些研究报告称,患者在位子宫内膜中 EMT相关基因的表达几乎没有变化。因此,EMT 可能不是子宫腺肌病或子宫内膜异位症的早期因果事件。
子宫腺肌病是一种众所周知的激素依赖性疾病,基因集变异分析 (GSVA) 表明,ECM-high 上皮细胞在所有上皮亚聚类中表现出最强的激素反应性(图2f)。患者中的这组细胞在正常和异位子宫内膜中均表现出几种激素信号通路的激活,包括黄体生成素、促卵泡激素、前列腺素、雌激素、孕酮和催乳素(PRL)的通路(图2g)。值得注意的是,PRL受体(PRLR)表达在 ECM-high 上皮细胞中高度富集(图2h),而雌激素、孕酮和雄激素受体在所有上皮亚聚类中均匀表达,这表明ECM-high相关细胞构成对 PRL 信号有反应的主要上皮亚型。
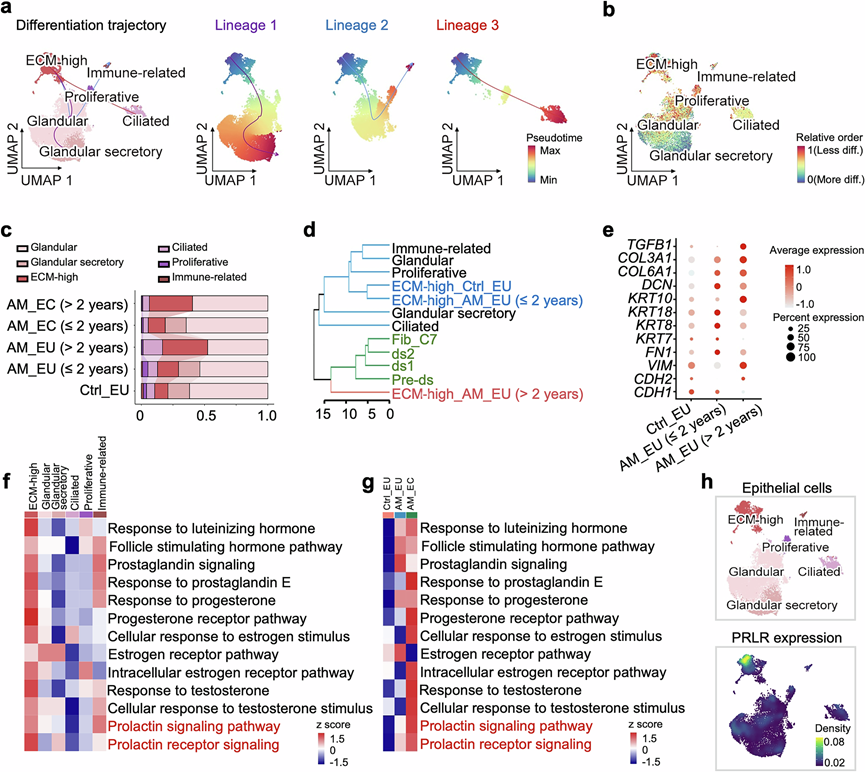
图2. 子宫腺肌病中 ECM-high 上皮细胞的病理变化。
(a) Slingshot分析显示了 3 个不同谱系的上皮细胞分化轨迹。(b) CytoTRACE 确定的每种上皮亚型的相对发育顺序。(c) 条形图显示对照个体 (Ctrl_EU) 的子宫内膜和子宫腺肌病病史少于或等于 2 年或超过 2 年的患者的在位 (AM_EU) 或异位 (AM_EC) 子宫内膜组织中上皮细胞亚聚类的分数。(d) 上皮细胞和成纤维细胞亚聚类的层次聚类。(e) 点图显示对照组(Ctrl_EU)和病程≤2年或≥2年的子宫腺肌病患者(AM_EU)在位子宫内膜ECM-high上皮细胞中EMT相关基因以及上皮细胞和成纤维细胞标志基因的Z分数尺度平均表达量。(f) 热图显示上皮细胞亚群中激素相关通路的基因集变异分析(GSVA)结果。(g) 热图显示Ctrl_EU、AM_EU和AM_EC的ECM-high上皮细胞中激素相关通路的GSVA结果。(h) 密度图显示上皮细胞中 PRLR 的表达水平。
03
增强的PRL信号促进子宫内膜上皮细胞的增殖和存活
免疫组织化学染色显示,子宫腺肌病患者血清PRL水平未升高,但PRLR表达增加(图3a-c)。此外,RNAscope染色证实了PRLR表达升高,并且即使在缺乏腺体结构的情况下,子宫肌层中也存在表达EPCAM和DCN的细胞(在本研究中代表ECM-high上皮细胞)(图3d)。这些发现表明,子宫肌层中ECM-high细胞的出现是子宫腺肌病发展的早期事件。
为了确定 PRL 信号增强的直接影响,将内源性 PRLR 表达的人原代子宫内膜上皮细胞与 PRL 一起孵育,PRL 以剂量依赖性方式刺激细胞增殖(图3e)。此外,PRL 治疗可保护子宫内膜上皮细胞免受阿霉素诱导的细胞凋亡(图3f)。与这些发现一致,scRNA-seq 数据显示异位病变中增强的 PRL 信号与凋亡评分降低相关(图3g),与同一患者相应的在位子宫内膜相比,病变中 TUNEL 染色强度降低进一步支持了这一点(图3h-i)。因此,表达 PRLR 的上皮细胞增殖增加和凋亡抑制可能共同驱动异位子宫内膜病变的扩张。
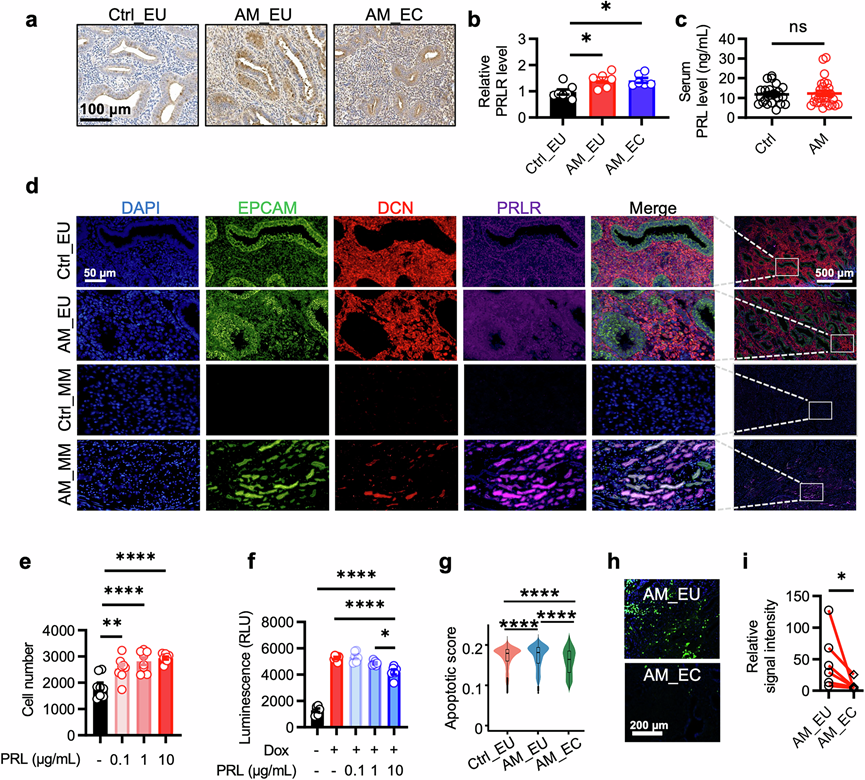
图3. PRL 信号促进上皮细胞增殖并抑制其凋亡。
(a-b) 人子宫切片中 PRLR 免疫组织化学染色的代表性图像和信号强度的统计结果。(c) 患有 (AM) 或不患有 (Ctrl) 子宫腺肌病的个体血清中的 PRL 水平。(d) 代表性图像显示对照组在位子宫内膜 (Ctrl_EU) 和子宫肌层 (Ctrl_MM) 中 EPCAM、DCN 和 PRLR 的表达,以及子宫腺肌病患者的在位子宫内膜 (AM_EU) 和子宫肌层病变 (AM_MM) 中 EPCAM、DCN 和 PRLR 的表达。(e) 用所示浓度的 PRL 处理的原代人类子宫内膜上皮细胞的数量。(f) 用阿霉素处理的原代人类子宫内膜上皮细胞中 caspase-3 和 caspase-7 活性的发光分析统计结果。(g) 箱线图和小提琴图显示 Ctrl_EU、AM_EU 和 AM_EC 组中上皮细胞的凋亡评分。(h-i) 同一患者的在位子宫内膜(AM_EU)和相应子宫肌层病变(AM_EC)的TUNEL染色信号强度的代表性图像和统计结果。
04
成纤维细胞在促进子宫腺肌病的子宫炎症、纤维化和结构破坏中的作用
子宫腺肌病的另一个重要病理特征是子宫壁纤维化,这可能会损害子宫弹性并导致不孕和痛经。病理检查显示,诊断患有子宫腺肌病超过2年的患者的子宫纤维化加剧(图4a)。成纤维细胞是组织纤维化的主要贡献者。事实上,子宫腺肌病病史较长的患者的成纤维细胞纤维化评分较高,尤其是子宫腺肌病病史较长的患者的成纤维细胞(图4b)。在成纤维细胞中,Fib_C7 的纤维化评分最高)。先前的研究表明,Fib_C7 细胞是子宫内膜异位卵巢病变中的主要成纤维细胞。类似地,AM_EC 中 Fib_C7 的比例增加(图1f),这可能加剧了子宫腺肌病的纤维化。此外,Fib_C7 是一种特殊的成纤维细胞亚聚类,富集于将功能层与子宫肌层分隔开的致密基底层,并且对于通过产生 ECM 成分来维持基底层的结构和功能完整性至关重要。有趣的是,患者在位子宫内膜的 Fib_C7 细胞的纤维化评分略低于对照细胞,这与GO分析富集的受抑制的 ECM 和细胞粘附相关通路有关。 ECM 的破坏可能会扰乱子宫内膜基底层的完整性,从而促进子宫内膜成分侵入子宫腺肌病患者的子宫肌层。
研究表明,增强的纤维化可能是炎症反应的后遗症。因此,他们评估了所有主要细胞类型中的炎症基因集。有趣的是,在所有主要细胞类型中,成纤维细胞的炎症评分增加最显著,而免疫细胞仅表现出中等或可忽略不计的变化,这表明成纤维细胞是与子宫腺肌病相关的增强炎症的主要来源。特别是,亚群 ds1 成纤维细胞在基础条件和子宫腺肌病下均表现出最高的炎症评分(图4c)。差异基因表达分析一致地强调了几个炎症相关基因是 ds1 的顶级特征基因,并且炎症通路是 ds1 群体中 AM_EU 相对于 Ctrl_EU 的主要激活过程(图4d),证实了 ds1 细胞参与了子宫腺肌病相关的炎症。值得注意的是,ds1细胞在患者体内表现出PRLR表达增加和PRL信号增强(图4e-f)。此外,用PRL治疗人子宫内膜基质hEM15A细胞可诱导一组与子宫腺肌病相关的炎症细胞因子的表达(图4g),这表明PRL信号有助于增强成纤维细胞的炎症反应。
除了纤维化和炎症之外,子宫腺肌病还会破坏成纤维细胞的生理功能。重要的是,成纤维细胞和上皮细胞之间的通讯受损。首先,成纤维细胞介导的 WNT 和 NOTCH 信号在月经周期再生过程中调节上皮细胞的命运。在子宫腺肌病患者中,WNT 和 NOTCH 信号均消失。此外,子宫腺肌病患者的成纤维细胞和上皮细胞通过细胞粘附信号[例如连接粘附分子 (JAM) 和钙粘蛋白 (CDH)]进行的通讯下调。受抑制的 JAM 信号与角质形成细胞和癌细胞的增殖和迁移有关,并通过 E-钙粘蛋白抑制细胞间相互作用,直接损害细胞附着并促进迁移,这些结果表明子宫内膜上皮细胞与周围环境的正常相互作用发生破坏。
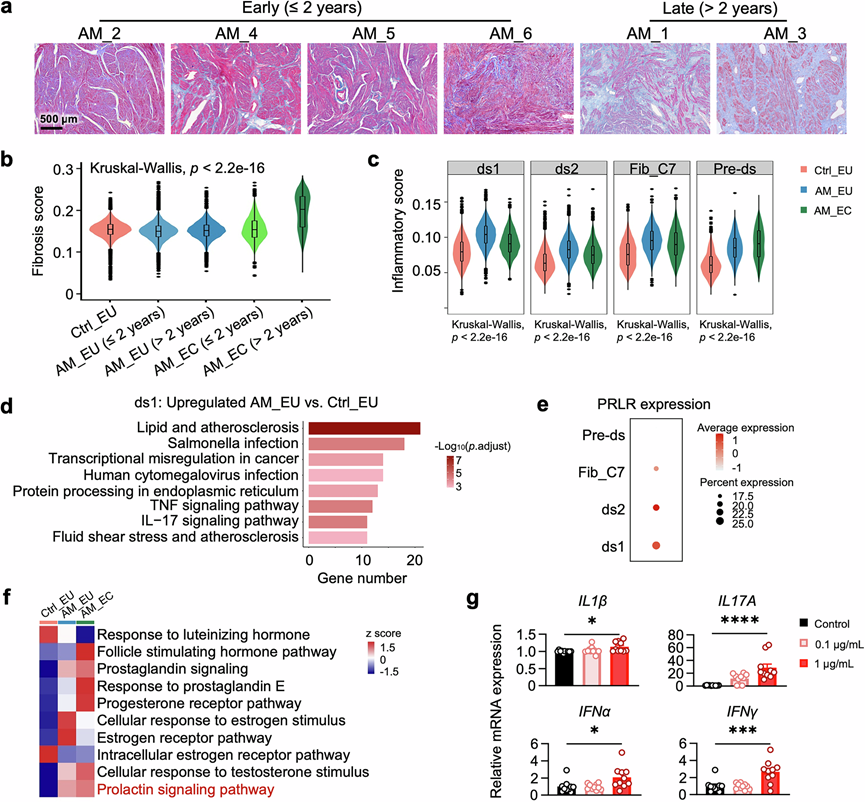
图4. 成纤维细胞亚聚类 ds1 在子宫腺肌病中富集了炎症基因的表达并增强了 PRL 信号传导。
(a) Masson 三色染色代表性图像。(b) 成纤维细胞的纤维化评分。(c) 箱线图和小提琴图显示不同成纤维细胞聚类的炎症评分。(d) 条形图显示通过KEGG分析富集的激活通路。(e) 点图显示每个成纤维细胞亚群中 PRLR 的Z分数尺度平均表达。(f) 热图显示 ds1 细胞中激素相关通路的 GSVA 结果。(g) 炎症细胞因子的相对 mRNA 水平。
05
催乳素信号增强促进子宫腺肌病发展
为了确定单独增强的 PRL 信号是否能够诱发子宫腺肌病,他们构建了循环 PRL 水平升高的 PRL 转基因 (PRL-TG) 小鼠(图5a),并通过分级系统在不同时间点评估其子宫,以测量子宫内膜组织侵入子宫肌层的程度。超过 80% 的 PRL-TG 小鼠在 12 月龄时患上子宫腺肌病,而它们的野生型 (WT) 同窝小鼠则表现出正常的子宫结构,这表明增强的 PRL 信号足以触发子宫腺肌病的发展(图5b-c)。他们进一步利用了一种小鼠模型,其中垂体(循环 PRL 的主要来源)已移植到肾包膜下或子宫角内。在肾包膜垂体移植(RPT)模型中,移植的垂体会释放激素进入血液,从而增加循环中的 PRL 水平;相反,在子宫角垂体移植(UPT)模型中,PRL 效应是局部的,而血清 PRL 水平并未发生显著改变。术后 2、4 或 6 个月对子宫进行组织学评估,发现子宫腺肌病呈进行性发展。到 6 个月时,所有 UPT 模型小鼠均已患上子宫腺肌病,而只有少数 RPT 模型小鼠出现病理变化,这强调了局部 PRL 信号在子宫腺肌病发病机制中的关键作用。
为了排除其他垂体衍生因素在子宫腺肌病发病机制中的作用,他们使用了HMI-115(一种靶向PRLR的单克隆抗体)来特异性阻断PRLR介导的信号传导。此外,他们还探索了靶向PRLR治疗子宫腺肌病的潜力。HMI-115在UPT术后2周给药,此时尚未出现任何病理变化。与接受人IgG治疗的对照组相比,这种早期干预显著降低了子宫腺肌病的进展和严重程度(图5d-f)。在更多治疗环境中,HMI-115 在术后 6 个月给药,此时子宫腺肌病已经确诊(图5g)。即使采用这种晚期治疗,HMI-115 也能有效降低病情严重程度,大约一半接受治疗的小鼠没有出现异位病变的病理迹象(图5h-i)。此外,HMI-115 的晚期治疗减弱了垂体移植诱导的 PRLR 表达的增加。重要的是,早期和晚期治疗均不影响体重或子宫重量。
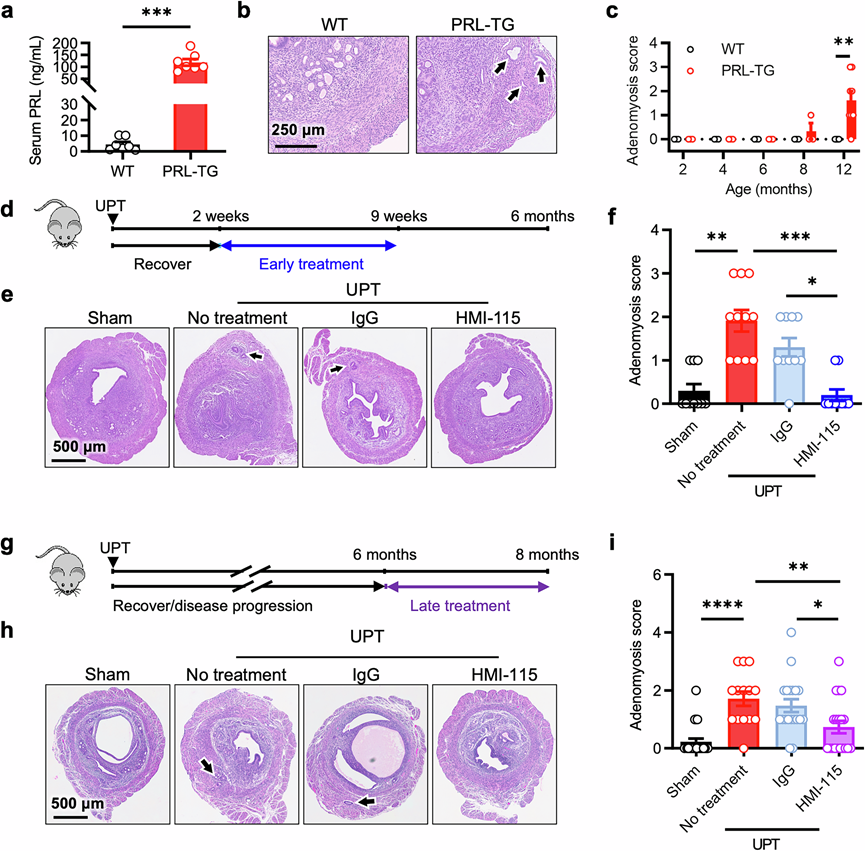
图5. 高水平的PRL会触发子宫腺肌病,而阻断PRLR则会减轻动物模型中的子宫腺肌病。
(a) PRL转基因(PRL-TG)小鼠及其野生型(WT)同窝仔鼠的血清PRL水平。(b) WT和PRL-TG小鼠经H&E染色的子宫代表性图像。(c) 所示年龄小鼠的子宫腺肌病评分。(d) 实验设计。(e) H&E 染色子宫的代表性图像。(f) 子宫腺肌病评分。(g) 实验设计。(h) H&E 染色子宫的代表性图像。 (i) 子宫腺肌病评分。
+ + + + + + + + + + +
结 论
通过对患者子宫样本进行scRNA-seq,本研究鉴定出PRL信号是子宫腺肌病的关键病理驱动因素。具体而言,scRNA-seq揭示了一个独特的上皮亚聚类,其中PRL受体(PRLR)表达丰富。PRL信号在该上皮亚聚类中过度激活,促进细胞存活和增殖,从而促进子宫腺肌病病变的形成和扩散。同时,PRLR也在成纤维细胞亚聚类中高表达,该亚聚类以炎症相关基因的强表达为特征。在临床前动物模型中,PRL 的转基因过表达或垂体移植诱导了子宫腺肌病的表型,进一步验证了病理性 PRL 过度激活。重要的是,本研究证实了局部 PRL 信号失调会导致子宫腺肌病的发生和发展,而使用单克隆抗体 HMI-115 抑制 PRLR 则显著改善了病理表现。这些发现确立了 PRL 信号是子宫腺肌病发病机制的关键驱动因素,凸显了 PRLR 抑制是一种有前景的治疗策略,并展示了 HMI-115 在治疗子宫腺肌病(一种长期因药物开发忽视的妇科疾病)方面的转化潜力。
+ + + + +



 English
English


