文献解读|J Hepatol(26.8):多组学分析揭示肝母细胞瘤的连续分化谱和 Wnt-MDK 驱动的免疫逃避
✦ +
+
论文ID
原名:Multiomic analysis uncovers a continuous spectrum of differentiation and Wnt-MDK-driven immune evasion in hepatoblastoma
译名:多组学分析揭示肝母细胞瘤的连续分化谱和 Wnt-MDK 驱动的免疫逃避
期刊:Journal of hepatology
影响因子:26.8
发表时间:2025.01.01
DOI号:10.1016/j.jhep.2025.01.031
背 景
肝母细胞瘤 (HB) 是儿童肝脏最常见的原发性恶性肿瘤,目前估计发病率约为每百万 1.5 例,且近几十年来发病率一直在上升。HB 每个肿瘤平均有 3.9 个突变,与成人癌症相比,乃至与其他儿童癌症相比,其突变负担较低。HB 中的大多数复发性基因突变会导致 Wnt/β-catenin 信号通路异常激活,其中CTNNB1改变会导致 β-catenin 降解减少,在 80% 的病例中均有出现。了解肿瘤微环境(TME)的复杂环境已为成人癌症带来了有希望的新疗法,但儿童癌症的类似方法仍然缺乏。
实验设计
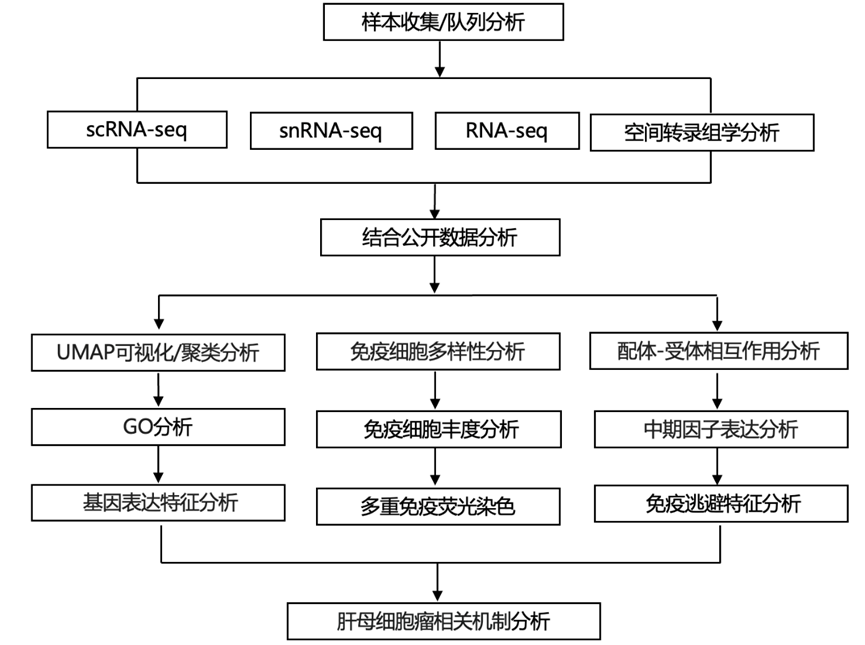
结 果
01
肝母细胞瘤肿瘤细胞表现出肿瘤间和肿瘤内异质性
为了阐明 HB 中的肿瘤异质性和 TME 景观,研究团队对 15 份人类 HB 样本进行了 单细胞转录组分析(scRNA-seq)和单细胞核转录组分析(snRNA-seq),并对 22 份和 7 份样本分别进行了空间转录组分析(ST) 和多重免疫荧光 (mIF) 染色。此外,他们整合了之前发表的包含 99 份 HB 和 11 份非肿瘤和胎儿肝脏样本的转录组分析(RNA-seq)数据以及包含健康肝脏灌注中的免疫细胞的 scRNA-seq 数据(图 1 a)。
本研究的 HB scRNA-seq 队列包含来自五名患者的十个样本,其中包括三个未接受过化疗的样本、四个接受过化疗的样本和三个来自肺转移的样本。共收集了 43441 个细胞,对其进行了进一步分析。整合所有十个样本、均匀流形近似和投影 (UMAP) 降维和聚类分析,最终得到 27 个具有不同基因表达谱的聚类。这种聚类在样本、条件和患者之间有很大重叠。通过结合典型标记基因表达、GO 分析和推断的拷贝数变异 (CNV),确定了肿瘤、淋巴样、髓样、内皮和肝星状细胞 (HSC) 的聚类(图 1b)。
总共 16978 个肿瘤细胞分成成 6个聚类(图 1c)。其中 4 个聚类,此处称为“发育 1”、“发育 2”、“发育 3”和“发育循环”,显示 PDE4D、AXIN2、SOX11和PTCH1等基因上调(图 1d)。GO 分析表明与细胞外基质 (ECM) 和早期发育相关的生物过程活性升高,例如Wnt 信号通路的调节、干细胞增殖和间充质发育;因此,他们将这组肿瘤细胞归入称为“发育”的程序 (图 1e)。其中,“发育循环”除了发育基因外,还显示与有丝分裂相关的基因上调,表明处于活跃增殖状态。相反,另一个聚类的特征是载脂蛋白和细胞色素 P450 基因家族的基因高表达,与脂质和肝脏特异性代谢有关(图1d-e)。这组分化程度更高的肿瘤细胞指定为“代谢”。“代谢”和“发育”这两个程序在某种程度上对应于公开数据中描述的 HB 分类,例如C1/C2 分类,其中 C1 组的特征是发育阶段较晚、肝脏代谢和更有利的结果,而 C2 组显示出不太发达的表型和不利的结果。来自“代谢”程序的细胞显示出更高的 C1 特异性基因表达,而 C2 特异性基因在“循环”细胞中表达更高。此外,公开数据定义的“肝细胞”聚类与本研究的“代谢”聚类有相似之处,而他们的“肝脏祖细胞”和“间充质”组都反映在本研究的“发育”程序中。有趣的是,除了这些程序之外,他们还确定了另一个聚类为“中间”,其中细胞表现出早期发育和 ECM 的转录模式,同时还表现出肝脏代谢(图 1d-e)。这表明存在沿着分化轨迹的连续细胞谱。在本研究的大多数样本中发现的“中间”细胞似乎代表了一种过渡状态。同样,来自其他程序的细胞也出现在本研究分析的大多数样本中,显示出高度的肿瘤内异质性。虽然“循环”程序主要由来自一个化疗未治疗的原代 HB 样本的细胞组成,但来自“发育”和“中间”程序的细胞趋于在化疗处理的样本中富集。他们在单独的五个 HB 样本的 snRNA-seq 队列中验证了这些结果,这验证了所识别程序的稳健性和一致性。
为了证实存在并进一步探索它们的相关性,他们为“发育”、“中间”、“代谢”和“循环”肿瘤程序创建了基因特征。他们发现“代谢”程序所代表的转录环境不是肿瘤所特有的,也可以在非肿瘤肝脏和胎儿肝脏样本中找到(图 1f)。与未经治疗的原发性 HB 样本相比,在复发或转移等后期条件下该程序的表达较低。与此相反,“发育”程序对肿瘤具有高度特异性,在后期条件下表达增加。然而,他们没有观察到“发育”评分与患者结果之间的联系。与非肿瘤肝脏相比,“循环”程序肿瘤中的富集程度明显更高,而在胎儿肝脏样本中的富集程度甚至更高。此外,“循环”评分从未治疗的原发性肿瘤到治疗、复发和转移性肿瘤逐渐增加。“中间”程序显示出对肿瘤样本高度特异性的模式,并且在患者预后较差的肿瘤样本中显示得分增加。另一个引人注目的观察结果是复发样本中“循环”和“发育”程序的活性升高,同时“代谢”程序的活性降低。这意味着复发性 HB 的侵袭性反映在更未分化和增殖的状态中(图 1f)。
为了解决肿瘤的空间组成和 scRNA-seq 识别的肿瘤程序,他们分析了 22 个人类 HB 样本的 ST 数据,证明了多个程序可以在一个样本中共存(图 1g)。虽然他们确实在某些样本中看到了“循环”或“中间”程序的明显富集,但与本研究的 scRNA-seq 数据类似,每个样本的大部分都反映在“发育”和“代谢”转录程序中。
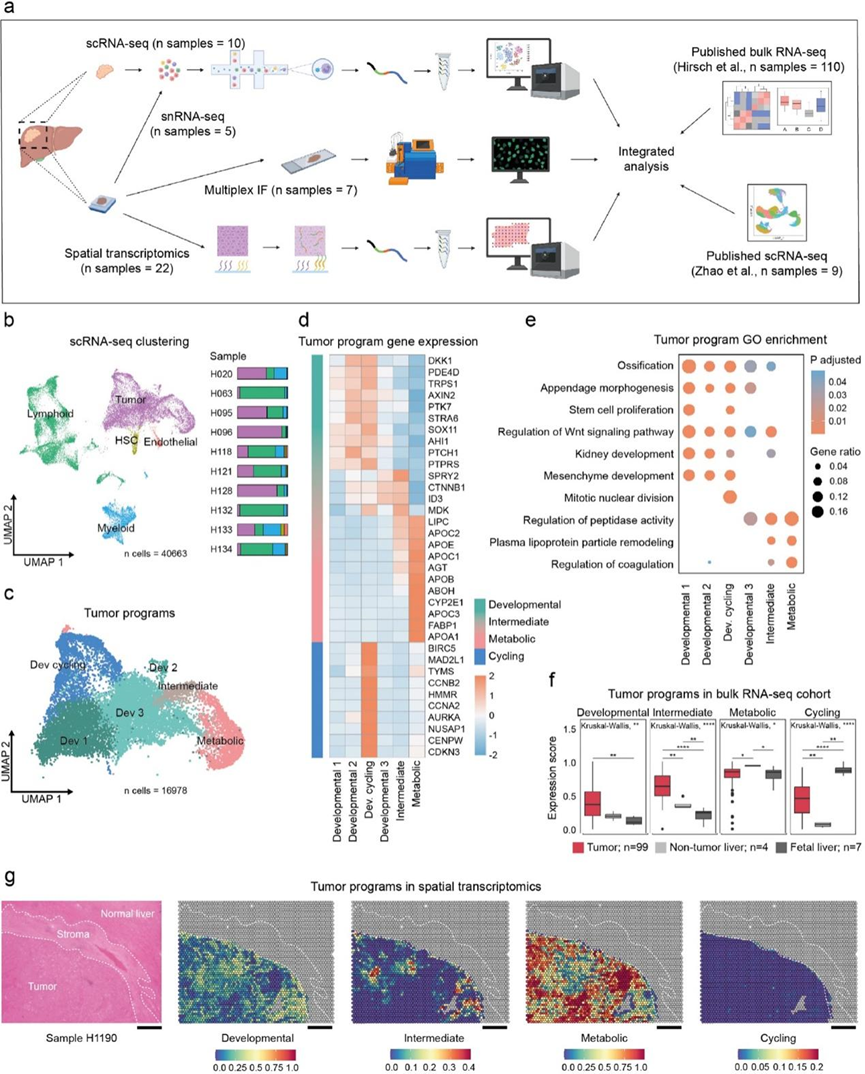
图1. 肝母细胞瘤肿瘤细胞显示肿瘤内异质性。
(a) 研究中使用的样本和技术的说明性描述。(b-c)UMAP可视化。(d) 显示代表每个肿瘤程序的标记基因的热图。(e)GO分析。(f) 代表每个肿瘤程序的基因特征表达分数的箱线图。(g) 组织病理学注释的 HB 切片的苏木精和伊红 (H&E) 染色和相应的空间转录组学 (ST) 图显示肿瘤斑点处每个肿瘤程序的丰度估计值。
02
肝母细胞瘤微环境的特点是免疫细胞多样性高
鉴于本研究的 scRNA-seq 队列中非肿瘤细胞的比例很大,更具体地说,免疫细胞的比例也很大,他们对此进行了更详细的注释。他们发现淋巴细胞类型高度多样化,尤其是 T 细胞(图 2a)。使用基于公开数据描述的肝脏免疫浸润单细胞景观的一组标记基因。他们鉴定了 CD8 + 细胞毒性 T 细胞、CD8 + 滤泡细胞毒性 T 细胞、CD8 + T 记忆细胞、粘膜相关不变 T 细胞 (MAIT)、幼稚 T 细胞以及 CD4 + T 记忆细胞和 CD4+ T 调节细胞 (Treg )。此外,他们还发现了常规和组织驻留 NK 细胞、先天淋巴细胞 (ILC)、B 细胞、浆细胞样树突状细胞 (pDC) 和一个独特的循环淋巴细胞聚类。
髓样区室约为淋巴区室大小的三分之一,由 CD14+ 和 CD16+单核细胞、肿瘤相关巨噬细胞 (TAM) 和两种类型的树突状细胞[常规树突状细胞类型 1 (cDC1) 和 2(cDC2)]以及肥大细胞组成(图 2b)。
为了更仔细地检查不同免疫细胞类型的丰度,特别是与正常肝脏的关系,他们比较了 RNA-seq 队列中肿瘤和非肿瘤样本之间细胞类型特异性特征的表达。值得注意的是,与非肿瘤和胎儿肝脏样本相比,肿瘤样本中 B 细胞富集的评分以及细胞毒性淋巴细胞与 Treg 之间的比率显著降低(图 2c)。此外,与原发性 HB 相比,B 细胞的估计值显示出复发或转移等后期阶段的负面趋势,并且从单次手术治愈的 HB 到复发性 HB 和以死亡告终的 HB,B 细胞的估计值显著下降。这表明 HB 具有独特的免疫细胞特征,与较差的预后相关。
他们将本研究的 HB scRNA-seq 队列与公开 scRNA-seq 数据整合在一起,该数据由来自健康肝灌注、脾脏和外周血的免疫细胞组成(图 2d)。两个数据集都显示了相似的髓系细胞以及 T 细胞和 NK 细胞的相对数量。然而,HB 样本中的 Treg 数量要高得多,而 B 细胞和浆细胞的数量则较低(图 2e)。
在髓系区室中,与 Zhao 数据集中的基因相比,HB 巨噬细胞中的几个基因显著上调(图 2f)。这些基因包括 MSR1,一种 TAM 标记物,已证明可以预测不同肿瘤实体的预后较差和 EGR1,一种可以抑制炎症基因并驱动肝单核细胞衍生的巨噬细胞从促炎状态转变为抗炎状态的转录因子。它们还包括 S100A10(它下调 toll 样受体功能)、CXCL8(据报道它可抑制不同胃肠道癌症中的 T 细胞浸润),以及髓系检查点分子 VSIR。
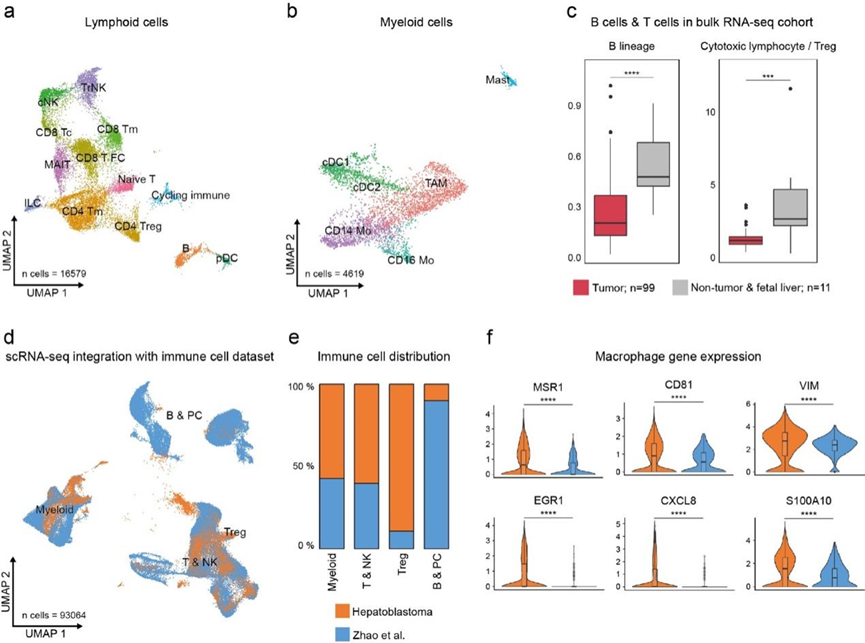
图2. 肝母细胞瘤中的免疫区室表现出改变的细胞类型组成。
(a-b)UMAP可视化。(c) 箱线图比较了RNA-seq数据的肿瘤和非肿瘤样本之间的 B细胞谱系(左)和细胞毒性淋巴细胞与 Treg 评分之间的比率(右)。(d)UMAP可视化。(e) 条形图比较了 HB 和 Zhao 等样本之间的细胞类型比例。(f) 小提琴图比较公开数据中巨噬细胞的基因表达。
03
空间解析分析揭示肝母细胞瘤的免疫逃避现象
为了进一步分析免疫细胞景观的空间表征,他们整合了本研究的 ST 数据和 scRNA-seq 数据集,以使用 Seurat 中实现的基于锚点的方法获得每个 ST 点的细胞类型丰度估计值。这揭示了大量的淋巴细胞和不同数量的髓细胞,它们似乎通常位于肿瘤边界。然而,最引人注目的结果是免疫细胞明显缺乏浸润到肿瘤细胞区域(图 3a)。量化肿瘤细胞、基质和邻近正常肝区域中的免疫细胞丰度证实与正常肝脏相比,肿瘤中淋巴细胞和髓细胞的存在减少(图 3b),支持这一观察结果的是,肿瘤接近度以及淋巴和髓细胞邻域评分呈现负相关性。比较未治疗和化疗治疗的样本,结果显示,一些治疗样本在相邻的正常肝区淋巴细胞丰度略低,而一些未治疗样本在肿瘤区髓细胞丰度略高于治疗样本。不过,在未治疗和治疗样本中,免疫逃避的总体观察结果是一致的。
为了更好地理解空间组成,他们通过对每个样本执行非负矩阵分解 (NMF) 生成元程序 (MP),将结果压缩为稳健的 NMF 模块并将其聚合为七个 MP。GO 分析显示 MP 代表一般过程,例如 ECM 组织、肝脏代谢、免疫过程、染色质重塑和细胞周期以及不同的发育过程、细胞凋亡和激素反应。当将代表免疫过程的 MP 3 与肿瘤邻域评分相关联时,再次看到负相关性。
接下来,他们对 ST 中分析的七个相同的 HB 样本进行了 mIF 染色。通过对 T、NK、B 和髓系细胞进行染色,他们在蛋白质水平上验证了免疫细胞的排除,尤其是淋巴细胞,这些细胞在肿瘤细胞区域中基本上不存在(图 3c)。非肿瘤区域中淋巴细胞的密度及其在所有细胞中所占的比例明显高于肿瘤区域(图 3d-e)。他们观察到的髓系浸润程度仅略高。有趣的是,许多确实浸润到肿瘤细胞区域的巨噬细胞对 CD204(由MSR1编码)呈阳性染色,这与在 scRNA-seq 数据(图 2 d)和另一项最近的研究中的发现一致,该研究描述了 HB 中 CD204+ TAM 的密度很高。
为了阐明这种免疫细胞排斥的潜在原因,他们通过定义肿瘤核心和肿瘤边界区域进一步探索了 ST 数据(图 3f)。大约一半的斑点指定为非肿瘤,而 45% 和 7% 分别定义为肿瘤核心和肿瘤边界。对这两个区域之间的GO 分析表明,肿瘤核心中与肝脏代谢相关的过程上调,而肿瘤边界区域中与 ECM 沉积和包膜形成相关的过程增多(图 3g)。由于这是已知的免疫逃避因素,它可能导致在 HB 肿瘤区域观察到的免疫细胞浸润缺乏。
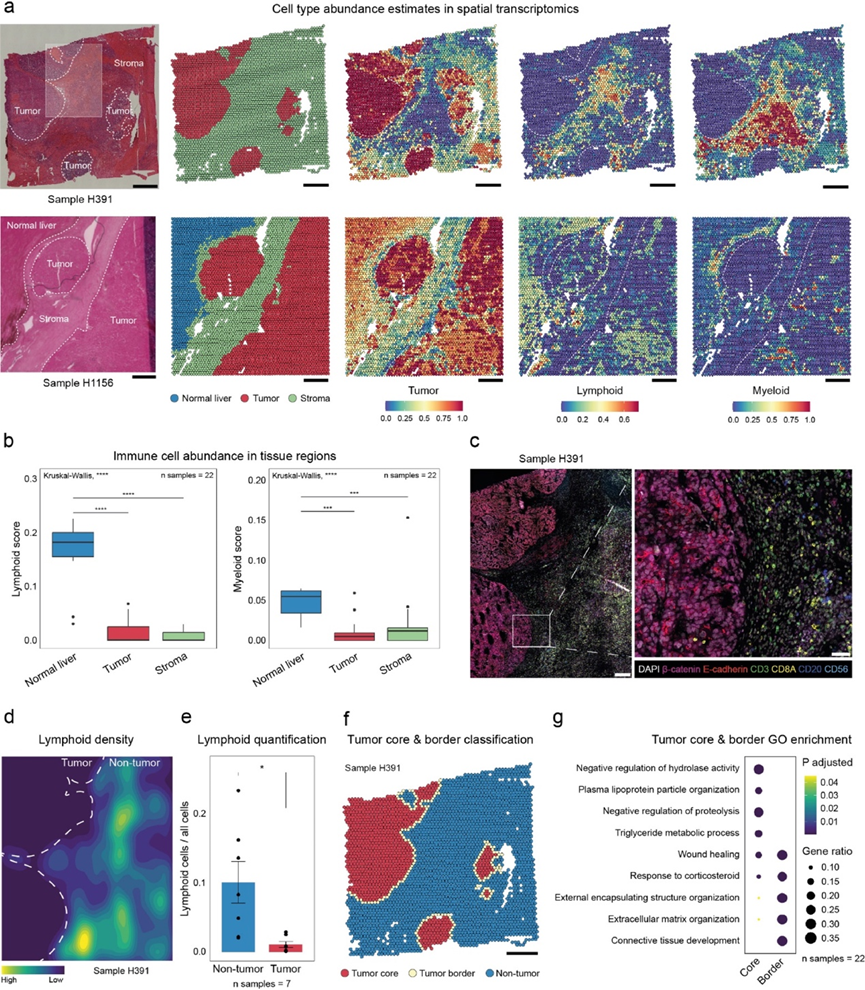
图3. 肿瘤微环境的空间分辨分析揭示了肝母细胞瘤的免疫逃逸。
(a) 两个组织病理学注释的 HB 切片的 H&E 染色和相应的 ST 图,显示样本内各个点的区域注释和细胞类型丰度估计值。(b) 箱线图比较 22 个 ST HB 样本的正常肝脏、肿瘤和基质中淋巴细胞和髓细胞丰度估计值的中位值。(c) 一个HB 样本的多重 IF。(d) 基于多重 IF 细胞分割数据中的淋巴细胞蛋白表达评分的淋巴细胞密度图。(e) 七个多重 IF 样本中淋巴细胞的平均比例。(f) 样本H391的空间图,按肿瘤核心、肿瘤边界或非肿瘤分类着色。(g)GO分析。
04
肿瘤特异性表达促进肝母细胞瘤中中期因子信号升高
为了更好地了解信号环境和HB调节其免疫微环境的潜在机制,他们使用CellChat 探索了主要细胞类型之间的配体-受体相互作用,特别是从肿瘤细胞传出的相互作用。最强的传出信号模式之一是中期因子(MDK)信号(图4a),近年来它作为不同癌症中的关键参与者而受到关注。在MDK的受体中,NCL在所有细胞类型中普遍表达, LRP1在髓系细胞和HSC中特异性表达, ITGA4仅在髓系和淋巴细胞中表达(图4b),除肿瘤细胞本身外,它在接收和影响MDK信号方面起着最重要的作用(图4c)。
最近描述 MDK 免疫调节作用的研究很好地证实了对免疫逃避和促炎与抗炎淋巴细胞之间比例变化的主要观察结果。例如,已发现 MDK-NCL 与抑制免疫活动有关,而 MDK-LRP1 已显示可诱导抑制性巨噬细胞表型,进而导致 Tregs 募集增强。根据这些报告,他们发现MDK的表达与 HB 的 RNA-seq 队列中细胞毒性淋巴细胞、NK、B 和单核细胞的估计丰度之间存在显著的负相关性(图 4 d)。
虽然之前没有关于 HB 的描述,但他们发现MDK在肿瘤细胞中高度且特异性地表达。他们在单细胞分辨率下(图 4b)以及在 ST 数据(图 4e-f)中观察到了这种模式。此外,他们在 HB 的 IF 染色中发现高水平的 MDK(图 4g)。RNA-seq 数据显示,与非肿瘤和胎儿肝脏样本相比,肿瘤中MDK表达升高,此外与未接受化疗的 HB 相比,化疗治疗和转移性 HB 中的表达显著更高(图 4h)。本研究的 ST 队列甚至在未接受化疗的样本中也显示出MDK上调。值得注意的是,与单次治愈性手术等结果更好的患者相比,遭受癌症相关死亡的患者的样本表现出明显更高的MDK表达(图 4h),强调了 MDK 与 HB 的相关性。
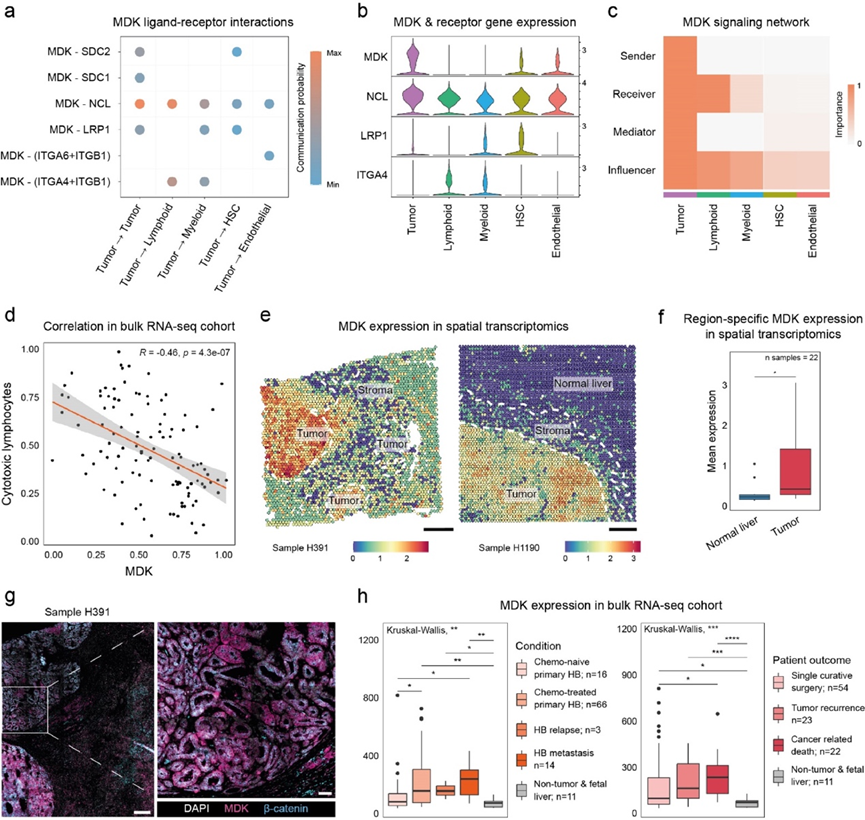
图4. 肿瘤特异性表达促进肝母细胞瘤中中期因子信号传导增强。
(a) CellChat分析。(b) HB scRNA-seq 数据中MDK及其受体的表达水平,以小提琴图表示。(c) 热图显示CellChat预测的 HB 中 MDK 信号的富集和主要细胞类型的相对重要性。(d) 公开 RNA-seq 数据中MDK表达与细胞毒性淋巴细胞评分之间的相关散点图。(e) 空间图显示两个HB ST 样本中肿瘤特异性MDK表达。(f) 箱线图显示 22 个 HB ST 样本正常肝脏和肿瘤区域的平均MDK表达。(g) 一个HB 样本的多重 IF。(h) MDK表达的箱线图。
05
β-catenin 表达增加介导中期因子上调
先前的研究表明,Wnt/β-catenin 信号转导可导致胶质瘤细胞中MDK的上调,这可能是通过 β-catenin 与MDK 启动子区中的 TCF/LEF 结合位点结合实现的。考虑到 Wnt/β-catenin 信号转导在 HB 中发挥的关键作用,他们旨在探究 HB 中与MDK的这种关联。
他们发现RNA-seq 队列中KEGG Wnt 信号通路特征与MDK的表达呈正相关(图 5a),ST 队列中CTNNB1与MDK的表达也呈正相关。为了进一步检验 Wnt 激活与MDK表达之间的因果关系,他们用 Wnt 信号抑制剂 PKF118-310 (PFK) 或 MDK 抑制剂 iMDK 处理 HepG2 和 Huh6 HB 细胞系,并通过免疫印迹和 RNA-seq 分析检测效果。与未经处理的细胞相比,他们观察到用 PKF 处理后 MDK 水平略有但显著降低。此外,抑制 MDK 后 β-catenin 下调,暗示 MDK 和 β-catenin 之间存在正反馈回路。
在转录水平上评估Wnt和MDK抑制对HB肿瘤细胞的其他下游效应,发现相关生物过程的富集发生了一些变化(图5b)。抑制Wnt和MDK后,与细胞凋亡相关的过程上调,生长出现负调节。PKF处理后的其他变化包括髓系白细胞活化上调,细胞外基质组织和与肝脏代谢相关的术语(如磷脂酰胆碱代谢过程)下调。抑制MDK后,一些最显著的额外变化是与白细胞迁移和趋化性、髓系细胞分化或白细胞介素-2产生相关的过程上调,而Wnt信号通路和骨化以及其他发育过程的调节则下调(图5b)。
为了进一步探索 MDK 在 HB 免疫调节中的作用,他们将 THP-1 衍生的巨噬细胞与 HB 细胞系共培养,HB 细胞中既有或没有先前的 MDK 抑制(图 5c)。随后对分类的巨噬细胞进行 RNA 测序,结果显示,与巨噬细胞单一培养(图 5d)和与 MDK 抑制的 HB 细胞共培养的巨噬细胞相比,未经处理的共培养衍生的巨噬细胞中与 ECM 沉积和胶囊形成相关的通路上调(图 5e)。这表明,HB 肿瘤细胞的紧密接近促进了巨噬细胞潜在的促纤维化转变,并且如果肿瘤细胞中的 MDK 信号传导受到抑制,这种影响就不会那么明显甚至会逆转。值得注意的是,这些生物学过程与在肿瘤边界区域富集的生物学过程非常相似(图 3g),许多髓样细胞位于该区域。
他们确定了几个参与 ECM 形成的单个基因,例如COL18A1、TGFBI或TMPRSS6,它们显示出相似的表达模式:与未处理的 HB 细胞共培养后上调,但与 MDK 抑制的 HB 细胞共培养后没有上调(图 5f)。具有相同模式的其他基因包括抗炎基因EGR1和S100A10,他们已在 scRNA-seq 中检测到它们在 HB TAM 中上调(图 2f),AMOTL2作为机械传感途径的一部分参与抑制炎症,PDLIM1是 NF-ĸB 信号传导的抑制剂,以及IL18BP,它抑制 IL18 诱导的干扰素γ产生。这些结果表明,MDK 信号传导(Wnt 活性增加)参与塑造 HB 的免疫环境,最有可能是通过改变巨噬细胞转录程序来实现的。虽然这些变化可能具有直接的抗炎作用,但共培养巨噬细胞和肿瘤边界中基因本体的相似性(特别是在 ECM 和包膜形成方面)表明存在其他间接作用,例如促进免疫逃避的 ECM 重塑(图 5g)。
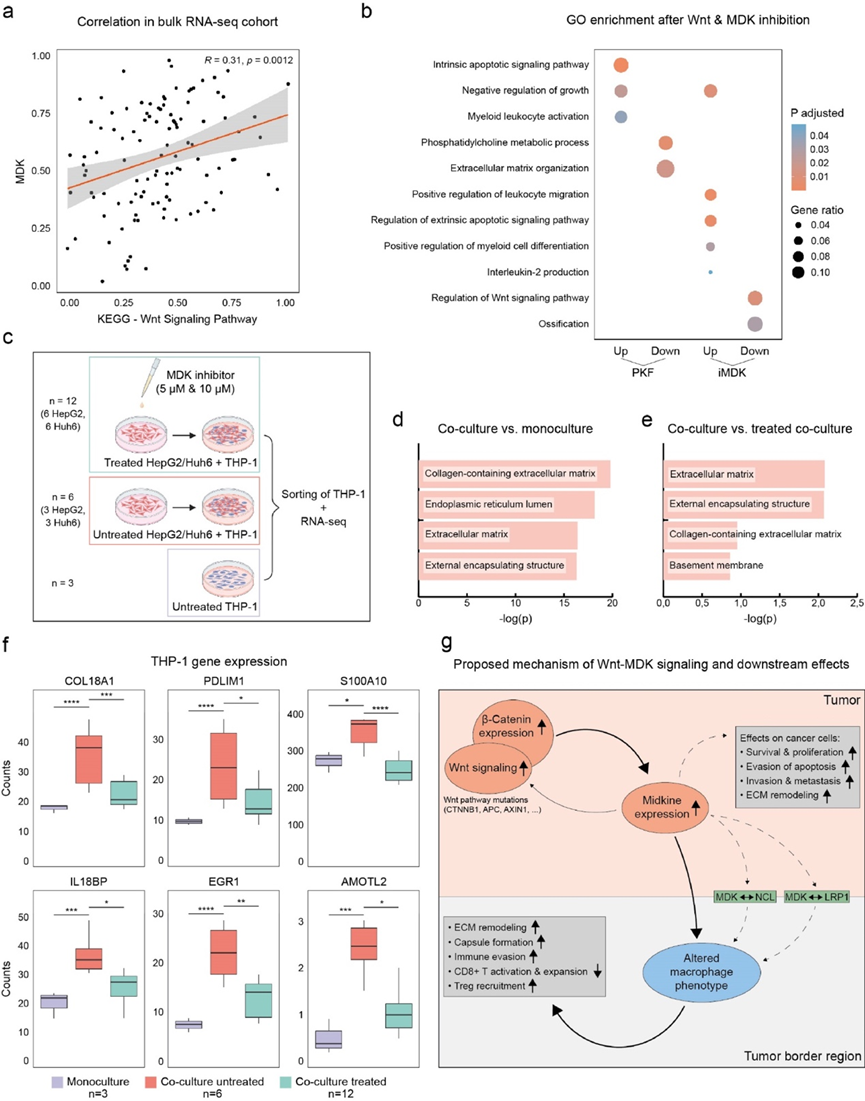
图5. Wnt 响应中期因子信号支持髓系驱动的免疫逃避。
(a) Wnt 信号通路评分与MDK表达之间的相关散点图。(b)GO分析。(c)实验设计。(d-e)GO分析。(f) 箱线图显示实验条件之间 THP-1 基因表达差异。(g) 图形总结了HB中 Wnt 和 MDK 信号之间推测的相互作用以及潜在的下游效应。
+ + + + + + + + + + +
结 论
本研究发现,在已确定的四个转录肿瘤程序中,“发育”和“代谢”反映了不同的肝分化阶段,而“循环”在未分化细胞和复发样本中富集,而“中间”在预后不良患者的样本中表现出高活性。本研究发现抗炎和促炎免疫细胞的比例增加,并且有证据表明肿瘤区域存在免疫排斥。肝母细胞瘤细胞中免疫调节剂中期因子的 Wnt 反应性上调与巨噬细胞表型的变化有关,这可以通过抑制中期因子部分逆转。肝母细胞瘤细胞存在于连续的肝分化谱中,并栖息于改变的免疫环境中。Wnt 信号增强了中期因子的表达,中期因子似乎通过修饰巨噬细胞来实现免疫逃避,从而参与塑造免疫环境,从而提供潜在的治疗靶点。
+ + + + +



 English
English


