文献解读|Nat Genet(29):单细胞和空间转录组学揭示复发性鼻咽癌的放射抗性和免疫逃逸机制
✦ +
+
论文ID
原名:Single-cell and spatial transcriptomics reveal mechanisms of radioresistance and immune escape in recurrent nasopharyngeal carcinoma
译名:单细胞和空间转录组学揭示复发性鼻咽癌的放射抗性和免疫逃逸机制
期刊:Nature Genetics
影响因子:29
发表时间:2025.07.21
DOI号:10.1038/s41588-025-02253-8
背 景
鼻咽癌的病理特征是肿瘤病灶周围和内部大量免疫细胞浸润,这表明鼻咽癌的肿瘤微环境 (TME) 非常复杂。TME 是一个复杂的生态系统,由包括恶性细胞、免疫细胞和基质细胞在内的异质性细胞类型之间的时空相互作用定义。TME 及其异质性与肿瘤的治疗耐药性和复发密切相关。因此,针对 TME 的治疗策略已成为临床研究的重点。放射抗性和免疫逃逸是复发性鼻咽癌 (rNPC) 的显著特征。然而,其机制尚不完全清楚。
实验设计
结 果
01
pNPC 和 rNPC 中的肿瘤生态系统分析
为了鉴定原发性鼻咽癌 (pNPC)和 rNPC 之间的肿瘤生态系统差异,研究团队收集了 11 例未经治疗的 pNPC 患者(以下简称 PT 样本)和 13 例 rNPC 患者(以下简称 RT 样本)的肿瘤样本进行单细胞转录组分析(scRNA-seq)和全外显子组测序 (WES),以及相应的肿瘤样本(包括 8 个 PT 样本和 7 个 RT 样本)进行空间转录组学分析。在这 13 名局部复发患者中,均发生了现场复发。此外,他们还整合了43 名 RT 和 32 名 PT 的 WES 数据进行进一步分析。他们还招募了另外 40 名配对的 PT 和 RT 患者进行免疫组织化学 (IHC) 染色(验证队列 1),还纳入了中山大学肿瘤防治中心 (SYSUCC) 回顾性队列中 86 名接受过根治性放射治疗的 pNPC 患者(验证队列 2)和前瞻性试验队列中 52 名接受 PD-1 抑制剂和抗 VEGFR 抗体治疗的复发性或转移性 NPC 患者25(验证队列 3)进行 IHC 染色。他们还纳入了88 个 PT 样本的转录组分析 (RNA-seq) 数据,用于验证和预后分析(验证队列 4)(图1a)。
他们构建了 pNPC 和 rNPC 的肿瘤生态系统图谱(图1b-c)。所有这些细胞类型在具有不同免疫细胞比例的肿瘤中都是相同的,揭示了 NPC 中免疫细胞组成的巨大异质性(图1c)。rNPC 呈现出独特的免疫生态系统,与 pNPC 相比,B 细胞比例降低,而成纤维细胞、中性粒细胞和内皮细胞比例增加(图1g)。非免疫细胞主要包括内皮细胞、成纤维细胞和恶性细胞(图1d),病变中的大多数非免疫细胞是恶性细胞(图1e-f)。
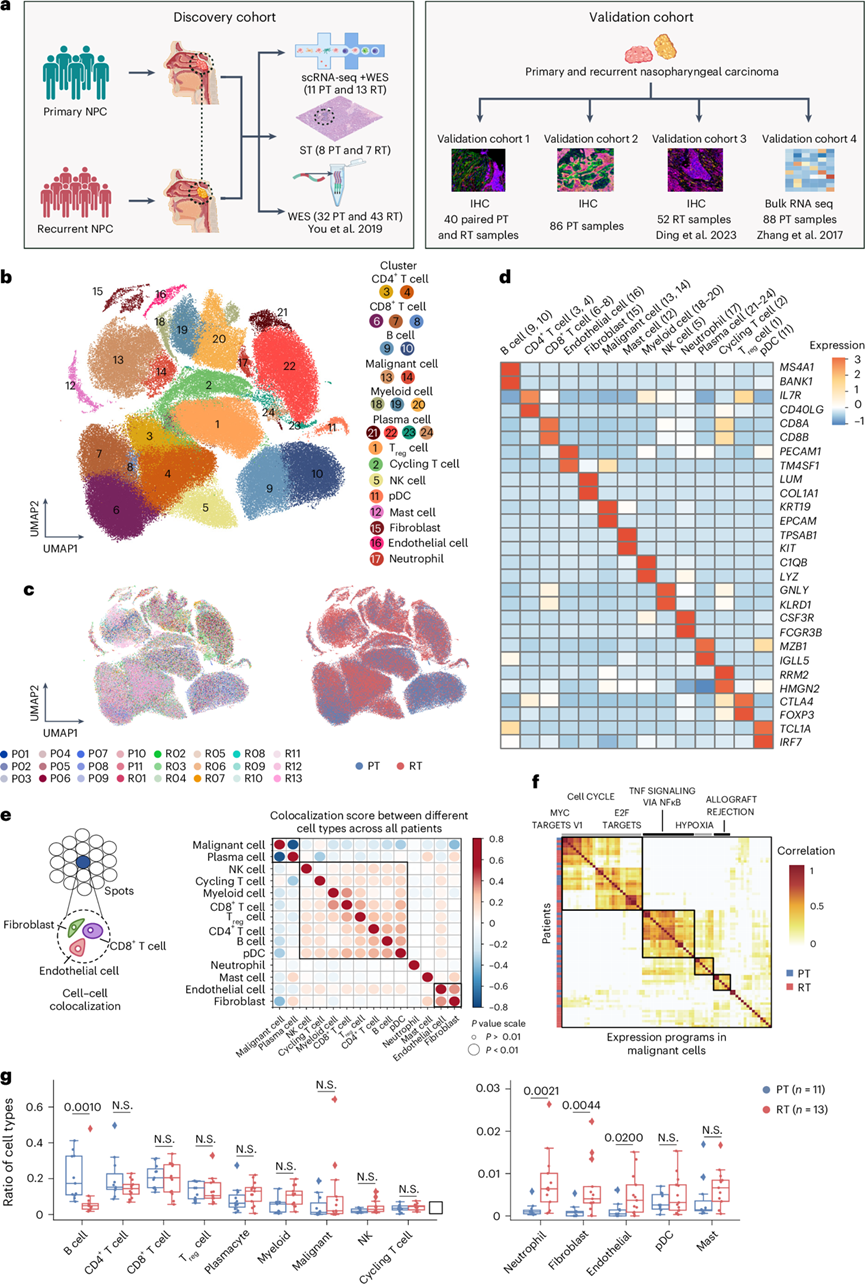
图1. pNPC 和 rNPC TME 的 ScRNA-seq 和空间分析。
(a) 实验设计。(b) UMAP 图显示了鼻咽癌生态系统中细胞类型的注释。(c) UMAP 图;细胞根据患者来源(左)或疾病状态(右)着色。(d) 热图显示了所示免疫细胞类型中标记基因的表达。(e) 气泡热图显示了所示空间细胞类型的细胞之间成对的共定位得分。(f) 热图描绘了来自 15 个样本的肿瘤内程序的成对相关性。(g) 使用双侧 Wilcoxon 秩和检验比较 PT 和 RT 样本的 TME 细胞分数。
02
放射抗性和免疫逃逸是 rNPC 细胞的双重特征
他们从发现队列中鉴定出 PT 和 RT 肿瘤细胞之间的许多差异基因,这些基因参与 PT 中的细胞周期相关通路,而 RT 中上调的基因主要属于免疫反应通路(图2a)。他们还观察到 RT 样本具有更高的免疫炎症特征和癌症相关信号(例如,NF-κB、PI3K-AKT、MAPK 和 P53 通路)(图2a-b)。他们从 C666 和 TW03 构建了衍生的放射抗性细胞系,并使用集落形成试验表明,与野生型 C666 和 TW03 细胞相比,抗放射的 C666-R 和 TW03-R 细胞在辐照后存活率更高。此外,他们验证了放射抗性细胞系中富集的通路,包括 NF-κB、MAPK 和 PI3K-AKT,表明放射治疗的放射抗性与这些通路的上调有关(图2b-c)。
他们还观察到 RT 样本表现出更高的免疫监视和逃逸特征(图2d)。在与免疫逃逸相关的基因中,RT 样本中恶性细胞的CD47和HLA-A / HLA-B / HLA-C表达增加(图2e)。关于肿瘤的抗原性,发现发现队列中的 PT 和 RT 样本之间的肿瘤突变负担、新抗原负担或体细胞拷贝数改变没有显著差异。此外,RT 样本的肿瘤异质性(MATH 评分)显著低于 PT 样本(图2f)。他们还观察到 RT 中的主要组织相容性复合体 I 类表达高于 PT 样本。关于免疫原性,VCTN1在放射治疗 (RT) 样本中的表达较高,而TNFRSF14、CD276、LGALS9和CD274在 PT 样本中的表达显著增加(图2g)。RT 具有很强的放射抗性,并且能够以独立于免疫原性和抗原性降低的特定方式逃避免疫细胞介导的杀伤。除了上述癌症相关通路的自我激活之外,他们推断 TME 还可以促进 rNPC 恶性细胞放射抗性的产生。他们进一步确定了恶性细胞与其他细胞之间的相互作用,发现成纤维细胞与恶性细胞的相互作用最多(图2h-j)。
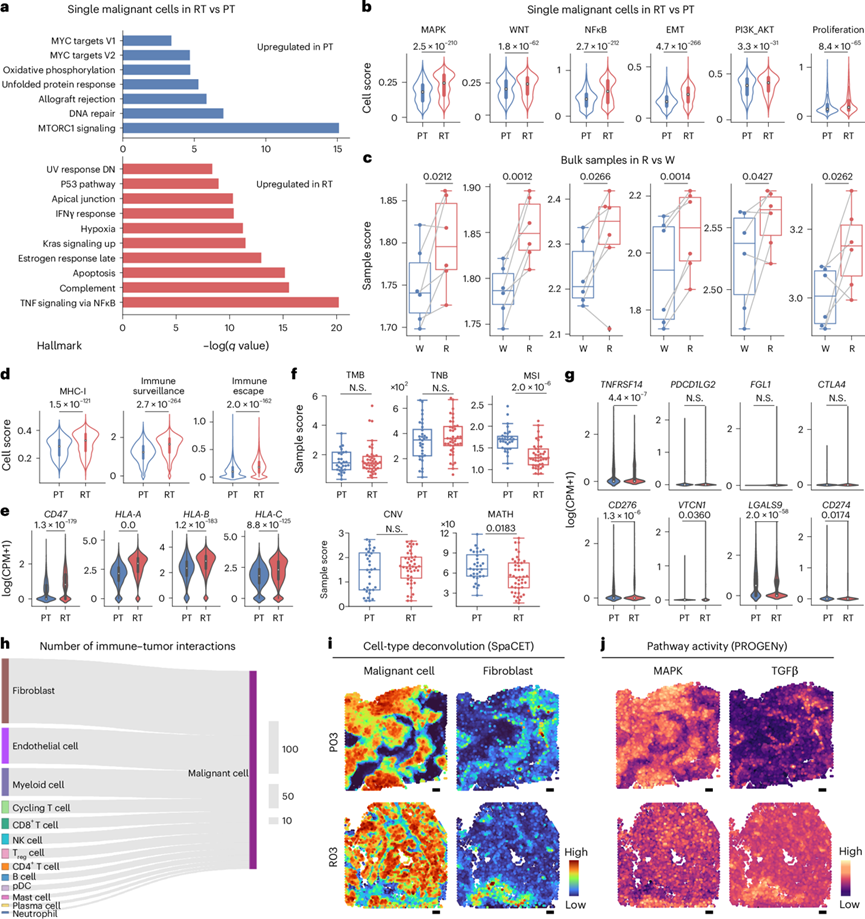
图2. PT和RT样本中恶性细胞的特征及其对肿瘤生态系统的影响。
(a) 条形图显示基于 PT 和 RT 样本中上调基因的 HALLMARK 基因集,恶性细胞中特定途径的富集情况。(b) 小提琴图显示 PT和 RT样本中恶性细胞选定途径的得分 。(c) 箱线图显示在抗辐射类型(R,n = 6)和野生型(W,n = 6)之间大量 RNA 中富集的选定途径的得分。(d) 小提琴图显示 PT和 RT样本中恶性细胞的主要组织相容性复合体 I 类(MHC-I)、免疫逃逸和免疫监视的 细胞得分。(e) 小提琴图显示 PT和 RT样本中肿瘤细胞中选定的免疫逃逸基因的表达。(f) 箱线图显示发现队列中 PT 和 RT 样本的 WES 数据中的肿瘤突变负担 (TMB)、肿瘤新抗原负担 (TNB) 和微卫星不稳定性 (MSI)、CNV 和突变等位基因肿瘤异质性 (MATH) 得分 。(g) 小提琴图显示 PT和 RT样本中恶性肿瘤细胞中免疫检查点基因的表达。(h) 桑基图显示 LIANA 推断出的 TME 细胞和恶性细胞之间显著相互作用的数量。(i-j) 使用细胞类型反卷积和通路活性分析对 pNPC 和 rNPC 样本进行空间转录组学数据表征。
03
MCAM + mCAF 有助于 rNPC 细胞的放射抗性
他们总共确定了 795 个成纤维细胞,它们可以聚类为四个亚聚类,包括癌相关成纤维细胞(CAF) CFD、CAF MCAM、CAF GREM1 和 CAF SFRP4(图3a-c)。接下来,他们检测了 PT 和 RT 样本中这些 CAF 亚群的相对丰度。令人惊讶的是,RT 样本中 MCAM+ mCAF的比例升高(图3d)。为了验证NPC 患者中MCAM + mCAF的存在,他们在验证队列 1 中应用了原位多色免疫荧光染色,并观察到肿瘤内基质细胞中的 ACTA2 和 MCAM 双阳性成纤维细胞,其中 RT 样本中 MCAM + mCAF 的比例与 PT 样本相比显著升高(图3e-f)。更令人信服的是,MCAM 还能通过流式细胞术对成纤维细胞进行分馏。他们进一步在独立的内部原代成纤维细胞队列中验证了这一发现,发现 RT 样本中 MCAM+ mCAFs 的比例为 58.47%(中位数),几乎是 PT 样本(中位数,6.275%)的 9 倍(图3g)。单变量和多变量分析均表明,在验证队列 2 中,MCAM+ mCAF比例较高与较差的局部区域无复发生存期 (LRRFS) 和总体生存期相关 (图3h-i)。
空间转录组学数据的邻域富集得分进一步表明,CAF MCAM 比其他 CAF 更接近恶性细胞。此外,CAF MCAM 附近的恶性细胞显示出更高的干性评分。通过蛋白质印迹分析验证了从大量 CAF 中分离的 MCAM+ mCAF的身份和纯度(图3j)。首先,他们发现 MCAM+ mCAF 不会影响 NPC 细胞的增殖率。此外,他们发现 MCAM−和 MCAM + CAF 在体外具有相似的活力和活性。当与 MCAM + mCAF共培养时,C666 和 TW03 NPC 细胞系减弱了由最佳剂量 10 Gy 辐射诱导的 γH2AX 的吸收(图3k)。此外,与 MCAM+ mCAF共培养增加了克隆数量并减弱了 10 Gy 剂量照射后 C666 和 TW03 细胞中的细胞凋亡(图3l-m)。NCG 小鼠皮下共注射模型一致证实,当与 MCAM+ mCAF共培养时,C666 显示出显著增强的放射抗性并持续肿瘤生长,并且显著降低肿瘤细胞中的细胞凋亡,但与 MCAM − mCAF 共培养时没有(图3n-q)。
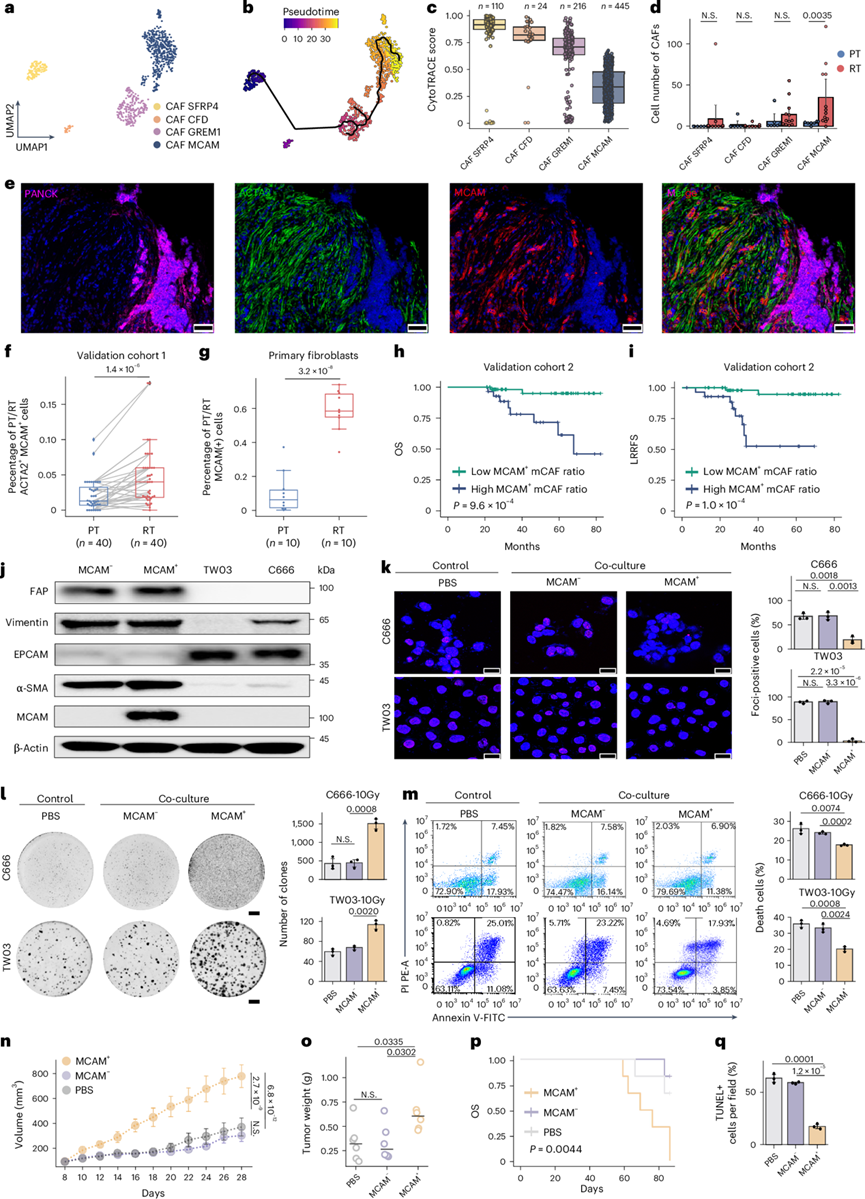
图3. 在 rNPC 中发现了 MCAM 阳性成纤维细胞,并发现其可促进 NPC 肿瘤细胞的放射抗性。
(a-b) UMAP 图显示CAF 的亚聚类和伪时间排序。(c) CAF 亚群的差异状态。(d) 条形图显示 PT和 RT 中 CAF 亚型的细胞数量。(e) 验证队列 1 中 PANCK、ACTA2 和 MCAM的多重免疫荧光。(f-g) 基于验证队列1。(h-i) Kaplan-Meier 分析显示验证队列 2 中患者的总生存率和 LRRFS。(j) Western blot 显示 FAP、波形蛋白、EPCAM、α- SMA和 MCAM 的表达。(k) 照射后与 MCAM+CAF、MCAM−CAF 和 PBS共培养的指定 NPC 细胞中 γH2AX 的核易位。(l-m) 克隆形成的代表性图像和细胞死亡的百分比。(n-o) 显示了注射 C666 的小鼠(每组n = 6 只)在指定治疗后平均肿瘤体积和肿瘤重量的时间曲线 。(p) 荷瘤 NCG 小鼠在指定治疗后 Kaplan-Meier 生存曲线。(q) 治疗后定量异种移植瘤中 TUNEL 染色的凋亡肿瘤细胞的条形图。
04
MCAM + mCAF通过COL4-ITGA2-FAK-AKT轴促进放射抗性
接下来,他们试图研究 MCAM + mCAF如何增强 NPC 的放射抗性。他们对 MCAM+ mCAF中的差异表达基因(DEG)应用网络分析来检测潜在的关键基因,其中包括ACTA2,COL4A2,ITGA1和COL4A1(图4a)。编码分泌蛋白的基因,包括COL4A1,COL4A2,PDGFA和IGFBP7,在 scRNA-seq 和 bulk RNA-seq 队列中的MCAM+ mCAF中均显著富集(图4b)。首先,他们发现 PDGFA 和 IGFBP7 不能增强 TW03 和 C666 细胞的放射抗性。鉴于COL4A1和COL4A2编码 IV 型胶原的 α1 和 α2 链,他们进一步研究了 IV 型胶原是否在促进鼻咽癌的放射抗性中发挥作用,观察到 MCAM + mCAF 中 COL4A1 和 COL4A2 在蛋白质水平上的表达上调(图4c-d)。他们进一步使用短发夹 RNA(shRNA) 生成稳定的 shCOL4A1 成纤维细胞,验证了 COL4A1 敲低(KD)后 MCAM、α-SMA 和波形蛋白的表达没有改变。将这些成纤维细胞或 MCAM− CAF 与 NPC 细胞共培养或用最佳浓度为 20 µg cm−2 的IV 型人类胶原蛋白直接处理 NPC 细胞后,他们发现 IV 型胶原蛋白增强了 NPC 细胞的放射抗性(图4e-h)。
整合素是常见的胶原受体。配体-受体分析表明,恶性细胞与 MCAM + mCAF 之间通过 COL4A1/2-ITGA2_ITGB1 和 COL4A1/2-ITGA3_ITGB1 轴存在增强的相互作用(图4i)。当在 C666 和 TW03 细胞中敲低ITGA3或ITGA2时,只有ITGA2 KD 显著降低了 IV 型胶原外部治疗诱导的放射抗性(图4j-k)。此外,体内实验显示,ITGA2 KD 的肿瘤细胞即使在晚期也有较弱的肿瘤形成能力,并且当与 MCAM + mCAF共同注射并受到照射时,肿瘤细胞凋亡显著增加(图4l-o)。先前的研究表明,胶原主要结合整合素来激活下游 PI3K-AKT 信号通路并发挥其生物学效应,例如诱导化疗耐药、癌细胞增殖等。他们观察到在照射后用外源性IV型胶原处理的TW03和C666细胞中FAK、AKT、Src和PI3K的磷酸化水平显著升高,而在NPC细胞中ITGA2 KD显著降低了IV型胶原对FAK和AKT信号通路的激活。此外,他们验证了FAK和AKT信号传导可能诱导细胞核中特定转录因子(STAT3、E2F8、LMNB1等)的激活,通过染色质重塑、细胞周期、DNA修复等途径促进放射抗性。AKT的抑制加速了两种细胞系中γH2AX病灶的吸收,当体内抑制PI3K-AKT通路时, MCAM+ mCAF的促肿瘤发生作用显著减弱(图4p-s)。
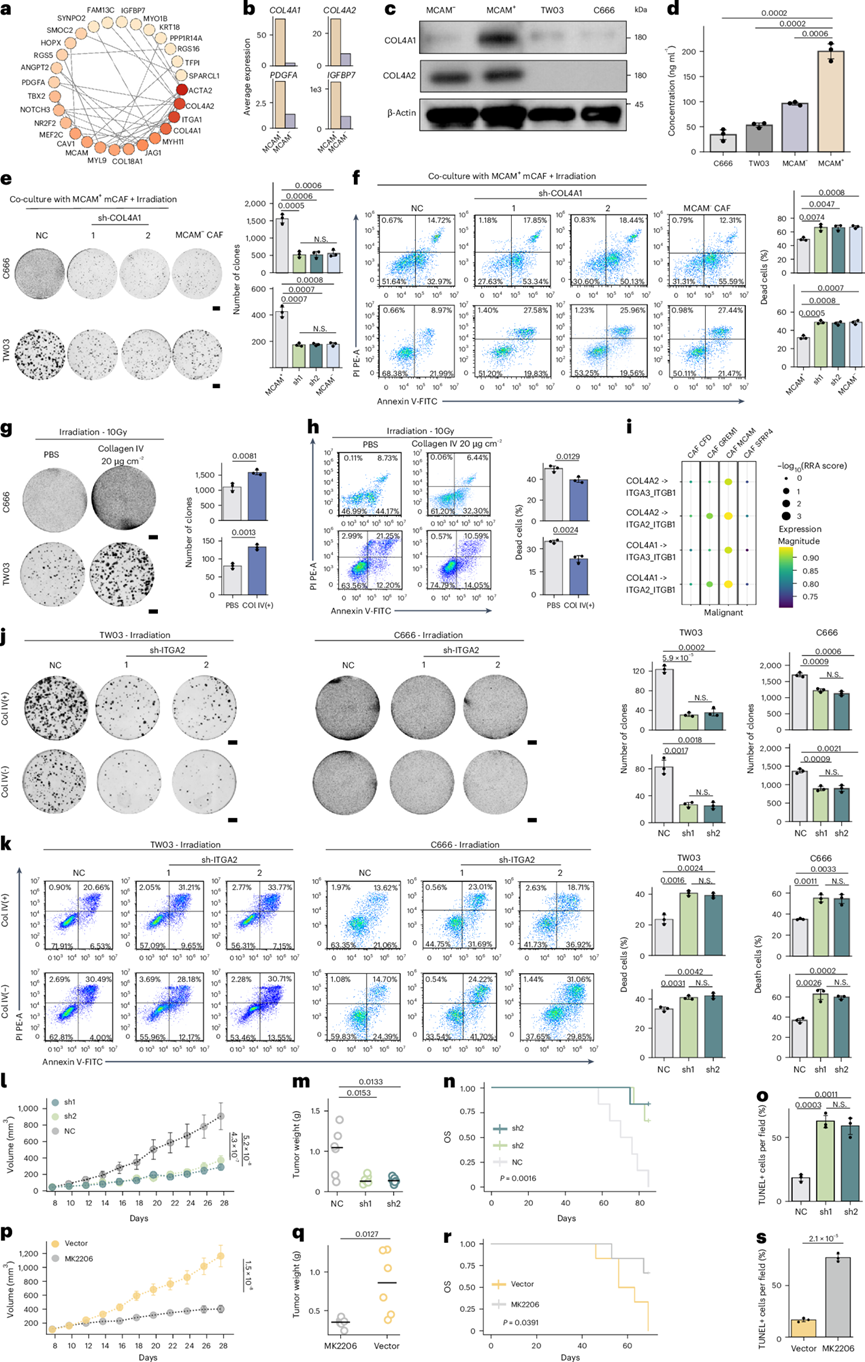
图4. MCAM + mCAF通过COL4–ITGA2–FAK–AKT通路促进鼻咽癌肿瘤细胞的放射抗性。
(a) MCAM+ mCAF中顶DEG 的富集网络。(b) MCAM +和 MCAM − CAF中选定基因的表达。(c) Western blot 显示 COL4A1 和 COL4A2 的表达。(d) 条形图显示所示细胞系中 IV 型胶原的 ELISA结果。(e-f) 共培养和照射后 NPC 细胞系中的细胞克隆形成和凋亡细胞百分比。(g-h) 用胶原蛋白 IV 预处理或未预处理,然后照射的细胞系中的克隆形成和凋亡细胞百分比的代表性图像。(i) 点图显示 CAF 亚型和肿瘤细胞之间的显著配体-受体对。(j-k) 在照射前用胶原蛋白 IV 预处理或未预处理的细胞系中克隆形成和凋亡细胞百分比的代表性图像。(l-s)肿瘤体积、重量、OS、细胞凋亡分析。
05
IV 型胶原蛋白与鼻咽癌中的 T 细胞抑制和免疫逃逸相关
胶原蛋白可以调节白细胞在肿瘤中的浸润,并且基质细胞中COL4A1的表达与几种癌症中的免疫抑制性 TME 相关。他们发现 IV 型胶原蛋白的较高表达确实与较少的 T 细胞浸润相关(图5a)。分析所有样本的胶原蛋白 IV 表达,中位 H 分数为 30.4(图5b)。有趣的是,他们发现较高的 IV 型胶原蛋白表达水平与 T 细胞浸润呈负相关(图5c)。此外,在验证队列 2 中,较高的 IV 型胶原蛋白表达也与较差的总生存率和 LRRFS相关(图5d-e)。始终如一的是,在验证队列 4 中,较高的COL4A1转录水平与 T 细胞相关基因的较低表达显著相关(图5g)。根据空间转录组学数据,他们还发现COL4A1的表达与 CD8+T 细胞和 CD4+T 细胞的比例呈负相关。此外,在验证队列 4 中,较高的COL4A1转录水平与 pNPC 患者的无进展生存期结果显著较差相关(图5f)。
为了探究IV型胶原蛋白在鼻咽癌免疫逃逸中的潜在影响,他们建立了人源化小鼠模型,结果表明,与MCAM + mCAF组相比,COL4A1敲除(KO)的MCAM + mCAF联合注射肿瘤细胞,其成瘤能力较弱,与PBS对照组相似(图5h-j)。此外,他们观察到COL4A1 KO组和载体组的MCAM和α-SMA表达均高于PBS组,而载体组的IV型胶原蛋白表达高于COL4A1 KO组和PBS组(图5k-l)。免疫荧光染色和流式细胞分析结果显示,载体组CD4+和CD8 + T 细胞比例均显著低于COL4A1 KO组和PBS组(图5m)。COL4A1 KO组和PBS组的CD8+ T 细胞处于活化期,CD44和CD69表达较高。此外,他们还观察到较高的IV型胶原评分与较低的CD4+ T 细胞和CD8+ T 细胞浸润显著相关(图5n)。
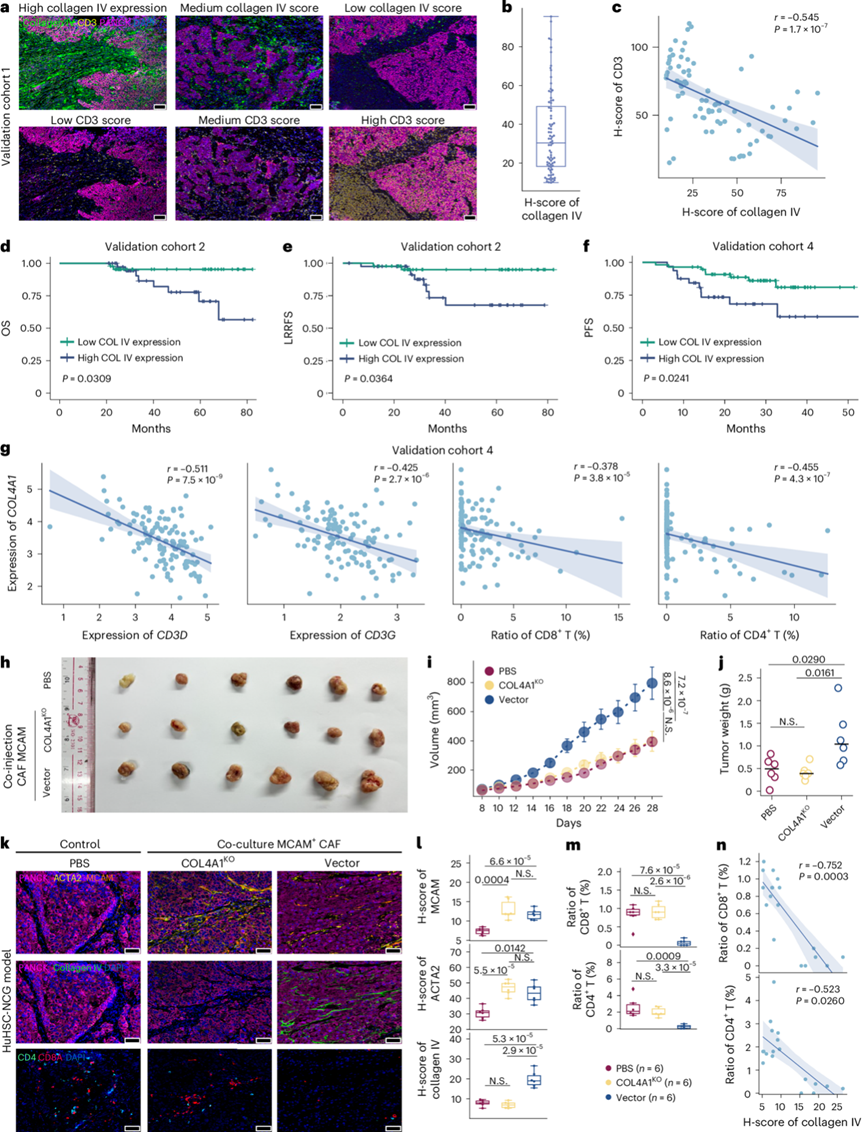
图5. 肿瘤内 IV 型胶原蛋白水平与鼻咽癌患者的 T 细胞抑制和免疫逃逸相关。
(a) 验证队列 1 中不同 IV 型胶原蛋白水平样本的多重免疫荧光染色代表性图像。(b) 验证队列 1样本中 IV 型胶原蛋白的 H 值。(c) 基于验证队列 1 的 IHC 结果,IV 型胶原蛋白和 CD3 的 H 值之间的相关性。(d-e) Kaplan-Meier 分析显示验证队列 2中 IV 型胶原蛋白表达低或高患者的 OS 和 LRRFS 率。(f) Kaplan-Meier 分析显示验证队列 4中COL4A1表达低或高患者的无进展生存期 (PFS) 。(g) 验证队列 4的 RNA-seq 数据中COL4A1与CD3D、CD3G表达以及 CD8+ T 细胞与 CD4 + T 细胞比例之间的相关性 。(h-j) 肿瘤体积分析。 (k) 代表性免疫荧光图像。(l-m) MCAM、ATCA2 和 IV 型胶原蛋白的 H 值以及 CD4+和 CD8+ T 细胞的比例。(n) 基于 HuHSC-NCG 模型的 IHC 结果,IV 型胶原蛋白的 H 值与 CD8+和 CD4+ T 细胞比例之间的相关性。
06
ZNF683+ CD8 + T 细胞在 rNPC 中表现出弱细胞毒性
他们进一步研究了 PT 和 RT 之间 TME 的差异。他们重点研究了 T 细胞和自然杀伤细胞(图6a),他们发现 CD8 ZNF683 细胞和 CD8 PNISR 细胞在 rNPC 中比在 pNPC 中丰富得多(图6b)。接下来,他们通过推断状态轨迹,使用 Monocle 3(图6c-e)探索了 NPC 浸润 CD8+ T 细胞中的动态免疫状态和细胞转变。基于伪时间分析,该转变始于 CD8 TCF7 细胞,通过以 CD8 FOSB 和 CD8 ITM2C 为特征的中间细胞毒性状态,最终达到两个终端状态,一个是以 CD8 TIGIT 细胞为代表的耗竭状态,另一个是 CD8 ZNF683 细胞的记忆状态(图6c)。在此转变过程中,细胞毒性和耗竭特征评分均增加(图6d)。值得注意的是,CD8 + ZNF683 + 细胞表达的细胞毒性和颗粒酶评分甚至低于 CD8+ TIGIT 细胞。有趣的是,幼稚 CD8 + TCF7 + 细胞主要存在于 pNPC 中,CD8 + ZNF683 + 细胞较少,而 CD8 + ZNF683 + 细胞主要在 rNPC 中检测到并表达驻留特征(图6c-e)。此外,PT 和 RT 样本的耗竭评分没有显著差异,而 rNPC 的 T 细胞共刺激评分明显低于 pNPC(图6f-g)。
他们进一步观察到,验证队列 1 的 RT 样本中 CD8 ZNF683 细胞的比例显著升高(图6h-i)。此外,在验证队列 2 中,CD8 ZNF683 细胞比例较高的患者总体生存率和 LRRFS 结果较差(图6j)。为了进一步评估这些细胞的功能,他们分离了鼻咽癌组织中的肿瘤浸润性 CD8 ZNF683+细胞和 CD8 ZNF683−细胞,以通过流式细胞检测它们的颗粒酶 B (GZMB) 表达水平。CD8 ZNF683+细胞显示出比 CD8 ZNF683−细胞更低的 GZMB 丰度(图6k)。
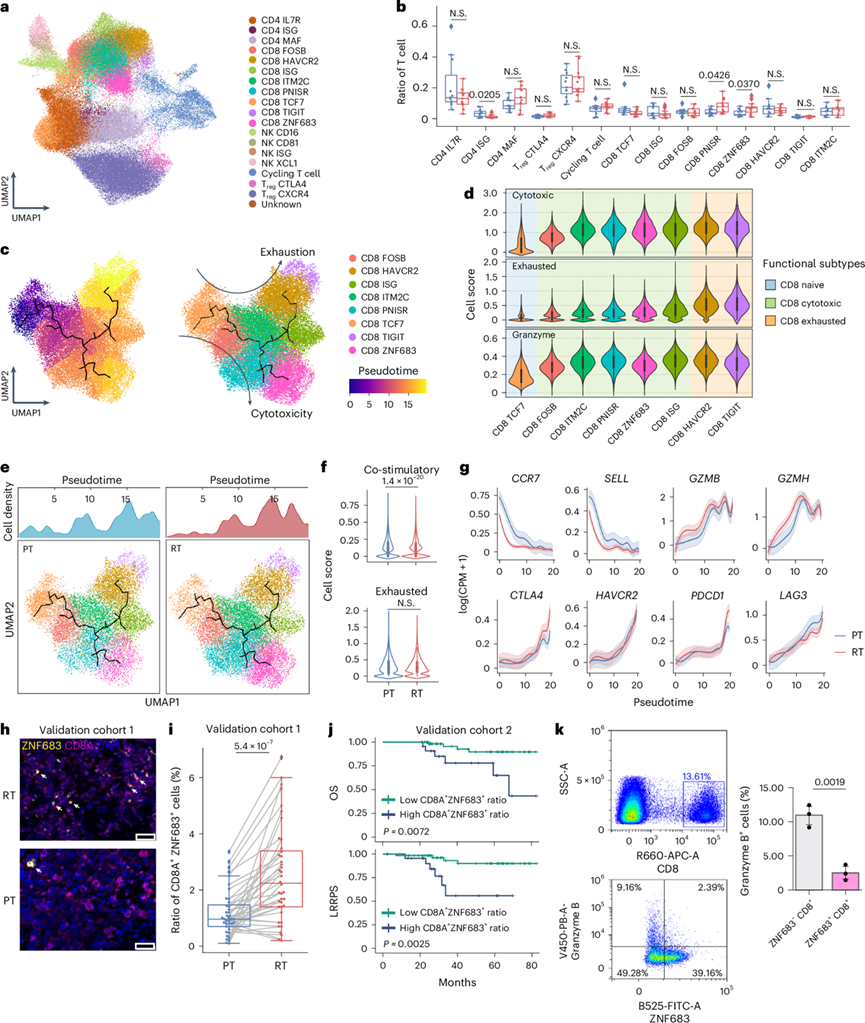
图6. CD8 + T 细胞在 rNPC 中保持具有弱细胞毒性的记忆表型。
(a) T 细胞和 NK 细胞亚型的 UMAP 投影。(b) 箱线图显示 PT和 RT样本中 T 细胞亚型的比例 。(c) CD8+ T 细胞的伪时间排序分析。(d) 小提琴图显示细胞毒性、耗竭和颗粒酶评分。(e) 伪时间排序的 CD8+ T 细胞图。(f) 小提琴图显示PT和 RT样本中 CD8+ T 细胞的共刺激和耗竭分数 。(g) 阴影线图表示所选基因在 PT 和 RT 样本中沿伪时间轴的表达水平。(h) CD8A 和 ZNF683 的 IHC 染色。(i) 箱线图根据 IHC 结果显示配对 PT 和 RT 样本中 CD8 ZNF683 细胞的比例 。(j) Kaplan-Meier 分析显示验证队列 2中患者的 OS 和 LRRFS 率 ,其特征是 CD8 ZNF683 细胞比例低或高。(k) 流式细胞分析。
07
rNPC 中的三级淋巴结构减少
他们之前观察到 rNPC 中 B 细胞比例显著下降,这在验证队列 1 中得到了进一步证实(图7d)。除 T 细胞外,适应性免疫系统主要由 B 细胞组成。他们检测到 23394 个 B 细胞,可分为五个聚类:B IGHM、B MCM4、B NEIL1、B FCRL4 和 B 记忆(图7a-c)。此外,他们观察到 rNPC 中记忆性 B 细胞的比例显著下降,而 B IGHM 细胞的比例增加(图7e)。B 细胞位于三级淋巴结构 (TLS) 中,TLS已在多种类型的癌症中得到证实,并可改善抗原呈递、增加细胞因子介导的信号传导并释放肿瘤特异性抗体,从而带来更好的生存结果。根据基于空间转录组学的共定位分析,他们发现 CD4+ T 细胞、CD8 + T 细胞、调节性 T 细胞和循环 T 细胞在 pNPC 中通常位于更靠近 B 细胞的位置(图7f)。对切片进行 H&E 染色后,由训练有素的病理学家 (WMH) 注释每个肿瘤的整体组织以及 TLS 的存在和定位。他们在 8 个 pNPC 样本(62.5%)中发现 5 个 TLS 阳性样本,而在 7 个 rNPC 样本(0%)中没有发现 TLS 阳性样本(图7g),TLS 区域具有特殊的细胞组成。
结构分析显示,在 TLS 区域中,CD20+ B 细胞与 CD4 +、CD8 +和 FOXP3 + T 细胞以及 CD21 +滤泡树突状细胞共定位(图7h)。此外,确认了验证队列 1 中 PT 中的 TLS 密度高于 RT 样本(图7i)。他们还发现,在验证队列 2 中,较高的 TLS 密度与明显更好的生存结果相关(图7j-k)。此外,他们还观察到验证队列 4 中 B 细胞标志物(MS4A1和BANK1)表达较高和 B 细胞比例较高,这与更好的无进展生存结果相关。有趣的是,在验证队列 3 中,TLS 状态阴性的患者在接受抗 VEGFR 和 PD-1 抑制剂治疗后无进展生存结果更差(图7l)。
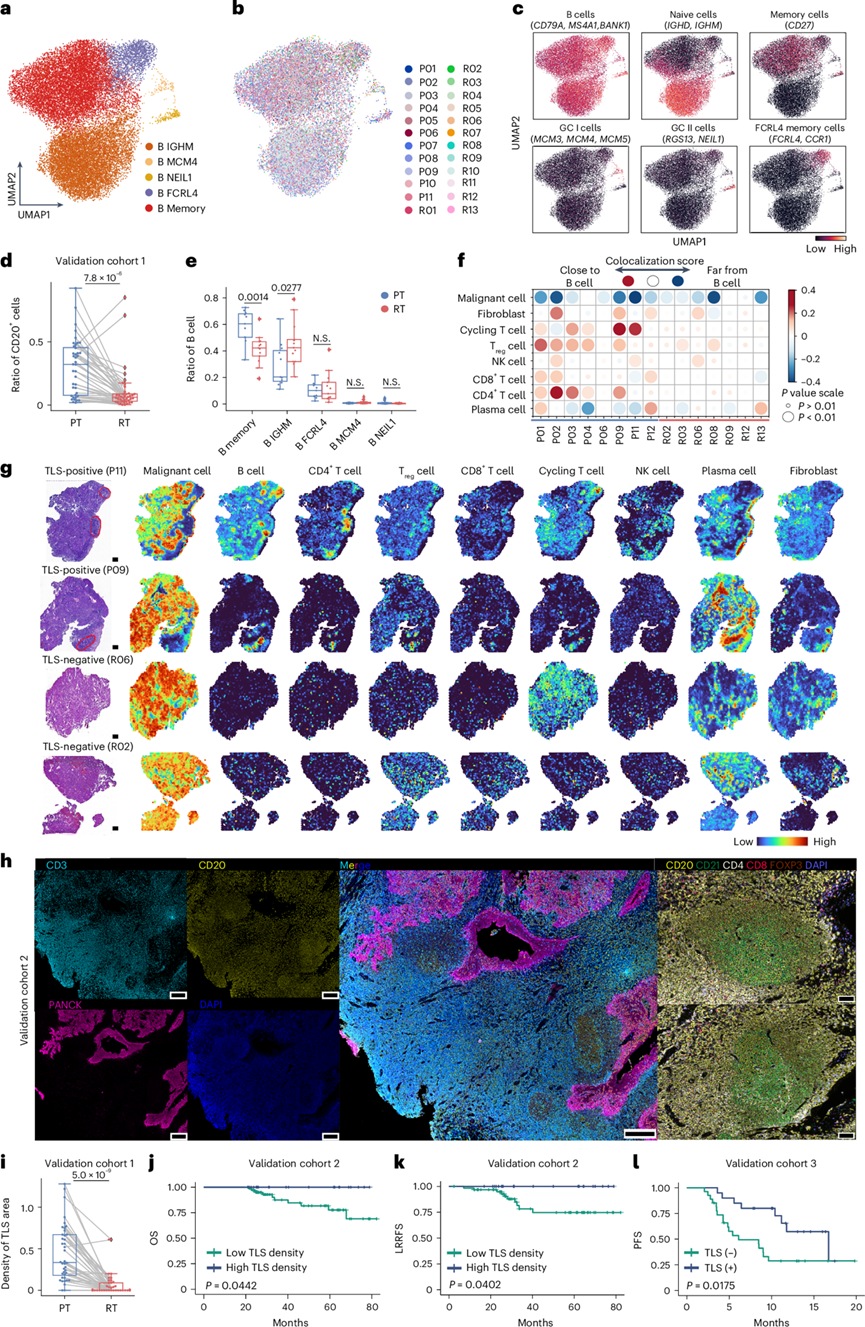
图7. rNPC 中的 TLS 已耗尽。
(a-c) 不同细胞亚型的 UMAP 投影。(d) 箱线图显示验证队列 1中 PT 和 RT 样本中CD20+细胞的比例 。(e) 箱线图分别显示 PT和 RT中 B 细胞亚型的比例 。(f) 根据空间转录组数据对个体患者中 B 细胞与其他细胞类型的共定位评分。(g) 病理学家对用于空间转录组学分析的 H&E 载玻片上 TLS 区域的注释。(h) 验证队列 1 中 CD3、PANCK、CD20、CD8、CD21、CD4 和 FOXP3 的多重 IHC 染色的代表性图像。(i) PT 和 RT 样本中 TLS 区域密度的箱线图 。(j-l) Kaplan-Meier 分析。
08
CD47-SIRPα相互作用抑制rNPC中的抗原呈递
他们在髓系中总共鉴定了 11 个聚类,包括 5 个巨噬细胞聚类、1 个单核细胞聚类、4 个树突状细胞聚类和 1 个活性周期细胞聚类(图8a-b)。单核细胞 FCN1 显示FCN1、VCAN、S100A8和S100A9的高表达,且在 RT 中的比例高于在 PT 样本中的比例(图8c、d)。此外,多色免疫荧光染色证实了验证队列 1 中 RT 与 PT 样本中单核细胞 FCN1 的丰度增加(图8e-f)。
基于空间转录组学分析,他们发现髓系细胞在RT样本中比在PT样本中更接近肿瘤细胞,并且表现出更多显著的相互作用对(图8g)。配体-受体分析表明,在rNPC中,恶性细胞和髓系细胞通过CD47-SIRPα发生更密切的相互作用(图8h)。此外,在RT样本中,更接近CD47 +恶性斑点的髓系斑点的SIRPα表达明显较高,但在PT样本中则没有(图8i)。他们根据多重IHC染色验证了SIRPα+ CD1C +树突状细胞位于CD47 +复发性恶性细胞附近(图8j)。
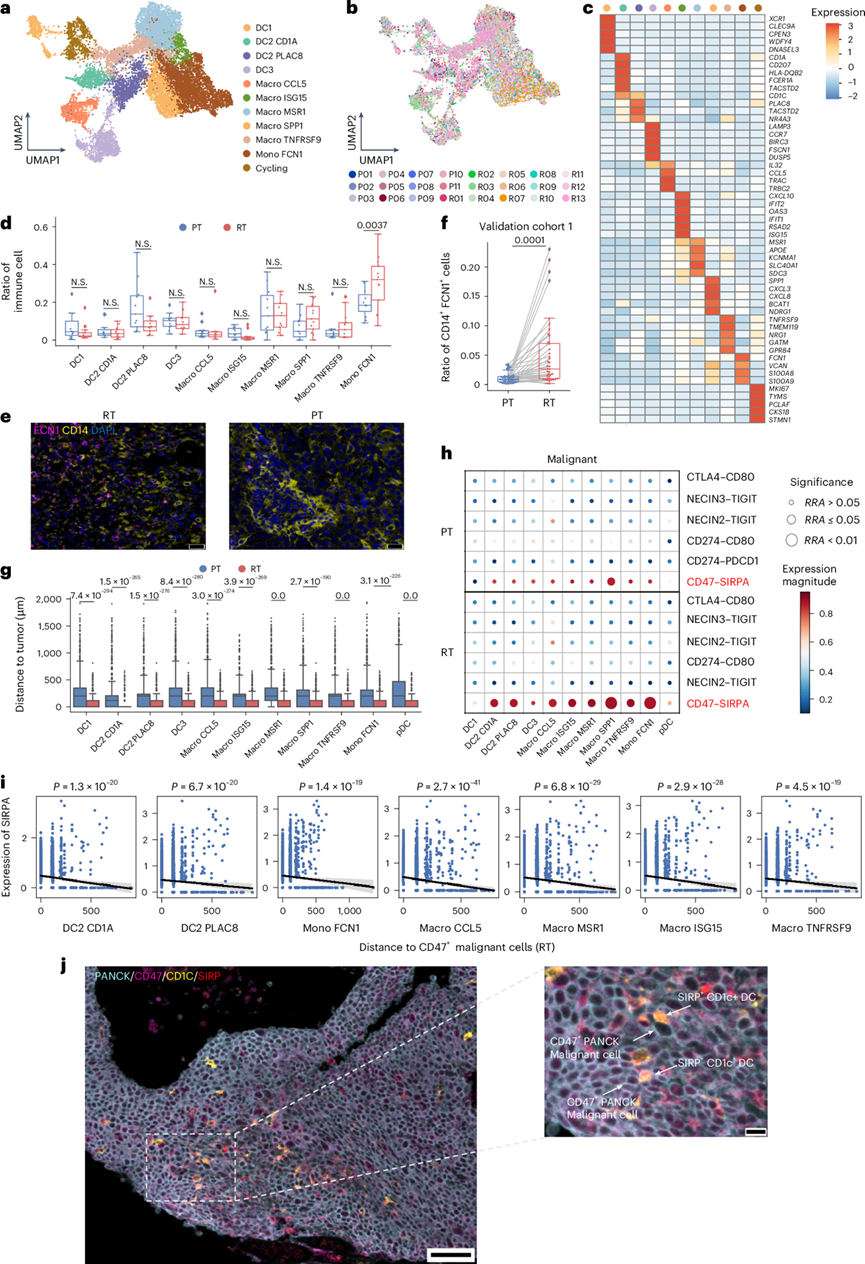
图8. SIRPα+髓系细胞位于 CD47 +恶性细胞附近,可能抑制 rNPC 中的抗原呈递。
(a) UMAP 图显示髓系衍生细胞的亚型。(b) UMAP 图显示 rNPC 和 pNPC 中的髓系细胞。(c) 热图显示髓系衍生细胞每种亚型中标志物基因的表达。(d) 箱线图显示 PT和 RT样本中髓系亚组的比例。(e) PT 和 RT 样本中 FCN1 和 CD14 原位 IHC 染色的代表性图像。(f) 箱线图显示验证队列 1中 PT 和 RT 样本中CD14+ FCN1+细胞的比例 。(g) 箱线图显示 PT和 RT样本中髓系亚群与恶性细胞之间的物理距离(μm)。(h) 气泡图显示基于选定的配体和受体对的 PT 和 RT 中恶性细胞与所示髓系细胞亚型之间的相互作用。(i) 基于空间转录组学数据,更接近 CD47+恶性斑点的髓系亚型在 RT 样本中 SIRPα 的表达显著更高。(j) 多重 IHC 染色的代表性图像 。
+ + + + + + + + + + +
结 论
本研究对来自 24 例患者的 39 个肿瘤进行了单细胞和空间转录组学分析,以揭示原发性鼻咽癌和 rNPC 之间的微环境差异。特异性 MCAM +癌症相关成纤维细胞在 rNPC 中显著富集,它们通过胶原 IV-ITGA2-FAK-AKT 轴促进肿瘤放射抗性。此外,本研究发现胶原 IV 抑制 T 细胞的浸润,并鉴定了 rNPC 中的免疫逃逸机制。本研究发现 CD8 + ZNF683 细胞在细胞毒性较低的 rNPC 中存在并发挥功能。B 细胞和三级淋巴结构的丰度在 rNPC 中显著减少。最后,本研究证实 CD47-SIRPα 在 rNPC 中的髓系细胞和恶性细胞之间普遍存在。本研究对rNPC的放射抗性和免疫逃逸机制提供了深入的理解,并为治愈rNPC指明了关键的初步目标。
+ + + + +



 English
English


