文献解读|Cell Stem Cell(20.4):胰腺癌类器官生物库通过多组学特征关联药物反应并评估他汀联合疗法的临床潜力
✦ +
+
论文ID
原名:A pancreatic cancer organoid biobank links multi-omics signatures to therapeutic response and clinical evaluation of statin combination therapy
译名:胰腺癌类器官生物库通过多组学特征关联药物反应并评估他汀联合疗法的临床潜力
期刊:Cell Stem Cell
影响因子:20.4
发表时间:2025.08.13
DOI号:10.1016/j.stem.2025.07.008
背 景
胰腺导管腺癌 (PDAC) 切除术后的标准辅助治疗包括单药吉西他滨 (GEM)、5-氟尿嘧啶 (5-FU)、吉西他滨/卡培他滨联合用药、白蛋白结合型紫杉醇 (PAC)/吉西他滨 (AG) 以及 FOLFIRINOX (FFX)。采用了积极的辅助化疗,但由于化疗反应率低,PDAC 的复发率仍然很高。尽管对 PDAC 基因组变异进行了广泛的研究,但由于关键驱动因素无法用药,有效的靶向治疗仍然有限,只有少数例外,例如微卫星不稳定性、BRCA2 突变和 KRAS-G12C 突变。有前景的进展包括 KRAS 靶向抑制剂,例如泛 KRAS 抑制剂和 KRAS-G12D 特异性抑制剂,这些抑制剂目前正在进行临床研究,并具有改善 PDAC 治疗方案的巨大潜力。随着治疗方案的不断扩展,对患者进行分层以预测疗效对于推进个性化肿瘤治疗至关重要.
实验设计
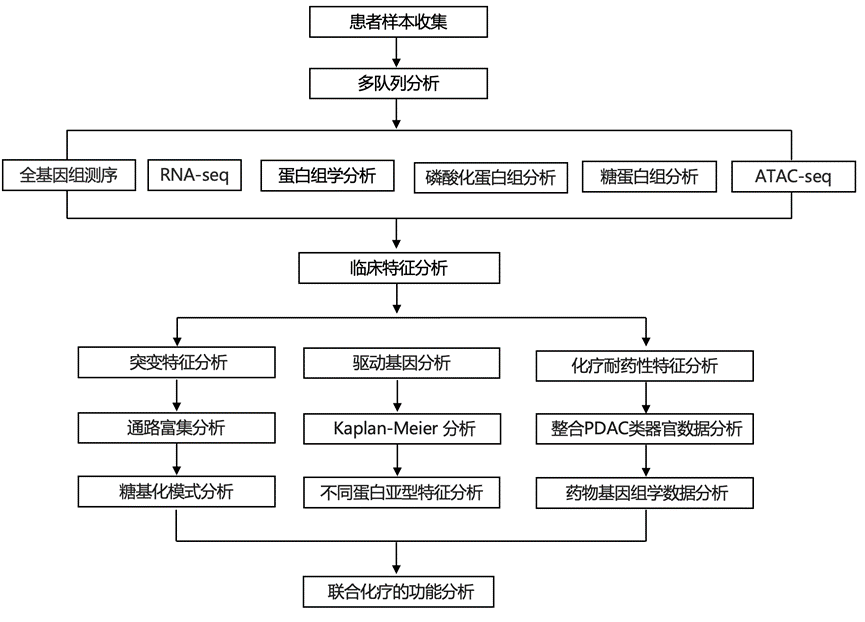
结 果
01
PDAC的蛋白质组学分析
研究团队通过手术切除、内镜超声引导下细针穿刺活检 (EUS-FNA) 或腹水采集获取胰腺癌样本,建立了 260 个胰腺外分泌肿瘤患者类器官系 (PancO)(图 1 A)。原始肿瘤包括 239 个胰腺导管腺癌 (PDAC)、10 个腺鳞癌 (ASC)、7 个导管内乳头状黏液肿瘤 (IPMN)、3 个腺泡细胞癌 (ACC) 和 1 个实性假乳头状肿瘤 (SPT)。此外,还建立了 18 个正常胰腺导管类器官 (NPO)。本研究的队列包括早期(I/II 期,约 70%)和晚期(III/IV 期,约 30%)胰腺癌,其中男性患者占 60%,胰头肿瘤占 57%。他们将 260 个 PancO 分为发现集(n = 197)和验证集(n = 63)。对发现集进行了全面的表征,包括全基因组测序 (WGS)、转录组分析 (RNA-seq)、使用转座酶可及染色质测序 (ATAC-seq)、蛋白质组学分析、磷酸化蛋白质组学分析、糖蛋白质组学、药物敏感性筛选和放射敏感性测试(图 1 A)。使用 RNA-seq 和药物敏感性评估对验证集进行分析。NPO 通过 RNA-seq、ATAC-seq、蛋白质组学和糖蛋白质组学进行表征。
染色质可及性是活性 DNA 调控元件的标志,只有转录因子 (TF) 等细胞机制才能接近它们。为了研究功能性非编码突变区域 (FNCMR),他们将高质量的 ATAC-seq 数据与 WGS 和 RNA-seq 数据集相结合。利用全基因组分析方法产生了 15860 个 ATAC-seq 峰和相应的 8208 个基因集(图 1 B)。进一步分析显示,与非编码热点突变相比,FNCMR 与更高的突变率和更大的 RNA 表达变化相关(7.11% 对 3.99%)(图 1 C)。值得注意的是,80.17% 的 FNCMR 位于活性启动子或增强子内,而热点突变只有 6.89%(图 1 C)。通路富集分析显示,调控信号通路中存在频繁突变,包括 Notch 信号通路、Hippo 信号通路、转化生长因子 β (TGF-β) 信号通路和轴突导向信号通路(图 1 D)。值得注意的是,还观察到蛋白多糖通路的富集,提示 PDAC 发病机制中存在异常的蛋白质糖基化(图1D-E)。在蛋白多糖通路相关基因突变的样本中,蛋白质糖基化水平显著升高(图 1 F)。
为了研究这些突变的影响,他们进行了小干扰 RNA (siRNA) 敲低筛选,以评估 5 个未发生蛋白多糖途径基因突变的 PancO 细胞系的增殖率。糖基转移酶 GALNT12、GALNT18 和 B3GNT2 通过激活 AKT 途径和抑制 Hippo 信号传导促进肿瘤进展。23个含有这些基因远端非编码突变的 PancO 表现出基因表达水平升高,而GALNT12、GALNT18和B3GNT2的敲低显著降低了细胞存活率(图 1 G)。FUT1(一种参与 H 抗原合成的岩藻糖基转移酶)的远端突变与基因表达增加相关,其敲低显著降低了细胞活力。相反,siRNA介导的ITPR1和FLNB(蛋白聚糖信号通路中突变后下调的基因)敲低提高了细胞存活率(图1 G)。这些表型进一步通过稳定的短发夹RNA (shRNA)介导的敲低进行了验证,结果显示,在体外和体内条件下,类器官的增殖效果相似(图1 H)。
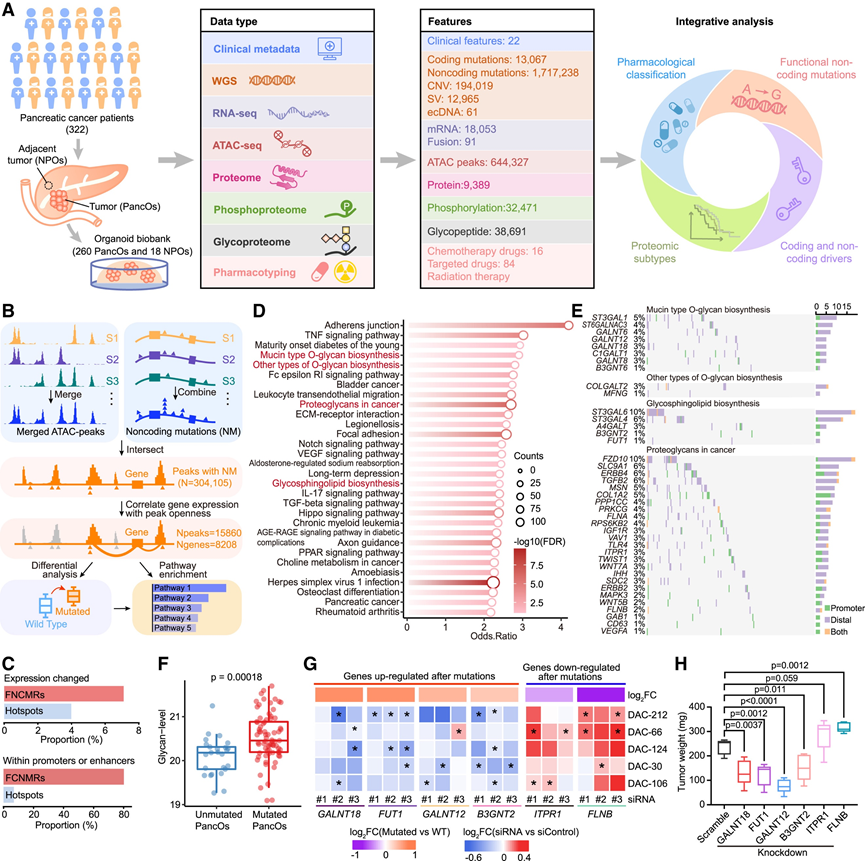
图1. 与功能性非编码突变相关的糖基化。
(A) 示意图显示了本研究中生成的数据和元数据的摘要。(B) 全基因组检测 FNCMR 的工作流程。(C) 突变样本与野生型样本中相应基因表达是否发生显著变化的热点和 FNCMR 比例(上)以及是否位于H3K27ac 或 H3K4me3 ChIP-seq 峰中(下)。(D) 通过通路富集分析,从与FNCMR相关的基因中识别PDAC调控过程。(E) 蛋白聚糖相关通路中FNCMR的突变图。(F) 样本水平上蛋白多糖相关通路突变型和野生型样本的蛋白质糖基化水平比较。(G) (H) 所示shRNA对DAC-30原位移植模型中肿瘤生长的影响。
02
编码和非编码驱动程序
他们设计了一种新方法 HNetDig,用于全基因组识别编码和非编码驱动因子(图 2 A)。HNetDig 在识别编码驱动因素方面优于现有方法(图2B-D),这与之前四项研究设定的金标准进行了验证。已确定了19个已知编码驱动因子和6个新的编码驱动因子(之前与其他癌症有关,但与 PDAC 无关)(图2 B)。这些新的编码驱动因子是 PDAC 独有的,在非 PDAC 亚型中未检测到,从而最大限度地减少了小型非 PDAC 队列对新驱动因素识别的潜在影响。与其他方法相比,HNetDig 识别的编码驱动因素表现出更高的 AUC 得分和 F1 得分(图2C-D)。
HNetDig 鉴定出 35 个高潜力非编码驱动基因和 275 个低潜力非编码驱动基因,分别对应 34 个高潜力非编码驱动基因和 276 个低潜力非编码驱动基因(图 2 E)。HNetDig 在检测非编码驱动基因方面的有效性体现在以下几个方面:首先,非编码驱动基因突变分布在高度保守的区域,而非随机位置或热点,这表明它们具有潜在的功能性。其次,非编码驱动基因在典型癌症基因中表现出显著富集,其中 8.03% 的驱动基因与 OncoKB 数据库中的癌症基因相关,远高于随机预期的 1.09%)。第三,使用组合注释依赖性消耗 (CADD) 和通过隐马尔可夫模型-多核学习进行功能分析 (FATHMM-MKL) 评分进行的致病性评估表明,非编码驱动突变与其他非编码突变相比具有更高的致病潜力(图 S4G和 S4H)。最后,HNetDig 确定了位于 ATAC-seq 峰内或调控和转录区域内的非编码驱动因子。他们分析了 35 个高潜力非编码驱动因素在 PDAC 和非 PDAC 中的分布,发现非 PDAC 中仅存在 7 个驱动因子。
与未突变样本和 NPO 相比,ACSL4的非编码驱动突变与其 mRNA 表达显著上调相关(图2F-G)。利用 CRISPR-Cas9 基因组编辑将这些突变引入未突变的 PancO 中,证实了ACSL4 mRNA 表达增加(图2H-J)。差异基序分析发现,EGR 和 E2F TF 基序在受ACSL4突变影响的序列中显著富集(图2K-L)。值得注意的是,ACSL4表达的这种增加与 PDAC 患者较差的总生存期 (OS) 和无病生存期显著相关(图2M-O)。与未突变样本和 NPO 相比,PCBP3启动子区的突变与 mRNA 表达降低相关。通过 CRISPR-Cas9 将此特定点突变引入 PancO后,PCBP3 mRNA 水平降低。差异基序分析发现,BCL6B 基序主要富集在突变区域,PCBP3表达降低与 PDAC 患者 OS 较差显著相关。ANO5 3′ 非翻译区 (UTR)突变导致 ANO5 基因表达和细胞增殖增加。敲低ANO5表达可显著抑制体内细胞增殖。GABRP 启动子区突变降低其 mRNA 表达,抑制细胞增殖,并产生对 GEM 和 PAC 的抗性。PTPN12因其在多种癌症类型中发挥的抑癌功能而闻名,其表达显著降低,且与一种鉴定为新型驱动突变的增强子突变相关。通过 shRNA 敲低PTPN12可显著增强体内细胞增殖。
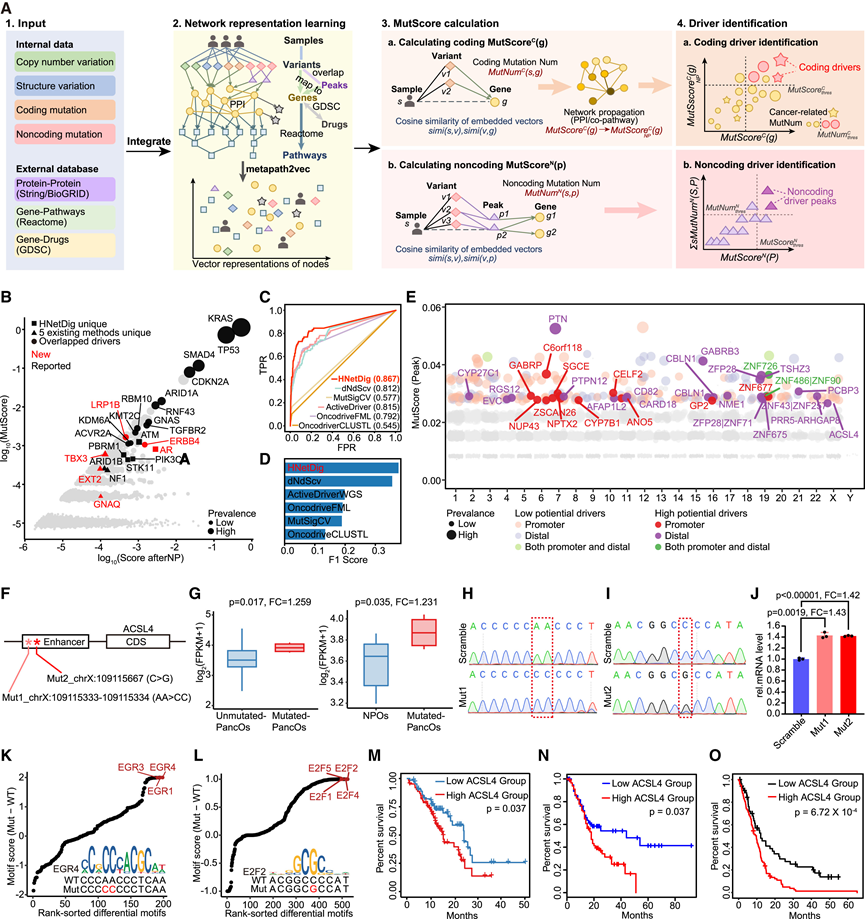
图2. 编码和非编码驱动因素。
(A) HNetDig 识别整个基因组内的驱动基因和峰值的示意图。(B) 散点图显示在 HNetDig 和 5 种现有方法中检测到的编码驱动程序。(C) ROC 曲线比较了 HNetDig 与 5 种现有方法在检测定义明确的 PDAC 编码驱动方面的性能。(D) HNetDig 与 5 种现有方法的 F1 分数比较。(E) 曼哈顿图显示 HNetDig 检测到的非编码驱动峰和相应的基因。(F) 实验示意图。(G) 箱线图显示突变 PancO 与未突变 PancO(左)以及突变 PancO与 NPO(右)之间ACSL4的表达。(H-I) DAC-23 类器官系中ACSL4增强子区域中编辑位点的桑格测序图。(J) DAC-23 类器官系中 CRISPR-Cas9 编辑突变和混乱组中ACSL4的相对 mRNA 表达水平。(K-L) 野生型和突变型ACSL4非编码区中基序得分的差异。基序得分表示目标序列与相关基序之间的相似程度。(M-O) Kaplan-Meier 生存曲线分析。
03
具有重要临床意义的蛋白质组亚型
他们使用非负矩阵分解 (NMF) 聚类分为四种转录组亚型,并将其与现有的分类框架配对,称为“基础样”、“混合 A”、“混合 B”和“经典样”。虽然基础样亚型表现出较差的预后,但所有亚型的化学敏感性仍然相当。为了进一步阐明生物学差异,他们采用了加权相关网络分析 (WGCNA),这使得可以对共表达网络进行无偏向的转录组范围探索。该分析确定了90个模块,其中 16 个模块在转录组亚型之间表现出显著的差异调控。值得注意的是,以基底细胞癌、丝裂原活化蛋白激酶 (MAPK) 和磷脂酰肌醇 3-激酶 (PI3K)-AKT 特征为特征的 2 个模块在基底样亚型中富集。MAPK 和 PI3K 网络活性从经典样亚型到混合亚型(混合型 A 和混合型 B)再到基底样亚型逐渐增强。与这些发现一致,基底样类器官对 MAPK 和 PI3K-AKT 抑制剂表现出更高的敏感性。利用变异性最高的蛋白质进行 K 均值聚类,他们鉴定出 3 种蛋白质组亚型。随后对这些亚型进行以通路为中心的分析,让他们能够探索每种亚型的独特生物学特性,发现一种亚型中聚糖生物合成过程显著富集。通过所有样本的基因集变异分析 (GSVA) 进一步验证了这种独特的聚糖组成(图 3 A),他们将其指定为高聚糖聚类(聚糖-H)。其余两种亚型分别命名为低聚糖(聚糖-L)和中等聚糖(聚糖-I)。在蛋白质组亚组中,聚糖-H 亚型的生存率最差,化疗耐药性最高(图3B-C)。然而,这三种蛋白质组亚型在其他临床参数中表现出相似的模式,强调了分子分类的重要性和糖蛋白分析的临床相关性。
他们观察到本研究队列中 RNA 和蛋白质水平之间存在中等中位相关性 (0.25),这与之前关于其他癌症中 RNA-蛋白质解偶联的报道一致。值得注意的是,亚型特异性聚糖途径蛋白表达的差异并未反映在 RNA 水平上,强调了 PDAC 中转录组学和蛋白质组学谱之间的一致性有限。为了剖析患者间的异质性,他们进行了综合多组学因子分析 (MOFA),确定了 15 个驱动跨分子层变异的因子。因子 2 成为蛋白质组和磷酸化蛋白质组变异的主要贡献者,并与聚糖代谢和聚糖-H 亚型密切相关。因子 2 与基于聚糖的主成分之间的高度相关性验证了这种关联。这种相关性强调了聚糖蛋白质组对因子2内蛋白质组特征的显著贡献。重要的是,主成分分析 (PCA) 表明,聚糖-H类器官只能在蛋白质组学水平上区分,而无法在转录组水平上区分。
糖蛋白质组学数据证实了聚糖-H 组内糖蛋白的明显存在(图 3D)。随后对四种聚糖类别进行的差异分析表明,聚糖-H 中糖蛋白的表达升高。然后,他们继续评估从本研究队列中随机选择的类器官和组织中的糖蛋白的唾液酸化聚糖。在聚糖-H 类器官和组织中,糖蛋白的唾液酸化聚糖的表达水平显著较高。对 270 例患者进行的组织微阵列 (TMA) 分析显示,糖蛋白上唾液酸化聚糖的高表达与最差的 OS 相关(图 3E)。
此外,使用两个已发表的 PDAC 队列独立验证了三种蛋白质组学亚型。利用相同的分类方法,他们在 Hyeon 队列中鉴定了三种蛋白质亚型(蛋白质-S1、蛋白质-S2 和蛋白质-S3)。通路富集分析证实,蛋白质-S3 对应于高糖亚型。在 Hyeon 队列中,蛋白质-S3 始终表现出最差的预后(图3F)。同样,根据亚型特异性标记基因将 Cao 队列分为三个亚型(蛋白质-C1、蛋白质-C2 和蛋白质-C3)。与其他两种亚型相比,蛋白质-C3 亚型患者的蛋白质糖基化水平最高,总生存期最差(图3G-H)。值得注意的是,两个队列中的高糖亚型也富含胆固醇代谢通路。这些发现凸显了高糖亚型的临床和生物学意义,该亚型的特征是蛋白质糖基化水平升高、胆固醇代谢途径富集、预后不良以及PDAC化疗耐药。
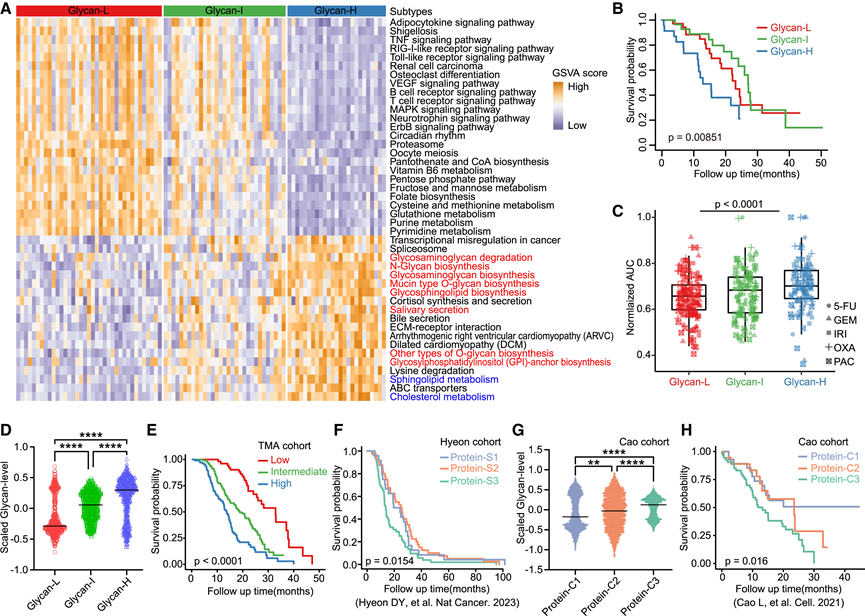
图3. 具有强烈预后和化学敏感性影响的蛋白质组亚型。
(A) 热图显示三种蛋白质组亚型之间具有差异 GSVA 富集得分的通路。(B) 三种蛋白质组亚型的总生存率 (OS) 的 Kaplan-Meier 生存曲线。(C) 5 种化疗药物在三种蛋白质组亚型中的标准化 AUC。(D) 三种蛋白质组亚型在糖基化位点水平上的糖水平(Z分值)比较。(E) 组织微阵列 (TMA) 中 OS 的 Kaplan-Meier 生存曲线。(F) Hyeon 队列三个亚组的 OS 的 Kaplan-Meier 生存曲线。(G) 糖基化位点水平上的糖水平比较。(H) 三个亚组的 OS 的 Kaplan-Meier 生存曲线。
04
蛋白质糖基化导致化疗耐药性
基于类器官的五种标准化疗药物的药理分型表明,PDAC 治疗反应在患者之间存在显著差异。根据对每种化疗药物的反应,将 PancO 分为 3 个亚组:耐药(AUC 最高 25%)、敏感(AUC 最低 25%)和中等(AUC 中间 50%)(图 4 A)。为了评估这些亚组的临床相关性,回顾性地从 30 名通过 EUS-FNA 获取类器官的 PDAC 患者那里获得了临床随访数据。根据类器官敏感性和实际化疗方案将患者分为 2 组:预测反应良好组(评分 ≥ 2),预测反应不良组(评分 < 2)。临床结果显示 17 例部分反应 (PR) 或病情稳定 (SD) 和 13 例病情进展 (PD)。良好反应组中的类器官和相应患者表现出良好的临床结果(PR/SD),而不良反应组中的类器官和相应患者则表现出不良结果(PD)(图 4 B)。值得注意的是,在 30 例病例中,有 7 例存在差异,导致类器官敏感性和患者结果之间的总体匹配率为 76.67%(图 4 C)。根据结构变异的分布,PancO 进一步分为三种亚型:“稳定”(结构变异最低 25%)、“不稳定”(结构变异最高 25%)和“分散”亚型(中等水平)。与之前的研究一样,不稳定亚型对 OXA 表现出更高的敏感性,但对其他四种化疗药物的敏感性没有增加。
根据这 5 种化疗药物的曲线下面积 (AUC) 值进行聚类分析,发现 PancO 主要分为三大组:化疗耐药组 (chemo-R)、化疗敏感组 (chemo-S) 和中间组 (chemo-I)(图4D)。通路富集分析发现化疗-R 组中存在失调的糖通路(图 4E),该组的蛋白质糖基化水平也显著升高(图 4 F)。为了研究蛋白多糖水平与化疗耐药性之间的潜在联系,他们使用糖蛋白质组学数据进行了聚类分析。由此鉴定出两个糖蛋白质组聚类,其糖蛋白水平(低糖和高糖)和化学敏感性存在显著差异(图 4 G-H),并且观察到糖蛋白质组亚型、蛋白质组亚型和药理学亚型之间存在显著相关性(图 4 I)。
他们将 OncoKB 和 CGI证据层级应用于泛癌症,以系统地评估本研究队列中可临床操作的基因组变异 (AGV)(图 4 J)。分析显示,79.6% 的样本含有具有临床意义的 AGV,可能会影响有关靶向治疗的临床决策(图 4 K)。针对 84 种靶向药物和 16 种化疗药物,建立了 183 种 PancO 的综合治疗概况,其中 14 种靶向药物、8 种单一化疗药物和 8 种联合化疗药物正在进行或已经完成 PDAC 临床试验。严格的质量控制确保了不同筛选之间的生物学重复之间的高度相关性。使用 IC50 或 AUC 量化药物疗效,两个指标均显示出很强的相关性和一致性,所有分析统一使用 AUC 值。为了探究类器官治疗分析在胰腺导管腺癌 (PDAC) 患者治疗中的适用性,他们评估了药物敏感性与相应 AGV 的一致性。当发生基因组改变的类器官的药物敏感性 AUC 低于队列平均值时,观察到了积极结果,通过类器官治疗分析验证了 37.68% 的 AGV-药物相关性(图 4 L)。当药物根据其主要靶点分为 6 个特定信号通路时,针对 PI3K、MAPK 和 DNA 损伤通路的化合物的 AGV 与药物敏感性之间的相关性最显著,而针对 RTK 和表观遗传通路的化合物的相关性最不显著(图 4 M)。这表明 PI3K 和 MAPK 通路的基因组改变可能导致对上游 RTK 通路抑制剂产生耐药性,这一假设得到了先前研究结果的支持,即针对 EGFR 信号的化合物在EGFR和ERBB2改变的细胞中具有强效活性,但在下游 ERK-MAPK 信号突变(如突变的 RAS)的细胞中则没有活性。
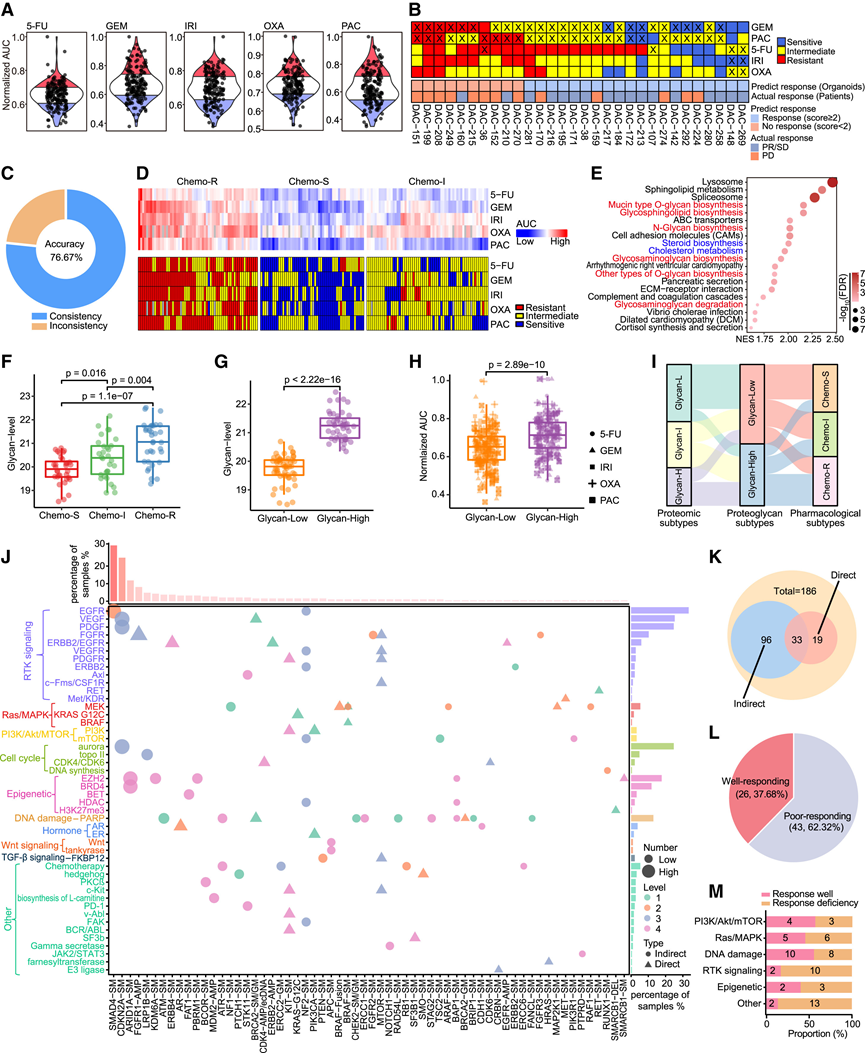
图4. 蛋白质糖基化导致化疗耐药性。
(A) PancO中 5 种化疗药物的 AUC 小提琴图。(B) 通过将预测结果与实际治疗反应进行比较,评估类器官药物敏感性评分预测治疗反应的准确性。(C) 类器官药物敏感性与患者临床结果的总体匹配率。(D) 热图(上)显示 5 种化疗药物的 AUC 曲线,这些药物分为三个亚型,热图(下)显示每种化疗药物的亚组。(E) 化学 R 亚型中前 20 条显著富集的通路。(F) 样本水平上三种药理亚型的蛋白质糖基化水平比较。(G) 样本水平上两种糖蛋白质组亚型的蛋白质糖基化水平比较。(H) 两种糖蛋白质组亚型中五种化疗药物的标准化 AUC 值。(I) 蛋白质组亚型、糖蛋白质组亚型和药理学亚型的分布。(J) 根据 OncoKB 和全癌症 CGI 证据等级,AGV 与药物靶点(根据靶向途径分类)之间的关系。(K) 饼图显示患有临床 AGV(直接或间接)的 PDAC 患者的比例。(L) 饼图显示反应良好的 AGV-药物对和反应较差的 AGV-药物对的比例。(M) 基于通路反应良好的 AGV-药物对和反应较差的 AGV-药物对的比例。
05
方差分析发现新的
探索多组学特征 (MOF) 与药物疗效之间的关系可以显著扩大受益于现有治疗的个体范围。他们应用了 GDSCTools ANOVA 平台来精确定位与药物反应相关的 MOF。GDSCTools ANOVA 分析揭示了 2794 个具有显著效应大小的显著关联(图 5 A),表明 10643 个 MOF 中有 1365 个(12.84%)与至少一种药物反应显著相关(图 5 B)。值得注意的是,与化疗药物相比,靶向治疗药物在关联中表现出更高的效应大小,而后者在敏感关联中表现出较低的效应大小。他们对缩小规模的 PDAC 类器官子集进行了方差分析,观察到与较少类器官系相关的显著关联急剧下降(图 5C),强调了大型异构类器官集合对于统计稳健性和基因型代表性的重要性。
带有BRCA1和BRCA2突变以及其他 DNA 损伤修复 (DDR) 基因(RAD54L、BRIP1和ATR)突变的类器官对奥拉帕尼表现出明显的敏感性(图5D)。ZNF652 直接与CCND3启动子结合,抑制其转录并增加活性氧 (ROS) 介导的 DNA 损伤。他们发现CCND3扩增子的存在与类器官对奥拉帕尼的敏感性增强有关(图 5D),而敲低CCND3则增加细胞对该药物的耐药性。基础 ATM 依赖性核因子 κB (NF-κB) 激活通过典型的 DNA 损伤途径发生,ERC1敲低导致 NF-κB 活性丧失。他们发现ERC1扩增子的存在与类器官对奥拉帕尼的敏感性增强有关(图 5 D),而敲低ERC1则增加细胞对该药物的耐药性。
BRAF突变(BRAF-600_601del和Q329X)和SESN3表达升高(一种由 Ras 抑制的抗氧化调节剂)与类器官对达拉非尼的敏感性增强有关(图 5 E)。此外, MAP4K4(MAPK/ERK 通路的新调节因子)和FGF19(通过 AKT 和 MAPK 通路促进 PDAC 致癌的驱动因子)表达降低均与类器官对达拉非尼的敏感性增加相关(图 5 E)。FGF19 的敲低增强了细胞对达拉非尼的敏感性,而 FGF19 的过表达则导致对达拉非尼的耐药性。
为了阐明药物靶点与生物标志物之间影响药物敏感性的相互作用,他们将药物靶点和生物标志物与蛋白质-蛋白质相互作用数据整合在一起。他们确定了药物靶点和生物标志物节点之间的最短网络距离(图5 F)。两种生物标志物类型的中位最短节点距离均为3,其中兼具药物靶点(最短距离为零)的生物标志物在敏感MOF-药物关联中(7.77%)比在耐药关联中(1.14%)更常见(图5 F)。
许多 MOF 以指示特定生物学作用的方式同时出现或互相排斥。他们采用了二进制输入到连续输出的逻辑优化 (LOBICO) 方法来推导出整合 MOF 的最佳逻辑模型,以阐明药物敏感性,以 AUC 值衡量。LOBICO分析揭示了已建立的和新的关联(图 5 H)。通常,与基于单一预测因子的模型相比,采用“或”逻辑的模型表现出更高的召回率和精确度(图 5H-I)。例如,72% 的类器官系中SMAD4突变或缺失的存在与对 PI3Kα 抑制剂 alpelisib 的敏感性相关,与仅考虑SMAD4突变时的 41% 敏感率相比显著增加。相反,基于“和”逻辑的模型显示出增强的精确度但降低了召回率(图5H-J)。例如,发现存在CDKN2A缺失而无UBR5扩增和FGFR2扩增的 PancO 对 PRMT5-MTA 复合物抑制剂 MRTX-9768(一种选择性靶向MTAP/CDKN2A缺失肿瘤的抑制剂)更敏感,达到 81% 的精确度(仅有CDKN2A缺失时为 67%),召回率略有下降(仅有CDKN2A缺失时为 66% 对比 69%)。此外,无CDKN2A突变或缺失的 PancO 对顺铂表现出更高的敏感性,达到更高的精确度(单预测模型为 93% 对比 54%),但召回率降低(单预测模型为 33% 对比 54%)(图 S10 Q)。LOBICO 分析强调了将致癌改变组合作为生物标志物进行整合以更准确地预测药物反应的关键作用。
根据放射后细胞活力的变化,他们把 PancO 分为 3 类:抗性(最高 25% AUC)、中等(中间 50% AUC)和敏感(最低 25% AUC)(图5K-L)。使用 GDSCTools ANOVA,他们确定了 322 个与放射反应相关的显著关联(图5M)。自噬通常是化疗和放疗损伤的主要反应机制,临床试验旨在通过抑制自噬来增强癌细胞的放射敏感性。他们发现自噬途径活性低的类器官对放射更敏感(图5M),而暴露于自噬抑制剂 3-甲基腺嘌呤会增加它们对放射的敏感性(图 5N)。然而,其他自噬抑制剂,如羟氯喹和 bafilomycin A1,并没有增强 PancO 的放射敏感性(图 5O-P)。本研究还涉及了对放射诱导自噬至关重要的 ATM 通路,ATM 蛋白表达升高和ATM突变与 PancO的放射敏感性增加相关(图 5 M)。此外,使用 ATM 激酶抑制剂 azd1390 和 ceralasertib 可增强类器官的放射敏感性(图5Q-R)。这些结果强调了在临床前研究和临床试验中选择合适抑制剂的重要性。相比之下,未发现凋亡通路和 Hedgehog 通路与放射敏感性之间相关性,针对这些通路的抑制剂不会影响 PancO 对放射的敏感性。
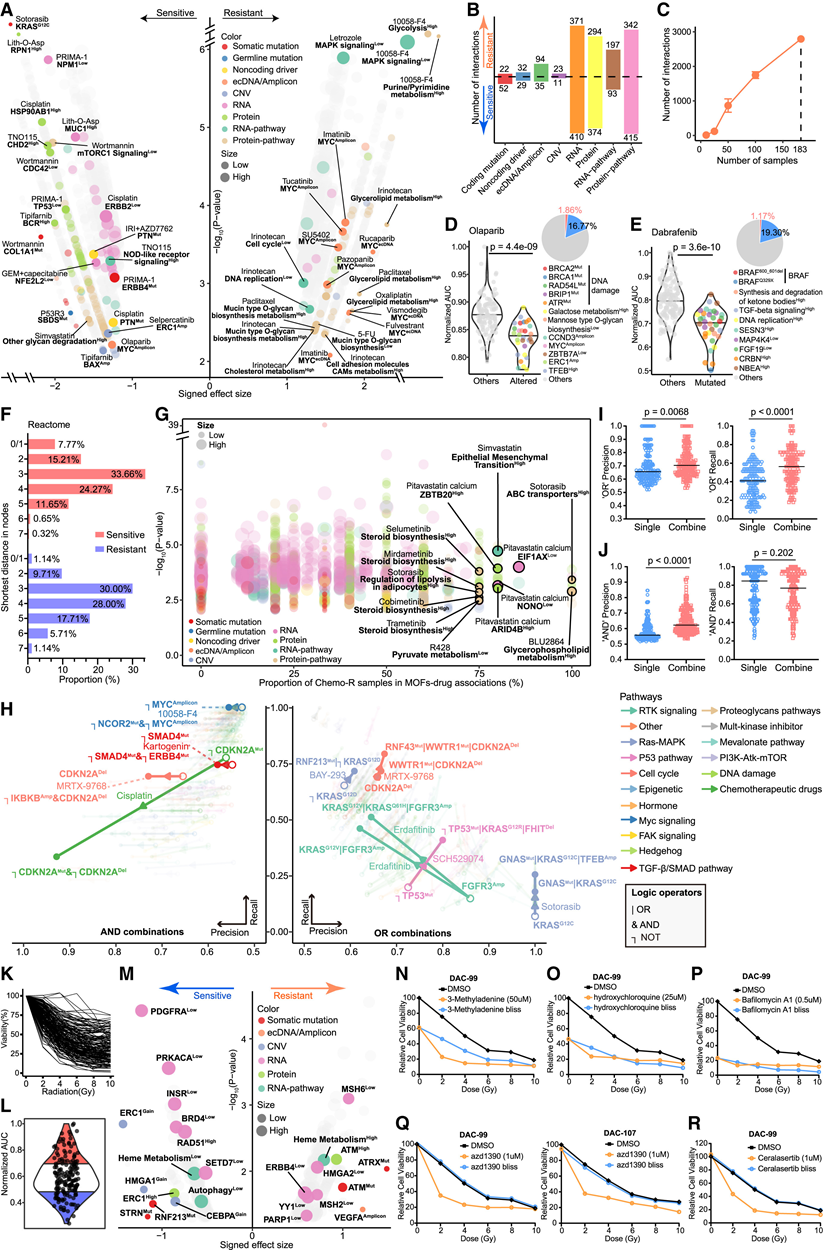
图5. 方差分析和 LOBICO 识别新的治疗机会。
(A) 具有符号效应大小的火山图和与标准化 AUC 相关的显著大效应大小生物标志物。(B) 生物标志物不同分子层中显著的大效应量相互作用的数量。(C) 在模拟下采样的癌症特异性方差分析中,保留的显著大效应量交互作用的数量。(D) 小提琴图显示方差分析鉴定出的奥拉帕尼-MOF关联。(E) 小提琴图显示方差分析鉴定出的达拉非尼与MOF的关联。(F) Reactome 相互作用组中药物靶标和 MOF 之间的最短距离。(G) 药物-MOF 结合的样本比例,将化学-R PancO 与其他 PancO 进行比较。(H) 最优 AND/OR 模型组合图。(I) 单一预测模型(“OR”)与逻辑组合在精确度和召回率上的比较。(J) 单一预测模型(“AND”)与逻辑组合在精确度和召回率上的比较。(K) PancO 对辐射的剂量反应。(L) 小提琴图显示辐射的标准化 AUC,分别分为 3 组。(M) 具有效应大小和与标准化 AUC 相关的生物标志物火山图。(N-R) 单次照射和与所示抑制剂联合照射的辐射响应曲线。
06
他汀类药物克服了PDAC的化学耐药性
为了确定化疗耐药性PDAC的治疗方法,他们比较了chemo-R和chemo-S类器官的药物反应。chemo-R类器官表现出广泛的耐药性,而三种他汀类药物——洛伐他汀(LOV)、匹伐他汀(PIT)和SIM——在选择性抑制这些药物方面表现出显著效果(图6 A)。
为了进一步研究他汀类药物在调节PDAC化学耐药性中的作用,在验证集中进行了单药和联合用药可行性试验。根据对五种化疗药物的反应,将该组分为敏感组和耐药组(图 6 B)。结果发现,耐药组对他汀类药物的敏感性高于敏感组(图 6 C)。将类器官对联合用药的反应与使用基于单药治疗活性的 Bliss 独立模型计算出的预期反应进行了比较。如果实际联合用药 AUC 的降低幅度大于 Bliss 预测的 AUC 降低幅度(ΔAUC > 0),则认为类器官-联合用药对具有协同作用。值得注意的是,780 个类器官-联合用药对中有 43.59% 表现出协同作用(图6 D),耐药组出现协同效应的可能性更高(图 6 E-F)。持续地,FFX 抗性的 DAC-71 衍生异种移植瘤在体内对他汀类药物和 FFX 的联合治疗表现出更高的敏感性(图 6 G-H)。相反,FFX 敏感的 DAC-77 衍生异种移植瘤在用他汀类药物治疗时未表现出任何协同反应。
接下来,他们研究了他汀类药物增强化疗敏感性的机制。首先使用蛋白质组学数据集分析了代谢途径与化疗敏感性或他汀类药物治疗之间的相关性。有趣的是,糖和脂质代谢途径(包括胆固醇代谢)与化疗耐药性呈正相关,但也与对他汀类药物的敏感性增加呈正相关(图 6 I)。已知他汀类药物通过抑制 MVA 通路中的 3-羟基-3-甲基戊二酰辅酶 A 还原酶 (HMGCR) 来降低胆固醇水平,而 MVA 通路是肿瘤生长的重要代谢途径(图 6 J)。MVA下游通路富集分析显示,与 chemo-S 类器官相比,chemo-R 类器官中糖和胆固醇代谢显著富集。然而,其他 MVA 下游过程在 chemo-R 类器官中并未显著富集。
正如预期的那样,ATO 处理导致细胞胆固醇含量显著降低(图 6K)。同时,ATO 处理导致化学抗性类器官中的蛋白质糖基化水平显著降低(图 6L)。四种聚糖类别的差异分析显示糖蛋白水平显著抑制,其中唾液酸水平下降最为明显。ATO 处理的类器官中唾液酸免疫荧光染色的降低进一步证实了这一点。同样,他汀类药物给药显著降低了化学抗性的 DAC-71 异种移植中的蛋白质糖基化水平。接下来,他们使用特定的抑制剂抑制了 MVA 通路的下游信号传导(图 6J)。针对蛋白质糖基化(SGN-2FF 和 Lith-O-ASP)和胆固醇代谢(阿伐麦布、奈伐麦布、NB-598 和依折麦布)的抑制剂与 FFX 治疗联合使用时表现出协同作用(图 6 M)。相比之下,针对其他 MVA 下游通路的抑制剂未表现出协同作用(图 6J)。这些发现表明,他汀类药物通过抑制糖和胆固醇代谢通路来抑制 MVA 通路并增强化疗敏感性。
为了研究糖和胆固醇代谢在调节化疗敏感性中的下游机制,他们进行了基因集富集分析 (GSEA),并分析了它们与 chemo-R 和 chemo-S PancO 中蛋白质糖基化和脂质代谢途径的相关性。EMT 信号通路在 chemo-R 类器官中显著富集,并与糖和胆固醇代谢途径密切相关(图 6 N)。此外,各种糖和脂质代谢途径与 EMT 显著相关。EMT 已确定为化疗耐药的基本机制。为了证实糖和胆固醇代谢与 EMT 特征之间的联系,他们用上游 HMGCR 抑制剂(ATO 和 SIM)以及下游蛋白质糖基化抑制剂(Lith-O-ASP 和 SGN-2FF)和胆固醇代谢抑制剂(阿伐麦布和奈伐麦布)治疗化疗耐药的 PancO。所有测试的抑制剂均显著抑制了 EMT 特征基因的表达(图 6 O -P)。相比之下,针对其他 MVA 下游通路(Tipifarnib、RSL3 和 TH-Z145)的抑制剂并未降低 EMT 特征基因的表达。这些结果表明,他汀类药物通过减弱聚糖和胆固醇代谢有效抑制化学耐药性 PancO 中的 EMT,为其化学增敏作用提供了机制基础。
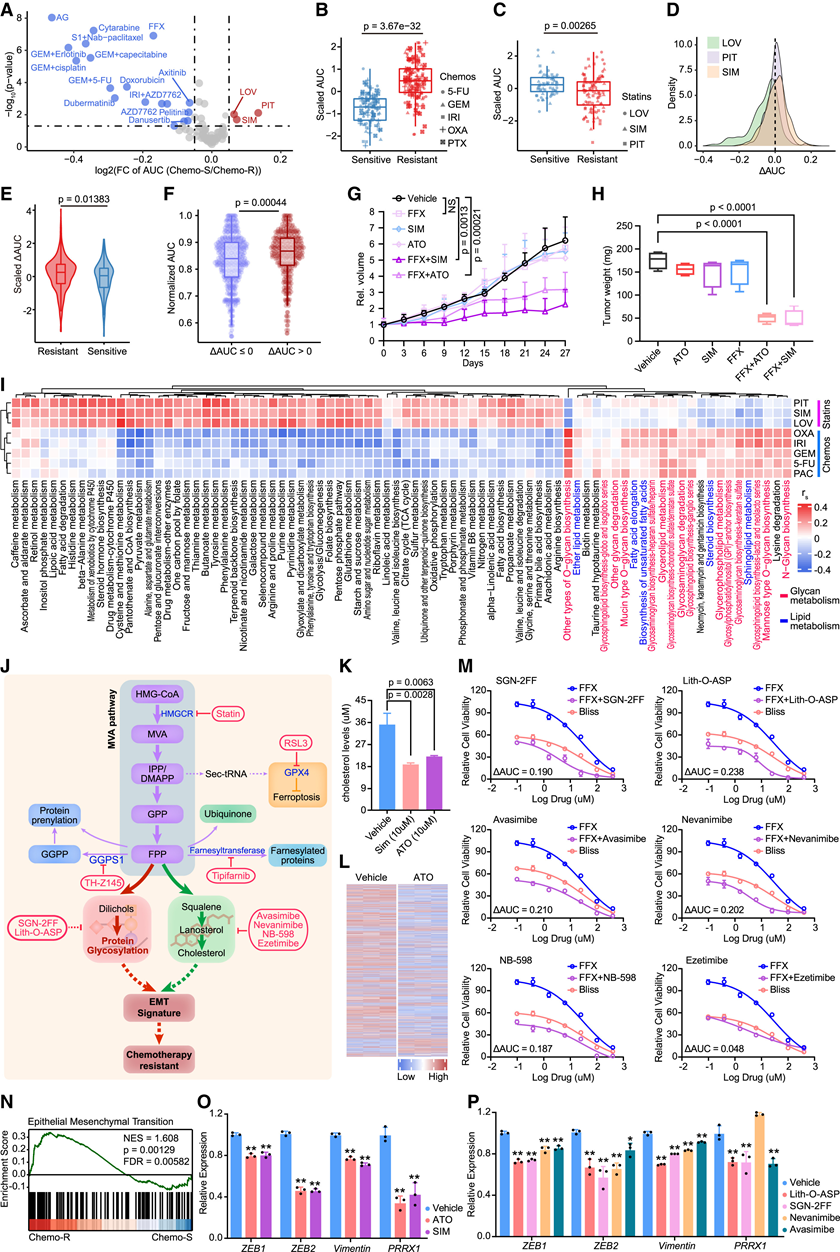
图6. 他汀类药物克服了 PDAC 的内在化学耐药性。
(A) 火山图显示了 chemo-R 和 chemo-S PancO 中抑制剂的分布。(B) 验证集中耐药组和敏感组间 5 种化疗药物的标准化 AUC。(C) 验证集中耐药组和敏感组之间 3 种他汀类药物的标准化 AUC。(D) 验证集中所有组合治疗的 ΔAUC 密度分布。(E) 验证集中耐药组和敏感组之间的缩放 ΔAUC 分布。(F) 验证集中协同和非协同 PancO 的标准化 AUC(化疗药物)分布。(G) 用指示药物治疗后,FFX 抗性的 DAC-71 衍生的皮下异种移植瘤的肿瘤体积。(H) 箱线图显示了使用指示药物治疗后 DAC-71 衍生的原位异种移植瘤的肿瘤重量变化。(I) 热图显示了来自蛋白质组学谱的代谢途径(KEGG 数据库)的 GSVA 富集分数与所示药物的 AUC 值之间的 Spearman 相关性。(J) MVA 和下游通路的示意图。(K) 他汀类药物治疗后 DAC-36 类器官系中细胞内游离胆固醇水平的变化。(L) 热图显示,ATO 处理的类器官系 (DAC-38) 和对照类器官系 (DAC-38) 之间的糖基化位点发生了显著变化。(M) FFX 与糖基化和胆固醇代谢抑制剂在 DAC-36 类器官系中的联合剂量反应曲线。(N) chemo-R 与 chemo-S 中 EMT 通路的 GSEA 富集图。(O-P) EMT 特征基因表达水平的变化。
07
他汀类药物在临床治疗中提高化疗疗效
为了探究他汀类药物对改善 PDAC 患者预后的疗效,他们开展了一项单组 II 期临床试验 (NCT06241352)。本研究招募了 42 例局部晚期或转移性胰腺癌患者(50% 为女性),他们的肿瘤标志物(CA19-9 或 CEA)在化疗期间均已达到平台期。在治疗期间,肿瘤标志物稳定在平台期通常是肿瘤正在产生化疗耐药性的指标。通过在现有治疗方案中添加他汀类药物,旨在验证他汀类药物是否能够减轻患者对化疗的耐药性。患者接受标准化疗方案以及 ATO 80 mg/天治疗。如果肿瘤标志物水平较基线升高超过 20%,则停止 ATO 治疗(图 7 A)。
入选的 42 名患者中,1 名失访,1 名自愿停药。除了 3 名患者因氨基转移酶水平升高而停止他汀类药物治疗外,其余患者在整个治疗过程中未发现意外的安全问题。在其余 37 名患者中,初步结果显示,26 名患者(70.3%)在添加 ATO 1 个月后肿瘤标志物(CA19-9 或 CEA)下降超过 20%(图 7 B)。根据迄今为止获得的随访结果,26 名患者的肿瘤标志物水平低于基线的平均时间为 62.35 天。值得注意的是,其中两名患者(CH-Patient#3 和 CH-Patient#15)最初对联合疗法有反应,但后来出现耐药性,肿瘤标志物再次迅速升高。 4 名患者(CH-Patient#7、CH-Patient#9、CH-Patient#14 和 CH-Patient#30)的肿瘤标志物水平稳定,7 名患者(CH-Patient#16、CH-Patient#17、CH-Patient#21、CH-Patient#22、CH-Patient#23、CH-Patient#35 和 CH-Patient#37)尽管接受了联合治疗,但肿瘤标志物水平仍升高(图 7 B)。在可评估的患者中,中位无进展生存期 (PFS) 为 8.05 个月,中位 OS 未达到。总体而言,处于化疗平台期的晚期PDAC患者在化疗方案中添加ATO后,肿瘤标志物水平和肿瘤大小均显著降低(图7 C-D)。例如,CH患者#2在接受三个周期的FFX和AG治疗后已达到平台期,CA19-9水平在超过4个月的时间内波动幅度不超过20%表明其疗效显著。ATO和AG联合治疗取得了显著疗效,肿瘤标志物水平和肿瘤大小均显著降低(图7 E-F)。
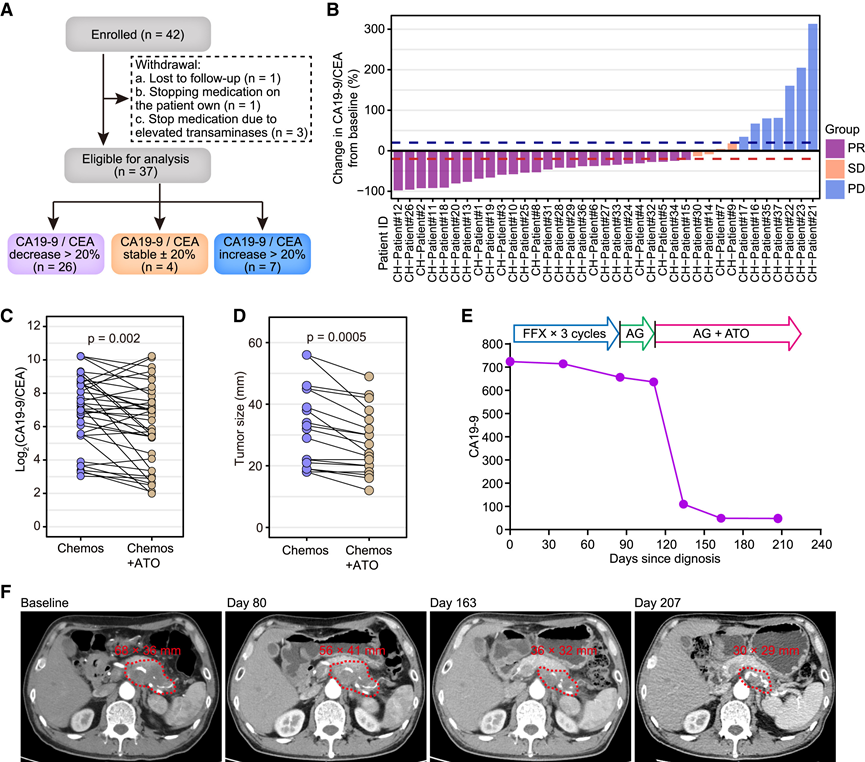
图7. 他汀类药物在临床治疗中提高化疗疗效。
(A) 临床试验示意图,包括患者入组和基于治疗效果的分组。(B) 条形图显示37例患者服用阿托伐他汀至少1个月后CA19-9或CEA的变化。(C-D) 线图显示服用阿托伐他汀 1 个月后 CA19-9 或 CEA 水平和肿瘤大小显著下降。(E) 患者(CH-患者#2)从诊断到治疗期间血清CA19-9的测量值。(F) 患者(CH-Patient#2)在不同时间点的代表性放射检查图像。
+ + + + + + + + + + +
结 论
本研究建立了 260 个胰腺癌类器官系,并进行了广泛的多组学分析和治疗敏感性评估。整合分析发现了 6 个新的编码基因和 35 个非编码驱动候选基因。本研究发现了 2794 个与药物敏感性相关的多组学特征和 322 个与放射敏感性相关的特征。药物基因组学分析显示,化疗耐药性类器官在蛋白质糖基化和胆固醇代谢途径方面表现出富集。值得注意的是,他汀类药物可有效靶向化疗耐药性 PDAC 类器官。他汀类药物治疗可减弱 PDAC 类器官中的蛋白质糖基化、胆固醇水平和上皮-间质转化 (EMT) 特征。本研究开展了一项单中心、单组、Ⅱ期临床试验 (NCT06241352),将阿托伐他汀与化疗联合用于治疗晚期胰腺癌患者。37例患者中,26例(70.3%)出现疗效反应,肿瘤标志物下降超过20%,这表明该疗法对这类极具挑战性的患者群体具有持久的疗效和潜在的临床益处。
+ + + + +



 English
English


