文献解读|(12.658):PCSK9通过调节肿瘤细胞EMT和PI3K/AKT信号及巨噬细胞表型极化促进肿瘤细胞的进展和转移
✦ +
+
论文ID
原名:PCSK9 promotes the progression and metastasis of colon cancer cells through regulation of EMT and PI3K/AKT signaling in tumor cells and phenotypic polarization of macrophages
译名:PCSK9通过调节肿瘤细胞EMT和PI3K/AKT信号及巨噬细胞表型极化促进肿瘤细胞的进展和转移
期刊:Journal of Experimental & Clinical Cancer Research
影响因子:12.658
发表时间:2022.10.14
DOI号:10.1186/s13046-022-02477-0
背 景
结直肠癌(CRC)是全球范围内发病率及死亡率均较高的一种癌症,预后非常差。因此,深入研究结直肠癌的发生发展,有助于有效地控制肿瘤转移以及延长患者的生存时间。前蛋白转化酶枯草杆菌蛋白酶/kexin9型(PCSK9)是调节脂蛋白稳态的原蛋白转换酶家族中的第9个成员,PCSK9的表达异常与肿瘤的发生发展密切相关。这项研究评估了PCSK9在人类结肠癌中的表达和功能,探索了潜在的分子机制。
实验设计
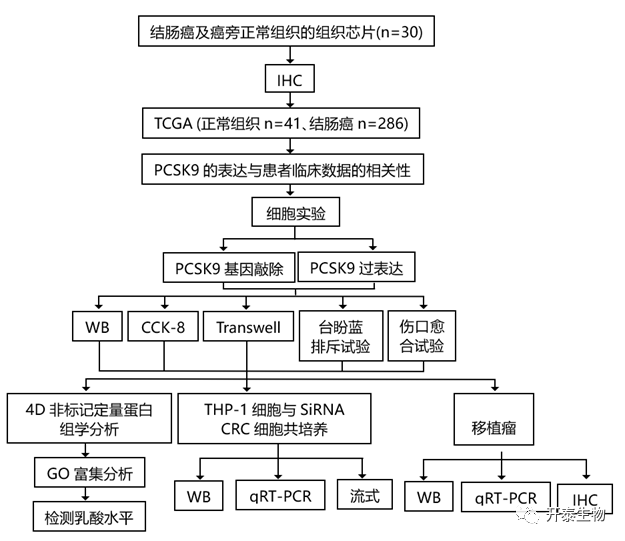
结 果
01

结肠癌组织中PCSK9的表达上调及其与临床病理因素的关系
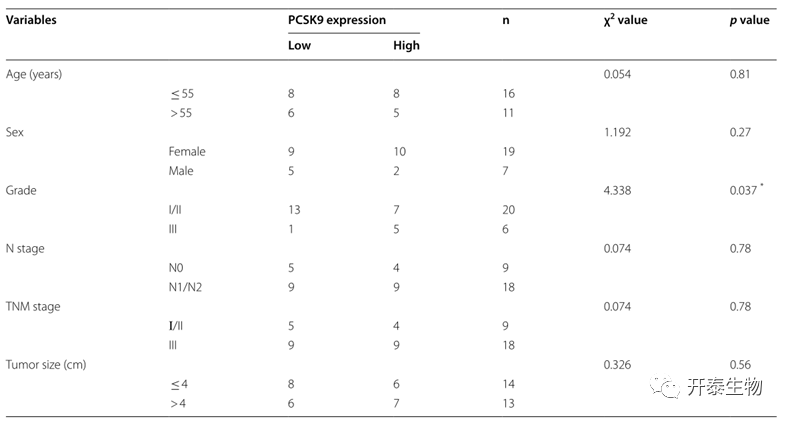
作者首先检测了PCSK9蛋白在结肠癌组织中的表达,发现与相邻的正常组织和远端组织相比,PCSK9蛋白主要在肿瘤细胞的胞质中高水平表达(图1a、b)。接着他们利用TCGA数据(包括41例正常组织和286例结肠癌组织)分析了PCSK9的表达水平,发现PCSK9在肿瘤组织中的表达显著高于正常组织(图1c)。对PCSK9的表达与患者的临床病理数据进行相关性分析发现,PCSK9表达与肿瘤的病理分级有关,而与患者年龄、性别、肿瘤大小、N期和TNM期无相关性(表1),在I级/II级,PCSK9在肿瘤细胞中低表达的结肠癌患者较多。
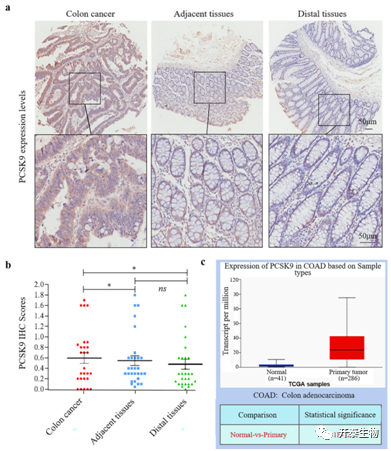
图1结肠癌组织中PCSK9表达上调
表1结肠癌患者PCSK9表达与临床病理参数的关系
02

PCSK9基因表达下调对结肠癌细胞活力、迁移和侵袭能力的影响
接下来,作者将PCSK9 siRNA和阴性对照(NC)siRNA瞬时导入HT-29和HCT116细胞,并用携带PCSK9 shRNA的慢病毒颗粒稳定感染细胞,评估了PCSK9基因敲除对结肠癌细胞表型调控的体外效应。首先,WB证实PCSK9蛋白表达减少(图2a-c)。瞬时转化后第4天,CCK-8和台盼蓝排斥实验显示,PCSK9表达下调降低了HCT116和HT-29细胞的活力(均P<0.05)(图2d,e),并降低了细胞增殖(图2f),伤口愈合实验(图2i,g)和Transwell实验(图2g-k)则显示其降低了结肠癌细胞的迁移和侵袭能力。
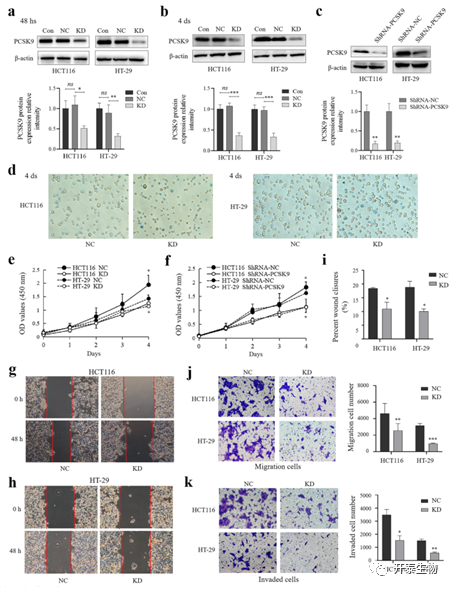
图2 PCSK9表达下调后,结肠癌细胞增殖、迁移和侵袭能力的降低
03

PCSK9过表达对结肠癌细胞增殖、迁移和侵袭的促进作用
为了进一步证实PCSK9在结肠癌细胞中的致癌作用,作者在HCT116和HT-29细胞中瞬时过表达了PCSK9。WB显示,与仅转染载体的细胞相比,PCSK9在这些细胞中的表达上调(图3a,b)。此外,评估了肿瘤细胞增殖、迁移和侵袭的变化,发现PCSK9过表达对体外培养的结肠癌细胞确实有相反的影响(图3c-h)。

图3 PCSK9的过表达对结肠癌细胞增殖、迁移和侵袭的促进作用
04

PCSK9基因调控的结肠癌细胞上皮-间充质转化
EMT是上皮细胞在特定的生理和病理条件下获得间充质干细胞表型的过程,它可介导结直肠癌的进展和转移。因此,作者通过WB证实结肠癌细胞中PCSK9基因敲除和过表达情况后(图4a,b),分析了EMT过程相关蛋白的水平。WB显示结肠癌细胞中PCSK9的敲除显著上调了E-钙粘蛋白蛋白的水平,但降低了N-钙粘蛋白、MMP9和Snail1蛋白的表达(图4c,d)。而PCSK9的过表达恰好与上述结果相反 (图4e,f)。这些数据表明,PCSK9改变了结肠癌细胞的EMT,从而改变了细胞的迁移和侵袭能力。
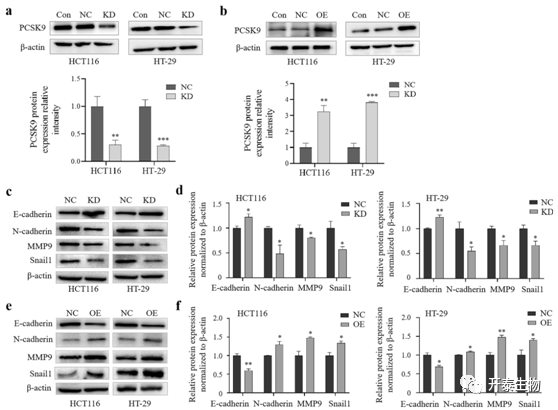
图4 PCSK9对结肠癌细胞EMT相关蛋白表达的影响
NC,阴性对照; KD: PCSK9基因敲除;OE: PCSK9过表达
05

PCSK9通过PI3K/AKT信号对结肠癌进展的调控
磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/AKT)信号通路是人类肿瘤中最常见的激活通路之一,它促进肿瘤细胞的存活、增殖、代谢、侵袭和血管生成。因此,作者评估了该信号蛋白表达的变化。WB显示PCSK9-siRNA或PCSK9过表达情况 (图5a,b),下调PCSK9确实降低了HCT116和HT-29细胞的p-PI3K和p-AKT蛋白的水平,但对总的AKT水平没有显著影响(图5c,d)。而PCSK9的过表达诱导了p-PI3K和p-AKT蛋白的表达,但也没有显著影响HCT116和HT-29细胞的总AKT水平(图5e,f)。
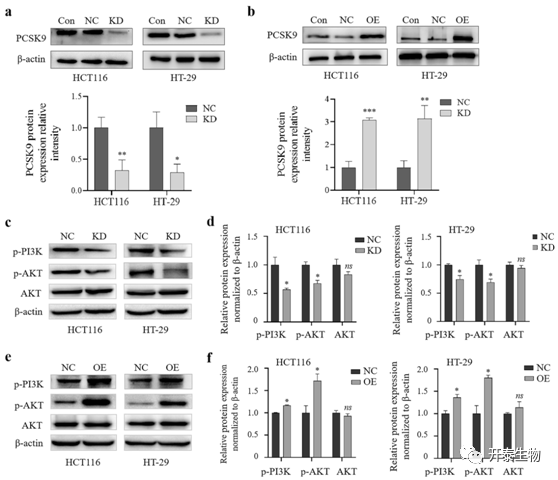
图5 PCSK9激活PI3K/AKT信号通路在体外结肠癌细胞中的作用
06

PCSK9对结肠癌细胞免疫和代谢以及巨噬细胞表型极化调节作用的蛋白质组学研究
为了进一步探索PCSK9在结肠癌进展中的潜在分子机制,作者进行了4D非标记定量蛋白质组学分析(图6a-d),并对差异表达蛋白进行了GO富集分析。结果表明这些差异表达的蛋白主要在细胞和代谢过程或免疫系统过程中富集(图6a),且主要分布在细胞核,其次是细胞质(图6b)。
随后,对PCSK9基因敲除后的HCT116细胞(图6e)进行了分析,发现共有475个蛋白质发生了显著变化,包括212个上调和263个下调蛋白(图6c),火山图显示了与糖代谢和免疫反应相关的差异蛋白(图6d)。此外,巨噬细胞迁移抑制因子(MIF)的下调比率(KD/NC)为0.6344(p=0.00025)。
接着,作者发现PCSK9在结肠癌细胞中被敲除后MIF蛋白的表达显著降低(图6F)。其次,利用抗L-乳酸赖氨酸抗体进行WB,探讨了PCSK9对蛋白质乳酸化水平的调节,并用乳酸检测试剂盒检测了结肠癌细胞培养上清液中乳酸的水平。结果发现,PCSK9敲除后,HCT116和HT-29细胞中乳酸修饰蛋白的水平显著降低(图6G),HCT116细胞培养上清液中乳酸浓度也显著降低(图6H)。因此,可以认为PCSK9促进了结肠癌细胞的乳酸水平和蛋白质乳酸化水平。
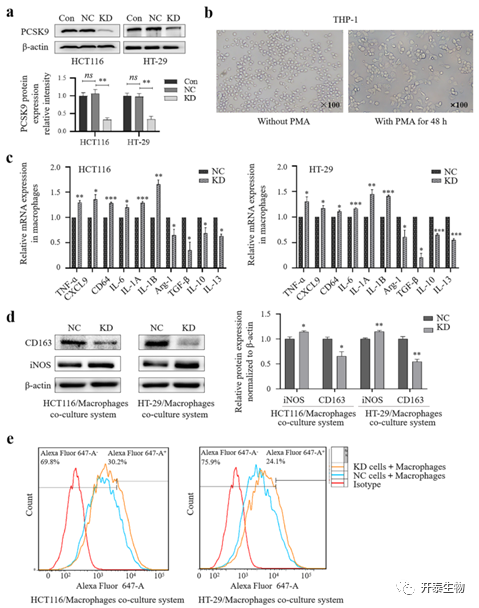
图6 结肠癌细胞差异表达蛋白的蛋白质组学分析
07

PCSK9基因敲除后抑制与结肠癌细胞共培养的M2巨噬细胞极化(但促进M1极化)
肿瘤相关巨噬细胞(TAMs)作为肿瘤微环境的一部分,可分为M1和M2型,M1型抑制肿瘤生长,而M2型促进肿瘤生长,乳酸和MIF诱导TAMS的极化。上述数据已表明,PCSK9调节结肠癌细胞中MIF的表达以及乳酸和蛋白质的乳糖化水平(图6)。因此,作者使用Transwell系统将PCSK9敲除后的HCT116或HT-29细胞(图7a)与THP-1来源的巨噬细胞共培养,并检测了M1/M2标记物的表达。结果发现,PMA可诱导THP-1细胞由悬浮生长转为贴壁生长,细胞停止增殖,由圆形变为纺锤形或不规则形(图7b)。qRT-PCR显示,与NC组相比,SiPCSK9组M1标志物IL-6、IL-1A、IL-1B、CXCL9、CD64和TNF-α的表达上调,而M2标志物IL-10、IL-13、Arg-1和TGF-β的表达下调(图7c)。WB结果显示,与NC细胞相比,siPCSK9组细胞中iNOS蛋白的表达上调,而CD163蛋白的表达降低(图7d)。此外,对CD86+巨噬细胞的流式细胞分析表明,下调HCT116和HT-29细胞中PCSK9的表达可增加CD86+巨噬细胞的数量(图7e),这表明在M1巨噬细胞中PCSK9的敲除增加。

图7:巨噬细胞与结肠癌细胞共培养后巨噬细胞活化的抑制
08

体内PCSK9基因敲除对结肠癌细胞转移的抑制作用
接下来,作者建立了小鼠异种移植瘤模型。首先,对 HCT116和HT-29细胞基因敲除后,通过荧光显微镜检查确定了携带PCSK9 shRNA或NC shRNA的慢病毒成功感染到肿瘤细胞中(图8a),并利用qRT-PCR和WB证实了基因敲除情况(图8b–d)。
6周后,NC组和shPCSK9组移植瘤的大小无明显差异,所有小鼠的肝转移都很少见,实验结束时两组小鼠的肝转移亦无显著差异;然而,NC组的六只小鼠都有肺转移,但转移情况明显比shPCSK9组严重(图8e)。
此外,他们还将PCSK9敲除的HT-29细胞注射到BALB/C裸鼠体内,建立了尾静脉-肺转移模型。5周后,NC和shPCSK9组的所有12只小鼠都出现了粗糙的肺表面及转移结节,但shPCSK9组肺结节数低于NC组(图8f)。HE染色显示,shPCSK9细胞注射小鼠的小面积肺泡壁轻微增厚,肺组织中有少量局灶性轻度出血(图8g),NC细胞组小鼠肺组织结构破坏,肺泡消失。肝转移在所有小鼠中都很少见,NC小鼠肝组织中偶有肝细胞变性,中心静脉周围坏死灶,而shPCSK9组小鼠的肝细胞轻度变性,没有明显的炎细胞浸润和坏死灶 (图8g)。
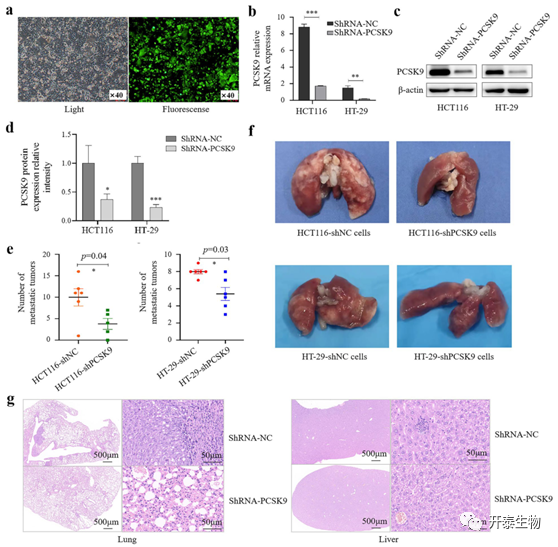
图9:体内PCSK9基因表达下调对结肠癌细胞转移的抑制作用
+ + + + + + + + + + +
结 论
该研究全面评估了PCSK9在结肠癌进展和转移中的作用,发现PCSK9通过调节肿瘤细胞EMT和PI3K/AKT信号转导途径,调节巨噬细胞表型极化,调节MIF和乳酸水平,在结肠癌的进展和转移中发挥重要作用。靶向PCSK9的表达或活性可作为有效控制结肠癌的潜在治疗方法。
+ + + + +



 English
English

