文献解读|Signal Transduct Target Ther(39.3):异常的上皮细胞相互作用促进食管鳞状细胞癌的发生和进展
✦ +
+
论文ID
原名:Aberrant epithelial cell interaction promotes esophageal squamous-cell carcinoma development and progression
译名:异常的上皮细胞相互作用促进食管鳞状细胞癌的发生和进展
期刊:Signal Transduction and Targeted Therapy
影响因子:39.3
发表时间:2023.12.15
DOI号:10.1038/s41392-023-01710-2
背 景
食管癌是世界上最常见的胃肠道恶性肿瘤之一,由两种组织学类型组成,即食管腺癌和鳞状细胞癌(ESCC)。众所周知,食管鳞癌的发展经历慢性炎症(INF)、癌前病变[包括低级别恶性上皮内瘤变(LGIN)和高级别上皮内瘤变(HGIN)]以及侵袭性食管鳞癌。
实验设计
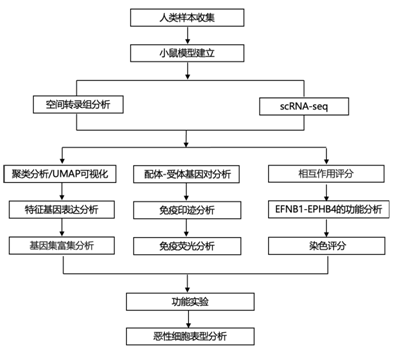
结 果
01
通过 EFNB1-EPHB4 的异常上皮细胞相互作用在小鼠 ESCC 形成中发挥作用
通过 Visium 空间转录组测序,研究者团队分析了在不同时间取自经化学致癌剂 4-NQO处理的小鼠模型的五种不同组织,即正常 (NOR)、INF、LGIN、HGIN 和 ESCC (图1a)。聚类分析将 NOR 中的四个转录组区域在组织学上定义为基底上层(SBL)、基底层(BL)、黏膜肌层(MM)和黏膜下层(SM)和四个患病食管样本(图1b)。他们发现了另一个特殊的具有高水平癌症标志表达的聚类[称为小鼠ESCC(mESCC)的发展区域(EDR)],出现在INF期,在癌前病变中逐渐扩大,最终占ESCC的82.1%(图1b-d)。这四个典型的组织区域基本上表达了与其分布和功能相对应的基因,而EDR则表现出高水平的参与角化细胞增殖、迁移和侵袭的基因(图1e-f)。这些结果表明 mESCC 发育过程中上皮结构的紊乱。
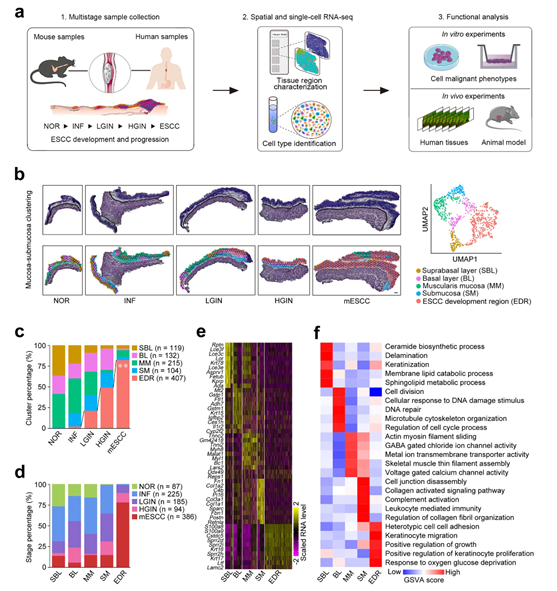
图1. 空间转录组学分析揭示了mESCC的发展和进展中明显的分子区域化。
(a)总体研究实验方案。 (b)对五个阶段样本中的粘膜-粘膜下层进行基于图形的聚类。(c)堆积直方图显示五个阶段样本中五个组织区域的组成。 (d)堆积直方图显示五个组织区域中五个阶段的组成。 (e) 五个组织区域中前 10 个高表达基因的缩放和标准化表达水平的热图。(f)基因集富集分析 (GSVA) 分数的热图。
接下来,他们检测了癌前病变和癌病变微环境中的细胞间相互作用,以分析它们对上皮破坏的影响。他们计算了配体-受体基因对的比率,发现不同的组织区域具有不同且特异性的细胞间信号转导。值得注意的是,EDR在细胞生长、细胞粘附和肿瘤炎症途径中具有高比例的配体-受体基因对(图2a)。他们进一步分析了多阶段小鼠模型的单细胞转录组数据集中协调这些相互作用的细胞类型(图2b),结果显示,随着疾病的进展,基底层上皮细胞中与Notch1相关的配体受体基因对Dlk2-Notch1、Dll1-Notch1和Jag2-Notch1相互作用的概率显著降低;然而,Ephrin/Eph酪氨酸激酶受体家族成员Efnb1-Ephb4的相互作用概率显著增加(图2b)。
空间转录组分析显示,有60个具有显著Efnb1-Ephb4相互作用的点,主要位于BL(20个点)和EDR(21个点)区域(图2c),其中Efnb1 - Ephb4相互作用得分显著高于BL(20个点)和EDR(21个点)区域,其他三个组织区域中也有斑点(图2d)。与这些结果一致, BL和EDR中的Efnb1和Ephb4 RNA水平显著高于其他区域(图2e)。单细胞转录组分析还表明,在正常和所有四个疾病阶段,Efnb1在上皮细胞中高表达,而Ephb4在癌前和癌上皮细胞中显著过表达(图2f-g)。小鼠组织样本的免疫荧光染色显示,EFNB1和EPHB4共定位于基底层上皮细胞膜上,并且随着疾病进展,相互作用信号显著且逐渐增强(图2h-i)。这些结果表明 EFNB1 和 EPHB4 的异常相互作用可能在 4-NQO 诱导的 mESCC 发育中发挥重要作用。
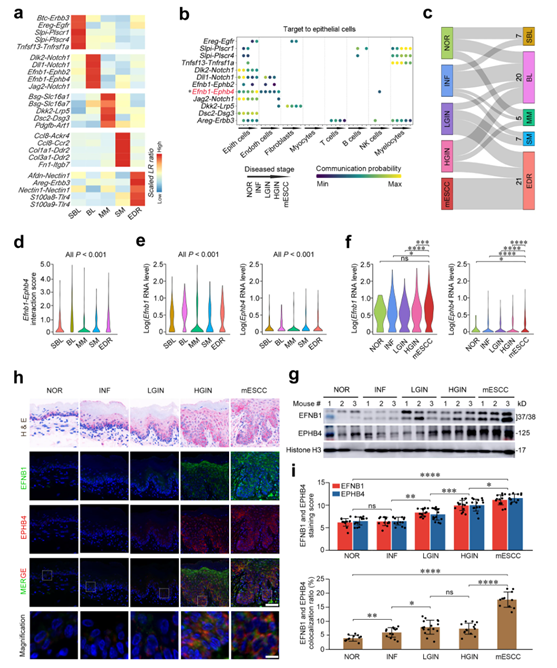
图2. 通过EFNB1-EPHB4的异常上皮细胞相互作用在mESCC的形成中起作用。
(a)5个组织区域富集的组织区域特异性配体受体(LR)基因对比例热图。 (b)气泡图显示了来自5期组织的单细胞转录组数据中8种细胞类型和上皮细胞之间的组织区域特异性LR基因对的相互作用(CRA002118)。 (c)Sankey图显示了在五个阶段样本的五个组织区域中Efnb1-Ephb4显著相互作用的斑点分布。 (d) Efnb1-Ephb4相互作用评分在5个组织区域的小提琴图。(e)五个组织区域中Efnb1(左)和Ephb4(右)对数归一化RNA水平的小提琴图。 (f)五个分期样本(CRA002118)上皮细胞单细胞转录组数据中Efnb1(左)和Ephb4(右)的对数归一化RNA水平小提琴图。 (g) 免疫印迹分析。(h)EFNB1和EPHB4在5个疾病阶段的代表性免疫荧光图像显示,它们在NOR和INF的基底层高度过表达,并随着癌前到癌性进展扩展到整个层。 (i)上:EFNB1和EPHB4染色评分的定量统计。下:共定位比例的定量统计。
02
通过 EFNB1-EPHB4 的异常上皮细胞相互作用促进人类 ESCC 形成
他们采用与小鼠模型相似的实验方法,人工分离4例人ESCC (hESCC)食管粘膜-粘膜下层3752个斑点,其中994个NOR,441个LGIN,888个HGIN,1429个hESCC,进行空间转录组分析。每个斑点平均有4485个基因和13119个独特转录本用于最终分析,分别来自SBL、BL和EDR(图3a)。他们发现EDR的比例随着LGIN、HGIN到hESCC的疾病进展而增加(图3b),这表明在mESCC模型中,hESCC的发育过程中也出现了类似的上皮组织紊乱。尽管SBL和BL分别在上皮角化、细胞坏死和紧密连接及氧化代谢、桥粒形成和转录因子活性方面具有高表达,但EDR在人食管组织中广泛高表达与细胞基质粘附、细胞对TGF-β和EMT反应相关的基因(图3c)。此外,他们发现EFNB1-EPHB4互作显著高的位点有184个,主要集中在BL(80个)和EDR(84个),它们的相互作用得分显著高于其他区域的位点(图3d-e)。值得注意的是,NOR、LGIN和HGIN的基底层EFNB1-EPHB4相互作用评分高于SBL,而在hESCC区域,相互作用信号更为广泛和弥漫(图3e)。与评分水平一致,BL和EDR的EFNB1和EPHB4 RNA水平明显高于SBL(图3f)。单细胞转录组分析显示,随着hESCC的进展,上皮细胞之间的EFNB1-EPHB4相互作用逐渐增强(图3g),上皮细胞中EFNB1和EPHB4的表达均上调(图3h)。免疫荧光染色也证实了EFNB1-EPHB4相互作用的时空变化,表明在NOR样本的BL中相互作用得分较高,在LGIN、HGIN和hESCC中相互作用得分增加并扩散(图3i-k)。
这些结果表明,人类食管癌的发展与mESCC的致瘤模型具有相似的分子机制,EFNB1-EPHB4的异常相互作用可能在上皮组织的致瘤紊乱中起重要作用。
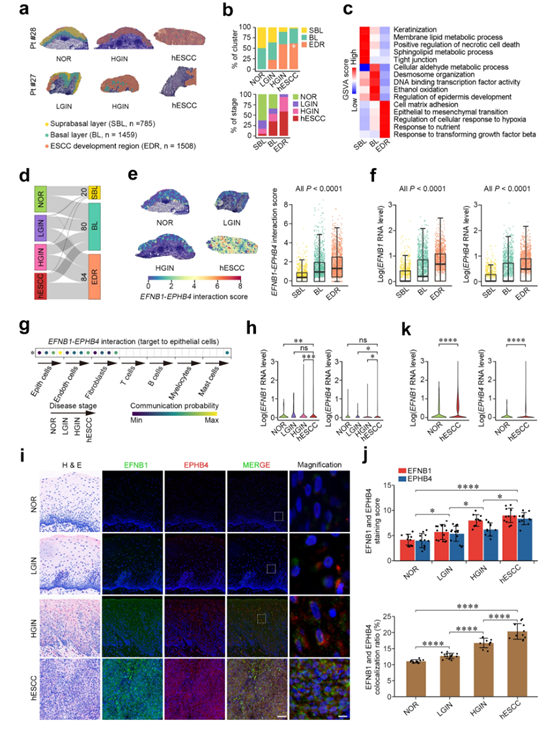
图3. 异常上皮细胞通过EFNB1-EPHB4相互作用促进hESCC的形成。
(a)空间图显示ESCC患者四个阶段样本中三个组织区域的分布。 (b) 堆叠直方图显示了跨越四个疾病阶段的三个组织区域(上)和跨越三个组织区域的四个阶段(下)的组成。(c)三个组织区域中选定的基因本体路径的标度和归一化基因集富集分析(GSVA)分数热图。 (d)Sankey图显示EFNB1-EPHB4在四个病理阶段的三个组织区域中显著相互作用的斑点分布。 (e)EFNB1-EPHB4在四个阶段三个组织区域的相互作用评分。 (f)三个组织区域中对数归一化EFNB1和EPHB4 RNA水平的箱线图。 (g)在多阶段单细胞转录组数据(HRA000776)中,7种细胞类型EFNB1-EPHB4与上皮细胞相互作用的泡状图。 (h)通过scRNA-seq (HRA000776),小提琴图显示了不同阶段样本上皮细胞中EFNB1和EPHB4 RNA的对数归一化水平。 (i)四个病理阶段EFNB1和EPHB4的代表性免疫荧光图像显示,它们在NOR的基底层高度表达,并随着ESCC的发展扩展到全层。(j) 上:EFNB1和EPHB4染色评分的定量统计。下:共定位比例的定量统计。(k)通过scRNA-seq,小提琴图显示hESCC上皮细胞和正常组织中EFNB1和EPHB4 RNA水平的对数归一化。
03
异常的 EFNB1-EPHB4 相互作用触发上皮间质转化和增殖
接下来,他们使用原代 mESCC 细胞和 hESCC 细胞(KYSE30)进行了相互免疫共沉淀测定,以检测EFNB1 和 EPHB4 之间的物理相互作用,结果清楚地证明了这两种蛋白质的相互作用(图 4a),进一步的体外免疫荧光测定表明相互作用位于细胞膜上(图4b)。
他们发现791和2633基因的mRNA水平分别与EFNB1和EPHB4 RNA水平显著相关,它们主要富集在上皮细胞增殖、迁移、细胞周期调节、细胞连接组装和上皮-间质转化(EMT)相关的通路中(图4c)。因此,他们在mESCC细胞、人永生化正常食管上皮细胞(HET-1A)和hESCC细胞(KYSE30和KYSE150)中进行了基因操作,以检测EFNB1和EPHB4对细胞恶性表型的影响,发现在癌细胞中下调EFNB1或EPHB4均可显著抑制细胞增殖,而异位过表达EFNB1或EPHB4在正常细胞和癌细胞中均具有相反的作用(图4d-e)。
敲低EFNB1或EPHB4也能显著抑制癌细胞的迁移和侵袭,但其过表达在正常细胞和肿瘤细胞中均有相反的作用(图4f)。稳定敲低或过表达EFNB1和EPHB4也显著改变KYSE30细胞在小鼠体内移植的生长速度(图4g)。EFNB1或EPHB4高表达的食管鳞癌患者的生存时间明显短于低表达者,但差异无统计学意义(图4h)。EFNB1和EPBH4均高评分的患者预后显著差于EFNB1和EPBH4均低评分的患者,校正性别、年龄和肿瘤分期后的死亡风险比为2.09(图4h)。体内外实验结果表明,EFNB1和EPHB4可能通过促进食管鳞癌的恶性EMT和增殖在食管鳞癌的发生发展中发挥重要作用。
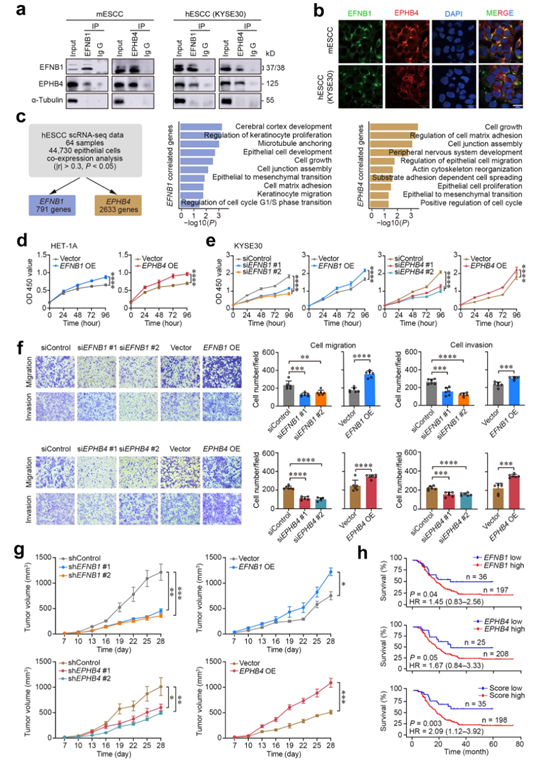
图4. 异常的EFNB1-EPHB4相互作用增强了小鼠和人ESCC细胞的恶性表型。
(a) 免疫印迹分析。(b) 免疫荧光染色。(c)通过scRNA-seq分析其表达水平与上皮细胞中EFNB1和EPHB4表达水平相关的基因(GSE160269数据)。 (d) EFNB1或EPHB4过表达对人食管上皮细胞HET-1A增殖的影响。(e) EFNB1或EPHB4表达改变对hESCC (KYSE30)细胞增殖的影响。(f) EFNB1和EPHB4强制表达改变对hESCC (KYSE30)细胞迁移和侵袭的影响。(g)诱导hESCC细胞(KYSE30) EFNB1和EPHB4表达变化对NSG小鼠异种移植物生长的影响 (h) 生存分析。
04
异常的 EFNB1-EPHB4 相互作用会触发上皮间质转化和细胞增殖。
他们观察了参与细胞周期调控和EMT过程的基因的表达水平, EFNB1或EPHB4过表达显著增加了细胞周期调控中的12个基因(如CCND1、CCND3、CDC40和CDK2)和EMT通路中的10个基因(如DST、ITGAV、SNAl1、SNAI2和VIM)的水平(图5a-b)。EFNB1或EPHB4过表达显著增加SRC、ERK和AKT的磷酸化水平(图5c)。更重要的是,他们发现细胞周期蛋白Cyclin D1、Cyclin D3和CDK2以及EMT蛋白cludin -1、Slug和β-Catenin的水平随着SRC/ERK/AKT的磷酸化而持续改变(图5d)。
随后,他们使用重组人EFNB1(rhEFNB1)和EPHB4受体抑制剂BHG712在KYSE30中进行挽救实验,发现rhEFNB1显著促进细胞增殖,而BHG712显著抑制细胞增殖。此外,rhEFNB1处理显著增加了SRC、ERK和AKT的磷酸化水平,而BHG712处理显著降低了这些癌蛋白磷酸化(图5e),表明EFNB1-EPHB4相互作用通过激活SRC/ERK/AKT信号传导触发EMT并加速细胞周期。
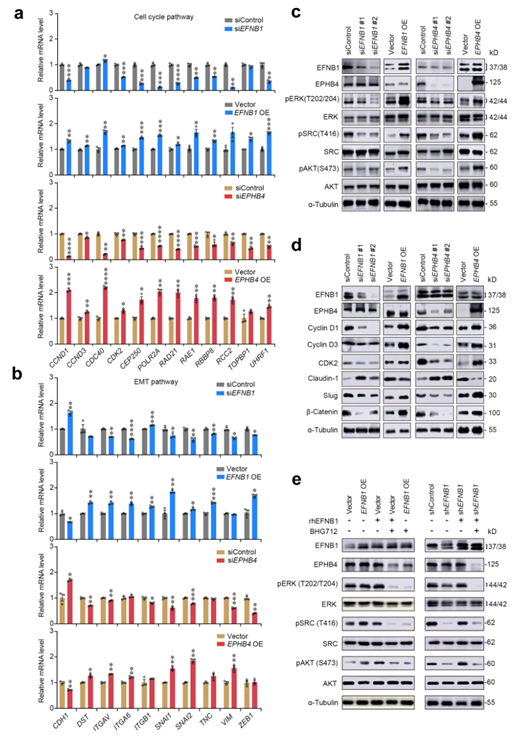
图5. 异常的EFNB1-EPHB4相互作用触发上皮向间质转化和细胞增殖。
(a-b)定性PCR验证EFNB1(上)和EPHB4(下)敲低或过表达(OE)对hESCC细胞周期通路和上皮-间质转化(EMT)通路相关基因表达改变的影响(KYSE30)。 (c-e)免疫印迹分析。
05
ESCC 进展过程中 ΔNP63 过度表达导致 EFNB1-EPHB4 相互作用异常
接下来他们探究 ESCC 进展期间上皮细胞 EFNB1-EPHB4 相互作用强烈增强的分子机制。在使用四个数据库的计算机分析中,他们鉴定了 46 个可能调节EFNB1和EPHB4表达的转录因子(图6a)。然而,相关性分析显示,其中只有TP63、ZNF263和CREB1在表达水平方面与EFNB1和EPHB4显著相关。体外基因操作测定表明,在mESCC和hESCC细胞(KYSE30)中,只有TP63而非ZNF263和CREB1敲除显著抑制EFNB1和EPHB4 mRNA和蛋白表达(图6b)。
然后,他们观察了EFNB1和EPHB4启动子序列,发现两者都含有一个TP63结合基序,TP63在人类食道中的主要亚型为∆NP63。他们进行了荧光素酶报告基因检测,结果表明,野生型EFNB1或EPHB4启动子的报告基因活性显著高于缺乏∆NP63结合基序的突变型EFNB1或EPHB4启动子的报告基因活性(图6c)。此外,细胞中TP63的敲低再次显著抑制了报告基因的活性(图6c)。他们还使用抗∆NP63抗体在KYSE30细胞中进行染色质免疫沉淀偶联qPCR检测,结果显示EFNB1和EPHB4大量富集(图6d),反映了∆NP63在这些细胞中结合了EFNB1和EPHB4启动子。
他们进一步研究TP63的时空变化及其对食管发育的影响。时空分析表明,在人和小鼠食管组织样本中,BL和EDR的TP63表达水平明显高于其他组织区域(图6e)。单细胞转录组学分析还显示,TP63在人癌前和癌性食管上皮细胞中的表达水平显著高于正常上皮细胞(图6f)。他们还对小鼠和人组织样本进行了免疫荧光检测,结果显示,与正常上皮相比,癌前上皮和癌性上皮中TP63蛋白以及EFNB1和EPHB4蛋白的染色评分明显更高,并且高染色的细胞主要位于基底层,但随着疾病的进展扩展到整个上皮层(图6g-h)。他们进一步敲除KYSE30细胞中的TP63,发现细胞周期和EMT通路的基因mRNA水平显著降低(图6i),这与EFNB1或EPHB4敲低的影响相似,提示TP63、EFNB1和EPHB4处于同一功能轴,TP63位于上游。
他们分析了之前报道的食管鳞癌患者的多个疾病阶段的组织样本中TP63启动子甲基化和拷贝数变异状态,发现尽管TP63启动子甲基化水平没有显著变化,但随着疾病的进展,TP63的拷贝数逐渐显著升高(图6j)。总之,这些结果表明,由于TP53功能丧失而导致TP63的扩增和过度表达,导致上皮细胞之间 EFNB1-EPHB4 相互作用增加,从而通过加速细胞周期和 EMT 促进 ESCC 进展。
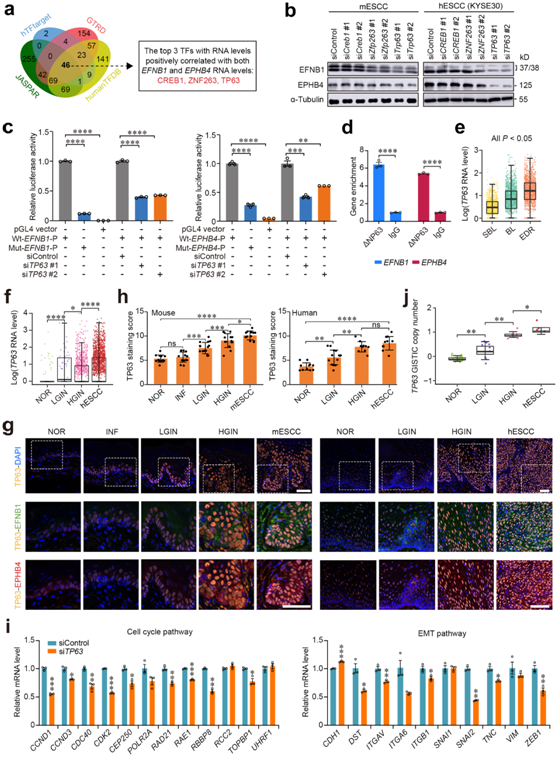
图6. ESCC 进展过程中 TP63/ΔNP63 的过度表达会导致 EFNB1-EPHB4 相互作用异常。
(a) 维恩图显示了scRNA-seq 数据 (GSE160269) 中与上皮细胞中EFNB1和EPHB4 RNA 水平呈正相关的潜在转录因子(TF) 。(b) 敲低三种感兴趣的 TF 对 mESCC 和 hESCC 细胞 (KYSE30) 中EFNB1和EPHB4蛋白水平的影响。(c) hESCC 细胞(KYSE30)中的报告基因检测结果。 (d) 染色质免疫沉淀和 qPCR 显示用 ΔNP63 抗体处理的细胞裂解液中EFNB1和EPHB4富集。(e) 通过空间转录组测序分析hESCC样本不同组织区域上皮细胞中TP63 RNA水平的差异。 (f) 通过scRNA-seq分析不同疾病阶段上皮细胞中TP63 RNA水平的差异。(g) 小鼠(左图)和人(右图)食管组织多阶段组织中 TP63、EFNB1 和 EPHB4 的代表性免疫荧光图像。(h)染色评分。 (i) TP63敲低 hESCC 细胞 (KYSE30)中细胞周期途径(左图)和上皮间质转化 (EMT) 途径(右图)中基因表达的验证。通过 qPCR 测定 mRNA 水平。(j) TP63的 GISTIC 拷贝数。
+ + + + + + + + + + +
结 论
本项研究对小鼠和人类的多期食管鳞状细胞癌(ESCC)样本进行了空间转录组和功能分析。通过研究时空基因表达模式和细胞间相互作用,发现通过 EFNB1-EPHB4 的异常上皮细胞相互作用触发下游 SRC/ERK/AKT 信号传导介导的 EMT 和细胞周期。异常的上皮细胞相互作用发生在早期癌前病变的基底层内,这种相互作用扩展到整个上皮层,并随着癌症的发生和进展而加强。功能分析显示,异常的 EFNB1-EPHB4 相互作用是由 TP53 突变导致的 ΔNP63 过度表达引起的,TP53 突变是人类 ESCC 肿瘤发生的主要因素。本项研究为 TP53-TP63/ΔNP63-EFNB1-EPHB4 轴在 EMT 和上皮癌形成中细胞增殖中的作用提供了新的理论依据。
+ + + + +



 English
English


