文献解读|Cell Rep Med(14.3):针对胰腺癌新辅助化疗诱导的代谢重编程可促进抗肿瘤免疫和化疗反应
✦ +
+
论文ID
原名:Targeting neoadjuvant chemotherapy-induced metabolic reprogramming in pancreatic cancer promotes anti-tumor immunity and chemo-response
译名:针对胰腺癌新辅助化疗诱导的代谢重编程可促进抗肿瘤免疫和化疗反应
期刊:Cell Reports Medicine
影响因子:14.3
发表时间:2023.10.17
DOI号:10.1016/j.xcrm.2023.101234
背 景
近 80% 的胰腺导管腺癌 (PDAC) 患者错过了前期切除 (UR) 的机会,必须接受化疗。到目前为止,化疗下PDAC的分子动力学仍不完全清楚。
实验设计
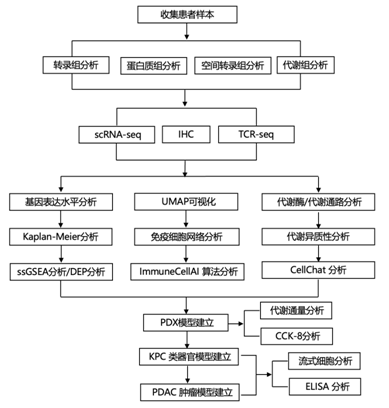
结 果
01
新辅助化疗(NAC)引发 PDAC 样本转录组和蛋白质组的广泛改变,以实现生存获益
为了研究 PDAC 对 NAC 的分子反应,他们分析了接受或不接受 NAC 治疗的患者切除的人类肿瘤组织中的转录组和蛋白质组。经 NAC 处理的 PDAC 样本和前期切除 (UR) 样本在转录组水平上存在 4473 个差异表达基因 (DEG)(图 1 A)。其中,有 3603 个基因上调,870 个基因下调。因此,他们想知道 NAC 是否通过影响基因表达来带来生存益处
为了探索这一假设,他们使用三个大型 PDAC 队列评估了已识别的 DEG 对患者 OS 的影响(图 1 A-B)。在癌症基因组图谱队列中, 在NAC后下调的基因里,有69 个基因与患者生存率(OS) 显著相关,其中有68个基因与较差的 OS 相关。相比之下,在 NAC 后上调的基因中,有 120 个基因与患者 OS 显著相关,其中 109 个基因与延长 OS 相关。
在 GSE71729 队列中,92.7% 与预后相关的下调基因与较差的 OS 相关,而 57.0% 与预后相关的上调基因与更好的 OS 相关。在 E-MTAB-6134 队列中也观察到类似的趋势,其中 84.2% 与预后相关的下调基因与较差的 OS 相关,65.8% 与预后相关的上调基因与更好的 OS 相关。使用单样本基因集富集分析 (ssGSEA) 算法,他们鉴定了 NAC 组中的富集的基因集(NeoHsig 和 NeoLsig),并检测了它们与患者 OS 的关系。NeoHsig 与延长 OS 相关,而 NeoLsig 预测三个独立 PDAC 队列的生存期较差(图 1 B)。
此外,使用基于CRISPR的筛选方法来分析胰腺癌细胞系中上调和下调基因的影响。结果表明,NAC 后大多数下调的基因可能有助于胰腺癌细胞的增殖表型,反之亦然(图 1 C)。以往的研究根据PDAC不同的分子特征将其划分为多种分子亚型,包括Moffitt亚型、Collisson亚型、微环境亚型和代谢亚型。为了探讨NAC是否促进PDAC中分子亚型的转变,他们使用卡方检验分析了有和无NAC治疗的PDAC样本之间每种亚型的百分比,并发现两组之间的 Moffitt 亚型百分比相似,而在 NAC 后的样本中观察到的免疫冷型和纤维化亚型较少,而代谢静止亚型较多,这表明 NAC 期间 PDAC 内发生了严格的免疫和代谢重编程(图 1 D)。在本研究中,通过蛋白质组分析共鉴定出478个差异表达蛋白(dep)。其中,大约29.7%的DEP属于免疫或代谢蛋白类别。这表明 NAC 治疗后 PDAC 微环境中发生了显著的免疫和代谢重塑(图 1E-F)。
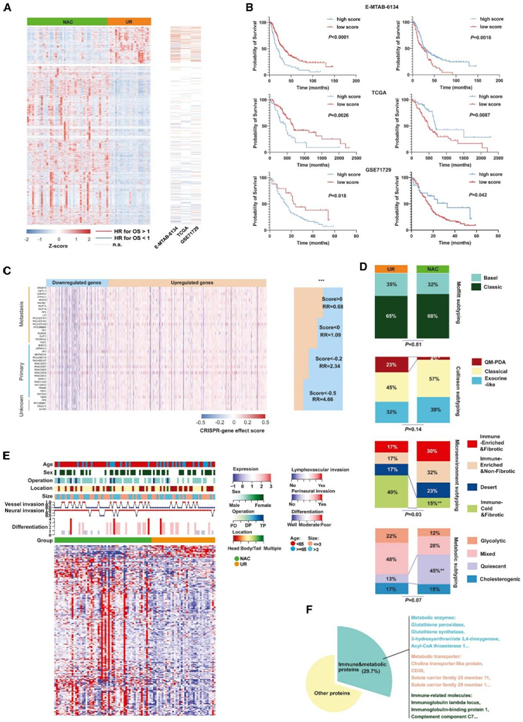
图1. NAC在PDAC中重建了生存受益的转录组和蛋白质组景观。
(A) 热图显示更多与良好预后相关的 DEG 在 NAC 样本中过表达。(B) Kaplan-Meier 曲线分析。(C) NAC 样本中下调的基因主要与胰腺细胞系的增殖表型相关。(D) NAC 组中代谢静止的百分比较高,免疫冷和纤维化 PDAC 亚型的比例较低。(E)热图显示 NAC 和 UR 组之间的 DEP 和临床参数分布。(F) 很大一部分 DEP 与免疫或代谢相关。
02
NAC 在 PDAC 中形成免疫原性抗肿瘤微环境
他们对新鲜 PDAC 样本进行单细胞转录组分析 (sc-RNA-seq),以描绘微环境中与化疗相关的分子变化。总共分析了 46993 个细胞,包括来自 NAC 样品的 37626 个细胞和来自 UR 肿瘤组织的 9367 个细胞。根据细胞独特的分子标记,将这些细胞进一步分为八个亚组(图2A-C)。然后,他们对 T 细胞亚群进行了细化,发现接受 NAC 的 PDAC 中 CD8 + T 细胞(肿瘤微环境中重要的抗肿瘤成分)的百分比显著增加(图 2D-E)。此外,他们进行了T细胞受体(TCR)测序(TCR-seq)分析,揭示了含有NAC的PDAC样本中TCR的克隆型不断扩大,这表明化疗后瘤内免疫成分消除肿瘤细胞的反应性增强(图2F-G)。为了评估免疫浸润的整体变化,他们使用计算了 PDAC 微环境中免疫细胞的相对丰度。正如预期的那样,他们发现与 UR 组相比,NAC 组的浸润 CD8 + T 细胞水平有所增加(图 2H-I)。空间转录组、另外三种基于转录组的算法(QUANTISEQ、TIMER 和 XCELL)以及免疫组织化学 (IHC) 结果也支持NAC 后肿瘤中CD8 + T 细胞的富集(图 2 J-K)。此外,他们发现在预处理的 PDAC 中,肿瘤微环境中颗粒酶 B + CD8 + T 细胞的浸润水平升高(图 2 L)。
使用ImmuCellAI算法(一种用于预测免疫治疗反应的方法),他们发现只有NAC组有潜在的免疫治疗反应(NAC组反应率为12.8%,UR组为0.0%),这表明NAC可能是提高后续免疫治疗疗效的有效方法(图2M)。
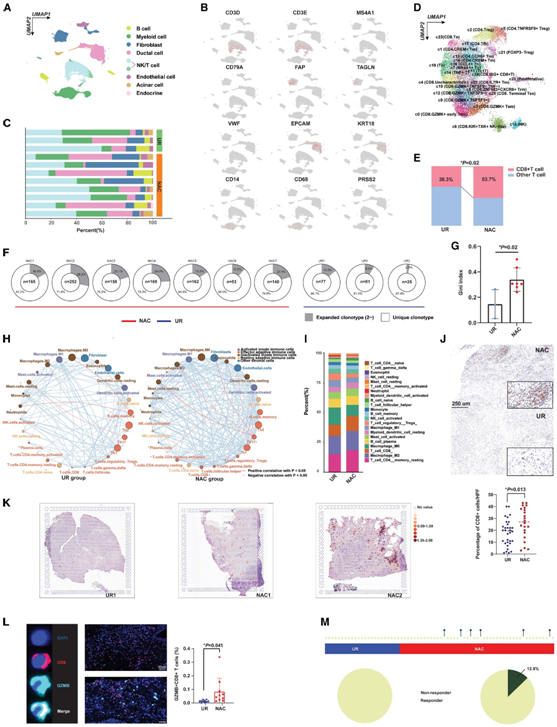
图2. NAC重塑了PDAC中的免疫微环境。
(A) UMAP 可视化。(B) 标记基因在不同细胞聚类之间的分布。(C)PDAC 样品中不同细胞聚类的百分比。(D) UMAP 图揭示了 NK 和 T 细胞的亚群。(E)通过卡方检验显示,经过 AG 处理的 PDAC 中富集了更多的 CD8 + T 细胞。(F)PDAC 显示出更高的 TCR 克隆型扩增。(G) NAC 的 PDAC 中 TCR 克隆型的基尼指数增加。(H) NAC 或 UR 组中免疫细胞的相关网络。(I)UR组和NAC组免疫细胞构成比较。(J) IHC 分析。(K) 空间转录组显示,含有 NAC 的 PDAC 样品的组织切片中富集了更多的 CD8 + T 细胞。(L) NAC处理的pdac中GZMB+ CD8+ T细胞的增加。(M)使用ImmuneCellAI算法进行分析,预测更多接受NAC的患者对免疫治疗有反应。
03
化疗引起的 PDAC 代谢异质性与免疫微环境重塑有关
他们进一步分析注释了 PDAC 细胞的 11 个亚群,其中 FXYD3 + TFF1 –亚型在 NAC 样本中显著减少(图 3 A)。癌细胞中的代谢重编程是癌症的标志,并在免疫逃避中发挥着重要作用。通过代谢酶表达的单细胞水平分析,他们发现化疗后存活的恶性细胞中脂质和谷氨酰胺代谢显著上调。相比之下,作为肿瘤细胞产生能量的核心代谢通路,经NAC处理的PDAC中糖酵解明显较低(图3B)。果糖代谢与糖酵解通量共享许多代谢物和酶,在 NAC 样品中也显示出下降(图 3 B)。然后,他们通过分析代谢酶沿糖酵解通路的差异表达,显示了糖酵解酶的广泛下调(图 3 C)。此外,通过基于基因列表的注释,他们发现NAC样本中糖酵解恶性细胞的百分比显著下降(图3D),而胆固醇合成、脂肪酸代谢、唾液酸代谢和色氨酸代谢等代谢通路显著上调。
此外,他们使用基于代谢通路活性的无监督聚类算法将 PDAC 细胞分为四种亚型,称为 C1-C4(图 3 E)。以高胆固醇生物合成为特征的 C4 在 NAC后 的 PDAC 中显著富集,而另一种亚型 C1 在没有化疗过的样本中富集(图 3 F-G)。在无 NAC治疗的 PDAC 中,C1 是主要的导管细胞亚型;相反,C4 导管细胞的分布在NAC后的 PDAC 中更加富集(图 3 H)。这些结果表明,与未经化疗过细胞相比,化疗后的PDAC细胞经历了严格的代谢重编程,这可能影响肿瘤微环境中的其他细胞。
他们在整体水平上探讨了上调/下调的代谢基因与细胞毒性特征/CD8 + T细胞浸润之间的相关性。值得注意的是,NAC 组中所有上调的基因均与 CD8+ T 细胞浸润和/或细胞毒性特征呈正相关,而 NAC 样本中几乎所有下调的基因均表现出相反的趋势(图3I)。然后,他们比较了 NAC 和 UR 样品之间细胞间相互作用的差异。有趣的是,NAC 后 PDAC 样本中导管细胞与T 细胞相互作用的数量和强度均显著增加(图 3 J)。其中,HLA-CD8、SPP1-CD44和SPP1-(ITGA4+ITGB1)等相互作用在化疗后的微环境中更常见,而LAMB1-CD44等相互作用在NAC组中减少(图 3 K)。
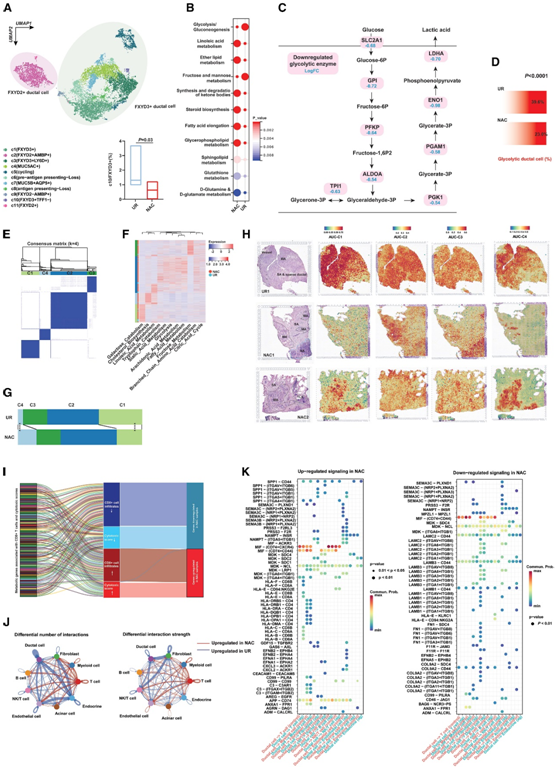
图3. 单细胞和空间转录组分析表明,代谢酶的改变可能有助于治疗相关背景中的免疫浸润。
(A) UMAP 分析显示经过或未经 NAC 处理的 PDAC 中导管细胞的亚聚类。(B) 单细胞代谢分析显示 NAC 和 UR 组之间代谢通路的激活存在差异。(C) 单细胞水平的转录组分析揭示了胰腺导管细胞中糖酵解酶的差异表达。(D) 经过 NAC 处理的 PDAC 中糖酵解导管细胞的百分比较低。(E) 共识聚类根据代谢通路的单细胞水平活性区分了四种类型的导管细胞。(F) 热图显示不同导管亚型和治疗组中代谢通路活性的分布。(G) C4 导管细胞在 NAC 组中更加富集,而 C1 导管细胞在 UR 组中更加富集。(H) 空间转录组可视化了有/无 NAC 处理的 PDAC 中亚型相关特征的分布。(I)在处理的pdac中,大多数基因下调与高水平的细胞毒性特征和CD8+ T细胞浸润呈负相关。(J) CellChat 算法显示具有或不具有 NAC 的 PDAC 具有不同的通讯模式。(K) CellChat算法分析。
04
接受化疗的 PDAC 可能通过促进油酸的积累而产生化疗耐药性
NAC后的代谢酶的表达无论是在蛋白质水平还是转录水平都经历了显著的改变。糖酵解通路上的所有核心酶在蛋白质和/或转录水平上均下调,例如 HK、ALDO、PGK1、LDHA 和乳酸转运蛋白 SLC16A1(图 4 A)。相比之下,其他代谢通路中的许多酶,包括脂质代谢、谷氨酰胺利用和氧化磷酸化,在 NAC 后普遍上调,可能是为了能量补偿(图 4 A)。为了更好地监测 NAC 前后的糖酵解活性,他们生成了异种移植瘤(PDX) 模型,并对异种移植体积相当的 PDX 小鼠进行化疗或安慰剂处理(图 4B-C)。用统一标记的C13 -葡萄糖进行葡萄糖代谢通量分析,结果显示, C13 -葡萄糖衍生的三羧酸循环代谢物(如m+2柠檬酸盐)显著增加,而C13标记的糖酵解代谢物(如m+3乳酸)显著减少(图4D)。
为了系统地研究化疗暴露期间 PDAC 代谢通量的扰动,他们估计了 NAC 和 UR 样本中的代谢通量,并揭示了乙酰辅酶 A (CoA) 和琥珀酰辅酶 A(脂肪酸 β- 的产物)的通量。经化疗处理的样品中氧化显著增加,可以进入 TCA 循环或生成酮体以保存能量。与此同时,含有 NAC 的 PDAC 上调了胆固醇的使用,而未经治疗的肿瘤则具有更活跃的核酸通量(图 4 E)。此外,他们进行了非靶向代谢组分析来筛选 NAC 特异性代谢物。NAC 和 UR 组之间总共检测到 270 种差异代谢物 (DM)。他们进一步对含有 NAC 和 UR 的样品进行了能量代谢靶向代谢组分析。结果证实,经 NAC 处理的样品中,糖酵解产物乳酸和 3-磷酸甘油酸减少,而 α-酮戊二酸增加(图 4 F)。
CCK-8检测表明,油酸处理显著增强了胰腺细胞的生长。据报道,棕榈酸也可以通过 CD36 进入肿瘤细胞,但它并没有显示出对胰腺癌细胞生长的影响。此外,他们使用 3D 细胞活力测定的研究表明,与正常对照相比,病人来源器官(PDO)在补充油酸的培养基中表现出加速生长。通过使用抗 CD36 中和抗体阻断油酸吸收,可以进一步挽救这些效应(图 4G-I)。通过EdU实验,他们进一步发现,与对照组相比,经过油酸处理的panc-1细胞显示出更高的增殖率,这可以通过阻断油酸吸收来减轻(图4 J),表明增加油酸的使用酸可能使 PDAC 细胞对 AG 产生抗性。
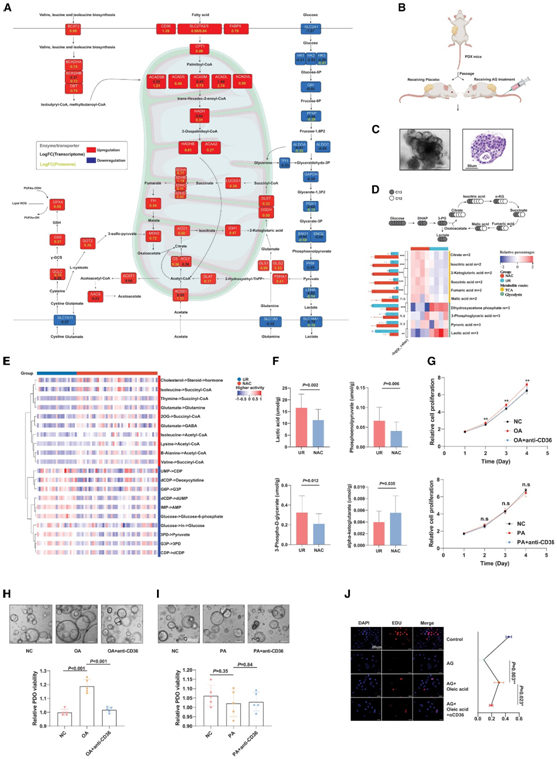
图4. 多组学分析证明 NAC 减少糖酵解。
(A) 转录组和蛋白质组分析揭示了与 AG 治疗相关的代谢酶的变化。(B)构建 PDX模型。(C) 在显微镜明场中的代表性图。(D) 代谢流实验显示出较低的糖酵解活性。(E) 基于 RNA-seq 数据(scFEA 算法)比较 AG 组和对照组之间的代谢通量。(F) 靶向代谢组学分析显示,含有和不含 NAC 后的 PDAC 样品之间的乳酸、3-PD、磷酸烯醇丙酮酸和 α-酮戊二酸存在差异,这意味着 NAC 与 PDAC 中糖酵解活性下调相关。(G) CCK-8实验分析。(H-I) 根据活力测定,发现油酸与棕榈酸相反,可以增强 PDO 的生长。(J) EdU 分析显示油酸可能会加剧对 AG 的耐药性,但可以通过靶向 CD36 来阻断。
05
NAC 触发 PDAC 微环境和循环中 CD36 的系统性上调
值得注意的是,如蛋白质组学分析和 IHC 验证所示,CD36[氧化脂质和游离脂肪酸(如油酸)的转运蛋白]在 NAC 后也在 PDAC 中显著过度表达(图5A)。为了保证NAC后油酸-CD36轴的上调,他们比较了经白蛋白结合紫杉醇和吉西他滨 (AG) 处理和未经AG处理的PDX油酸摄取能力。通过对13C标记油酸的示踪,发现13C标记油酸的丰度显著增加,证实了化疗后PDAC细胞对油酸的吸收能力增强(图5B)。
通过对切除的 PDAC 组织的分析,他们发现 CD36 在肿瘤浸润的 CD8+ T 细胞上也过表达,并广泛分布在三级淋巴组织(TLS)中(图 5C-D)。
然而,CD36 还显示出与免疫细胞的许多特征高度相关,尤其是 CD8+ T 细胞,仅在 NAC 组中存在,这意味着在化疗后,CD36 可以在免疫细胞中诱导(图5 E)。除了肿瘤浸润免疫细胞之外,他们还检测了患有和不患有 NAC 的患者循环免疫细胞上的 CD36 表达。总体而言,CD36表达增加,其中CD45+CD8+ T细胞的趋势最显著(图5F)。为了进一步探讨油酸-CD36 轴上调对 CD8+ T 细胞功能的影响,他们检测了预期治疗中 IFN-γ 的分泌。流式细胞结果显示,油酸积累可能会抑制CD8+ T细胞的分泌能力,并且可以通过阻断CD36来挽救这种效应(图5G)。
虽然使用 NAC 的 PDAC 微环境中 CD8+ T 细胞更加富集,但 CD36+ CD8+ T 细胞的百分比也增加,这可能减轻术前化疗的免疫原性效应。总体而言,在使用 NAC 样品组织裂解物处理的组中,CD8+ T 细胞的细胞毒性和 IFN-γ 释放均有所增加;值得注意的是,这种增加在 CD36-low 的NAC 样本的情况下更为明显(图 5 H-I)。他们观察到CD36阻断和AG治疗对PBMC介导的肿瘤杀伤有协同作用,这表明在PDAC患者的NAC或辅助治疗中,CD36阻断联合AG药物具有潜在的临床价值(图5J-K)。
此外,他们构建了表达卵清蛋白的KPC类器官,以实现由OT-1细胞介导的抗原特异性免疫应答(图5L)。基于此实验设计,他们观察到与病人来源的类器官类外周血单个核细胞(PBO-PBMC)共培养体系相似的结果,这些发现进一步证实了CD36靶向结合AG治疗的协同作用(图5M)。
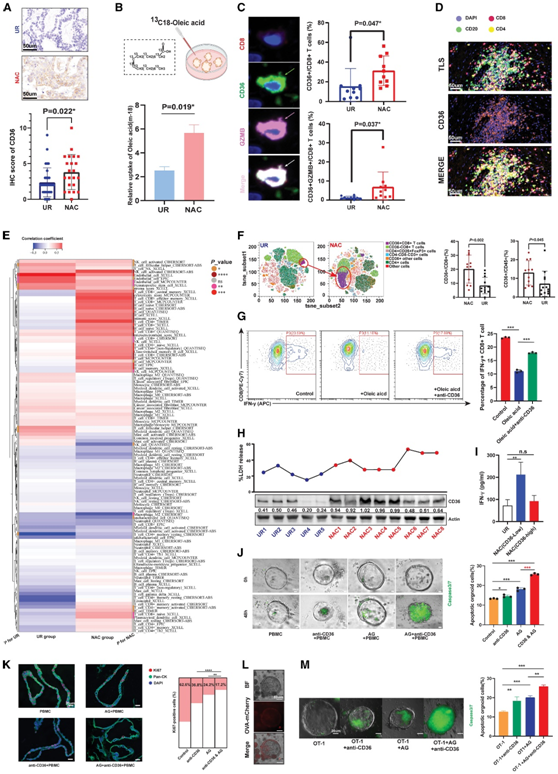
图5. CD36在肿瘤细胞以及常驻和循环免疫细胞中系统性上调。
(A) 免疫组织化学染色分析。(B) 代谢通量分析。(C)在用 NAC 处理的 PDAC 中, CD36 + CD8 + T 细胞和 CD36+ GZMB+ CD8+ T 细胞的百分比显著上调。(D) 免疫荧光代表性图显示 CD36 和 TLS 在 PDAC 中的共定位。(E) 热图显示 CD36 表达与免疫细胞浸润之间的相关性。(F) t 分布随机邻域嵌入 (t-SNE) 分析。(G)流式细胞分析。(H) LDH 释放实验表明,用不同 PDAC 样品的裂解物处理的 T 细胞表现出不同的肿瘤杀伤能力。(I) 与 UR 样品相比,用 CD36-low NAC 样品裂解物处理的 T 细胞显示出显著更高的 IFN-γ 分泌。(J) Caspase3/7 检测分析。(K) mIF 显示 CD36 阻断增强了 AG 的杀伤效果。(L) 成功构建卵清蛋白 (OVA+) 鼠 KPC 类器官。(M) OVA+类器官/OT-1 细胞共培养系统验证了 CD36 阻断对 AG 介导的肿瘤杀伤的协同作用
06
在临床前模型中靶向 CD36 协同促进 PDAC 的 AG 功效
接下来,他们基于几种临床前动物模型研究了抗CD36治疗是否可以提高AG在体内的疗效。接受 AG 联合 CD36 中和抗体的肿瘤异种移植物生长速度明显慢于单独 AG 或抗 CD36 治疗的肿瘤异种移植物,这表明使用 AG 进行额外的抗 CD36 治疗可能会优化 NAC 功效(图6 A-D)。进一步的分析证实,AG 处理增加了 CD8+ T 细胞的瘤内浸润和颗粒酶 B+ CD8+ T 细胞的百分比(图 6E-F)。同样,他们发现 AG 处理增加了 CD8+ T 细胞上的 CD36 表达,但不增加 CD4+ T 细胞上的 CD36 表达(图 6 F)。抗CD36治疗与AG的组合有效增加了肿瘤异种移植物中细胞毒性特征的表达以及IFN-γ和肿瘤坏死因子-α(TNF-α)的水平,进一步揭示了抗CD36是AG治疗期间的靶向免疫调节分子(图6G)。随后,他们生成了胰腺癌的原位小鼠模型,并将它们分为不同的治疗组(图 6 H)。AG +抗CD36抗体治疗组的生存期最长(图6I)。与单独使用AG相比,CD36阻断剂和AG联合治疗的人源化PDX小鼠的肿瘤生长明显减慢,而单独使用CD36阻断剂并没有达到令人满意的效果(图6J)。接下来,他们在组织微阵列(TMA)队列中检测了PDAC样本的CD36表达。在筛选术后接受AG辅助治疗的参与者后,发现在这一特定人群中,CD36表达上调与较差的预后显著相关(图6K-L),这表明抗CD36 + AG可能是一种有前景的策略。
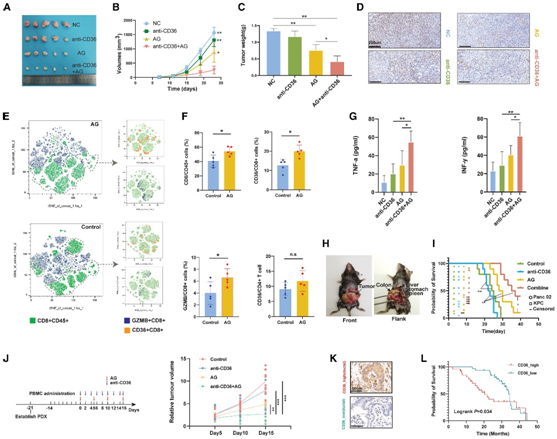
图6. 临床前模型中靶向CD36协同促进AG介导的PDAC杀伤。
(A) 每组皮下异种移植鼠 PDAC 肿瘤模型(C57 小鼠)的视觉呈现。(B) 肿瘤体积的分析。(C) 肿瘤重量的分析。(D) 代表性 IHC 染色显示用不同方案处理的皮下异种移植物中 Ki67 的表达。(E) t 分布随机邻域嵌入 (t-SNE) 分析显示 CD36 + CD8 + T 细胞和 GZMB + CD8 + T 细胞的聚类。(F) 流式细胞分析。(G) ELISA 结果分析。(H) PDAC 原位小鼠模型的代表性图像。(I) Kaplan-Meier 曲线分析。(J)在人源化PDX模型中,CD36阻断与AG方案协同作用可显著缩小PDAC肿瘤大小。(K) CD36 高和低 PDAC 的代表性 IHC 染色图像。(L) Kaplan-Meier 曲线显示 CD36 表达增加预示接受 AG 辅助化疗的 PDAC 患者预后较差。
+ + + + + + + + + + +
结 论
本项研究利用复旦大学上海癌症中心的队列,收集了新辅助白蛋白结合紫杉醇和吉西他滨 (AG) 的 PDAC 样本,进行了单细胞转录组和空间转录组、蛋白质组、转录组和代谢组联合分析,深入研究对 PDAC 响应化疗的分子变化的理解。NAC 会诱导 PDAC 代谢模式重编程并增强免疫原性。值得注意的是,NAC 导致糖酵解下调和 CD36 上调。组织微阵列分析表明,CD36 高表达与接受 AG 术后患者的较差生存率相关。靶向 CD36 可协同改善体外和体内PDAC 对 AG 的反应,包括源自患者的临床前模型。
+ + + + +



 English
English


