文献解读|Nat Med(50):多囊卵巢综合征患者子宫内膜的单细胞分析
✦ +
+
论文ID
原名:Single-cell profiling of the human endometrium in polycystic ovary syndrome
译名:多囊卵巢综合征患者子宫内膜的单细胞分析
期刊:Nature Medicine
影响因子:50
发表时间:2025.03.20
DOI号:10.1038/s41591-025-03592-z
背 景
多囊卵巢综合征 (PCOS) 影响 11-13% 的育龄妇女,并在 2020 年造成了 80 亿美元的经济负担。PCOS是无排卵性不孕的主要原因,并与胰岛素抵抗、2 型糖尿病 (T2D) 和子宫内膜癌等合并症有关。主要的生殖特征包括高雄激素血症、无排卵和月经不调,肥胖会加剧这些症状。与没有 PCOS 的女性相比,患有 PCOS 的女性会经历着床失败、妊娠早期和中期流产,并且患妊娠糖尿病、高血压、先兆子痫和宫内生长受限的风险更高,这些疾病都与子宫内膜功能障碍有关。PCOS 子宫内膜表现出无对抗的雌激素刺激和孕激素抵抗5、6,损害蜕膜化并可能改变免疫细胞功能。这些变化以及基因表达的改变与子宫内膜容受性降低、早期流产、不良妊娠结局和子宫内膜癌风险增加有关。与非 PCOS 女性相比,PCOS 的免疫环境预计也会改变。虽然这些发现表明子宫内膜存在内在功能障碍和独特的 PCOS 表型,但对于特定细胞类型(如上皮细胞、基质细胞、内皮细胞、腺细胞、平滑肌细胞和免疫细胞)如何导致这种功能障碍或特定细胞类型是否起主导作用知之甚少。
实验设计

结 果
01
人类 PCOS 子宫内膜单核图谱
研究团队收集了12名PCOS女性(除一名外,其余均符合鹿特丹标准)和5名年龄、体重和身体质量指数(BMI)相似的对照者在增生期(第6-8天)的功能层浅表子宫内膜活检样本(图1a)。基线评估后,10名PCOS患者接受了为期16周的随机试验[二甲双胍组:n =7;生活方式管理组(简称生活方式组),n=3](图1a)。除5例PCOS患者使用安宫黄体酮(Provera)进行出血诱导外,其他患者停用药物≥3个月。PCOS患者表现出高雄激素血症[Ferrima-Gallwey评分、脱氢表雄酮(DHEA)和雄烯二酮升高]和胰岛素抵抗[胰岛素抵抗稳态模型评估(HOMA-IR)升高]。子宫内膜厚度和孕酮水平证实了增生期取样结果。二甲双胍降低了窦卵泡数量、雄烯二酮、睾酮和游离雄激素指数,而生活方式干预未显示显著的激素变化。在3名生活方式干预组和7名二甲双胍干预组受试者中,分别有1名和3名受试者的月经频率有所改善,并转变为规律的月经周期或缩短了月经间隔。
他们从27份活检样本中提取的单细胞核使用10x Genomics方案进行单细胞核转录组分析(snRNA-seq)(图1a)。对6个样本(两个对照组、两个PCOS基线组、一个PCOS二甲双胍组、一个PCOS生活方式组)进行空间转录组学分析(Stereo-seq)(图1a)。经过质量控制后,共分析了 247791 个细胞核:44336 个来自对照组,99482 个来自 PCOS 基线组,78664 个来自 PCOS 二甲双胍组,25309 个来自 PCOS 生活方式组(图1b-c)。根据已知标志物鉴定出七个主要细胞聚类:基质细胞(n = 124055)、平滑肌细胞(SMC)(n = 2737)、上皮细胞(n = 105095)、淋巴和髓系免疫细胞(n =13596)、内皮细胞(n = 2308)和淋巴细胞(n = 2308)(图1c-d)。虽然所有参与者的子宫内膜活检均在月经周期的同一阶段进行,但与对照组相比,PCOS活检的上皮细胞更多,基质细胞和淋巴样细胞更少,干预后没有显著变化(图1e-f)。将细胞类型比例与人类子宫内膜细胞图谱中的对照组和子宫内膜异位症活检中的增生性子宫内膜进行比较,揭示了相似的模式。
空间转录组学证实了细胞类型定位,验证了用于聚类注释的标记基因,并揭示了细胞亚群的空间位置,突出了两组对照、两组PCOS、一组PCOS-二甲双胍组和一组PCOS-生活方式组样本中上皮细胞(EPCAM)和基质细胞(IGF1)的不同聚类(图1g)。这些发现提供了PCOS子宫内膜改变的详细转录和空间图谱。
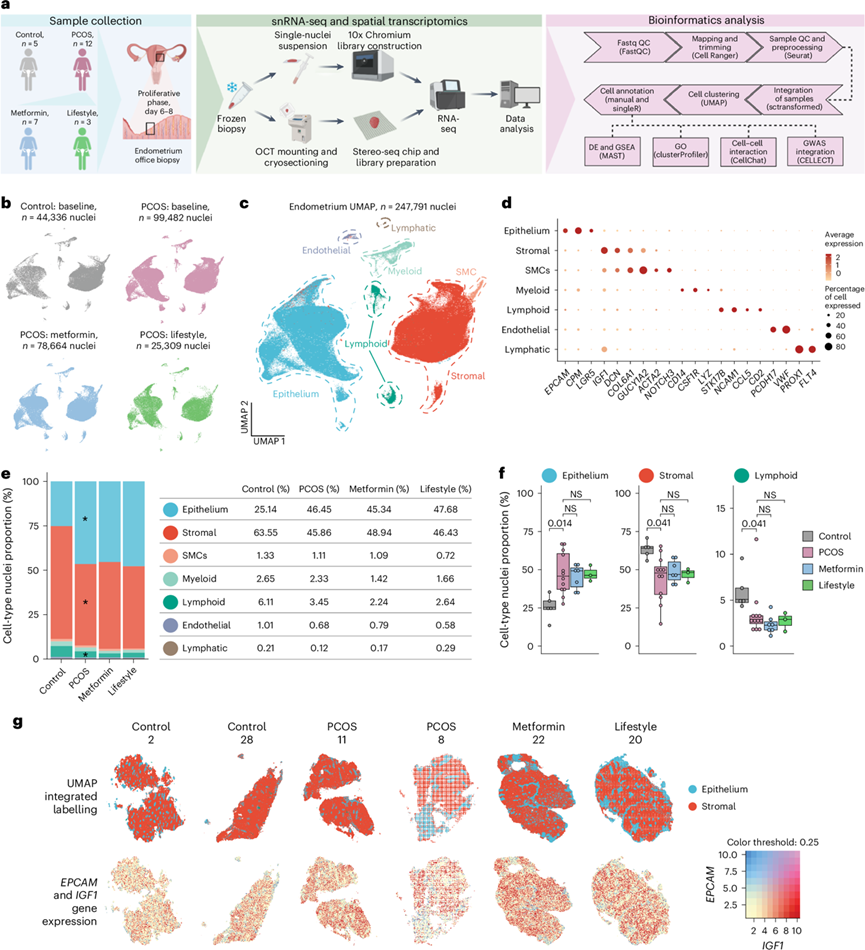
图1. 多囊卵巢综合征 (PCOS) 女性和对照组的子宫内膜单细胞分析。
(a) 纳入参与者的示意图,在增殖期第 6-8 天收集的子宫内膜活检样本,用 10x Genomics 进行 snRNA-seq,并进行空间转录组学分析,以及生物信息学分析流程。(b) 基线和用二甲双胍或生活方式干预治疗 16 周后对照和 PCOS 子宫内膜 snRNA-seq的颜色代码和捕获的细胞核数量。(c) 7 个细胞类型特异性聚类。(d) 点图显示表征每个主要聚类的细胞类型标记的基因表达。(e) 条形图和表格显示基线时增殖期子宫内膜活检中主要细胞聚类的比例。(f) 箱线图显示基线时患有和不患有PCOS的女性之间上皮细胞、基质细胞和淋巴细胞的细胞核比例(细胞核百分比)的差异。(g)对两个对照个体的上皮和基质主要聚类的整合标记和主要标志物进行空间转录组学分析。
02
增生上皮的时空改变
上皮亚群分析确定了 6 个亚群:(1)腔内阳性,(2)SOX9 + LGR5 +,(3)SOX9 + LGR5 −,(4)SOX9 +循环,(5)纤毛细胞和(6)AR+细胞(图2a-c),从有诱导出血和无诱导出血的女性身上获得的样本之间没有差异。尽管 PCOS 子宫内膜中上皮细胞核的比例较高(图1e-f),但与对照子宫内膜相比,上皮亚群中的比例没有差异(图2d)。雌激素-α(ESR1)、孕激素(PGR)和雄激素(AR)受体对子宫内膜增殖和分化至关重要,其表达在月经周期期间有所不同。与非 PCOS 女性相比,PCOS 女性的AR+、SOX9+ LGR5+和 SOX9 +循环上皮亚群中的ESR1下调(图2e),这在蛋白质水平上得到证实(图2f),与之前的研究一致,二甲双胍可部分逆转这一情况(图2e)。AR和PGR(编码 PR)的表达均无显著差异,反映了增殖期。点图和立体测序显示了不同亚群中的ESR1、PGR和AR表达水平。
差异表达基因 (DEG) 分析比较了上皮亚群中患有和不患有 PCOS 的女性样本,发现 SOX9 + LGR5 + (n = 138)、SOX9 +循环 (n = 174)、AR + (n= 257) 和纤毛 (n= 259) 亚群中的 DEG 最多。补充表2a-c列出了 上调和下调最多的五个基因以及每个亚群的所有 DEG (图2g)。许多基因在多个亚群中存在差异表达,这表明 PCOS 特异性的上皮细胞组成和对上皮细胞的影响。例如,与非 PCOS 和子宫内膜薄的参与者的分泌期相比,SEMA3(编码与血管生成和细胞增殖相关的信号蛋白)的表达在增殖期增加。在本研究中,PCOS女性除纤毛细胞外,所有上皮亚聚类中的SEMA3E均下调。在非 PCOS 子宫内膜中,ROBO2受体在增殖期升高,在分泌期降低,而在 PCOS 子宫内膜的 AR +、SOX9 + LGR5 +和腔内亚聚类中则下调。与复发性流产、孕激素相关的子宫内膜蛋白 PAEP 在 PCOS 腔内、SOX9+ LGR5+、SOX9 + LGR5 −和 AR +亚聚类中上调。与子宫内膜癌、着床失败和炎症相关的NEAT1在 PCOS SOX9+LGR5 −和 AR +亚聚类中上调(图2g)。抗菌基因SLPI在PCOS腔内亚群、SOX9 + LGR5 +亚群和SOX9 + LGR5-亚群中上调(图2g)。与PCOS相关的基因ITGA2在SOX9 + LGR5 +亚群中特异性增加(图2g),这些发现提示PCOS女性子宫内膜具有独特的上皮组成和转录组谱。
GO分析揭示了与妊娠、排卵、内胚层发育、组织结构、整合素介导的粘附、信号传导和细胞外基质 (ECM) 组织相关的跨亚群富集通路(图2h)。二甲双胍逆转了 SOX9 + LGR5+和 AR+亚群中的信号通路和 DEG,而生活方式管理仅影响 AR +亚群(图2i)。在 PCOS-SOX9+ LGR5+亚群的排卵周期通路中,二甲双胍恢复了ROBO2、MDK(与子宫内膜癌相关)以及ESR1和MAP2K6(与复发性植入失败相关)表达。对于整合素介导的信号传导和 ECM 组织,在 PCOS 子宫内膜中,两种治疗均恢复了 ArgGluAsp 受体(ITGB6、ITGB8和ITGAV)、胶原受体ITGA2、层粘连蛋白受体ITGA3和ADAMTS9(与 PCOS 中卵母细胞成熟度降低有关)的表达。整合素作为跨膜受体,介导 ECM-细胞骨架连接,在疾病中传递关键的生化和机械信号。
为了绘制 snRNA-seq 鉴定出的亚群的空间分布图,他们将细胞类型特异性标记基因投影到 空间转录组学分析(Stereo-seq)数据上,验证亚群并定义空间坐标(图2j)。将腔内细胞 (LGR5)、SOX9 + LGR5 + (WNT7A)、SOX9 + LGR5 − (IHH)、SOX9 +循环 (PAEP) 和 AR +细胞 (AR) 均绘制出来。对子宫内膜功能障碍相关的关键标记物,例如ROBO2、ITGA2和ADAMTS9,也进行了可视化。总体而言,他们对受PCOS影响的子宫内膜中的上皮亚群进行了表征和定位,结果显示具有独特DEG模式的上皮细胞比例增加,这些模式与子宫内膜癌、子宫内膜容受性和着床失败相关,这验证了其与增生期PCOS特异性子宫内膜功能障碍之间的联系。SOX9+ LGR5+和 AR+亚群富集了ECM组织、胶原代谢、整合素信号传导通路。这些亚群对二甲双胍的反应性独特,并能逆转多个失调基因。生活方式的改变也对基因调控有影响,但是程度较小。
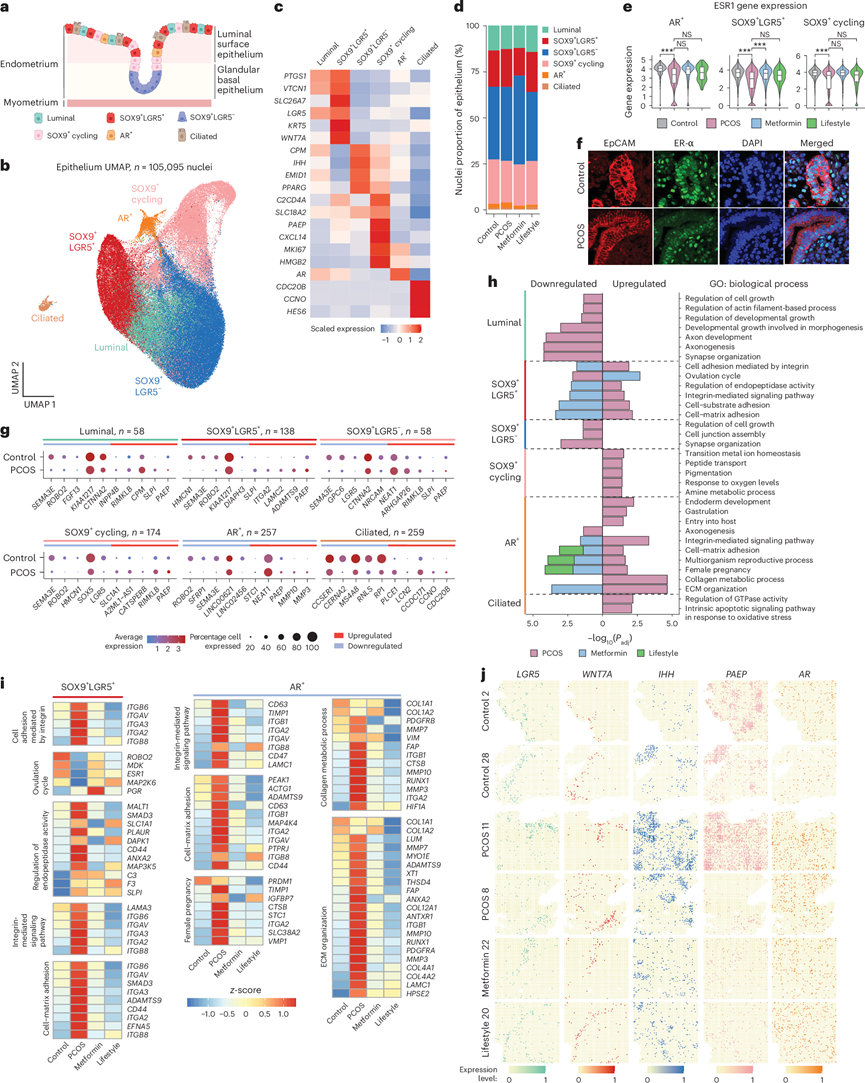
图2. 多囊卵巢综合征 (PCOS) 女性子宫内膜上皮细胞的时间和空间特征以及二甲双胍和生活方式的影响。
(a) 增生性子宫内膜上皮细胞的示意图。(b) 所有个体的上皮细胞核的 UMAP 投影,揭示了 6 个亚聚类。(c) 表征六个上皮亚聚类的基因表达的热图。(d) 六个上皮亚聚类的比例。(e) ESR1表达的小提琴图。(f) 代表性荧光显微镜图像和合并图像。(g) 每个上皮亚聚类中的 DEG 总数以及每个亚聚类中五个上调或下调最多的 DEG(对照与 PCOS)的点图。(h) GO分析。(i) 热图显示对照组和 PCOS 组之间上皮亚聚类中 GO 的 DEG,以及二甲双胍或生活方式干预可逆转的 DEG。(j) 空间转录组分析。
03
PCOS子宫内膜基质细胞的时空改变
基质细胞可注释为五个亚群:(1)基质1,(2)基质2,(3)增生性基质,(4)成纤维细胞和(5)平滑肌细胞(SMC)(图3a-b),诱导和非诱导出血样本之间没有差异。虽然PCOS子宫内膜中的基质细胞比例低于非PCOS子宫内膜,但干预后亚群比例保持不变(图3c)。与上皮细胞一样,与非PCOS子宫内膜相比,PCOS子宫内膜中的增生性基质细胞、成纤维细胞和SMC中的ESR1下调,而PCOS女性的生活方式管理可逆转这一现象(图3d)。PCOS女性和非PCOS女性之间的比较显示,增生性基质、成纤维细胞和SMC中的DEG数量最多。PCOS 中基质 1 和基质 2 中关键的上调和下调 DEG,在任何其他亚群中均无差异表达,包括PIK3C2G(下调),与颗粒细胞瘤相关的基因,MAP3K5(上调),人类子宫内膜容受性的标志物,以及胶原基因COL7A1(上调),基底膜和周围血管的组成部分,在调节组织重塑和体内平衡中起重要作用(图3e)。此外,与对照组相比,PCOS 女性的基质 1、基质 2、基质循环和 SMC 亚群中SFRP1(一种在增殖期表达较高的 Wnt 信号抑制剂)下调。此外, PCOS 子宫内膜的基质 1、基质 2 和 SMC 中的NEAT1也上调。
PCOS病例组和对照组DEG的GO分析揭示了与雌激素反应、生殖发育、上皮组织、ECM和胶原组织相关的富集通路,尤其是在成纤维细胞、增殖性基质和平滑肌细胞(SMCs)中(图3f)。在PCOS女性中,二甲双胍和生活方式管理(程度较小)仅逆转了成纤维细胞和SMC中胶原代谢、ECM组织和结缔组织发育的失调(图3f-g)。在成纤维细胞中,生活方式以及(在较小程度上)二甲双胍使升高的HIF1A(损害对胚胎着床至关重要的基质成纤维细胞蜕膜化)、RUNX1(与子宫内膜癌和血管生成有关)、MMP3和MMP10(参与细胞外重塑并与子宫内膜异位症有关)和ITGA2恢复正常,这些在子宫内膜癌和PCOS上皮细胞中经常上调。在平滑肌细胞中,两种治疗均恢复了胶原编码基因以及纤连蛋白和CD44的表达。
接下来,他们将snRNA-seq中细胞类型特异性的基质细胞标记基因投影到Stereo-seq数据上,以验证每个亚群,并为特定标记基因定义具体的空间坐标:ESR1(基质1)、PAEP(基质2)、TOP2A(循环基质)、PCOLCE(成纤维细胞)和MCAM(平滑肌细胞)(图3h)。也对HIF1A、RUNX1、ITGA2和CD44进行可视化。
综上所述,他们定义并空间定位了PCOS患者子宫内膜中的基质亚群,并发现基质细胞比例降低,提示其增殖速度较慢,他们观察到与子宫内膜癌以及子宫内膜容受性和着床失败相关的不同DEG模式。二甲双胍和生活方式管理恢复了与胶原代谢和ECM组织相关的通路,尤其是在成纤维细胞和SMC中,这反映了PCOS特异性子宫内膜功能障碍的治疗特异性改善。
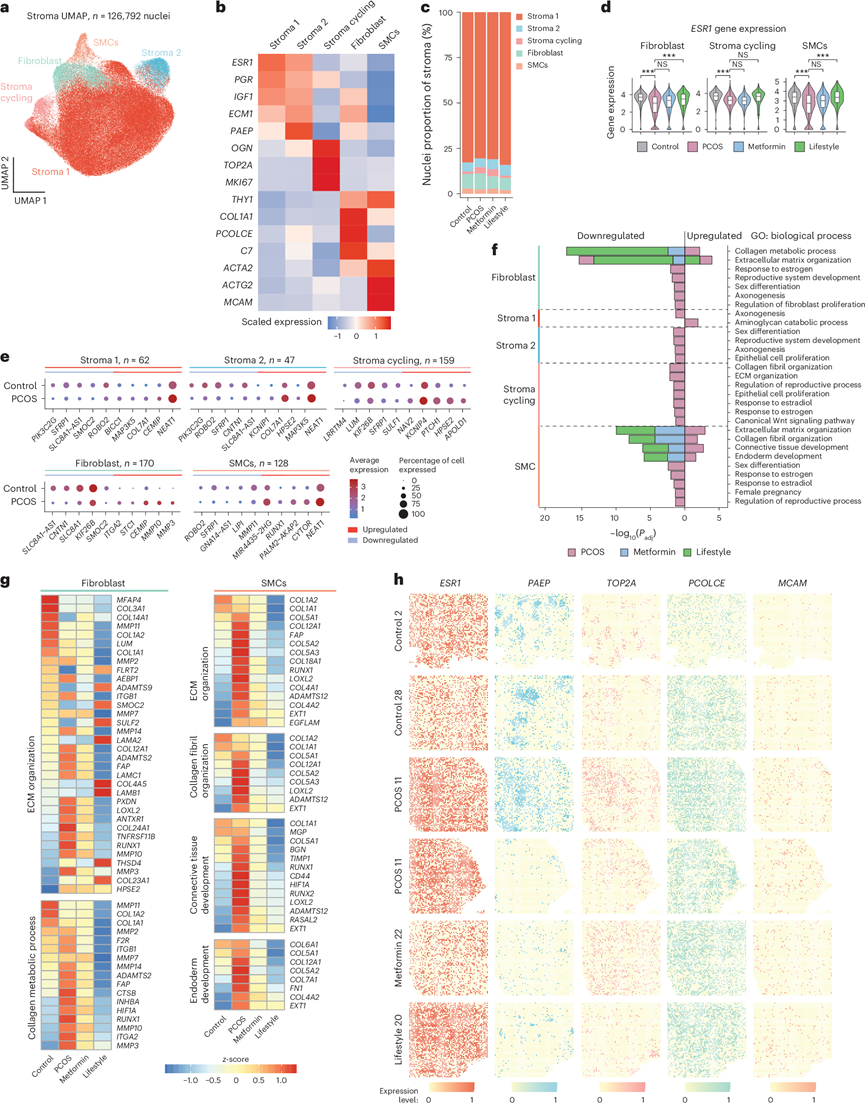
图3. 多囊卵巢综合征 (PCOS) 女性子宫内膜基质细胞的时间和空间特征以及二甲双胍和生活方式的影响。
(a) 所有个体的基质核亚聚类的 UMAP 投影。(b) 表征五个基质亚聚类的基因表达热图。(c) 五个基质亚聚类的比例。(d) ESR1表达的小提琴图。(e) 每个基质亚聚类中的 DEG 总数以及每个亚聚类中前五个上调和下调的 DEG(对照组与 PCOS 组)的点图。(f) GO分析。(g) 热图显示对照组和 PCOS 组之间基质亚聚类中 GO 中的 DEG 以及二甲双胍或生活方式干预可逆转的 DEG。(h) 基质亚聚类中选定细胞类型标记的空间转录组学分析。
04
PCOS子宫内膜免疫和内皮细胞改变
PCOS 与低度炎症3和功能失调的免疫微环境有关,而这又与子宫内膜容受性受损有关。在 PCOS 小鼠模型中,高雄激素血症会增加子宫自然杀伤 (uNK) 细胞频率,而 AR 拮抗剂可逆转这一效应。他们对13596个子宫内膜免疫细胞进行了表征,鉴定出三个 uNK 群(uNK1、uNK2 和 uNK3)、两个子宫巨噬细胞群(uM1 和 uM2)、调节性 T 细胞、CD8+和 CD4+ T 细胞、B 细胞、树突状细胞(DC1 和 DC2)和肥大细胞。尽管有这些发现,PCOS 女性和非 PCOS 女性之间的免疫亚群比例没有差异(图4a-c)。
具有最多 DEG 的最大免疫亚群是 uNK1、uNK2和 uM1(图4d),诱导和非诱导出血样本之间没有差异。这些细胞在月经期和增殖期活跃,对伤口愈合和子宫内膜再生至关重要,而这些过程在 PCOS中受损。uNK1、uNK2 和 uM2 中升高的关键基因包括与胚胎质量相关的GPX3,以及对子宫内膜容受性很重要的SLPI、CXCL14、PAEP和NAMPT(图4d)。值得注意的是,二甲双胍逆转了PAEP表达,部分通过生活方式管理逆转。
GO分析显示uNK2和uM1通路富集,大多数uNK2通路在PCOS患者中下调,但在二甲双胍治疗16周后恢复,但生活方式对其恢复程度较小(图4e-f)。二甲双胍还使uNK2中的ECM和胶原相关基因(COL1A1、COL1A2、COL3A1和MMP7)以及uM2中的整合素介导通路正常化(图4e-f)。
在 PCOS 子宫内膜中,最小的亚聚类,即内皮细胞或淋巴细胞(2308 个细胞核)(图4g-i),显示内皮动脉亚聚类中的PDE3A、SULF1、FN1和CLDN5下调,淋巴细胞中的FN1、CD9和DSCAM下调,而内皮动脉亚聚类中的HDAC9上调(图4j),这些变化不受干预措施的影响。GO 分析突出显示了淋巴细胞中细胞发育和连接组装中的通路(图4k)。

图4. PCOS 子宫内膜中的免疫细胞亚群以及二甲双胍和生活方式的影响。
(a) 所有个体的亚聚类免疫细胞的 UMAP。(b) 表征 15 个免疫亚聚类的基因表达热图。(c) 15 个免疫亚聚类的比例。(d) 六个免疫亚聚类中的 DEG 总数以及这些免疫亚聚类中前五个上调和下调的 DEG(对照组与 PCOS 组)的点图。(e)GO分析。(f) 热图显示了对照组和 PCOS 病例之间的 GO 中的 DEG,以及通过二甲双胍或生活方式干预逆转的DEG。(g) 所有个体亚聚类内皮细胞或淋巴细胞的 UMAP。(h) 五个内皮细胞或淋巴细胞亚聚类的比例。(i) 表征五个内皮细胞或淋巴细胞亚聚类的基因表达热图。(j) DEG分析。(k) GO分析。
05
PCOS子宫内膜中的细胞间相互作用
SnRNA-seq 和 Stereo-seq 数据揭示了 PCOS 子宫内膜上皮、基质和免疫亚群中不同的失调基因和生物学过程。亚群内部和亚群之间的细胞间通讯对于子宫内膜对激素失衡的反应至关重要,他们使用 CellChat 分析了亚群之间细胞间配体-受体相互作用。在PCOS子宫内膜中,基质1亚群与SOX9+循环、SOX9+LGR5+、SOX9+ LGR5 −以及腔内亚群表现出显著的相互作用强度。这些相互作用不受二甲双胍和生活方式干预的影响。
接下来,对不同亚群中的配体-受体基因进行分析表明,PCOS 子宫内膜中最强的相互作用涉及 ECM 成分,包括胶原蛋白、层粘连蛋白和纤连蛋白 1 (FN1) 通路,与主要亚群中的 DEG 一致(图5a-b)。
PCOS 子宫内膜的关键发现包括uNK2 中的胶原配体COL1A1和增生性基质、成纤维细胞和 uNK2 中的COL1A2下调,而 AR+上皮、基质 2 和 SMC中的COL4A1、COL4A2和COL6A3上调(图5a)。胶原配体与上调的整合素编码基因相互作用,例如SMC 中的ITGA1、SOX9 + LGR5 +中的ITGA2、SOX9 +循环和 AR +以及AR +和 uM1中的ITGAV和ITGB1。CD44在除腔内、纤毛、基质 2 和 uM2 以外的上皮和基质亚聚类中均有表达(图5a-d)。这种相互作用支持 ECM 信号通路的激活,可能通过增强增殖来增加 PCOS 子宫内膜中上皮细胞的比例。
FN1在SMC、动脉内皮细胞和淋巴细胞中下调,而LAMA2在AR +上皮细胞中下调。相反,LAMC1和LAMC3在AR+细胞中上调,LAMC2在SOX9+LGR5+细胞中上调。这些FN1和层粘连蛋白配体与胶原蛋白配体一样,与相同的整合素编码基因相互作用(图5a)。
在分泌信号通路中,SPP1(骨桥蛋白)在PCOS子宫内膜的uM1和uM2中上调,与ITGA9(在uM2中上调)、ITGAV(在SOX9+LGR5+、AR +和uM1中)和ITGB1(在AR+和uM1中)形成配体-受体对(图5b)。GDF7在AR +和成纤维细胞中下调,与BMPR1B受体相互作用,而BMPR1B受体在纤毛细胞中下调。IGF1在AR+、成纤维细胞、SMC和uM1细胞中下调,与IGF1R相互作用。SEMA3E在上皮亚群中下调,与PLXND1相互作用,而PLXND1的表达保持不变。在 Slit-Robo 通路中,仅ROBO2受体在上皮和基质亚群中下调(图5b-d)。
细胞粘附分子相关信号通路包括CADM1,它既作为配体又作为受体,在管腔上皮细胞、SOX9+ LGR5+和 AR +上皮细胞中上调,并与NECTIN3相互作用,而 NECTIN3 的表达无差异(图5c)。CNTN1在 AR+和基质亚群中下调,与NOTCH1-2和NRCAM受体相互作用,后者在除 AR+以外的上皮亚群中表现出差异表达(图5c-d)。NRXN3在管腔上皮细胞和SOX9+ LGR5 +中上调,与CLSTN1和NLGN1相互作用,后者在 PCOS 的增生性基质中升高。
重要的是,许多编码配体和受体的DEG在PCOS与对照组中排名靠前(图2-4) 。将CellChat DEG与治疗反应基因进行比较,发现胶原蛋白、整合素、CD44和ROBO2表达发生了显著变化,这通过Stereo-seq数据得到了进一步验证(图5d-e)。
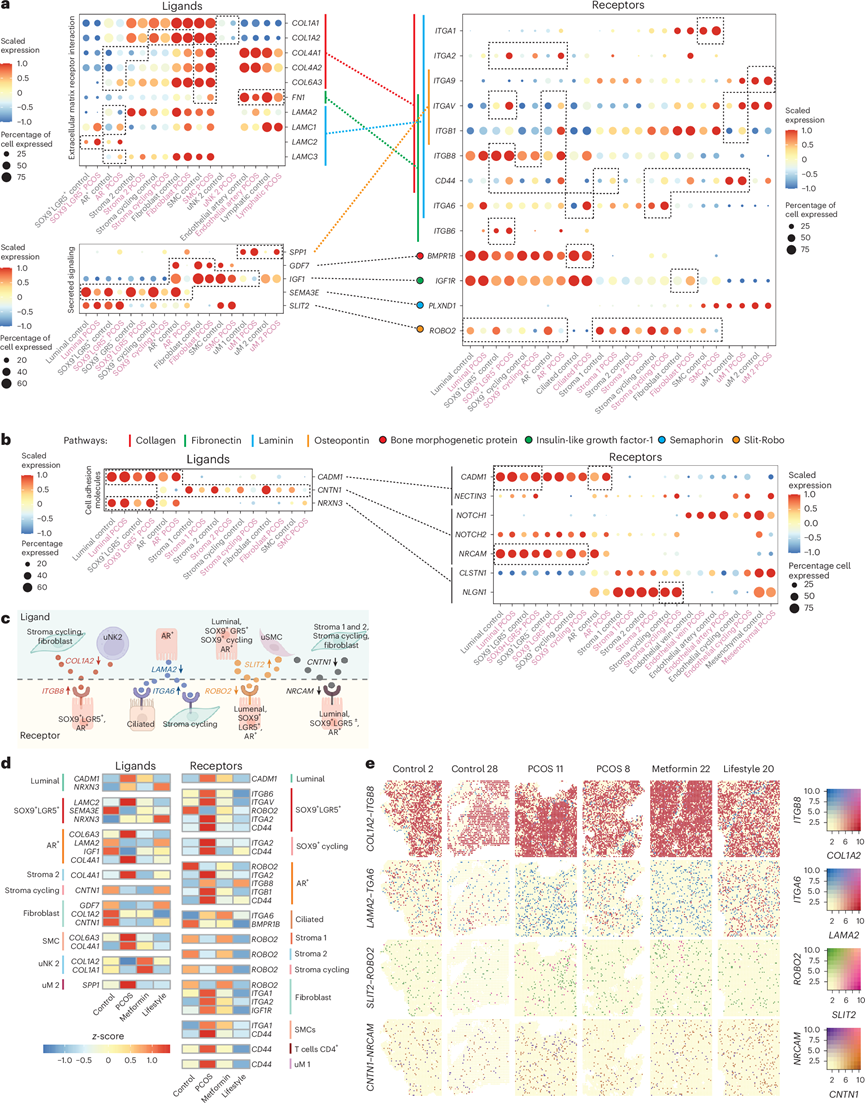
图5. 独特的上皮-基质免疫细胞串扰和配体-受体相互作用。
(a) 配体点图指的是注释为 ECM-受体相互作用或相关分泌信号的信号通路。(b) CellChat 注释为细胞粘附分子的配体-受体对基因点图。(c) 选定的细胞亚群和特定受体和配体的图解。(d) 与 PCOS 相比,二甲双胍或生活方式治疗后逆转的配体和受体编码基因热图。(e) 选定的相互作用配体和受体基因的空间分布和基因表达。
06
子宫内膜细胞类型与人类疾病
PCOS 与多种生殖和代谢疾病有关,全基因组关联研究 (GWAS) 表明 PCOS 与生物可利用睾酮、子宫内膜癌和子宫内膜异位症之间存在联系。此外,PCOS 与 2 型糖尿病、空腹胰岛素和血糖以及 BMI 调整后的腰臀比 (WHR) 共有基因位点。他们利用 CELLEX 和 CELLECT,将 snRNA-seq 数据与 GWAS 整合,以鉴定介导这些关联的子宫内膜细胞类型。
PCOS GWAS 与纤毛上皮细胞显著相关,而子宫内膜异位症 GWAS 与浆细胞样树突状细胞 (pDC) 相关。除增生性基质外,基质亚群与 BMI 校正后的WHR 密切相关。此外,与 2 小时血糖水平 GWAS 和空腹胰岛素 GWAS 相关的 uNK2 和 uNK3 与基质 1、基质 2、成纤维细胞、增生性内皮细胞和 3 型先天淋巴细胞(ILC3 细胞)相关(图6a-b)。
为了研究每种细胞类型的 DEG 平均基因表达与 PCOS 临床特征之间的关系,他们对包括所有女性在内的基线细胞类型进行了相关性分析。PCOS中的 AR+和基质亚群中CNTN1下调,与基质细胞中的 HOMA-IR 和雄烯二酮呈负相关(图6c-g)。CNTN1受体NRCAM与上皮亚群中的 HOMA- IR呈负相关(图6d)。CD44和ITGA6与基质 1、成纤维细胞和纤毛上皮细胞中的 HOMA- IR呈正相关(图6e-f)。ROBO2、ESR1和COL1A2与上皮和基质亚群中的雄烯二酮呈负相关,而IGF1R与成纤维细胞中呈正相关(图6h-k)。
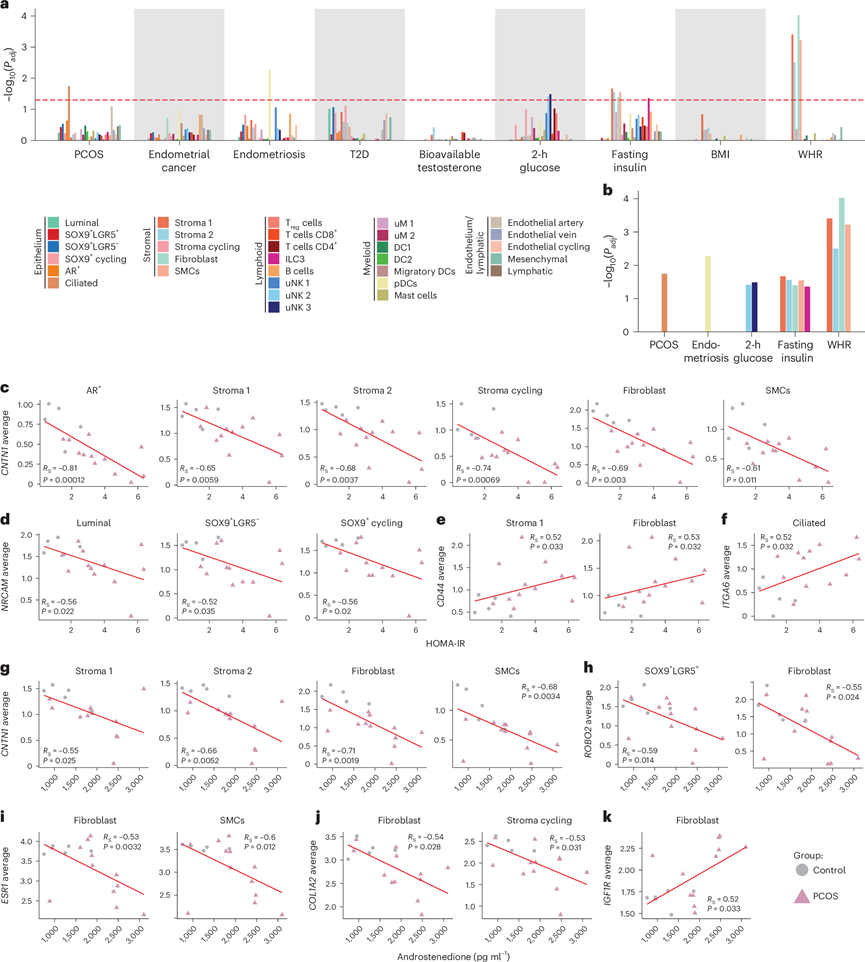
图6. 通过 GWAS 和 DEG 与胰岛素抵抗和高雄激素血症的相关性进行的亚群-疾病关联。
(a) CELLECT 分析人类子宫内膜 snRNA-seq 数据(PCOS + 对照)中细胞类型与 GWAS 之间的关联。(b) CELLECT 分析确定为显著富集的 GWAS 和亚聚类的放大图。(c) 每个亚聚类中 DEG 平均基因表达的 Spearman 相关性。(d) NRCAM1与上皮亚群中的 HOMA - IR 呈负相关。(e-f) CD44和ITGA6与基质亚群中的 HOMA-IR 呈正相关。(g) CNTNT1与基质亚群中的雄烯二酮呈负相关。(h) ROBO2与上皮亚群中的雄烯二酮呈负相关。(i-j) ESR1和COL1A2与基质亚群中的雄烯二酮呈负相关。 (k) IGFR1与基质亚群中的雄烯二酮呈正相关。
+ + + + + + + + + + +
结 论
本研究构建了 PCOS 女性增生期子宫内膜的细胞图谱,并与年龄、体重和体质指数相近的对照组进行了比较。本研究对 27 例活检样本(5 例对照组、12 例 PCOS 患者,7 例接受二甲双胍治疗 16 周后,3 例接受生活方式干预后)的 247791 个分离的子宫内膜细胞核进行了分析,揭示了细胞类型特异性的疾病特征以及细胞组成和定位的差异。在接受二甲双胍治疗并进行生活方式管理 16 周后采集的样本显示,疾病特异性子宫内膜特征已得到广泛恢复。本研究将每种细胞类型的特定作用与雄激素过多症和胰岛素抵抗等临床特征整合起来,并将特定细胞类型与子宫内膜和代谢疾病的风险联系起来。此外,本研究还确定了整合素抑制剂等潜在治疗靶点,并强调了二甲双胍在恢复PCOS患者子宫内膜健康方面的作用。本项研究结果为进一步理解 PCOS 特异性子宫内膜功能障碍奠定了基础,有助于未来开发靶向治疗。
+ + + + +



 English
English


