文献解读|Cell Rep Med(14.3):结直肠癌对放化疗和靶向治疗反应的蛋白质组学特征揭示了潜在的治疗策略
✦ +
+
论文ID
原名:Proteomic characterization of the colorectal cancer response to chemoradiation and targeted therapies reveals potential therapeutic strategies
译名:结直肠癌对放化疗和靶向治疗反应的蛋白质组学特征揭示了潜在的治疗策略
期刊:Cell Reports Medicine
影响因子:14.3
发表时间:2023.12.11
DOI号:10.1016/j.xcrm.2023.101311
背 景
结直肠癌(CRC)是消化系统最常见的恶性肿瘤之一,也是全球癌症相关死亡的主要原因。与其他癌症不同,大多数结直肠癌病例并不是由单一危险因素造成的。放化疗和靶向治疗是CRC的主要治疗方法。然而,与治疗耐药性相关的分子特性尚未完全表征。
实验设计
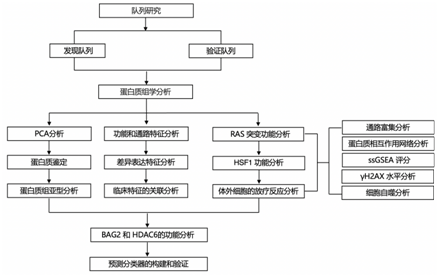
结 果
01
CRC 队列:CRC 患者对放化疗和靶向治疗的反应和蛋白质组学分析
为了研究与化疗(CT) 和靶向治疗反应相关的蛋白质组模式,研究者团队组建了一个由 254 名 CRC 患者组成的队列,其中包括发现队列和验证队列,这些患者接受CT[主要是 FOLFOX (亚叶酸、氟尿嘧啶和奥沙利铂)治疗]、放化疗(CRT)(主要是 FOLFOX 加放疗)或 CT加靶向治疗(CTT)(主要是 FOLFOX 加西妥昔单抗治疗)(图 S1A)。
在发现队列中,CT 子队列分为 CT-S 组和 CT-NS 组; CRT 子队列分为 CRT-S 组 和 CRT-NS 组; CTT 子队列分为 CTT-S 组和 CTT-NS 组(图 S1B)。在独立验证队列中,他们收集了 130 名 CRC 初治患者的样本,并进行靶向定量蛋白质组学分析(图1A)。CT、CRT 和 CTT 亚组之间的性别和年龄没有基线差异。在CRT子队列中发现91.1%的患者患有直肠癌并正在接受CRT,其余8.9%的患者患有结肠癌(图1B)。
蛋白质组学结果显示,所有样本中共有11558个基因产物(GP),每个样本中有6519-7372个GP(图1C-F,图S1C-G)。在三个子队列中,蛋白质组学覆盖率没有差异(图1C),主成分分析(PCA)也显示没有批次效应(图1D和S1H)。
一些已知的生物标志物,如EZR、DPYD、TYMP、KRAS、NRAS、PTEN、BRAF、PIK3CA和TP53,主要参与肿瘤进展并对CRC的临床治疗策略有指导意义。他们在本项研究的CRC队列中高度识别到这些生物标志物(图1E)。此外,差异分析显示,与正常样本相比,在CPTAC和TCGA队列中,肿瘤样本中TP53和TYMP的增加更高,验证了CRC生物标志物的重要性,并表明它们与治疗反应的潜在关联(图S1I)。
然后,他们根据本项研究的蛋白质组数据,初步探索这些生物标志物是否与结直肠癌患者的治疗反应准确相关。在确保蛋白质组学覆盖率在铭感(S)组(10599个GP)和不敏感(NS)组(10616个GP)之间没有显著差异后(图1F),他们进一步比较了S组和NS组之间的这些生物标志物,发现本项研究的队列中没有显著差异(图1G),这表明需要寻找CRC治疗的潜在生物标志物。
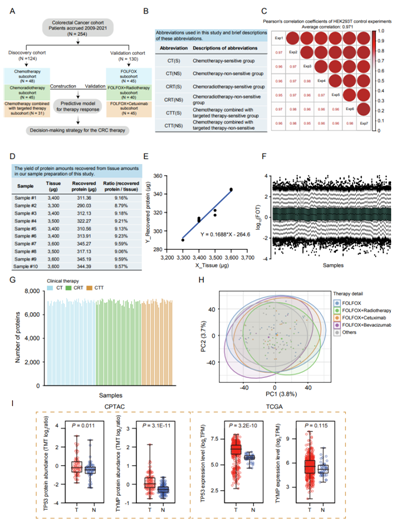
图S1. 使用质谱平台进行蛋白质组学分析和质量控制的实验流程。
(A)队列分析。(B)不同反应的缩写与不同的治疗方案。(C)利用HEK293T细胞胰蛋白酶消化法对质谱进行纵向质量控制。左下表示样本的成对Pearson相关系数,右上表示来自同一比较的成对散点图。(D)本研究样品制备中从组织中回收的蛋白质量的产率。(E)蛋白质产量与组织数量之间的线性关系。(F)124例CRC病例的箱线图。(G)包括化疗、放化疗和化疗联合靶向治疗在内的124例CRC病例中鉴定的蛋白数量的柱状图。(H)主成分分析(PCA)。(I)差异丰度和差异表达分析。
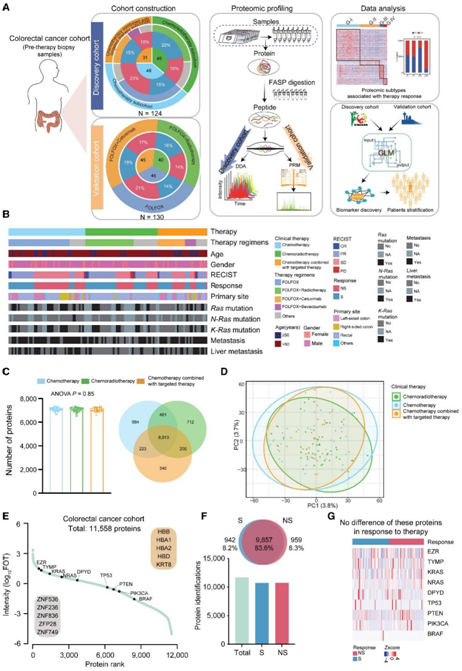
图1. 结直肠癌蛋白质组分析。
(A) 蛋白质组实验流程涉及三个模块:队列构建(包括发现队列和验证队列)、蛋白质组分析和数据分析。(B) 三个亚组的临床特征。(C) 三个亚群的蛋白质鉴定和蛋白质重叠。(D) 三个亚组的主成分分析(PCA)。(E) 根据蛋白质丰度降序排列的每个样品的蛋白质鉴定的动态范围。(F) S 组和 NS 组的蛋白质鉴定和蛋白质重叠。(G) 热图显示 S 组和 NS 组之间这些蛋白质的表达没有差异。
02
CRC 队列的蛋白质组亚型及其与治疗反应的关联
他们首先对发现队列进行共识聚类分析,并确定了四种蛋白质组亚型,其中 57、48、9 和 9 名患者分别分为亚型 G-I、G-II、G-III 和 G-IV(图2A)。蛋白质组学亚型表现出不同的临床特征,尤其是在治疗反应方面(图2B)。S患者中G-III亚型比例较高(77.8%),NS患者中G-IV亚型比例较高(88.9%)(图2C)。进一步的功能富集分析确定了每个亚型的优势通路(图2D)。对治疗敏感的G-III亚型主要以免疫相关通路为主,而对治疗不敏感的G-IV亚型主要以RAS-MEK-ERK信号通路为主(图2D-E)。这些发现为蛋白质组模式与治疗反应的关联提供了直接依据,促使他们寻找更多与反应相关的分子特征。
为了验证这些与治疗反应相关的生物学途径,他们在发现队列中对S组和NS组进行了直接比较分析。因此,基因集富集分析(GSEA)显示S组中最富集的途径包括补体级联和中性粒细胞脱粒(图2F)。这些结果一致地揭示了免疫相关途径与治疗敏感性的关联。重要的是,在G-III亚型中上调的1663个蛋白中,573个蛋白在S组中显著增加。为了研究蛋白表达与治疗敏感性的关系,他们利用来自癌症依赖图谱项目(DepMap)的结直肠癌细胞系数据,探索了这573种蛋白的药物敏感性。结果显示219个蛋白分别与5-氟尿嘧啶(5-FU)和奥沙利铂(oxaliplatin)的药物敏感性相关。其中, 106个重叠蛋白与5-FU和奥沙利铂的药物敏感性相关。此外,他们发现了一组参与中性粒细胞降解(RNASE2、PTPRJ和CEACAM8)和补体/凝血级联(SERPINA5、C7和F10)的蛋白,这些蛋白的丰度与药物敏感性(5-FU和奥沙利铂)呈负相关,表明具有免疫应答通路特征的患者更有可能从CT或靶向治疗中获益(图2G)。在平行反应监测(PRM)分析中,他们观察到这些蛋白表达更高,与NS组相比,S组的差异倍数(FC)>2(图2H),验证了免疫相关蛋白与药物敏感性之间的关联。
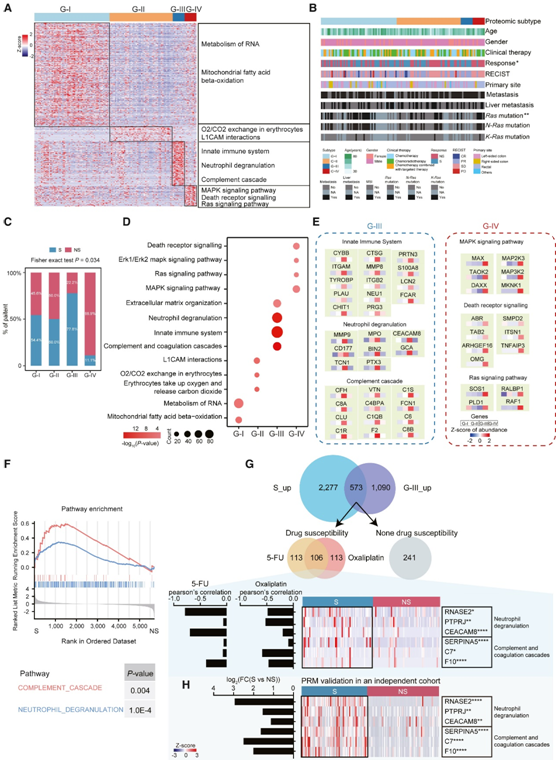
图2. 结直肠癌序列蛋白组亚型及其与临床特征的关联。
(A) 四种亚型的特征蛋白的相对丰度和生物学功能。(B) 四种蛋白质组亚型与临床特征的关联。(C) S 和 NS 组在四种蛋白质组亚型中的分布。(D) KEGG通路富集分析。(E) G-III 和 G-IV 中涉及的差异表达特征和信号级联。(F) S 组和 NS 组之间补体级联和中性粒细胞脱颗粒的 GSEA。(G) G-III 亚型和 S 组中特征蛋白上调及其与 DepMap 数据库中药物反应关联的验证。(H) 基于独立队列中 PRM 定量的这些蛋白质的差异表达。
03
PLA2G4A 介导的串扰信号与具有 RAS 突变的 CRC 化疗耐药性相关
为了进一步探讨特定治疗的敏感性/耐药性机制,他们对CT亚队列中纳入的 S和 NS患者的未接受治疗样本进行了比较蛋白质组分析(主要是 FOLFOX CT),鉴定了CT亚队列的主要临床特征及RAS突变(图3A)。由于79%的患者接受了FOLFOX治疗,在CT亚队列中占最大比例,ConsensusPathDB通路富集分析显示,T细胞受体(TCR)信号通路、固有免疫系统、fc γ r介导的吞噬、趋化因子信号通路和自噬通路在S组中显著富集,而在NS组中,过表达的通路为甘油磷脂代谢和嘌呤/嘧啶代谢(图3B)。
综上所述,免疫调节信号通路与CT敏感性相关,而代谢生物过程与CT抗性相关。嘌呤和嘧啶代谢在癌细胞增殖中起关键作用;因此,嘌呤代谢受损与癌症进展相关。参与嘌呤/嘧啶代谢的关键酶在接受FOLFOX CT的CRC患者中NS组表达上调(图3C)。与以往的研究一致,对5-FU的耐药与主要靶点TYMS的表达升高相关,TYMS催化了脱氧胸苷一磷酸(deoxythymidine monophosphate)的生成从头途径。此外,他们发现NS组参与甘油磷脂代谢的蛋白显著上调。PRM分析进一步表明,参与嘌呤/嘧啶代谢(POLE、POLR1D、DCK和TYMS)和甘油磷脂代谢(GP1D、PCYT2和PLA2G4A)通路的蛋白在NS组中也显著上调,该队列由45例接受FOLFOX CT的CRC患者组成(图3D)。相关性分析显示,细胞质磷脂酶A2组IV家族成员PLA2G4A与5-FU和奥沙利铂的敏感性均呈最显著正相关(图3E)。PLA2G4A的表达可能是由RAS突变介导的。三种RAS GTPase (KRAS, NRAS和HRAS),特别是家族成员KRAS,是癌症中最常见的突变致癌基因。据报道,CRC中基因突变的分布频率分别为~ 40%的KRAS和3% ~ 5%的NRAS。在本研究中,他们发现73%的RAS突变CRC患者对FOLFOX CT表现出耐药性,这表明RAS突变患者不太可能从FOLFOX CT中获益(图3F)。
为了研究RAS突变调控的下游通路,他们对RAS突变患者和野生型患者进行了比较蛋白质组学分析。他们发现在RAS突变组中有289个蛋白显著升高,这些蛋白主要富集于MAPK信号通路、Fc γR介导的吞噬、VEGF信号通路、RAS信号通路、PI3K-Akt信号通路和甘油磷脂代谢通路。在这些上调蛋白和过度表达的通路中,他们发现PLA2G4A参与了大多数通路调控(图3G)。他们观察到PLA2G4A在RAS突变的CRC患者中表达更高,这在其他CRC队列中也得到了验证(图3H)。此外,差异分析显示RAS突变的NS患者PLA2G4A表达增加6.8倍(图3I)。综上所述,他们认为除了嘌呤和嘧啶代谢外,PLA2G4A介导的甘油磷脂代谢与结直肠癌患者,特别是RAS突变的结直肠癌患者的化疗耐药有显著关联。
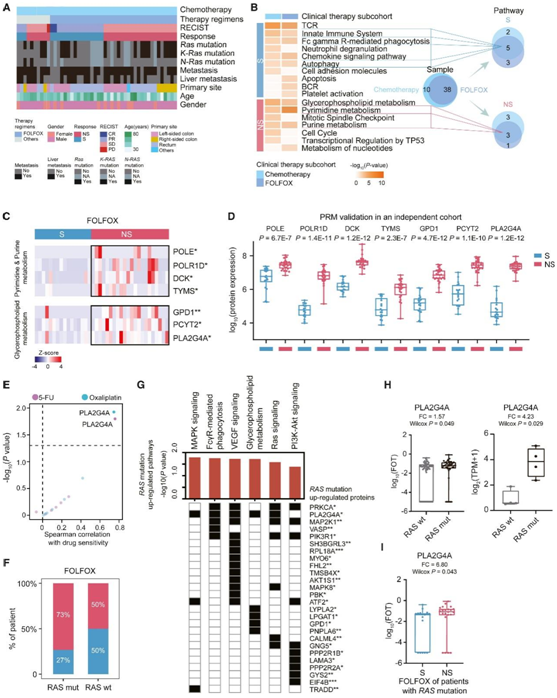
图3. 化疗亚组中敏感组和非敏感组蛋白的差异表达。
(A) 化疗亚组的详细临床特征。(B) 化疗亚组和 FOLFOX 亚组的通路富集结果。(C) 参与嘧啶/嘌呤代谢和甘油磷脂代谢的蛋白质的差异表达。(D) 使用 PRM 方法量化的 S/NS-sig 的差异表达。(E) 火山图显示这些蛋白质与药物敏感性的相关性。(F) RAS突变组与RAS 野生型群体。(G) RAS 突变组中上调的通路和相关蛋白。(H) PLA2G4A在队列中RAS突变/野生型组(左)和CRC细胞系(右)的差异表达。(I) RAS突变的结直肠癌患者FOLFOX S组和NS组PLA2G4A的差异表达。
04
HSF1调节单碳代谢和细胞周期,与直肠癌放疗耐药相关
除CT外,CRT也作为局部晚期直肠癌的标准治疗方法。在这项研究中,CRT 亚组包括 45 名患者,其中 66.7% 接受 FOLFOX 加放疗。他们对 S 和 NS 患者进行了比较蛋白质组学分析,并在 CRT 亚组和 FOLFOX 加放疗亚组中分别鉴定了 266 个 差异表达蛋白(DEP) 和 310 个 DEP。ConsensusPathDB通路富集分析显示,中性粒细胞脱颗粒、趋化因子信号传导、粘着斑、ECM和血小板激活等免疫相关通路在S组中显著富集。而在NS组中,上调的蛋白主要涉及代谢相关途径,如氨基酸代谢、膜运输、囊泡介导的运输以及维生素和辅因子的代谢。他们在 FOLFOX 加放疗亚组中发现了一致的通路富集结果(图 4A-B)。
癌症代谢通常以代谢需求、营养供应和代谢酶调节的改变为特征。在接受 FOLFOX 加放疗的 NS 患者中,参与一碳代谢的蛋白质,包括 AHCY、ALDH1L1、ALDH1L2、GLRX、MTHFD1L、MTHFD2 和 SHMT2 显著增加(图4D)。然后他们研究了与 CRT 反应相关的转录调控差异,发现 S 组和 NS 组之间有 8 个转录因子 (TF) 存在显著差异(图4E),其中HSF1差异最显著。此外,基于来自GSE68204数据集的转录数据,他们在59例接受放疗的直肠癌患者(32例NS患者和27例S患者)组成的独立队列中进一步验证了HSF1与放疗的相关性(图4F)。此外,HSF1与单碳代谢单样本GSEA (ssGSEA)评分的相关性最高(图4G)。涉及一碳代谢调节的特征(包括AHCY、ALDH1L1、ALDH1L2、MTHFD1L、SHMT2、GLRX、MTHFD2和HSF1)的联合预测模型在区分接受FOLFOX +放疗的S患者和NS患者方面表现出良好的性能[曲线下面积(AUC) = 0.89](图4H)。
更重要的是,在由40名接受FOLFOX加放疗的直肠癌患者组成的独立队列中,使用PRM方法进一步验证了这些关键蛋白(图4I)。免疫组织化学(IHC)染色显示,接受CRT的患者中,S组和NS组HSF1表达差异有统计学意义(图4J),证实了上述观察结果,即HSF1表达对放疗有负反应。总之,这些结果表明HSF1可以转录调节单碳代谢,并与对CRT的抗性有关(图4K)。
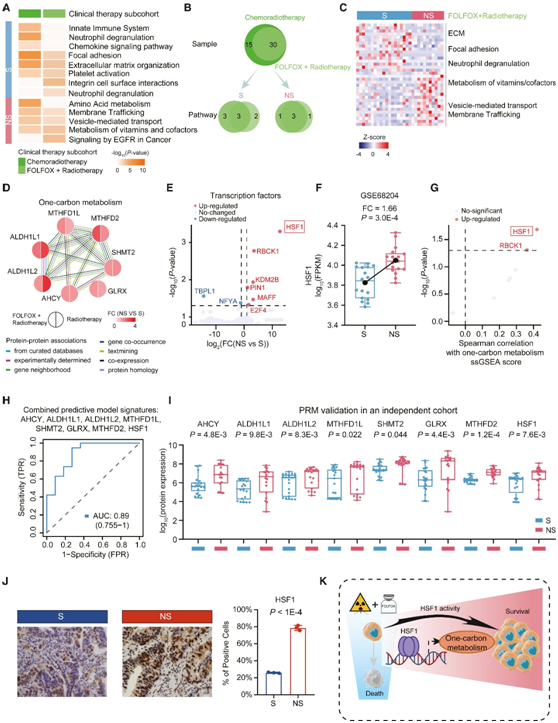
图4. 放化疗敏感组和非敏感组的蛋白质表达和信号通路差异。
(A) 通路富集结果。(B)放化疗亚队列中接受FOLFOX +放疗的患者比例以及S组和NS组的通路富集分析。(C) 参与一致特征途径的蛋白质的差异表达。(D) 参与一碳代谢途径的蛋白质的相互作用网络。(E) FOLFOX 加放疗亚组中 TF 的差异表达。(F) GSE68204 数据集中 S 组和 NS 组中 HSF1 的差异表达。(G) HSF1 和一碳代谢 ssGSEA 评分的 Spearman 相关性。(H) 组合预测模型特征的 ROC 曲线。(I) 在独立队列中使用 PRM 方法量化 S/NS组的差异表达。(J) 代表性示例中免疫组织化学(IHC) 染色的 HSF1 的鉴定。(K) 示意图显示 HSF1 响应放化疗的潜在调节。
05
分析HSF1表达对CRC细胞系放疗反应的影响
为了探索 HSF1 对放疗反应的潜在调节作用,他们进一步进行了体外验证实验。首先在 SW480 和 SW620 中构建了 HSF1 过表达稳定细胞系 (HSF1-OE),在 HCT116 和 RKO 细胞中构建了 HSF1 敲低细胞系 (HSF1-KD)。与对照组相比,HSF1的过表达促进了SW480和SW620的增殖(图5A),而他们观察到HSF1- KD组的生存受到抑制。然后,他们确定了HSF1差异表达的CRC细胞的放射耐药表型。细胞活力测定显示,与对照组相比,HSF1-OE组对辐射的抵抗力更强,生存率显著提高(图5B)。磷酸化H2AX (γH2AX)水平和γH2AX病灶是DNA损伤的敏感标记。因此,他们通过免疫荧光法进一步研究HSF1对X射线处理的CRC细胞(SW480和SW620)中γH2AX水平和病灶的影响。结果显示,HSF1-OE与对照组在X射线治疗后2 h的病灶形成没有差异,这表明初始辐射剂量相同,而在24 h后,他们观察到HSF1-OE组在2 Gy X射线治疗后24 h的γH2AX水平低于对照组,病灶较少(图5C)。总体而言,HSF1过表达的细胞表现出更强的放射抗性,并伴有放射后DNA修复的增加。进一步对HSF1过表达组/对照组和HSF1-KD组/对照组进行差异蛋白质组学分析,证实HSF1过表达促进DNA复制和细胞周期,而HSF1抑制导致细胞凋亡和DNA损伤反应(图5D)。辐射后CRC细胞的蛋白质组数据表明,HSF1过表达使CRC细胞更容易对辐射产生抗性(如细胞周期、DNA复制和染色质组织上调),相反,辐射后的HSF1-KD CRC细胞中,除了TNF α和凋亡生物过程外,他们观察到更高水平的自噬和溶酶体相关信号,这些结果表明,HSF1过表达增加了辐射抵抗,抑制HSF1可诱导自噬相关的细胞凋亡(图5E)。
辐照后12 h,上调蛋白主要富集于细胞周期调控、DNA合成和复制。这些结果揭示了HSF1-OE结直肠癌细胞存在脂质-染色质组织代谢-细胞周期调控的动态信号轴,并与辐射耐药有关(图5F)。进一步的ssGSEA显示,辐照后HSF1-OE组细胞周期ssGSEA评分逐渐升高,辐射后HSF1-KD组细胞周期ssGSEA评分逐渐降低。相反,自噬ssGSEA评分在辐照后HSF1-OE组逐渐降低,而在辐照后HSF1-KD组逐渐升高(图5G-H)。一些研究表明,自噬可以增强放疗的抗癌效果,从而促进辐射引起的细胞杀伤(定义为自噬性细胞死亡)。与HSF1-OE组相比,在辐照后1、2、12 h, HSF1-KD组的自噬明显增强(图5I),这一结果证实了HSF1抑制容易导致辐射引起的自噬细胞死亡。综上所述,辐射后HSF1表达与自噬ssGSEA评分呈负相关,与细胞周期ssGSEA评分呈正相关;细胞周期与自噬ssGSEA评分呈负相关(图5J)。他们观察到自噬标志物(ATG7和ATG9A)和凋亡调节因子(CASP6和PARP2)在HSF1-OE组在照射后1-12 h持续下调,并与照射剂量呈正相关,而脂代谢相关酶(AACS和DHCR7)、染色质组织相关酶(KDM2A和SETD2)和细胞周期蛋白(CDCA5和MCM4)在HSF1-OE组分别在照射后1、2和12 h上调(图5K)。综上所述,他们认为HSF1过表达驱动脂质-染色质组织代谢-细胞周期调控的信号轴,从而引发对放疗的耐药,而HSF1抑制容易产生细胞自噬死亡,从而促进对放疗的敏感性(图5L)。
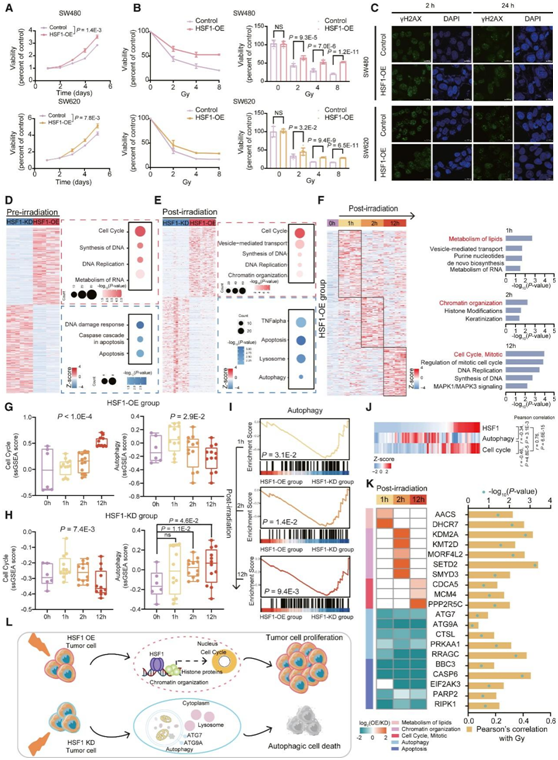
图5. HSF1表达对CRC细胞系放疗反应的影响。
(A) HSF1 过表达对 CRC 细胞增殖的影响。(B) CRC 细胞暴露于逐渐增加剂量的电离辐射(0、2、4 和 8 Gy),并通过 CCK8 对存活细胞进行定量。(C) HSF1-OE 和对照细胞中存在的代表性 γH2AX 病灶。(D-E) 辐射前后HSF1-OE 组和 HSF1-KD 组的差异蛋白和 KEGG 通路变化。(F) 与辐射前 HSF1-OE 组相比,辐射后 1、2 和 12 小时的差异蛋白和 KEGG 通路变化。(F) 与辐射前 HSF1-OE 组相比,辐射后 1、2 和 12 小时的差异蛋白和 KEGG 通路变化。(I) 与 HSF1-OE 组相比,HSF1-KD 组在辐射后 1、2 和 12 小时的自噬 GSEA。(J) HSF1 和 ssGSEA 评分与自噬和细胞周期的相关性。(K) HSF1-OE/KD 组中照射后 1、2 和 12 小时参与这些途径的关键蛋白的差异表达(左)。这些蛋白质与辐射剂量的Pearson相关性分析(右)。
06
NFYC 调控 Hub 蛋白 HDAC6 过度表达协同诱导西妥昔单抗耐药
随着靶向治疗的使用越来越多,更多试验相关研究表明,西妥昔单抗和贝伐珠单抗在 KRAS 中的临床疗效优于 CT 野生型和 KRAS 突变转移性 CRC。然而,西妥昔单抗和贝伐单抗的 ORR 仅为 50% 左右。因此,有必要探索相对耐药/敏感性机制并确定这些靶向治疗的预测标志物。在这里,他们构建了一个 CTT 亚队列,其中接受 FOLFOX 加西妥昔单抗治疗的患者最为常见。对于接受 FOLFOX 加西妥昔单抗治疗的患者,他们发现 S 组中有 64 个蛋白质上调,NS 组有 47 个蛋白质上调(图6A)。通路富集显示,PTEN 依赖性细胞周期停滞和凋亡、氧化磷酸化和中性粒细胞脱颗粒通路在 S 组中显著富集,而细胞周期相关通路包括 TNF α 通路、mRNA 剪接、RNA 转运和NS 组的 DNA 修复显著富集。此外,他们构建了蛋白-蛋白相互作用(PPI)网络并鉴定了核心蛋白,其中BAG2和HDAC6分别是S组和NS组的核心蛋白(图6B)。因此,他们提出BAG2和HDAC6是与西妥昔单抗敏感性/耐药性相关的重要核心蛋白。
为了验证HDAC6与西妥昔单抗耐药性的关联,他们分析了来自GSE59857数据集的接受相同治疗方案(FOLFOX +西妥昔单抗)的CRC患者CRC组织的细胞系的转录组和药理学特征。结果显示,在独立队列中,NS组HDAC6的表达显著升高,与本项研究的队列结果一致(图6C)。进行相关性分析鉴定出一组与HDAC6呈正相关的蛋白,这些蛋白主要参与增殖相关通路(图6D)。GSEA还验证了与HDAC6正相关的蛋白在细胞周期中显著富集(图6E)。与Human Protein Atlas数据库匹配,他们发现有160个TF与HDAC6呈正相关(图6D)。为了探索与HDAC6相关的西妥昔单抗耐药的潜在转录调控机制,他们比较了TF的蛋白质组谱。他们发现4个TF在S组和NS组之间有显著差异表达,其中NFC与HDAC6的相关性最高(图6F-G)。基于DepMap的CRC细胞系数据,他们观察到一致的结果,进一步验证了NYFC与HDAC6之间的关联(图6H)。
他们还在一个独立队列中进行了PRM分析,该队列包括45名接受FOLFOX +西妥昔单抗治疗的患者。NFC和HDAC6在NS组也显著升高,且有显著正相关(图6I)。此外,他们还在GSE59857数据集中验证了NS组中NFYC上调,相关分析显示NFYC与HDAC6之间存在显著正相关(图6J)。此外,他们在JASPAR开放访问数据库的基础上,通过在Ensembl中沉积的NFYC结合域矩阵进行了分析。JASPAR分析显示,HDAC6在其DNA转录调控区具有2个推测的NFYC结合位点(GGCCAATAATA和TTCCACTCAGA),同源性高于80%),这为西妥昔单抗靶向治疗提供了潜在的间接转录抑制靶点。更直接的是,免疫组化显示在接受西妥昔单抗治疗的患者中,S组和NS组之间HDAC6的表达有显著差异(图6K),证明了西妥昔单抗耐药患者的直接抑制靶点。综上所述,由TF NFYC调控的HDAC6可通过诱导肿瘤增殖协同导致西妥昔单抗耐药(图6L)。因此,他们提出了一种潜在的策略,西妥昔单抗联合HDAC6抑制剂(如tubastatin A、ACY-241和nexturastat),可以提高西妥昔单抗治疗在临床上的疗效。
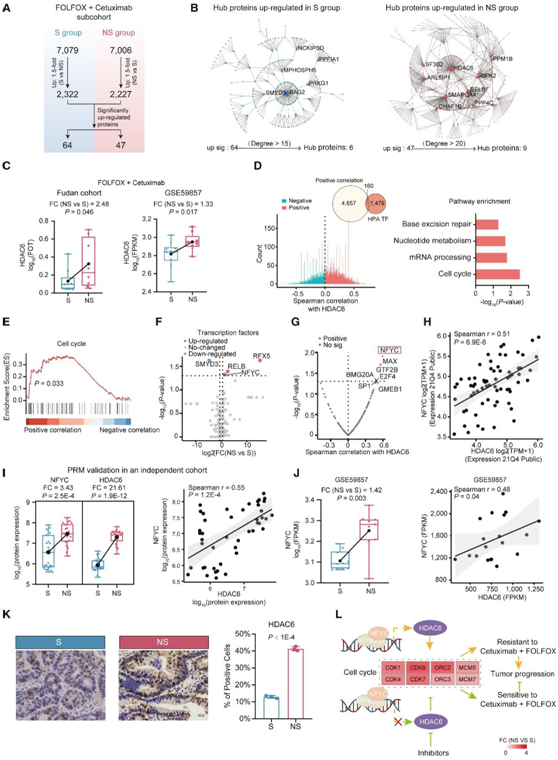
图6. FOLFOX+西妥昔单抗亚组敏感组和非敏感组中蛋白质和通路的差异表达。
(A) FOLFOX 加西妥昔单抗亚组中 S 组和 NS 组之间的差异蛋白。(B) S/NS 组中中枢蛋白的 PPI 网络上调。(C) HDAC6在复旦队列中S组和NS组的差异表达和GSE59857数据集。(D) 图表显示与 HDAC6 呈正相关或负相关的蛋白质以及这些蛋白质所涉及的通路。(E) GSEA 富集与 HDAC6 正相关的蛋白质。(F) S 组和 NS 组中 TF 的差异表达。(G) TF 与 HDAC6 的相关性。(H)基于DepMap数据的NFYC和HDAC6的关联。(I) HDAC6 和 NFYC 的差异表达(左)及其相关性(右)。(J) GSE59857数据集中S组和NS组NFYC的差异表达以及NFYC与HDAC6的相关性。(K) 代表性示例中 IHC 染色的 HDAC6 的鉴定。(L) 示意图表明 HDAC6 响应西妥昔单抗治疗的潜在调节。
07
CRC CT、放化疗和靶向治疗预测模型的构建和验证
在提出了个体化治疗指导的潜在敏感或耐药机制后,他们下一步研究了DEP是否可以区分对FOLFOX治疗、FOLFOX加放疗和FOLFOX加西妥昔单抗有应答的S组患者和NS组患者(图7A)。在这些DEP的基础上,他们通过逐步逻辑回归确定了一个特征子集,可以准确区分S组患者和NS组患者对这些治疗的反应。为了对模型进行训练和后续测试,在响应组的基础上对样本进行划分,80%的样本作为训练集,剩下的20%作为独立的测试集。基于这些 S/NS 特征(FOLFOX;FOLFOX 加放射治疗;FOLFOX 加西妥昔单抗),他们对训练集应用 10 倍交叉验证来评估性能(图7B)。当应用于独立测试集样本时,三个预测模型在三个子队列中分别实现了 0.88、1 和 0.75 的高精度(图7B)。
热图显示,在三个独立的亚队列中,S组和NS组之间存在明显的分离(图7C)。此外,他们在PRM量化数据的基础上,通过准确度指标和受试者工作特征(ROC)分析进一步验证了预测模型,在FOLFOX、FOLFOX +放疗和FOLFOX +西图昔单抗亚队列中分别获得了0.93、0.93和0.96的高精度。此外,ROC曲线显示出较高的预测敏感性和特异性,这些亚队列的AUC值分别为0.99、0.94和0.99(图7C)。总的来说,这些特征蛋白的预测能力在独立验证队列中通过 PRM 测定得到了进一步验证。此外,这些预测模型在CT、CRT和CTT中表现出良好的性能,表现出稳健性、准确性和普适性。
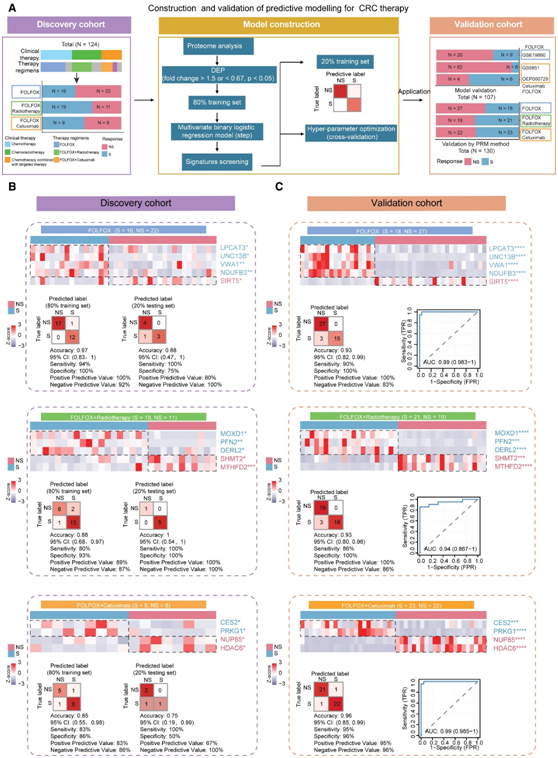
图7. 预测分类器的构建和验证。
(A) 描述 CRC 治疗预测模型的构建和验证的图表。(B) 热图显示预测模型特征的差异表达。(C) 热图、分类误差矩阵和 ROC 曲线,显示三个独立子队列中使用 PRM 方法量化的特征的差异表达。
+ + + + + + + + + + +
结 论
本项研究对来自接受化疗、放化疗或化疗联合靶向治疗的 CRC 患者的 254 个肿瘤组织的蛋白质组进行了分析。基于蛋白质组的分类揭示了四种具有不同生物学和治疗特征的亚型。 CRC细胞系和临床样本的综合分析表明,免疫调节与药物敏感性显著相关。 HSF1可以增加DNA损伤修复和细胞周期,从而诱导对辐射的抵抗力,而HDAC6的高表达与西妥昔单抗的反应呈负相关。此外,他们开发了高精度的预后模型来预测治疗反应,并通过独立验证队列中的PRM分析进一步验证。这项研究为研究结直肠癌放化疗和靶向治疗的机制和指标提供新的理论依据。
+ + + + +



 English
English


