文献解读|Nat Microbiol(20.5):帕金森病药物恩他卡朋通过铁隔离破坏肠道微生物群稳态
✦ +
+
论文ID
原名:The Parkinson’s disease drug entacapone disrupts gut microbiome homeostasis via iron sequestration
译名:帕金森病药物恩他卡朋通过铁隔离破坏肠道微生物群稳态
期刊:Nature Microbiology
影响因子:20.5
发表时间:2024.11.21
DOI号:10.1038/s41564-024-01853-0
背 景
最初设计用于专门针对人体细胞的药物通常也会影响微生物。由于胃肠道吸收不良和/或胆汁分泌不良,许多此类药物到达大肠,在那里它们遇到并可能与数百至数千种不同的微生物物种发生相互作用,这些微生物物种在人体生理学的各个方面发挥着重要作用。事实上,一些队列研究已经报告了药物的使用与肠道微生物组成和功能变化之间的显著关联。一项具有里程碑意义的研究评估了 835 种人靶向药物对 40 种培养的肠道微生物的抗菌作用,结果显示相当大比例 (24%) 的药物可以在体外抑制至少一种肠道细菌菌株的生长。另一项研究通过宏蛋白质组学测试了较小组药物对粪便样本的影响,结果表明,绝大多数测试药物均具有选择性抗和/或促微生物活性,而且相当一部分药物也会改变微生物组组成。值得注意的是,这项研究表明,细菌功能可能会因药物而发生变化,而分类单元的丰度不会发生变化,因此强调在研究药物影响时需要使用丰度以外的指标。重要的是,微生物组和药物之间的相互作用是双向的,许多研究清楚地表明肠道微生物也可以主动代谢,并且在某些情况下生物累积药物。虽然到目前为止已有多项研究揭示了微生物驱动的药物转化的性质和程度,但针对人类的药物对微生物组影响的机制细节仍有待阐明。
实验设计
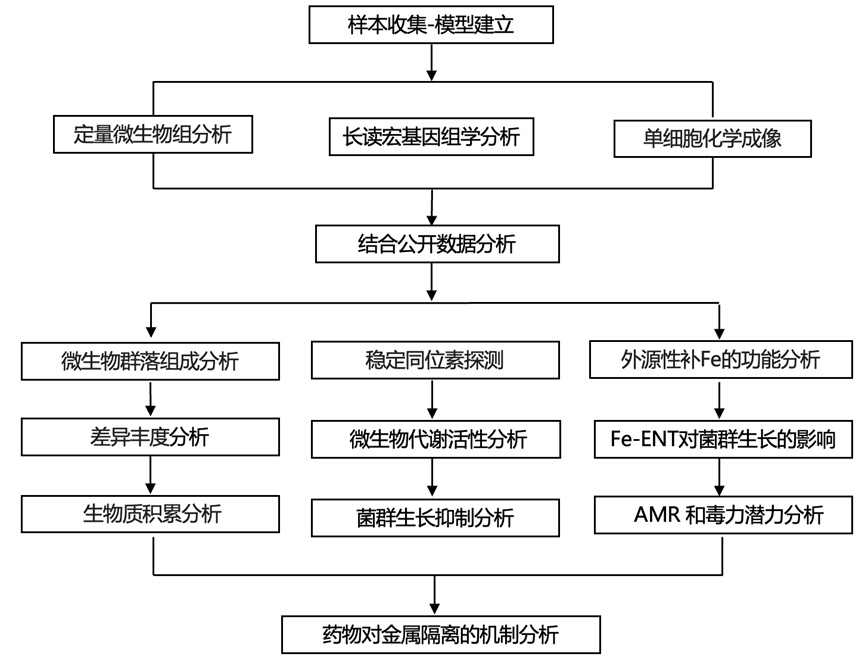
结 果
01
针对神经系统的药物影响微生物群
为了评估恩他卡朋 (ENT) 和琥珀酸洛沙平 (LOX) 对整个肠道微生物群落的影响,研究团队将从六个健康成年人身上采集的新鲜粪便样本与两种药物浓度[低浓度和高 (Hi) 浓度]一起培养(图1a)。与所有其他测试条件相比,补充 ENT-Hi 可显著减少微生物细胞的数量(图1b)。通过 16S 核糖体 RNA 基因扩增子测序分析发现,在 ENT-Hi、LOX-Hi 和 LOX-Low 处理后,微生物群落组成发生了重大变化(图1c),而在 ENT-Hi 的情况下,这些变化还伴随着 alpha 多样性的变化。
通过将微生物总数与 16S rRNA 基因扩增子测序数据整合,他们确定了所有检测到的分类群的绝对丰度(图1d)。重要的是,绝对丰度数据证实,所采用的培养条件使粪便样本中最初存在的几乎所有分类群的丰度增加(图1e),从而可以追踪药物引起的活动和微生物组成员的丰度变化。与二甲基亚砜 (DMSO) 对照相比,ENT-Hi 和 LOX-Hi 样品中拟杆菌属和Clostridium sensu stricto 1的绝对丰度均降低(图1d)。然而,许多检测到的效应是药物特异性的,ENT-Hi 降低了Anaerostipes、Fusicatenibacter、Ruminococcus torque、 Eubacterium hallii、Erysipelotrichaceae UG-003 和Roseburia的总丰度,而 LOX-Hi 增加了这些属的总丰度。几个属的丰度仅在 ENT-Hi 的作用下发生了显著变化:Escherichia-Shigella和Ruminococcus 的丰度增加,而Alistipes 属、Streptococcus或Blautia属的丰度减少(图1d-e)。当使用不同的营养丰富的培养基 (BHI) 与相同的六个供体进行孵化以及使用来自另外三个个体供体的样品进行的额外孵化时,也可以观察到ENT-Hi 对微生物生物量积累和整体群落组成的类似影响。
差异丰度分析表明,培养 24 小时后,29.4% 的 16S rRNA 基因扩增子测序变体 (ASV) 的丰度受到 ENT-Hi 的显著影响,11.8% 的 ASV 受到 LOX-Hi 的影响,而只有 3.6% 和 6.0% 的 ASV 分别受到 ENT-Low 和 LOX-Low 的影响。有趣的是,LOX-Low 导致的生长抑制模式与将相同药物添加到纯培养中生长的肠道成员时观察到的模式不同,在纯培养中,它仅特异性地抑制拟杆菌的生长。这些结果表明,在整个所检测的微生物群落背景下,其他革兰氏阴性菌和几种革兰氏阳性菌都会受到 LOX-Low 的影响。这些包括丹毒丝菌科属、颤螺菌科属。和毛螺菌科属,表明在群落中对洛沙平存在交叉致敏。对于 ENT-Low,只有极少数生物受到显著影响,其中大多数是厚壁菌门,这与之前的报告一致。
对粪便样本进行长读宏基因组测序,他们总共检索到了 1049 个宏基因组组装基因组 (MAG)。通过将 ASV 与包含 16S rRNA 基因的 MAG 联系起来,可以以更高的分类学分辨率跟踪药物驱动的群落变化(图1e-f)。这表明,在 ENT-Hi 中蓬勃发展的大肠杆菌和瘤胃球菌类群的 ASV 可以精确匹配大肠杆菌和R. bromii基因组中的 16S rRNA 基因。这些分析还表明,LOX-Hi 条件选择性地促进了Mediterraneibacter faecis、Faecalibacillus faecis和Blautia_A等类群的生长。高浓度任一药物的存在完全或部分抑制梭状芽胞杆菌sp900539375(基于 SILVA 分类学的Clostridium sensu stricto 1)和几种拟杆菌属物种[B.uniformis、B.stercoris、Phocaeicola dorei(以前称为B. dorei)和P. vulgatus(以前称为B.vulgatus)]。 ENT-Hi 比 LOX-Hi 更明显(图1e-f)。另一方面,普氏菌属sp900546535 和几种革兰氏阳性菌,如链球菌、柯林斯菌、长双歧杆菌、Mediterraneibacter faecis和粪杆菌,仅由 ENT-Hi 抑制生长(图1e-f)。总之,这些结果揭示了生理浓度的恩他卡朋和洛沙平在短期内对微生物组成和丰度具有强烈但不同的影响,恩他卡朋的影响比洛沙平更明显。

图1. 粪便样本的药物补充会影响生物质积累和微生物组成。
(a) 粪便样本与药物恩他卡朋 (ENT) 和洛沙平 (LOX) 孵育的示意图。(b) 总微生物细胞负荷。(c-d) 粪便微生物群落的相对和绝对属丰度谱,并通过 16S rRNA 基因扩增子测序进行评估。(e) 热图显示所有样本中检测到的 25 种最丰富的 ASV 的绝对丰度。(f) 16S rRNA 基因序列与(e)中显示的 ASV 匹配的 MAG。
02
针对神经系统的药物改变微生物代谢
接下来,他们在单细胞水平上评估了这些药物对微生物活动的影响。为了确定药物引起的微生物活动变化,他们在培养液中添加了重水 (D2O) 作为通用代谢示踪剂(图1a)。可以使用受激拉曼散射光谱 (SRS)检测和量化单个微生物细胞从D2O中掺入氘 (D) 产生的 CD 键。他们之前已成功将 SRS 与荧光原位杂交 (FISH) 相结合,通过高通量技术确定肠道微生物组对糖的反应。使用优化的 SRS-FISH 平台,该平台提供比以前的设置更高的通量和灵敏度,他们在药物和对照存在下孵育 6 和 24 小时后测量了约 8000 个单个微生物细胞(图2a-b)。在用 ENT-Hi 孵育的样品中检测到了意外的非振动信号,因此这些样品可排除在活性测量之外,并进一步探究该信号的来源。正如预期的那样,在没有药物的情况下,几乎所有分析的细胞都检测到在培养基中具有活性,90%和 98%的细胞在孵育 6 小时和 24 小时后分别显示高于阈值的 %CD SRS值(图2b)。添加 ENT-Low、LOX-Low 或 LOX-Hi 均导致总活性细胞比例显著降低,单细胞代谢活性也显著降低。LOX-Hi 的降低更为明显,其次是 LOX-Low 和 ENT-Low(图2b)。因此,这些药物明显影响了群落内的微生物活性,即使在短时间培养后,在未检测到对其总体丰度产生影响的条件下也是如此(图1b)。
为了检测复杂群落中微生物组中特定种群的活性,他们使用 SRS-FISH 针对了六个不同的丰富分类单元,这使他们能够确定这些分类单元中单个细胞的活性。目标分类单元包括其丰度受到药物负面影响和正面影响的生物。LOX-Low 和 LOX-Hi 孵育均显著降低了除大肠杆菌以外所有目标肠道微生物群成员的活性(图2d)。有趣的是,Clostridium sp900539375、B. uniformis、Ruminococcus bromii和P. dorei在 LOX 处理中表现出活性降低,但只有P. dorei和Clostridium sp900539375的丰度受到负面影响(图2d-e)。LOX-Low 和 LOX-Hi 似乎在 6 小时内强烈抑制P. dorei 的生长(图1e),可能导致该分类单元的大多数细胞无法通过 FISH 检测到,因为非活性细胞的低核糖体含量阻碍了 FISH 检测。他们推测只有少数耐药P. dorei细胞仍然具有足够的活性可以通过 FISH 检测到,而且这些细胞的活性没有受到强烈影响(图2c-d)。在链球菌属中检测到了类似的活性下降,但在这种情况下,令人惊讶的是,在 6 小时后,活性的下降伴随着丰度的略微增加(图2d-e)。然而,从 6 到 24 小时,与对照组相比,在 LOX 存在下,Clostridium sp900539375、B. uniformis 和Streptococcus lutentiensis MAG所代表的种群数量有所减少(图1e-f),这可能是由于 SRS 在 6 小时的 LOX 条件下检测到的活性较低所致。
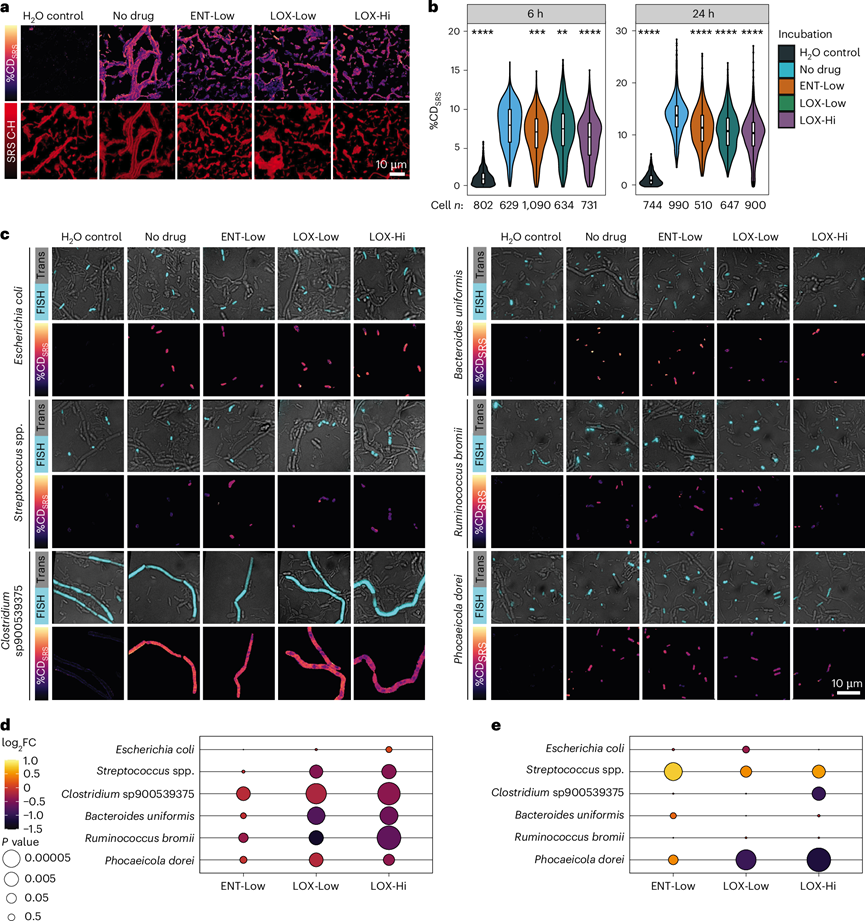
图2. 通过 SRS 氘掺入测量药物孵育单微生物组细胞的代谢活性。
(a) 代表性SRS图像。(b) 每个分析样本中的单细胞%CD SRS值。(c) 将药物孵育的粪便样本与不同细菌的荧光标记寡核苷酸探针杂交。(d) 气泡图表示 FISH靶向的分类群在 6 小时时与“无药物”孵育相比,用药物孵育的活性水平。(e) 气泡图表示 FISH 靶向的分类群在 6 小时时与“无药物”孵育相比,用药物孵育的绝对丰度。
03
恩他卡朋在微生物群细胞中生物积累
研究表明肠道微生物会对某些药物进行生物累积,从而导致周围环境中的药物耗尽。由于 ENT-Hi 样品在 SRS 泵探测检测期间显示出强烈的非特异性拉曼信号,他们探索了该信号的来源并得出结论,它是光热 (PT) 信号,源自恩他卡朋在微生物细胞内的生物累积。通过对比来自 ENT-Hi 样品和对照的 PT 信号强度(图3a),他们发现恩他卡朋的荧光信号主要出现在与药物共孵育后经洗涤再固定的微生物细胞中,而在先固定后孵育药物(即死细胞)中几乎检测不到该信号(图3b-c)。在同一细胞中测量时,恩他卡朋的积累和细胞活性之间没有很强的相关性,但是恩他卡朋蓄积量高的细胞活性往往较低(图3d)。
为了确定主要的药物积累类群,他们进一步研究了上述 FISH 探针所针对的种群中恩他卡朋的分布情况(图3e)。所有目标种群均显示出不同强度的恩他卡朋信号。虽然P. dorei和(程度较轻的链球菌属和大肠杆菌)似乎是强的恩他卡朋积累者,但只有一小部分R. bromii和部分B. uniformis种群积累了恩他卡朋(图3e-f)。在 FISH 非针对的细胞中也检测到了高的恩他卡朋信号(图3e-f)。他们进一步证实了P. dorei在纯培养中生长时积累恩他卡朋的能力。有趣的是,虽然恩他卡朋的积累极大地抑制了P. dorei作为微生物群落成员和纯培养物的生长,但它对群落中链球菌的生长却没有产生同样程度的影响,甚至还促进了大肠杆菌的生长(图3f-g)。因此,药物的生物累积与某些分类群的生长抑制相关,而其他分类群的生长不受影响甚至受到刺激。
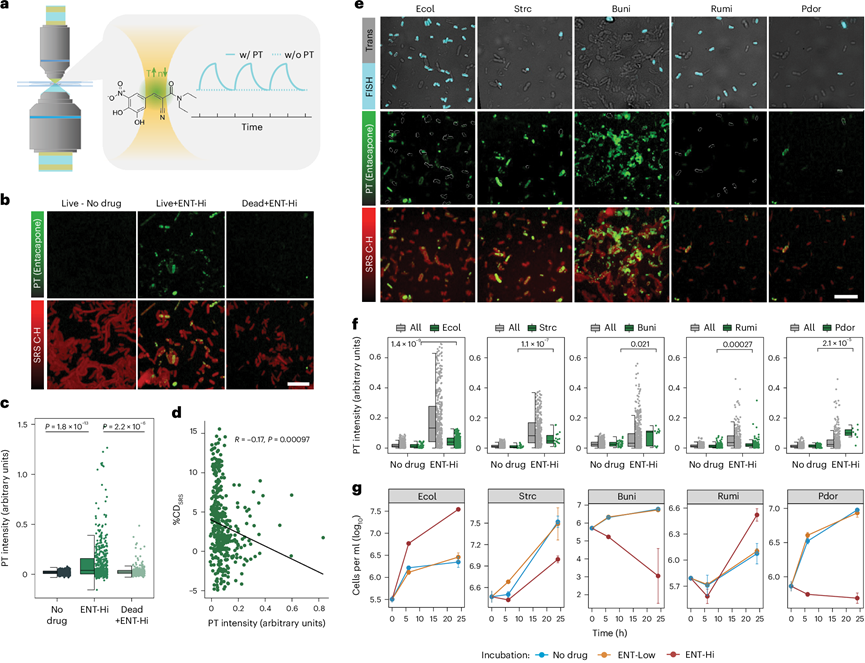
图3. 微生物细胞中恩他卡朋生物累积的光热成像。
(a) 时间依赖性信号示意图。(b) 恩他卡朋 (PT) 的光热信号强度分布。(c) 单细胞光热信号强度分布。(d) 暴露于 ENT-HI 6 小时的微生物细胞的活性(%CD SRS)和 PT 信号强度之间的相关性。(e) 6 个粪便样本的原始混合物的代表性图像。(f) 单细胞光热信号分布。(g) 无药物、Ent-Low 和 ENT-Hi 孵育条件下 FISH 所针对的分类群的绝对丰度。
04
恩他卡朋螯合铁并诱导铁缺乏
恩他卡朋的硝基儿茶酚基团可以作为双齿配体,通过儿茶酚酸根氧原子与过渡金属离子三价铁 (Fe(III)) 螯合并形成稳定的三价铁配合物。使用广泛用于检测溶液中 Fe 螯合剂的分析方法,他们证实了恩他卡朋能够螯合三价铁[Fe(III)](图4a)。恩他卡朋与 Fe 结合的稳定常数 [pFe(III) = 19.3]已证明与其他已知铁螯合剂如 2,2′-联吡啶[pFe(III) = 21.5]的常数相似。预计恩他卡朋还能以相当高的亲和力与二价铁[Fe(II)]络合,但预计不会与任何其他金属阳离子形成强配合物,这些结果证明恩他卡朋不与亚铁结合。
铁是肠道中的一种限制性营养物质,对大多数肠道微生物的生长至关重要。粪便中的铁浓度估计为 ~60 μM,本文用于粪便样品培养的 sM9 培养基含有相似浓度的铁(31 μM)。由于大肠中恩他卡朋的估计浓度大约高出两个数量级(1965 μM),他们推测 ENT-Hi 对微生物生长的抑制作用可能与其通过螯合剥夺肠道微生物铁的能力直接相关,类似于已记录的其他 Fe(II) 和 Fe(III) 螯合剂。为了验证这一假设,他们在存在 ENT-Hi 或 Fe 负载的 ENT-Hi 的情况下培养了受 Ent-Hi 严重影响的肠道共生菌B. thetaiotaomicron(图4b)。值得注意的是,在预络合反应中,FeSO4中的 Fe(II)暴露于药物溶剂 DMSO,导致瞬间氧化为 Fe(III)。因此,ENT-Hi 与 FeCl3或 FeSO4的预络合均产生载 Fe(III) 的恩他卡朋。ENT-Hi 抑制了B. thetaiotaomicron的生长,而与铁预复合的 ENT-Hi 则不会抑制 B. thetaiotaomicron 的生长,从而使B. thetaiotaomicron能够正常生长(图4b)。这是因为铁饱和的螯合剂不再能够复合培养基中(或细胞内)存在的游离 Fe(II)[或 Fe(III)],从而使细菌能够获取铁并正常生长。最初,他们预计在厌氧条件下添加的铁大多以较低氧化状态存在。令人惊讶的是,在添加了FeSO 4的培养基中对 Fe(II) 进行定量分析后发现,虽然存在厌氧环境且存在 0.1% (w/v) l-半胱氨酸作为还原剂,但添加的 Fe(II) 很快氧化成 Fe(III),这可能是由于培养基中存在磷酸盐。仅添加 ENT-Hi,然后添加越来越多的铁 (FeSO4),可减轻 ENT-Hi 对B. thetaiotaomicron的抑制作用(图4b)。添加类似量的铜离子[Cu(II)]不能逆转 ENT-Hi 的生长抑制作用(图4b),证实了观察到的效果是铁所特有的。总之,这些结果表明,单独补充 Fe(III) 或补充 ENT-Hi:Fe 复合物可挽救 ENT-Hi 对B. thetaiotaomicron的抑制作用,这强烈表明恩他卡朋会导致铁限制。
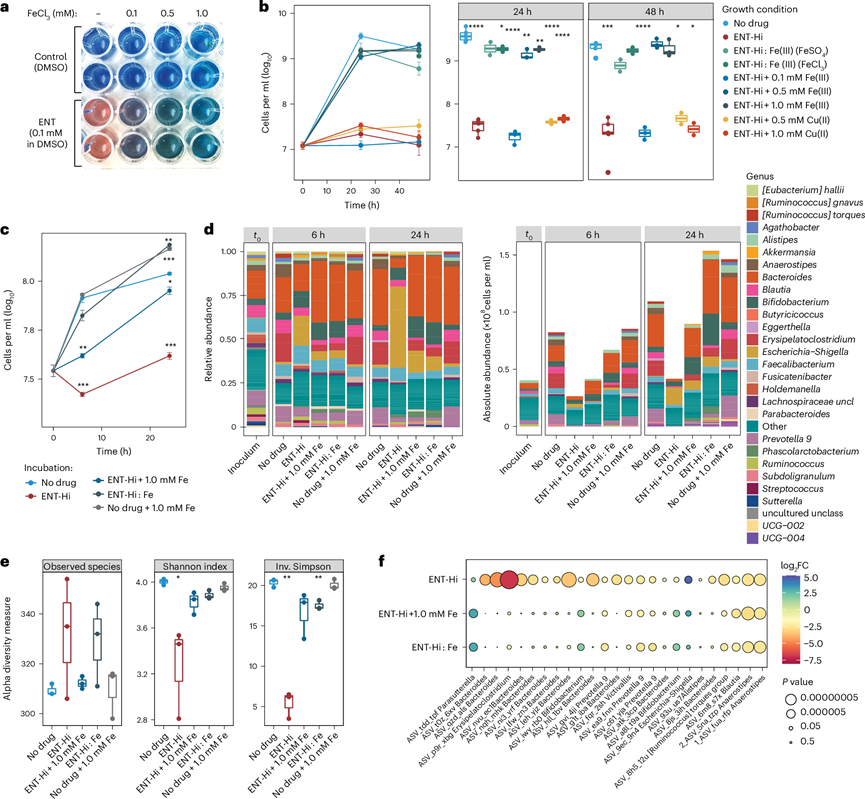
图4. 补铁可挽救恩他卡朋对肠道微生物群的影响。
(a) 铁载体检测试验显示在存在 0.1 mM 恩他卡朋的情况下颜色发生了变化。(b)细菌生长分析。(c) 粪便样本(来自 5 名捐赠者的混合物)中的总细胞负荷。(d) 微生物群落的相对(左)和绝对(右)属丰度谱。(e) 培养 24 小时后肠道微生物群落的 Alpha 多样性指标。(f) 气泡图表示相对于对照培养的 25 种最丰富的 ASV 的绝对丰度。
为了确定上述结果是否也适用于复杂的微生物群,他们在图1a所示的等效条件下培养粪便样本。与单独使用B. thetaiotaomicron获得的结果一致,向整个微生物群补充载铁的 ENT-Hi 或先补充 ENT-Hi 再补充铁,可完全或接近完全逆转对微生物生物量积累的抑制作用(图4c-d)。补充 Fe(III) 可逆转 ENT-Hi 对群落 alpha 多样性指标的影响,以及对几乎所有受影响最大的前 25 个分类单元的生长的影响(厚壁菌门如Anaerostipes和Blautia除外)(图4e-f)。补充铁不仅能使受恩他卡朋负面影响的分类群生长,而且似乎还能限制由 ENT-Hi 促使的大肠杆菌等生物的加速扩张(图1e,图5a-d)。重要的是,他们证实这种影响不是由于细胞吸收降低造成的,因为 ENT-Hi:Fe(III)在微生物细胞中的生物累积水平与 ENT-Hi 单独使用的水平相同或更高,从而表明 ENT-Hi:Fe(III)复合物在渗透和在细胞中积累的能力方面与恩他卡朋相似。微生物细胞和恩他卡朋蓄积菌种P. dorei在暴露于恩他卡朋时显示出比未暴露于恩他卡朋的细胞高得多的铁含量,这强烈表明 ENT-Hi:Fe(III)复合物是稳定的并能到达细胞空间(图5d-f)。然而,许多细胞可能由于无法从恩他卡朋复合物中释放铁而挨饿。总之,这些结果表明,恩他卡朋与限制性营养铁的络合是导致恩他卡朋对微生物组产生强烈抑制作用的主要机制。
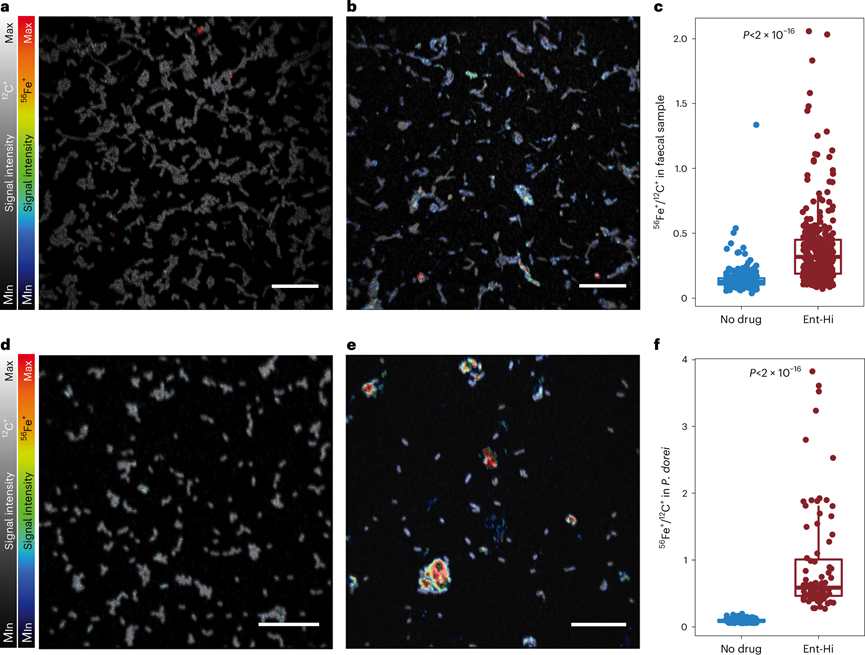
图5. 暴露于恩他卡朋的微生物细胞显示出更高的铁含量。
(a-b) 信号强度的NanoSIMS 叠加图像。(c) 离子信号强度比。(d-e) 信号强度的NanoSIMS 叠加图像。(f) 离子信号强度比。
05
恩他卡朋促进铁清除大肠杆菌的生长
接下来,他们探究了少数土著微生物组成员在 ENT-Hi 诱导的铁限制条件下茁壮成长的能力。已知几种共生和致病肠杆菌科细菌(包括大肠杆菌)能够合成和释放与 Fe(III) 高亲和力结合的铁载体,从而增强其肠道定植。ENT -Hi 培养中最主要的生物是归类为大肠杆菌_D 42 的大肠杆菌菌株,他们从中获得了完整的 MAG(bin.187)。在大肠杆菌_D MAG中搜索参与铁载体合成的基因,他们发现了一整个基因聚类,该基因聚类编码了铁载体肠杆菌素的合成、输出和输入所必需的蛋白质(图6a)。因此,他们推测大肠杆菌产生肠杆菌素的能力使其能够在 ENT-Hi 诱导的铁限制条件下生长。事实上,从甘油保存的 ENT-Hi 培养物中分离出高度相似的大肠杆菌菌株(分离株 E2)后,可以确认它在存在 ENT-Hi 的情况下在基本培养基中生长的能力(图6b)。同样,ENT-Hi 补充对野生型大肠杆菌K12 菌株 BW25113的生长没有显著影响,但它显著降低了编码肠杆菌素生产所需蛋白质的 BW25113 缺失突变体的生长(entB)或肠杆菌素吸收(fepA)(图6c)。在恩他卡朋存在下,fepA突变体的生长水平高于entB突变体,这可能是因为吸收了与铁复合物的肠杆菌素分解产物,而铁可能通过其他受体进入细胞。正如预期的那样,在生长培养基中添加肠杆菌素可挽救恩他卡朋引起的entB生长缺陷,但不能挽救fepA突变体生长缺陷(图6c)。这些结果有力地支持了在恩他卡朋存在的情况下,肠杆菌素的合成和/或输入是最佳生长所必需的,因此,恩他卡朋的存在会导致铁限制。肠杆菌素与三价铁的螯合亲和力比恩他卡朋高得多[pFe(III) = 49],这些结果表明,它使大肠杆菌能够清除并获得足够的铁,以在恩他卡朋诱导的铁限制条件下维持其生长(图6d)。有趣的是,他们在 ENT-Hi 条件下蓬勃发展的Ruminococcus菌株的 MAG 中没有发现任何参与已知铁载体产生的基因,但他们发现了一个基因,该基因编码了鼠疫耶尔森氏菌中螯合铁运输所需的膜蛋白 YfeB 的直系同源物。因此,他们推测Ruminococcus通过导入载铁的铁载体或其他铁螯合分子,或通过产生其他高亲和力的铁结合蛋白在补充恩他卡朋的培养基中扩增(图6d)。
在致病性或致病菌菌株中通常观察到铁载体的产生和铁清除作用,这些菌株也倾向于编码其他毒力特性。对MAG 目录进行筛查以查找毒力因子和抗菌素耐药性 (AMR) 基因,发现在检索到的肠道 MAG 中存在多样化的 AMR 和毒力基因,即使这些样本来自健康个体。ENT-Hi 导致粪便微生物群中 AMR 和毒力的丰度增加(图6e)。这种增加在很大程度上是由E. coli_D丰度的增加所驱动的,其基因组编码了总共 14 个 AMR 和毒力基因,此外还有至少一个铁载体生产聚类,从而表明该生物具有致病潜力。虽然不能排除 AMR 和毒力指数增加是由于大肠杆菌与其他分类群相比基因组表征改善的可能性,但这些结果表明 ENT-Hi 促进了具有相关致病潜力的铁清除生物的生长。
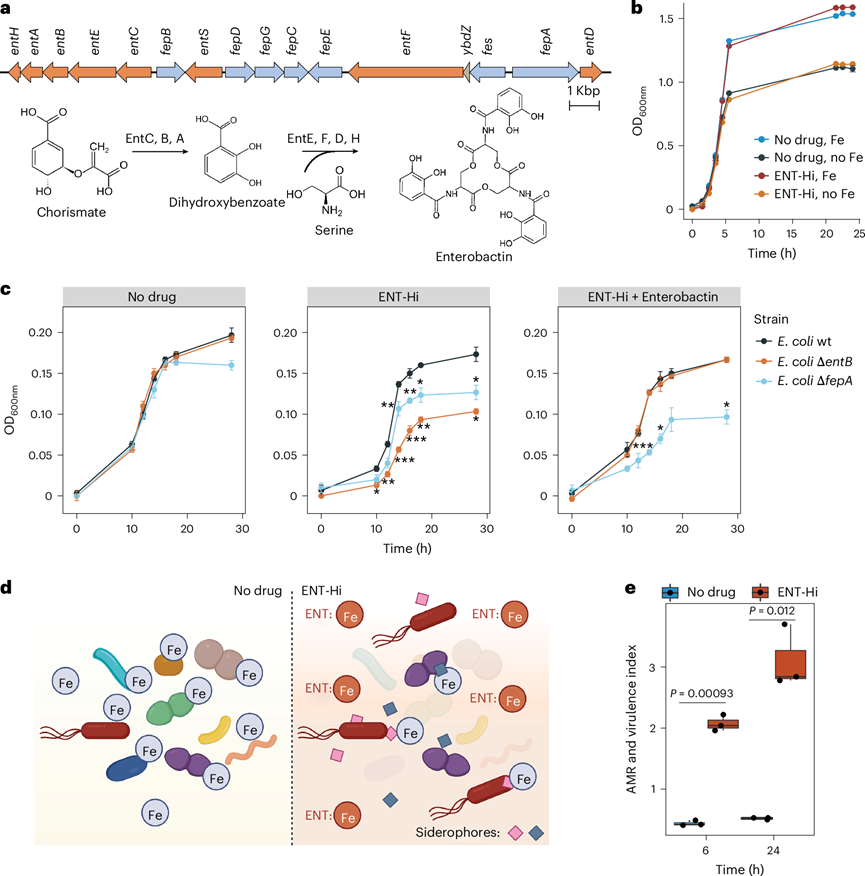
图6. 恩他卡朋诱导的铁限制条件选择了铁载体生产者并导致粪便微生物群中 AMR 和毒力潜力的增加。
(a) 大肠杆菌D bin.187中肠杆菌素生物合成基因座的遗传组织。(b) 大肠杆菌分离株E2的生长情况。(c) 细菌生长情况分析。(d)实验设计示意图。(e) 无药物对照和恩他卡朋 (ENT-Hi) 处理样本的AMR 和毒力指数增加。
+ + + + + + + + + + +
结 论
本研究结合了定量微生物组分析、长读宏基因组学、稳定同位素探测和单细胞化学成像,以研究两种广泛处方的药物对肠道微生物群的影响。将生理相关浓度的恩他卡朋(一种治疗帕金森病的药物)或洛沙平琥珀酸盐(用于治疗精神分裂症)与人类粪便样本一起体外孵育。这两种药物都显著影响微生物活性,而不是微生物丰度。从机制上讲,恩他卡朋可以消耗可用的铁,导致肠道微生物组组成和功能发生变化。通过补充微生物可利用铁水平可以挽救微生物的生长。此外,恩他卡朋诱导的铁饥饿选择了编码抗菌素耐药性和毒力基因的铁清除肠道微生物组成员。这些发现揭示了两种尚未充分研究的药物对整个微生物群的影响,并确定金属螯合是药物引起微生物群紊乱的一种机制。
+ + + + +



 English
English


