文献解读|Signal Transduct Target Ther(52.7):全面的基因组和转录组分析揭示食管鳞状细胞癌的预后分层
✦ +
+
论文ID
原名:Comprehensive genomic and transcriptomic analyses reveal prognostic stratification for esophageal squamous cell carcinoma
译名:全面的基因组和转录组分析揭示食管鳞状细胞癌的预后分层
期刊:Signal Transduction and Targeted Therapy
影响因子:52.7
发表时间:2025.07.17
DOI号:10.1038/s41392-025-02306-8
背 景
食管癌是全球最致命的恶性肿瘤之一,发病率位居第 11 位,癌症相关死亡率位居第 7 位,全球报告的新病例估计为 510716 例,死亡人数为 445129 人。食管鳞状细胞癌(ESCC) 是中国食管癌的主要组织学亚型,约占诊断总数的 85% 至 90%。虽然手术技术、化疗方案和围手术期护理有所改进,但 ESCC 的预后仍然不佳。许多患者确诊时已为晚期,即使在根治性食管切除术后仍会出现局部区域复发或远处转移。此外,ESCC 表现出明显的肿瘤间和肿瘤内异质性,缺乏明确的分子亚型和明确的驱动突变,患者的临床结果差异很大。这些限制阻碍了有效靶向治疗的开发和不理想的临床管理。
实验设计
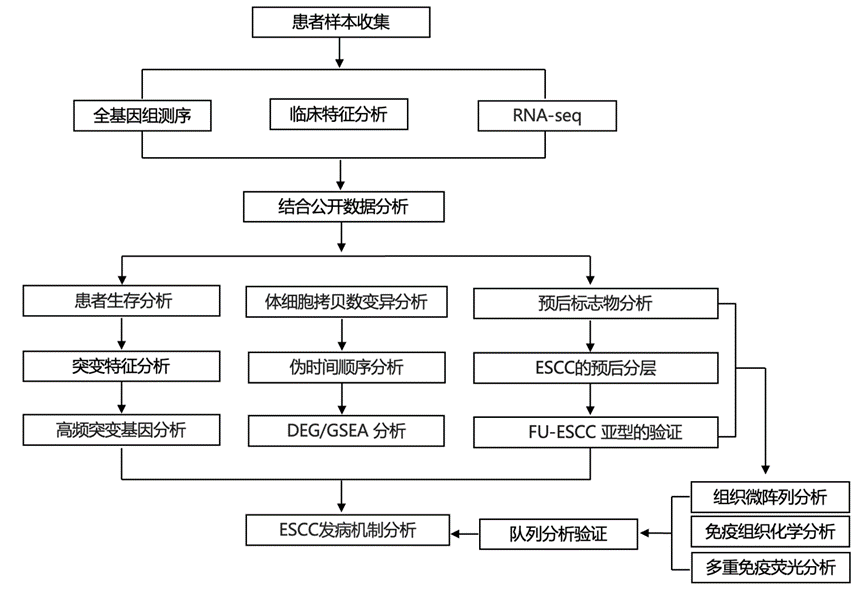
结 果
01
患者队列临床特征
研究队列包括从 ECTOP-2002 随机对照试验(队列 1)中收集的 203 对未经治疗的食管鳞状细胞癌 (ESCC) 肿瘤和邻近非肿瘤组织。这些样本来自 203 例食管切除术后的 ESCC 患者,随访时间最短为 5 年(平均 68.7 个月;中位数:71 个月)(图1a)。对配对组织进行全基因组测序 (WGS) 和转录组分析(RNA-seq),以进行深入的分子分析。此外,还制备了来自独立验证队列(队列 2)的福尔马林固定石蜡包埋 (FFPE) 组织样本,用于多重免疫荧光 (mIF) 和其他下游分析。大多数患者归类为 II 期(36.9%)或 III 期(41.9%),整个队列的中位年龄为 68 岁(图1b-c)。病理分期越晚,复发率越高(图1d),吸烟和饮酒史的患病率也越高(图1e-f),后期男性患者比例较大(图1g)。203 名患者中,144 名(70.9%)的 ESCC 位于胸段食管中 1/3,59 名(29.1%)位于下 1/3。41% 的患者接受了化疗,24% 的患者接受了术后放疗,这些治疗主要在晚期患者中使用。在随访期间,放疗和化疗均未显著影响 II 期和 III 期患者的复发率或总生存期 (OS)(图1h-i)。放疗对 IV 期患者的 OS 有益(图1i)。在所有患者中,5 年 OS 因分期而异,I 期患者的 5 年 OS 为 87%,II 期为 77.8%,III 期为 60.8%,IV 期为 45.8%(图1j)。同样,5 年无病生存率 (DFS) 在 I 期为 82.6%,II 期为 70%,III 期为 52.3%,IV 期为 29.4%(图1k)。值得注意的是,LNM 成为影响患者预后和复发风险的关键因素(图1l-n)。

图1. 研究的总体设计和临床特征。
(a) 研究设计示意图。(b) ESCC患者的临床分期分布。(c-g) 年龄、性别、吸烟史、饮酒史和不同病理分期疾病复发的比例。(h) 接受化疗患者与未接受化疗患者的复发率。(i) 接受和未接受放疗患者的疾病复发比例,按病理分期分层。(j-k) 不同病理分期OS 和 DFS 的 Kaplan-Meier 曲线。(l-m) LNM 患者和非 LNM 患者的 OS/DFS 比较。(n) 不同病理分期 LNM 状态的分布。
02
ESCC体细胞突变概况
一般认为,癌症的进展伴随着肿瘤突变负荷(TMB)的增加、致癌基因和抑癌基因突变的积累以及结构变异。因此,解释和比较每个阶段的基因组特征对于理解疾病进展过程中的分子变化至关重要。他们首先在队列中确定了体细胞突变和 TMB。共检测到 2932597 个体细胞突变,包括 2758882 个单核苷酸变异(SNV)、62794 个小插入和 110921 个缺失(INDEL)。最常见的突变基因是TP53(87%),其次是TTN(39%)、NOTCH1(27%)、CSMD3(23%)、SYNE1(16%)、KMT2D(15%)、MUC16(15%)和CDKN2A(14%)(图2a)。回顾先前的报告,他们在 ESCC 队列中发现的高频突变基因与先前研究报告的基因基本一致。
TTN编码人体中最大的蛋白质,这种基因的突变一般认为在功能上与肿瘤生物学无关。因此,作用于TTN突变的选择压力很低。此外,MUC家族基因(MUC12、MUC5B、MUC17)在 ESCC 中高度突变,与野生型相比,这些突变与较差的 OS 相关(图2b)。此外,ESCC 中的平均体细胞突变率为每兆碱基 (Mb)(图2c),与转换 (Ti) 突变相比,颠换 (Tv) 突变的比例更高。有趣的是,在不同的病理阶段中没有观察到 TMB 的显著差异(图2d),并且 TMB 水平不能预测患者预后。
肿瘤中的突变事件可以互相排斥,也可以同时发生,它们的共突变状态具有预后价值。在这个大型单机构队列中,他们进行了共突变分析,重点关注基因表达水平最高的 20 个突变基因(图2f)。具体而言,RYR2突变与TTN和MUC5B突变同时发生。在FAT1和KMT2D之间以及PCLO和SYNE1之间也观察到共现。在分析的所有基因对中,只有NOTCH1和OBSCN表现出统计学上显著的互斥性。

图2. ESCC 中的基因组变化。
(a) 突变情况分析。(b) Kaplan-Meier 分析。(c) ESCC 中的 TMB 与来自癌症基因组图谱计划 (TCGA) 的各种癌症类型的比较。(d) 不同病理阶段中的TMB分布。(e) 不同病理阶段中高频基因突变频率的比较。(f) 共突变分析显示15个选定基因之间的互斥性和共发生性。
03
不同病理阶段体细胞拷贝数变异的比较
在不同病理阶段,鉴定了拷贝数变异 (CNV),并将其归类为增加或丢失。在 I-II 期中,最常见的 CNV 事件是 11q 染色体的增加,其次是 3q、7q、8q 和 14p 染色体的增加(图3a)。在 III-IV 期中观察到了类似的模式,并注意到了其他阶段特异性 CNV 特征。例如,随着肿瘤进展(I-II 期至 III-IV 期),2 号染色体上的片段从重复转变为缺失(图3a)。在比较无淋巴结转移 (nLNM) 和 LNM 组时观察到了类似的转变。致癌基因MYCN和癌症相关基因NFE2L2分别位于 2 号染色体的 2p24.3 和 2q31.2。它们的增加可能有助于早期 ESCC 肿瘤发生。先前的研究已经证实,NFE2L2的敲低会促进 ESCC 细胞的增殖,表明患者预后较差,这与在 III-IV 期队列中观察到的 2 号染色体缺失结果相一致。
为阐明ESCC患者基因组变化的时序规律,研究团队通过MutationTiming流程对SNV、插入缺失及结构变异进行伪时间排序分析。结果显示,相较于其他基因组事件,9q、9p、17p和11q染色体片段的缺失/增益属于最早发生的变异(图3b),而这些区域恰好包含TP53、NOTCH1、CDKN2A和CCND1等ESCC高频突变基因。随后出现的变异包括7p、3q和8q染色体增益,该区域分布着EGFR、SOX2、PIK3CA及MYC等已知能显著促进癌细胞增殖、存活与侵袭的基因。值得注意的是,针对EGFR通路(厄洛替尼、吉非替尼)和PI3K/AKT/mTOR通路(阿培利司)的抑制剂已开发为抗癌药物。末阶段变异表现为2p区段(含原癌基因MYCN)的增益,该扩增事件已通过多项研究证实与多种癌症不良预后相关。综上,拷贝数变异分析揭示了ESCC进展过程中的基因组演变规律及其潜在预后价值。
他们使用改进的非负矩阵分解 (NMF) 算法研究了 ESCC 中的突变特征,从本研究的队列中识别出 11 个突变特征(Sig1-Sig11)(图3c)。其中,Sig4、Sig7 和 Sig10 与癌症体细胞突变目录 (COSMIC) 数据库中的已知特征不对应。其余特征与 COSMIC 匹配如下:Sig1 和 Sig3 与 APOBEC(载脂蛋白 B mRNA 编辑酶,催化多肽样)活性有关;Sig2 与 5-甲基胞嘧啶的自发脱氨有关;Sig5 与活性氧 (ROS) 损伤有关;Sig6与同源重组 DNA 损伤修复缺陷有关;Sig8 和 Sig 11 具有潜在的测序伪影。此外,与早期和非淋巴结转移组相比,晚期(III-IV 期)和淋巴结转移组的 Sig3(APOBEC 标记)活性显著升高(图3d-e),提示其与ESCC的发展和临床预后存在潜在关联。先前研究表明,APOBEC3B 可在体内驱动肿瘤的发生和发展。重要的是,APOBEC 标记活性与食管鳞状细胞癌的转移和不良预后之间的关联此前已得到证实。
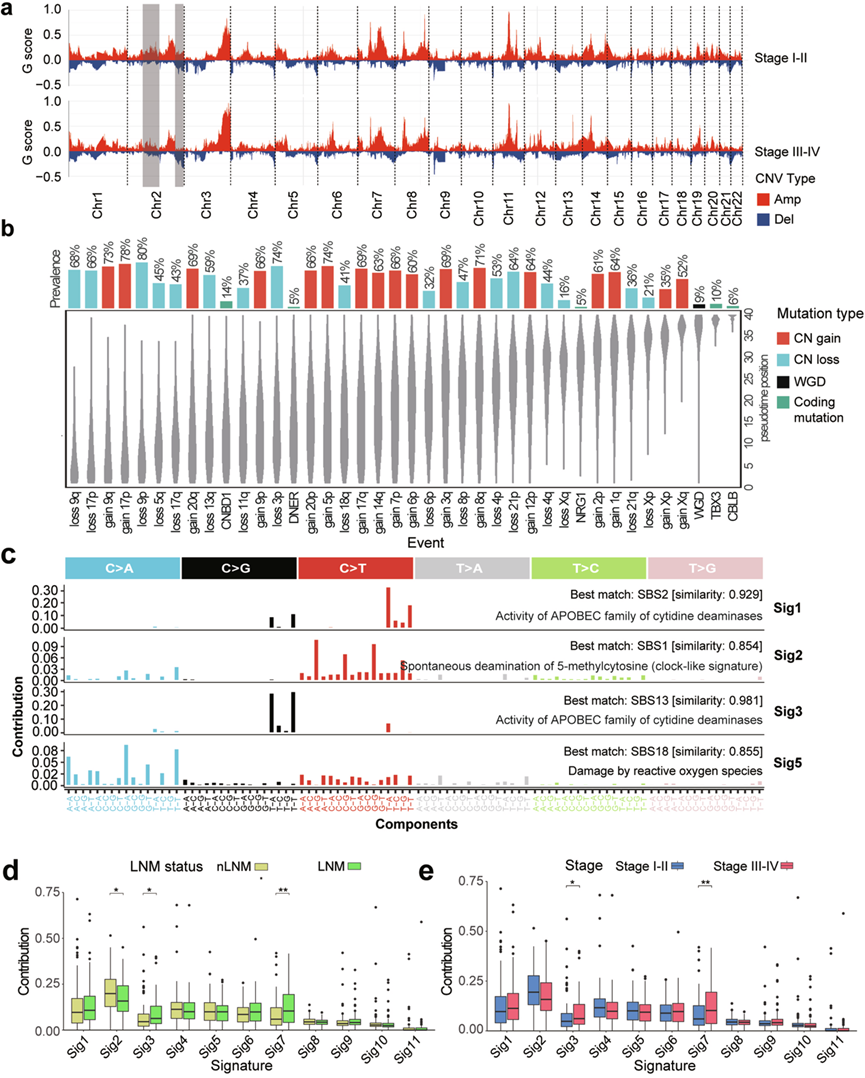
图3. ESCC的CNV特征和突变特征谱。
(a) ESCC不同病理阶段的CNV特征。(b) ESCC中基因组事件的伪时间顺序。(c) ESCC中突变特征及其类似的COSMIC特征的识别。(d-e) nLNM组和LNM组之间以及I-II期和III-IV期之间的ESCC突变特征比较。
04
EpK通路与ESCC进展相关
为了进一步研究转录组分析对ESCC临床结果的影响,他们系统地分析了基因表达与临床特征之间的关联。在早期(I-II期)和晚期(III-IV期)ESCC之间共鉴定出204个上调基因和26个下调基因(图4a)。进一步的GO分析显示,晚期肿瘤中上调的基因主要富集在有机羟基化合物代谢过程,有机磷酸酯生物合成过程和炎症反应等通路。相反,早期肿瘤中高表达的基因在EpK相关的生物过程中显示出显著富集,包括表皮发育,上皮细胞分化,角质形成细胞分化和表皮细胞分化(图4b-c)。同样,nLNM 组与 LNM 组之间的比较也揭示了一致的结果,这些结果表明 EpK 过程与 ESCC 进展之间存在密切联系。随后,他们整理了一个代表 EpK 通路的基因集,并利用基因集变异分析 (GSVA) 分析每个样本的 EpK 活性评分。进一步的预后分析表明,EpK 评分较高的患者的 OS 时间和 DFS 时间更长(图4d)。
EpK评分需要转录组数据进行计算,这限制了其在临床筛查和诊断支持中的适用性。为了解决这个问题,需要鉴定出更简单的代表EpK通路的标记物。进一步研究表明,S100A8(钙颗粒蛋白A)和S100A9(钙颗粒蛋白B)与EpK通路的表达相关(图4e)。单个特征S100A8/A9(S100A8和S100A9的平均表达)可以显著区分ESCC的OS和DFS(图4f)。此外,与低表达组相比,S100A8/A9 高表达的 ESCC 患者的复发率 (18% vs. 46%) 和化疗后复发率 (29% vs. 58%) 较低(图4g),突出表明其作为指导 ESCC 术后化疗策略的标志物的潜力。重要的是,多变量 Cox 比例风险回归模型支持,与 LNM 状态和临床分期相比,S100A8/A9 是 ESCC 的独立预后因子(图4h)。总之,EpK 通路与 ESCC 进展和预后密切相关,S100A8/A9 是临床结果的有希望的预测因子。
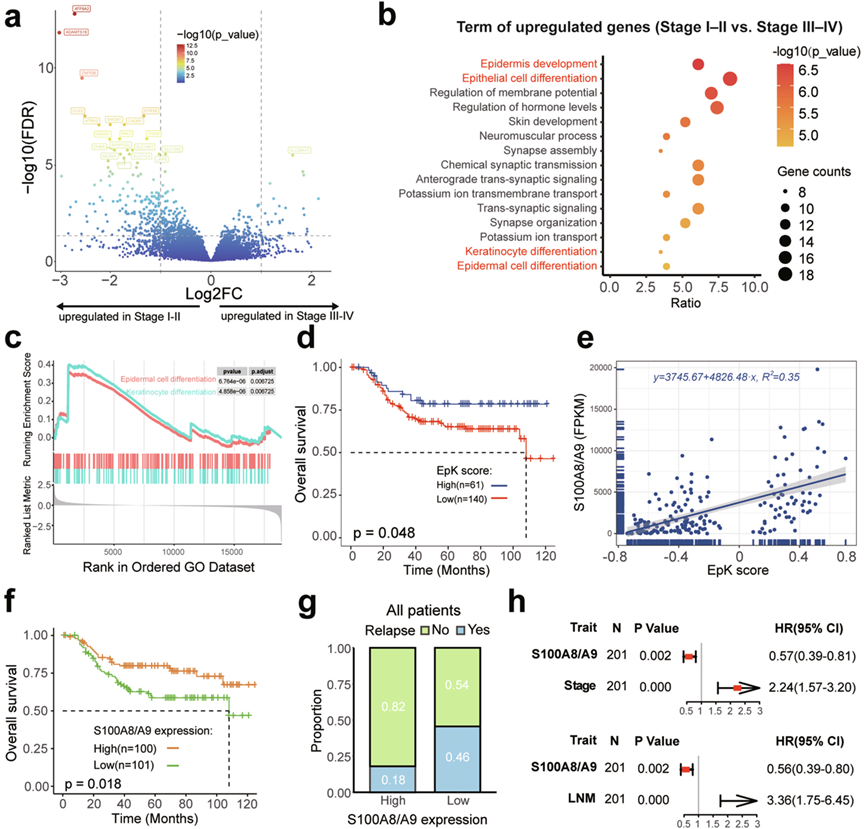
图4. ESCC 的基因表达改变。
(a) 差异表达基因 (DEG) 分析。(b) 通路富集分析。(c) 比较 I-II 期和 III-IV 期的 GSEA 富集分析。(d) EpK评分区分 ESCC 中的 OS。(e) 通过线性回归评估 S100A8/A9 表达与 EpK 评分之间的相关性。(f) 按高和低S100A8 /A9 表达水平分层的患者(按中位数分组)的 OS 的Kaplan-Meier 分析。(g) 所有样本中高和低 S100A8/A9 表达组之间的复发率。(h) S100A8/A9、临床分期和LNM状态的多元Cox回归分析。
05
ESCC 的预后分层
患者分层对于推进食管鳞状细胞癌的精准医疗至关重要。本研究探索了两种构建食管鳞状细胞癌预后亚型的不同策略:整合基因组和转录组分析,以及单独进行转录组分析。
他们首先应用聚类分析(COCA) 方法整合基因组和转录组数据进行聚类(称为 GT 聚类)。虽然所得的 GT 聚类在预后方面存在显著差异,但他们观察到基因组变异对亚组区分的贡献很小。此外,多元 Cox 回归分析表明,该聚类结果与淋巴结转移 (LNM) 状态或 T 分期并非无关。因此,他们选择仅使用转录组数据对患者进行分层。通过共识聚类,他们确定了 ESCC 的三种亚型分类,将其命名为 FU-ESCC 亚型(图5a)。该亚型显示出显著的预后差异(图5b),并且发现与 LNM 和 T 分期均无关(图5c)。具体而言,与亚型 2 (S2) 和亚型 3 (S3) 相比,亚型 1 (S1) 患者的 OS 和 DFS 明显更好(图5b)。
为了探究这三种亚型是否表现出不同的基因组改变,他们分析并比较了体细胞突变频率。在突变频率最高的100个基因中,只有7个基因在不同亚型间表现出显著差异。具体而言,FAT1和HMCN1在亚型1中突变频率较高,而RYR2、ZNF750和DMD在该亚型中的突变频率较低。FSIP2突变在亚型2中较少见,而TP53和ZNF750在亚型3中突变频率高于其他组。值得注意的是,与 S2/S3 相比,S1 组 EpK 通路表达更高(图5d),淋巴结转移 (LNM) 和复发率更低,这与先前的研究结果一致(图4d-f)。此外,S1 组中大多数患者 S100A8/A9 表达较高。因此,他们假设 S100A8/A9 可以作为 S1 亚型的代表性标志物,同时预测 ESCC 的预后。
为了进一步研究这些组成差异的功能含义,他们分析了不同亚型中 CAF 基因特征以及免疫相关趋化因子、细胞因子和免疫检查点分子的表达(图5e)。结果显示,S2 显示 CAF 相关基因的表达显著升高(图5e-f)。基因集富集分析 (GSEA) 表明,与 S3 相比,与皮肤和表皮发育相关的通路(成纤维细胞在其中发挥重要功能作用)在 S2 中显著富集(图5g)。基于这些结果,他们提出 S2 代表 CAF 相关亚型, FAP和VIM高表达是潜在标志物。与S2相比,S3在免疫相关基因集表达总体呈降低趋势(图5e)。虽然PD1和LAG3等基因在S3中的表达量高于S1和S2,但差异并不显著。此外,与S2相比,S3中多种免疫反应相关通路显著下调(图5h),这进一步验证了S3可能以免疫激活受抑制为特征的观点。
为了验证上述亚型特异性特征与预后的关系,他们收集了160例初治ESCC患者的独立队列(队列2)。构建组织微阵列(TMA),并进行三组免疫组织化学(IHC)和mIF检测。第1组检测S100A8 + S100A9复合物(以下简称S100A8/A9复合物)。第2组检测α-SMA、波形蛋白、FAP和HIF-1α。第3组评估CD3、CD4、CD8和Foxp3。根据队列1中鉴定出的标志物(S1组为S100A8/A9复合物;S2组为FAP和波形蛋白),他们将队列2中的患者分层为FU-ESCC亚型。Kaplan-Meier生存分析显示,队列2中FU-ESCC亚型的预后趋势与队列1的预后趋势一致(图5i),证实了FU-ESCC分类的预后相关性和可重复性。
S100A8/A9 复合物水平高(S1)的患者预后明显较好(图5i)。S100A8 和 S100A9 是钙结合蛋白,它们形成共同的异二聚体结构 S100A8/A9 复合物。在免疫系统中,S100A8 和 S100A9 蛋白单体主要在中性粒细胞和单核细胞中表达,在调节炎症反应和炎症相关疾病中起关键作用。相反,在鳞状细胞癌中,S100A8 和 S100A9 蛋白单体表现出相反的预后关联。在本研究中,他们发现 S100A8/A9复合物主要由鳞状上皮衍生的癌细胞表达。与癌组织相比,癌旁非肿瘤组织中S100A8/A9的RNA表达水平较高。单细胞数据分析进一步证实S100A8/A9基因主要在健康鳞状上皮细胞中表达。为了研究S100A8/A9复合物的转录调控作用,他们首先分析了S100A8/A9复合物在ESCC中的亚细胞定位。队列2和新收集的ESCC肿瘤组织的IHC均显示S100A8/A9复合物定位于细胞质而不是细胞核中(图5j)。同样地,在正常的食管鳞状上皮细胞中,S100A8/A9复合物也位于细胞质中(图5j)。基于这些观察,他们推断S100A8/A9复合物不太可能在ESCC中作为转录调节因子发挥作用。此外,他们探索了S100A8/A9复合物作为非侵入性生物标志物的潜力。然而,血清和肿瘤组织中S100A8/A9复合物水平之间没有观察到显著相关性,这表明循环S100A8/A9复合物水平可能无法作为患者预后的可靠预测指标。总之,这些数据表明EpK通路高表达表明癌细胞保留了更多的鳞状上皮特征而不是恶性特征,这与更好的患者预后相关(图5k)。S100A8/A9复合物可作为检测ESCC中上皮角化通路激活的有效替代标志物。
S2 经验证为富含 CAF 的亚型,mIF 证实其含有更高的 CAF(图5l)。先前的研究报告称,成纤维细胞转化为 CAF 可促进 ESCC 中的肿瘤进展。S2的特征分析表明,这种亚型的患者可能需要更密切的临床监测,并可能从针对 CAF 的临床试验中受益。此外,S2 显示免疫细胞浸润增加(图5m)和增殖相关标志物表达升高,包括增殖细胞核抗原 (PCNA)、缺氧诱导因子 1A ( HIF1A) 和极光激酶 A (AURKA)。这些发现表明 S2 的特点是 CAF 富集和活跃的细胞增殖,这些特征可能导致不良预后和潜在的治疗耐药性。在验证队列(队列2)中,S3定义为不满足S1或S2分类标准的患者。该亚型的特征是免疫细胞浸润减少和免疫相关通路活性降低(图5m-n)。在本研究中,他们将S3定义为免疫沙漠样亚型,这一特征可能意味着其对当前治疗策略的反应有限。
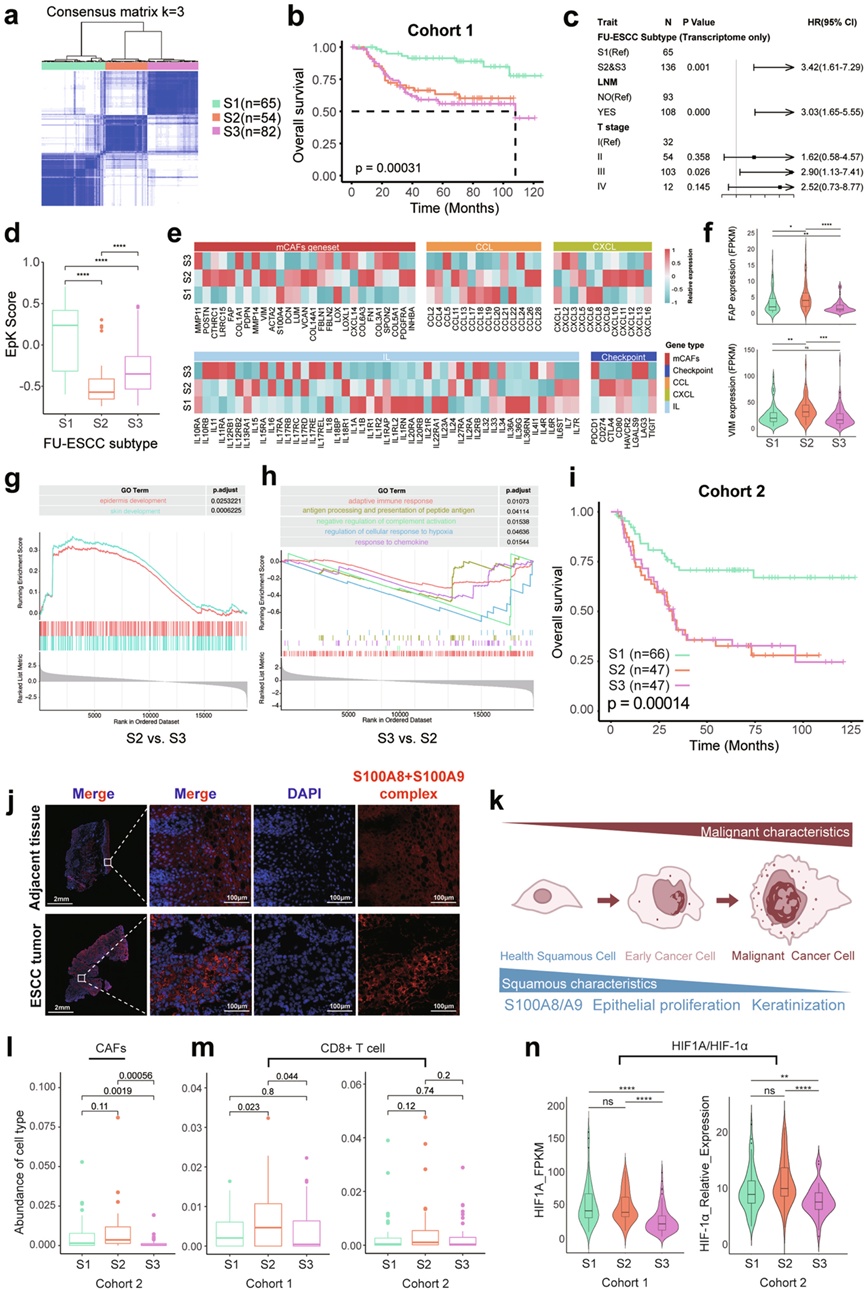
图5. ESCC 的分子分类。
(a) 基于转录组分析的队列 1 的共识聚类。(b) Kaplan-Meier 生存分析。(c) 结合队列 1中的 FU-ESCC 亚型、临床分期和 LNM 状态的多元 Cox 回归分析。(d) 通过GSVA 对队列 1 中三种亚型的 EpK 评分进行比较。(e) 比较队列 1 中不同亚型间 mCAF 相关基因和免疫相关基因的表达。(f) 队列 1 中三种亚型中 FAP 和 VIM 的表达水平。(g-h) 通路富集分析。(i) Kaplan-Meier 生存分析。(j) 新鲜配对 ESCC 和邻近正常组织中 S100A8/A9 复合物的亚细胞定位。(k) ESCC细胞从健康鳞状上皮进展为恶性肿瘤的潜在进展示意图。(l-m) 两个队列中不同细胞组成的比较。(n) 两个队列中 HIF1A/HIF-1α 的表达比较。
+ + + + + + + + + + +
结 论
本研究对来自 ECTOP-2002 研究的 203 名拥有完整临床信息的患者进行了基因组和转录组分析。黏蛋白家族突变以及 APOBEC 标记与不良预后相关。相反,EpK通路的激活与良好的预后和较低的化疗后复发率密切相关。独立验证支持 S100A8 + S100A9 复合物作为 EpK 通路的关键标志物。此外,他们建立了预后分层系统 FU-ESCC 亚型,该系统定义了三种具有不同分子和临床特征的亚型。EpK激活亚型保留了健康鳞状上皮细胞的特征,S100A8 + S100A9复合物高表达,且预后良好。CAF富集亚型FAP和波形蛋白表达增高,CAF富集,增殖活性高,且预后不良。免疫沙漠亚型的特点是免疫浸润低、免疫信号传导受抑制,预后同样不良。本研究提供了宝贵的资源和见解,有助于在精准医疗和靶向治疗时代更好地理解ESCC。
+ + + + +



 English
English


