文献解读|Clin Mol Hepatol(16.9):肝内胆管癌的放射基因组学预测免疫化疗反应并确定治疗靶点
✦ +
+
论文ID
原名:Radiogenomics of intrahepatic cholangiocarcinoma predicts immunochemotherapy response and identifies therapeutic target
译名:肝内胆管癌的放射基因组学预测免疫化疗反应并确定治疗靶点
期刊:Clinical and Molecular Hepatology
影响因子:16.9
发表时间:2025.02.10
DOI号:10.3350/cmh.2024.0895
背 景
肝内胆管癌 (ICC) 是仅次于肝细胞癌的第二大常见原发性肝癌,全球发病率和死亡率都在上升。仅约 20% 至 30% 的患者适合根治性切除术,5 年生存率为 20% 至 35%。对于其余 70% 至 80% 的局部晚期或转移性患者,全身化疗仍然是标准治疗方法,但获益有限,中位生存期不到 12 个月。虽然癌症免疫疗法在过去十年中取得了前所未有的成果,但早期研究表明,免疫检查点抑制剂 (ICI) 单药治疗对晚期 ICC 患者的疗效有限,这凸显了对新的基于免疫的治疗策略的需求。来自 III 期临床试验和真实世界数据的最新证据表明,程序性细胞死亡蛋白 1 (PD-1) 抑制剂帕博利珠单抗或程序性死亡配体 1 (PD-L1) 抑制剂度伐利尤单抗联合化疗可作为晚期胆道癌(尤其是肝内胆管癌)新的一线标准治疗方法。然而,确定哪些患者更有可能从此类联合治疗中获益仍然是一项关键挑战。
实验设计
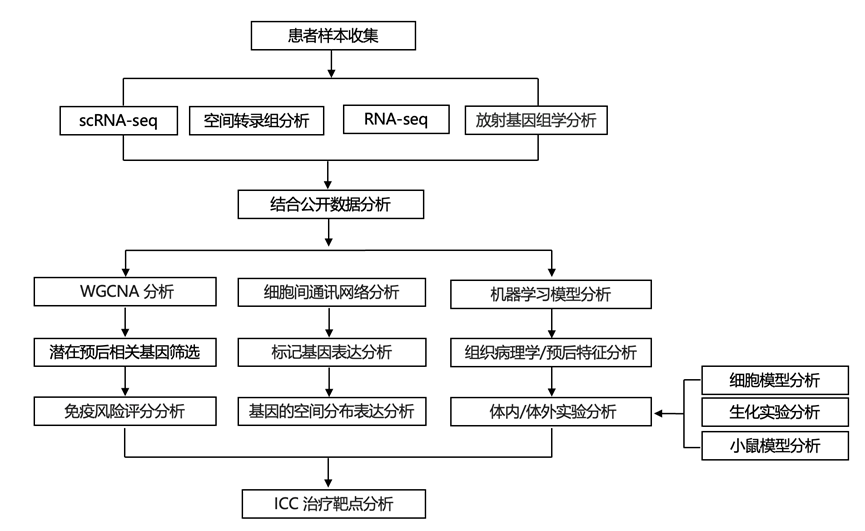
结 果
01
研究设计和数据来源
研究团队从公开可用的数据集中收集了 ICC 的转录组分析 (RNA-seq) 数据和患者水平临床数据,这些数据集至少包含 40 例肿瘤样本和随访数据(图1A)。共纳入 401 例患者(244 例来自 Fudan-ICC,81 例来自GSE89749,76例来自 EMTAB-6389)。基于Fudan-ICC 队列构建了免疫相关评分 (IRS),并在GSE89749和 E-MTAB-6389 队列中进行了验证。对来自两个 GEO 数据集(GSE138709和GSE189903)的 16 例人类 ICC 样本和 6 例癌旁正常肝脏样本进行了单细胞转录组分析(scRNA-seq) (图1A)。他们利用 GeoMx™ DSP 技术对来自 40 位患者的 120 个样本进行了空间转录组分析,每个样本包含 3 个主要区域,分别称为肿瘤核心(内部三分之一部分)、中间区(从核心到边缘的过渡三分之一部分)和浸润性边缘(外部三分之一部分),以表征肿瘤-免疫相互作用的空间异质性,并结合空间放射基因组学特征分析(图1B)。所有样本共包含 240 个(120 个上皮细胞和 120 个基质细胞)感兴趣区域 (ROI),并由认证病理学家进行注释(图1C)。最后建立细胞和动物模型进行验证(图1D)。
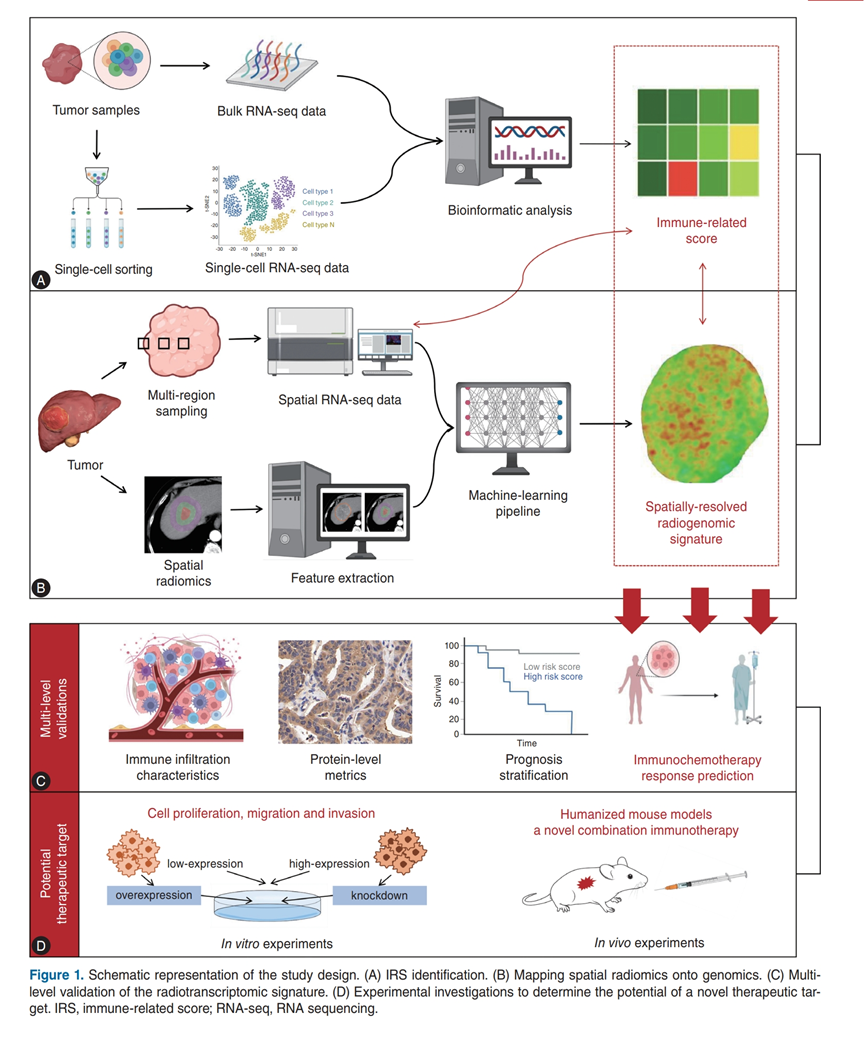
图1. 研究设计示意图。
(A) IRS 识别。(B) 将空间放射基因组学数据映射到基因组学数据进行分析。(C)放射基因组学特征的多级验证。(D) 为确定新型治疗靶点的潜力而开展的实验研究。
02
免疫相关评分的发现和多级验证
在发现队列(复旦-ICC)中,他们确定了最优的3聚类解决方案(C1、C2和C3),其免疫浸润程度存在显著差异,其中C1和C3的免疫浸润丰度明显高于C2(图2A)。通过WGCNA分析鉴定出4个与免疫聚类高度相关的关键模块(蓝色、绿色、plum2和skyblue3),进而筛选出706个免疫相关关键基因(图2B)。与ImmPort数据整合后,保留172个重叠基因用于后续分析。单因素Cox分析筛选出46个预后相关基因,经LASSO-Cox和RSF算法进行特征排序后,最终获得5个重叠基因(图2C)。通过向后逐步选择法优化多因素Cox模型,构建出包含3个基因的免疫风险评分(IRS)。值得注意的是,尿激酶型纤溶酶原激活物受体(uPAR/PLAUR)是唯一的独立危险因子(图2D)。
在复旦大学-ICC队列中,IRS评分C-index为0.72,提示生存预测效果良好。多因素Cox回归分析表明,在调整现有临床特征后,IRS评分仍然是预后的有力独立预测因素。IRS还对外部验证队列(GSE89749和EMTAB-6389)进行了分层,C-index分别为0.64和0.65。按中位数对患者进行分层表明,在各个队列中,高评分患者的预后均显著较差(图2E)。他们进一步研究了它与 CIBERSORT 评估的免疫浸润之间的关系,结果显示它与免疫抑制屏障(例如 M0 巨噬细胞和中性粒细胞)呈正相关,但与抗肿瘤免疫(例如幼稚 B 细胞和 CD8+T 细胞)呈负相关(图2F)。IRS 与预测综合 T 细胞亚群的 ImmuCellAI 评分呈负相关,并且在 ImmuCellAI 预测的免疫治疗应答者与无应答者之间存在显著差异。此外,他们观察到 IRS 与缺氧之间存在显著的正相关,从而调节肿瘤增殖(P53 通路)、代谢(糖酵解)、侵袭和转移(通过 NF-κB 的 TNF-α 信号传导)。药物敏感性分析强调,低 IRS 与对目前首选化疗药物(吉西他滨和奥沙利铂)和分子靶向药物(仑伐替尼和瑞戈非尼)的敏感性显著增加相关。
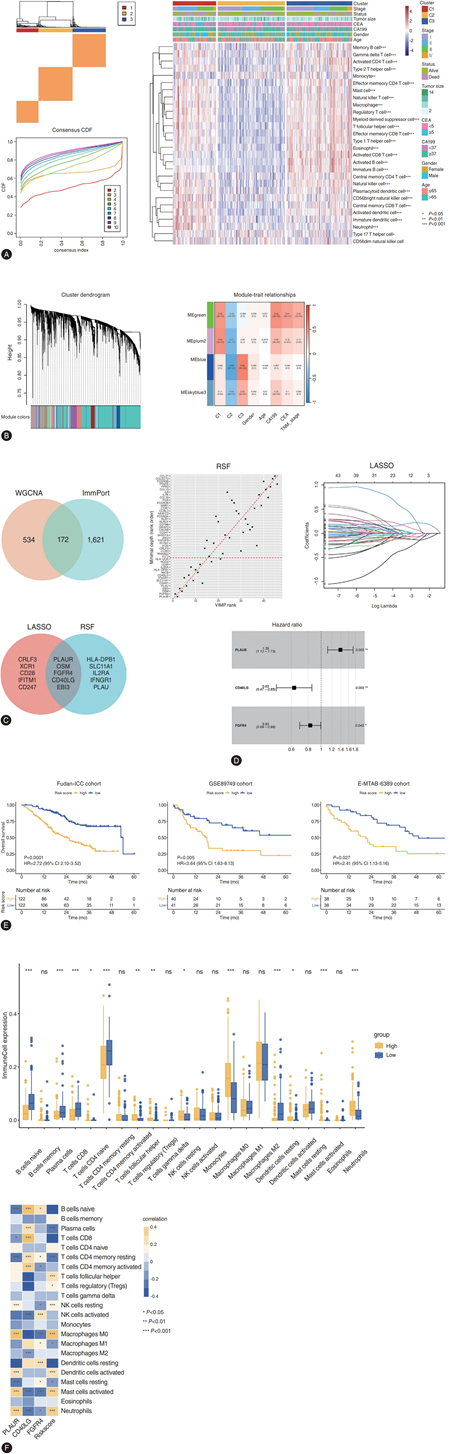
图2. 通过整合程序开发和验证IRS。
(A) 复旦大学-国际儿科中心(Fudan-ICC)队列的共识评分矩阵,用于确定最佳三聚类方案,其中包含28个浸润性免疫细胞亚群。(B)WGCNA树状图识别的基因共表达模块,以及与免疫聚类高度相关的四个关键模块。(C) 经RSF和LASSO-Cox算法筛选的WGCNA与ImmPort之间的重叠基因。(D) 多元后向逐步Cox回归分析中保留基因风险比的森林图。(E) 不同队列中IRS风险组的Kaplan-Meier图。(F) IRS与免疫浸润的相关性。
03
单细胞转录组分析
此外,他们从 GEO 数据库中获得了 51642 个细胞的单细胞转录组数据,使用已知标记基因将这些细胞分成 10 个主要细胞聚类。他们发现 IRS 在单核细胞-巨噬细胞中富集程度最高,其次是恶性细胞;PLAUR、CD40LG 和 FGFR4 基因分别在单核细胞-巨噬细胞、T 细胞和恶性细胞中富集程度最高(图 3A)。细胞间通讯网络反映了恶性细胞、单核细胞-巨噬细胞和 T 细胞之间的紧密细胞相互作用(图 3B),强调了恶性细胞、单核细胞-巨噬细胞和 T 细胞之间的许多免疫调节相互作用的高概率值,例如 MDK-NCL、SPP1-CD44 和 LGALS9-CD44/45(图 3C),这些相互作用已证明可以抑制 T 细胞活化并限制抗肿瘤免疫反应。为了在单细胞水平上更详细地了解三基因 IRS 的机制,他们检测了所选标志物在富集细胞类型的不同亚群中的表达:表达 PLAUR 的恶性细胞与表达 FGFR4 的细胞互斥,提示它们在 ICC 进展中发挥着不同的作用(图 3D)。与 FGFR4+ 细胞相比,PLAUR+ 细胞中上述免疫抑制配体-受体对的通讯概率增加。此外,CD40LG 在增强抗肿瘤免疫的记忆性 CD4+ T 细胞中富集,而 PLAUR 在所有单核细胞-巨噬细胞聚类中富集,这些聚类具有 M2 样表型和表达抑制分子(例如 CD163、MS4A4A 和 VSIG4)的特征(图 3E-F),这些分子已证明可以抑制 T 细胞功能。
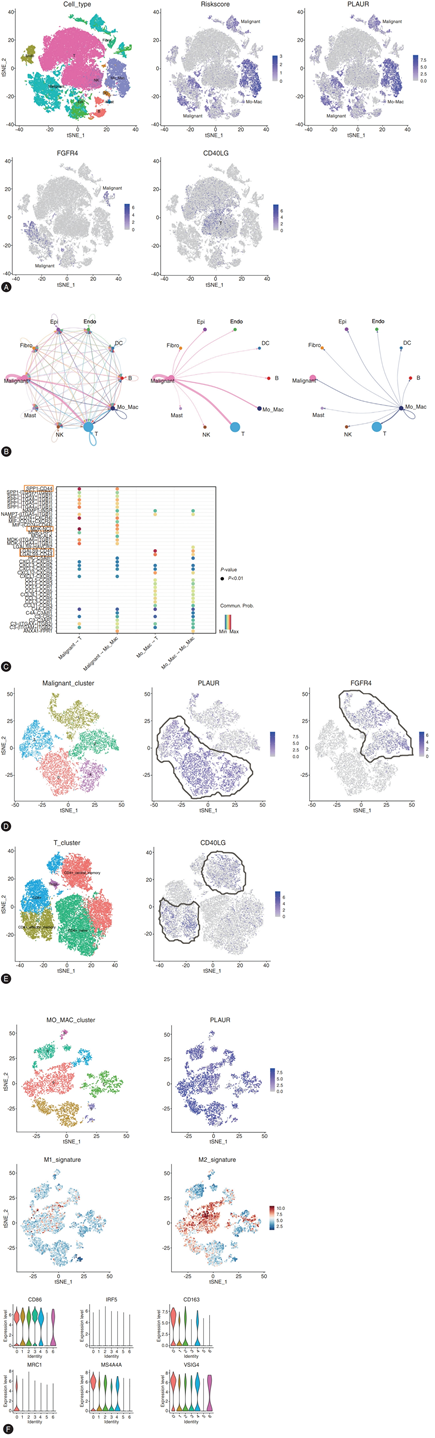
图3. 使用单细胞转录组数据分析 IRS。
(A) 细胞类型识别的 t-SNE 图,所有单细胞均以 IRS 和组成基因着色。(B) 已识别细胞类型之间的加权细胞间相互作用网络。(C) 推断的恶性细胞、单核细胞-巨噬细胞和 T 细胞之间的配体-受体相互作用。(D) 不同恶性亚群中 PLAUR 和 FGFR4 表达的 t-SNE 图。(E) 不同 T 细胞亚群中 CD40LG 表达的 t-SNE 图。(F) 不同单核细胞-巨噬细胞亚群中 PLAUR 表达、M1 和 M2 表型的 t-SNE 图以及标记基因表达的小提琴图。
04
机器学习将空间转录组学与放射基因组学相结合
他们采用数字空间分析技术(DSP)解析IRS相关特征区域的免疫微环境特征,结果显示3基因IRS在不同瘤内区域间差异较小,但在上皮与间质区域间存在显著差异(图4A-B)。典型表现为FGFR4在肿瘤上皮区过表达,这与scRNA-seq结果一致。通过CIBERSORT计算发现,IRS与免疫浸润的关联性在肿瘤上皮区域与RNA-seq结果高度一致,而在间质区域则不然。因此,基于上皮区域的DSP数据已用于建立放射基因组学关联模型。
他们从动脉期和门静脉期扫描图像中,提取了与每个DSP采样区域对应的全肿瘤空间亚区共5798个放射基因组学特征。在3827个具有高稳定性和可重复性的特征中,筛选出288个(154个手工设计特征和134个深度学习特征)与任一IRS组分高度相关的特征进入机器学习流程。通过中位数分割法定义IRS高低分组,他们构建了基于特征类型的三种概率分类模型(手工特征模型 vs 深度学习特征模型 vs 联合特征模型)。虽然三种模型均表现良好,但采用逻辑回归算法结合3个手工特征构建的模型在内部验证集中展现出最高准确率,最终确定为放射基因组学标志物(图4D)。他们依次证实了选定的放射基因组学特征、空间特异性基因表达和免疫浸润之间存在高度相关性(图4E)。令人惊讶的是,3个特征的放射基因组学特征显示出与肿瘤上皮内PLAUR表达和巨噬细胞浸润最高的正相关性。
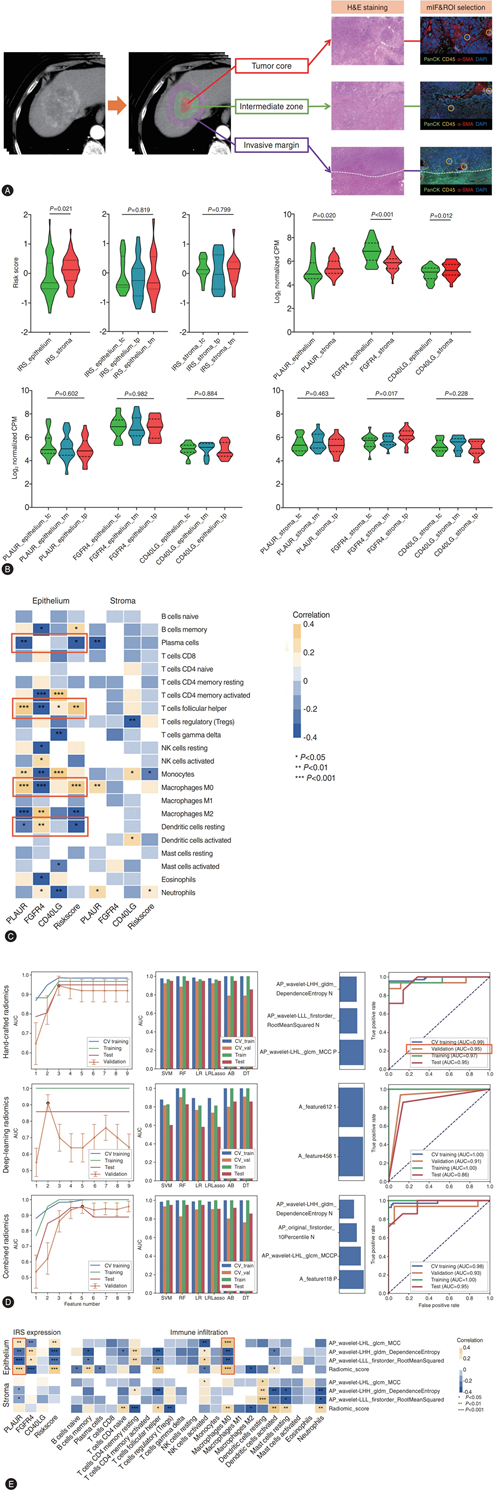
图4. 使用机器学习对空间分辨放射基因组特征进行训练-验证-测试。
(A) 从代表性空间分离区域采集的福尔马林固定石蜡包埋组织切片的 DSP。(B) 内源性相关区域 (IRS) 和组成基因空间分布的小提琴图。(C) 在 DSP 中,通过 CIBERSORT 估计的免疫浸润与定义的 IRS 之间的相关性分析。(D) 基于递归特征消除法的包装特征选择的机器学习流程、最佳分类器的选择、放射基因组学特征的权重以及导出模型的受试者工作特征曲线。(E)放射基因组学、IRS 和免疫浸润之间的相关性分析。
05
放射基因组学特征的多级验证
在分子队列中,基于免疫组化密度定量分析的IRS与放射基因组标志物显著相关,与DSP数据一致(图5A)。在切除队列中,该标志物可将患者分为不同预后亚组,预测总生存期和无复发生存期的C-index分别为0.67和0.64(图5B)。逐步多因素Cox回归分析显示,即使纳入主要语义影像特征,该标志物仍是独立预后因素。免疫化疗队列中位随访16.2个月后,中位无进展生存期和总生存期分别为6.3个月和16.2个月,客观缓解率(ORR)为36.1%,疾病控制率(DCR)为52.8%。与PD-L1表达相比,该标志物预测肿瘤客观缓解和疾病控制的AUC分别为0.84和0.81,性能指标显著更优(图5C-D)。高风险组与低风险组在无进展生存期和总生存期方面均存在显著差异(图5E-F)。
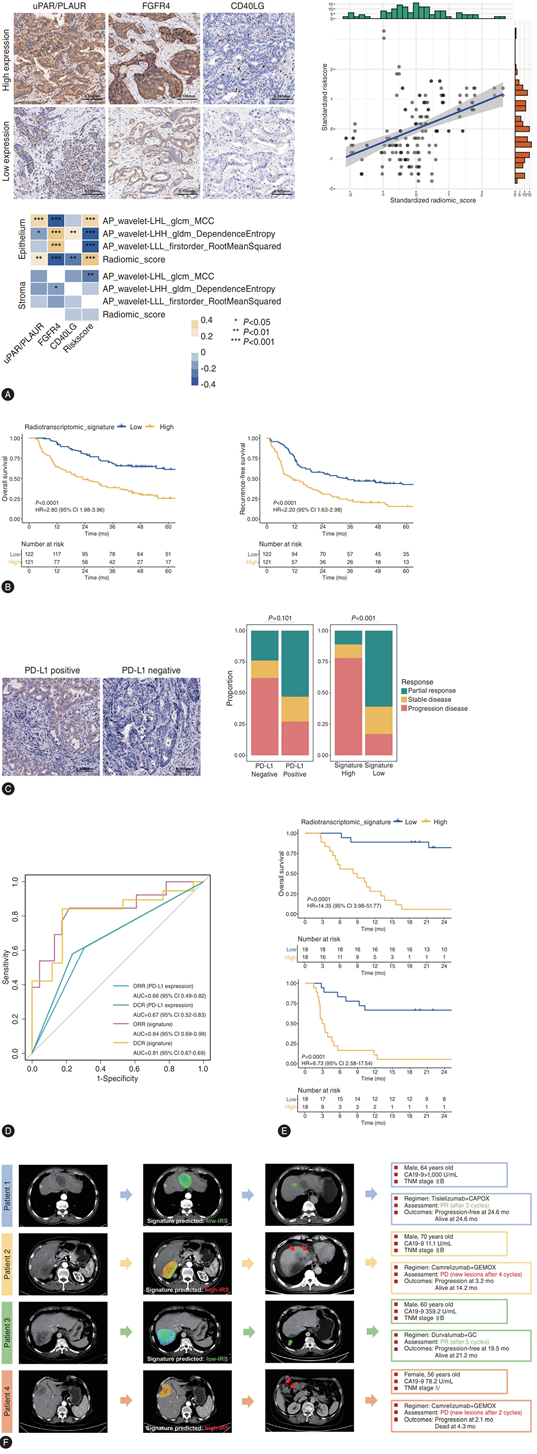
图5. 放射基因组学特征的多级验证。
(A) 通过 IHC 切片定量分析确定计算得出的特征与 IRS 之间的关联。(B) Kaplan-Meier 图显示切除术后患者的生存情况。(C) 使用 χ2 检验比较按 PD-L1 表达和放射基因组学特征分层的治疗反应比例。(D) PD-L1 表达和放射基因组学特征在预测治疗反应方面的表现。(E) 按特征分层的 Kaplan-Meier 图。(F) 放射基因组学特征的示例。
06
uPAR 是 ICC 的潜在治疗靶点
他们重点介绍了uPAR在恶性细胞和单核细胞-巨噬细胞中的表达(特征核心),设计了临床前体外和体内研究来检验针对uPAR的治疗策略的潜力。虽然在3种不同的ICC细胞系中都验证了uPAR的高表达,但他们选择了表达相对较高且受短小干扰RNA(siRNA)介导的敲低干扰的HuCCT1细胞,以及表达相对较低且受质粒介导的过表达(OE)干扰的RBE细胞(图6A)。使用CCK8、克隆形成、transwell和划痕愈合实验,表明uPAR促进ICC进展和THP-1迁移。为了阐明其潜在机制,他们在 uPAR OE 之前和之后对 RBE 和 THP-1 细胞进行了RNA-seq,随后进行了 KEGG 通路分析,结果显示 PI3K-Akt 信号通路富集,这也与单细胞数据分析的结果一致(图6B-D)。此外,PI3K 抑制剂(LY294002)和抗 uPAR mAb 均可显著抑制 PI3K-Akt 信号通路,从而抑制 ICC 进展以及 THP-1 迁移(图 6E-F、图7A)。抗 uPAR mAb 强烈诱导 THP-1 衍生的 CXCL9 的产生,而 CXCL9 已证明可以调节 CD8+ T 细胞的募集。
此外,他们利用uPAR阳性PDX人源化小鼠模型,观察到与安慰剂组相比,单独使用抗uPAR或抗PD-1单药治疗可显著抑制肿瘤生长,而两种单抗联合使用则进一步抑制肿瘤生长。免疫组化染色显示,这种联合疗法可有效抑制细胞增殖和巨噬细胞浸润,并增加肿瘤浸润CD8+ T细胞(图7B-F)。
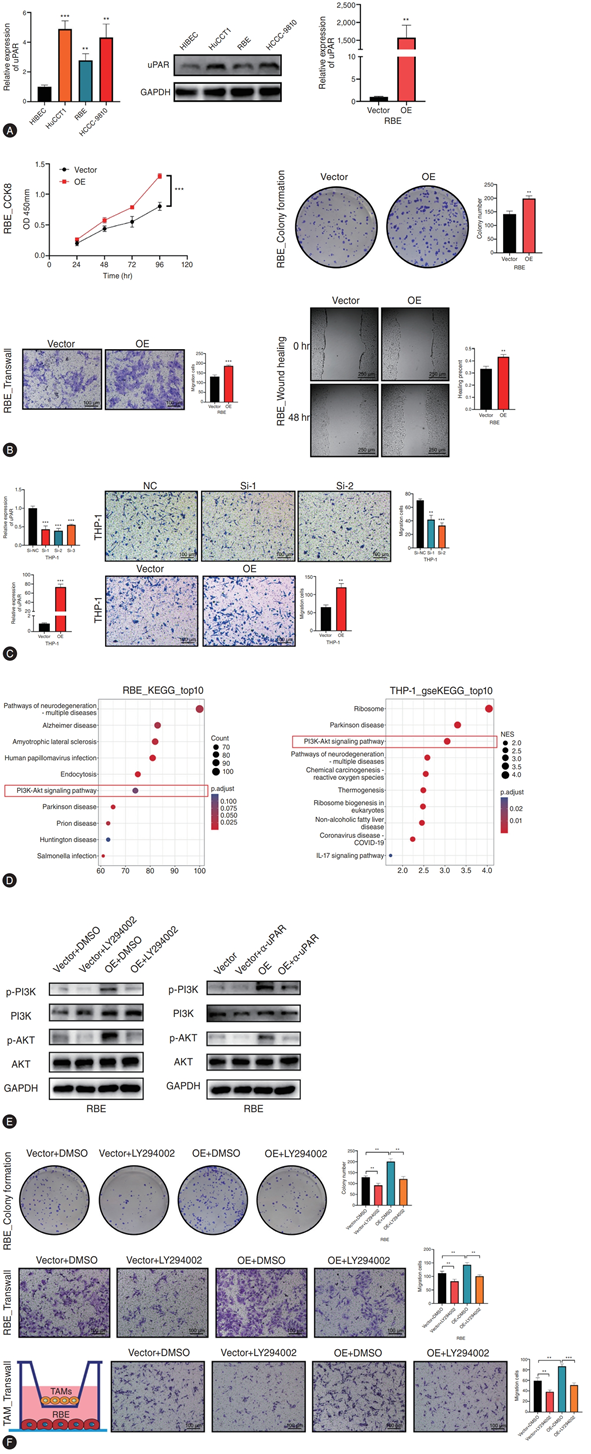
图6. uPAR在体外通过激活PI3K-Akt信号通路促进细胞增殖和迁移。
(A) qRT-PCR和Western blot检测HiBEC和3种ICC细胞系中uPAR的mRNA和蛋白表达水平,qRT-PCR认证uPAR质粒在RBE细胞中的效率。(B) 在转染了uPAR质粒的RBE细胞中进行CCK8、克隆形成、transwell和划痕修复实验。(C) 在转染了uPAR siRNA或质粒的THP-1细胞中,qRT-PCR认证uPAR质粒或siRNA在THP-1细胞中的效率,同时进行transwell实验。(D) uPAR OE组和对照组RBE和THP-1细胞中差异表达基因的KEGG通路分析。(E) Western blotting 分析显示 PI3K 抑制剂 (LY294002) 或抗 uPAR 治疗前后 RBE 细胞中 PI3K、p-PI3K、AKT 和 p-AKT 的水平。(F) 在 RBE 细胞和 TAM 中分别进行 CCK8 和 transwell 实验。
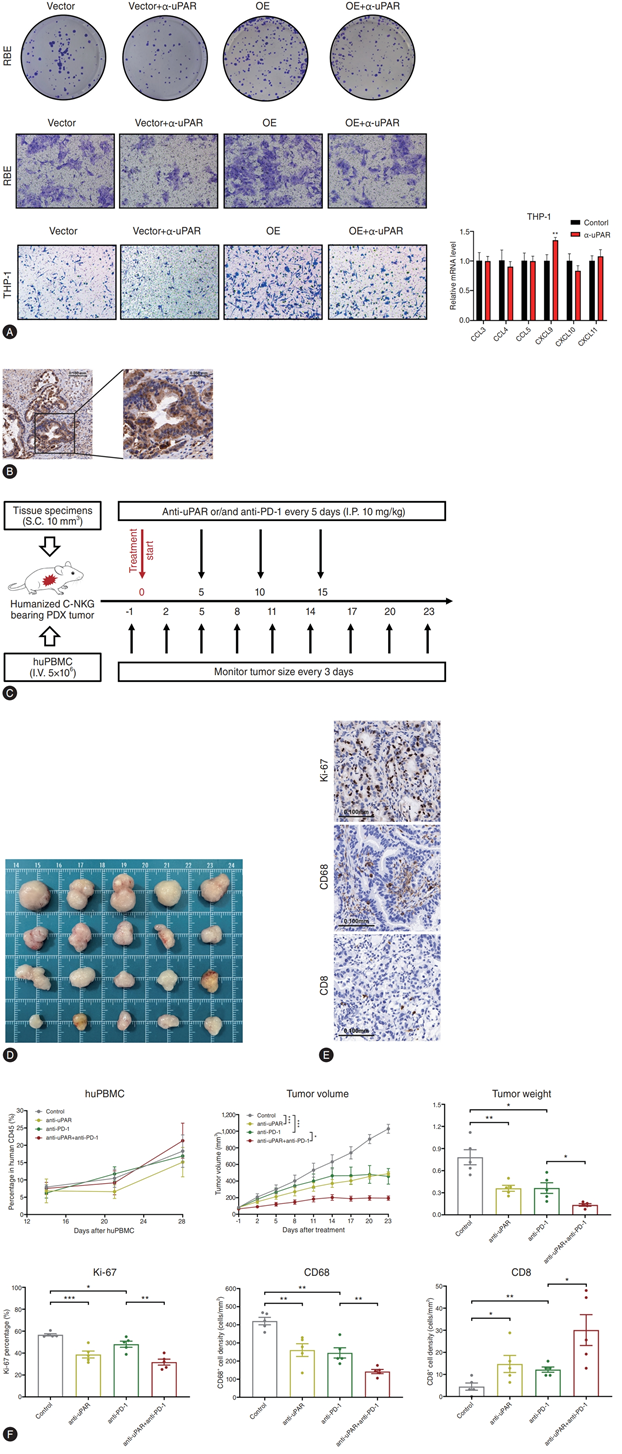
图7. 抗 uPAR 单独或与抗 PD-1 联合体外和体内治疗。
(A) 质粒介导的 uPAR OE 之前和之后用抗 uPAR mAb 处理的 RBE 和 THP-1 细胞的克隆形成和 transwell 测定,以及抗 uPAR 治疗之前和之后 THP-1 巨噬细胞中 T 细胞相关趋化因子的 mRNA 表达水平。(B) PDX 肿瘤的 uPAR IHC 染色。(C) 实验流程示意图。(D) 治疗结束时各组人源化 PDX 小鼠的肿瘤图像。(E) Ki-67、CD68+巨噬细胞和 CD8+ T 细胞的 IHC 染色。(F) 各组治疗结束时 huPBMC 重建效率、肿瘤生长和肿瘤重量以及 Ki-67、CD68 +巨噬细胞和 CD8 + T 细胞的免疫组织化学分析。
+ + + + + + + + + + +
结 论
本研究揭示了一种新的3基因(PLAUR、CD40LG和FGFR4)IRS,其下调与更好的生存率和对免疫化疗的敏感性增强相关。本研究强调了IRS-免疫相互作用在肿瘤上皮细胞内而非基质细胞内的功能性作用,且与地理空间位置无关。机器学习流程确定了最佳的3聚类特征,该特征已通过分子队列中的免疫组化分析得到充分验证,在切除队列中表现出良好的外部预后效度(C-index超过0.64),并在免疫化疗队列中预测治疗反应。本研究还使用体外ICC细胞系和体内人源化ICC患者来源的异种移植小鼠模型,证明抗uPAR/PLAUR单药治疗或联合抗程序性细胞死亡蛋白1疗法可显著抑制肿瘤生长。
+ + + + +



 English
English


