文献解读|Genome Med(10.4):空间转录组分析确定DTX3L和BST2是食管鳞状细胞癌肿瘤发生的关键生物标志物
✦ +
+
论文ID
原名:Spatial transcriptome profiling identifies DTX3L and BST2 as key biomarkers in esophageal squamous cell carcinoma tumorigenesis
译名:空间转录组分析确定DTX3L和BST2是食管鳞状细胞癌肿瘤发生的关键生物标志物
期刊:Genome Medicine
影响因子:10.4
发表时间:2024.12.18
DOI号:10.1186/s13073-024-01422-4
背 景
食管癌 (EC) 仍然是全球癌症相关发病率和死亡率的主要原因。食管鳞状细胞癌 (ESCC) 是亚洲人群中 EC 的最常见组织学亚型。由于ESCC进展迅速、治疗耐药性和转移率高,其预后极差且死亡率高。因此,有必要制定早期或癌前阶段的 ESCC 治疗策略。然而,早期肿瘤发生的细胞和分子机制仍未充分探索,正常组织向低度异型增生、高度异型增生以及最终发展为侵袭性癌症的过程尚不清楚。
实验设计
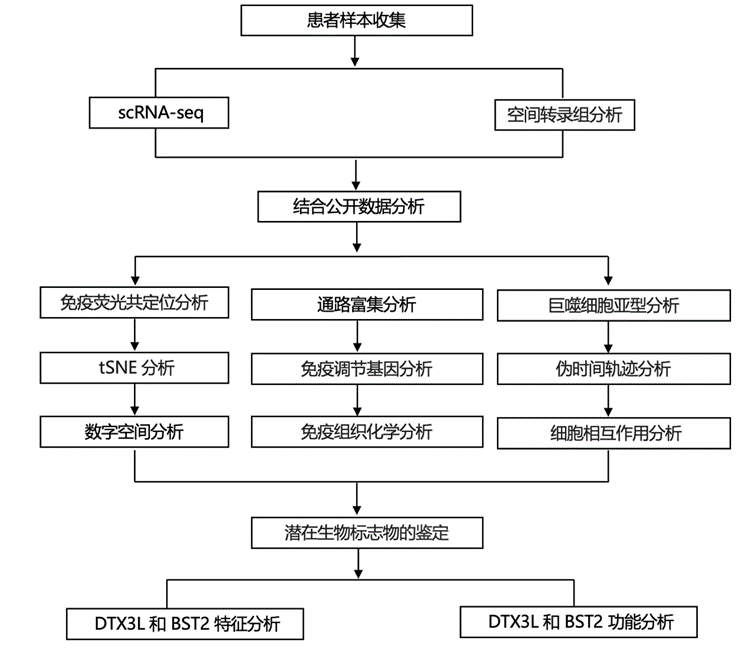
结 果
01
ESCC 肿瘤发生的空间转录组分析
为了研究 ESCC 发病和进展过程中发生的分子改变,研究团队采用 GeoMx 数字空间分析(DSP) 技术对 11 名 pT1 ESCC 患者的 44 份多期食管切除标本进行了分析。标本包括正常组织 (N)、低度异型增生 (L)、高度异型增生 (H)和肿瘤 (T)。他们显示了具有苏木精和伊红染色或荧光标记的代表性 DSP 分析组织样本(图1A-B),每个样本选择三个感兴趣区域(ROI),并且通过荧光共定位将每个 ROI 分割成分子定义的组织区室,使用掩蔽和分割策略来专门分析每个区室内的转录改变,包括上皮(PanCK + /CD45 −)、免疫细胞(PanCK − /CD45 +)和非免疫细胞基质(PanCK − /CD45 − /SYTO13 +)区室(图 1 C)。总共有 373 个照明区域 (AOI)符合 QC 标准,其中包括 129 个上皮细胞(33 N、33 L、33 H 和 30 T)、118 个免疫细胞(29 N、30 L、30 H 和 29 T)和 126 个非免疫细胞基质(31 N、32 L、32 H 和 31 T)AOI。将免疫细胞和非免疫细胞基质区室合并为“基质”后,共有 244 个(60 N、62 L、62 H 和 60 T)AOI 用于分析。
通过降维进行数据探索的 tSNE 表明,AOI 基于片段明显分离(图 1 D)。GeoMx癌症转录组图谱(CTA)集合中的基因在一种样本类型或所有样本的片段之间表现出差异表达。随后,他们按片段可视化无监督聚类热图中所有 1825 个 CTA 基因的表达(图 1 E)。在肿瘤发生过程中,上皮、免疫细胞和非免疫细胞基质区室中分别有 240、54 和 238 个基因上调。值得注意的是,在 ESCC 进展过程中,大量基因表现出表达下降,特别是在上皮部分,并且在样本之间基本一致(图 1 E),反映了恶性转化过程中组织生理特征的共同丧失。
为了全面评估进展过程中从正常组织到癌症的变化,他们使用从 WikiPathways 数据库 获得的数据集进行了通路富集分析。根据通路富集评分,上皮段的大多数癌症和高级别发育不良 AOI 聚集在一起,与正常组织和低级别发育不良的组织学有明显区别。确定了七个通路聚类(C1-C7),它们与恶性转化有不同程度的关联(图 2)。两个聚类(C1 和 C2)将主要在上皮段中活跃的通路分组在一起。C1 通路包括与细胞增殖和 DNA 损伤修复相关的生物过程,这些过程在 ESCC 发病期间持续增加。聚集在 C2 中的大多数通路与线粒体功能有关,线粒体功能在上皮段恶性转化过程中会降低。C5 和 C6 中的通路与基质区室相关。C5 中的通路反映了在肿瘤发生过程中失调的免疫相关通路。C3、C4 和 C7 中聚集的通路在上皮和基质中活跃,表明与肿瘤进展存在不同的关联。
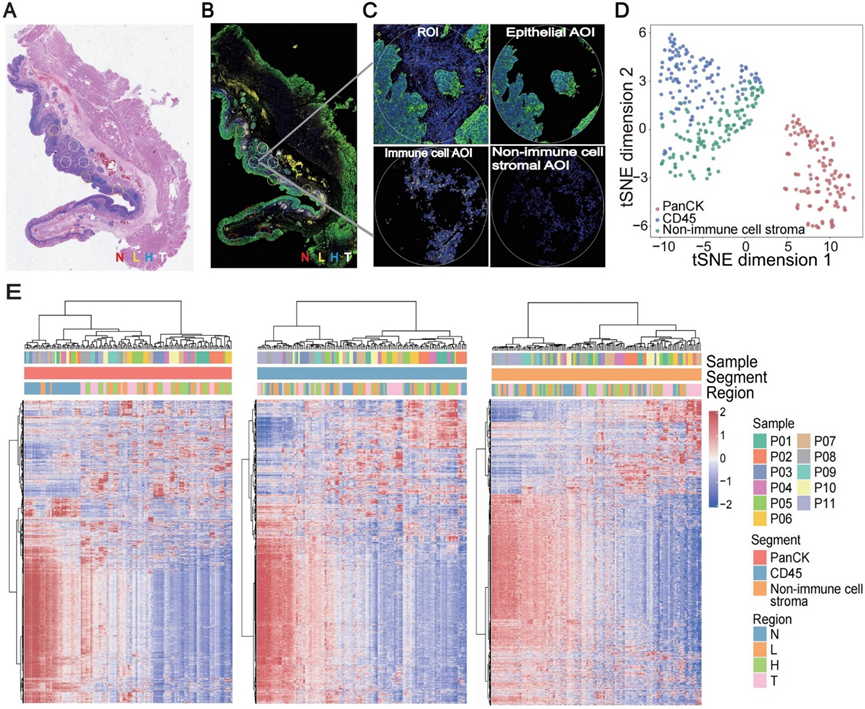
图1. 早期 ESCC 的数字空间分析。
(A) 用 H&E 染色的 pT1 ESCC 标本的代表性示例。(B-C) 免疫荧光检测。(D) 根据tSNE的整体基因表达谱对所有 AOI 进行降维可视化。(E) 基因表达热图。
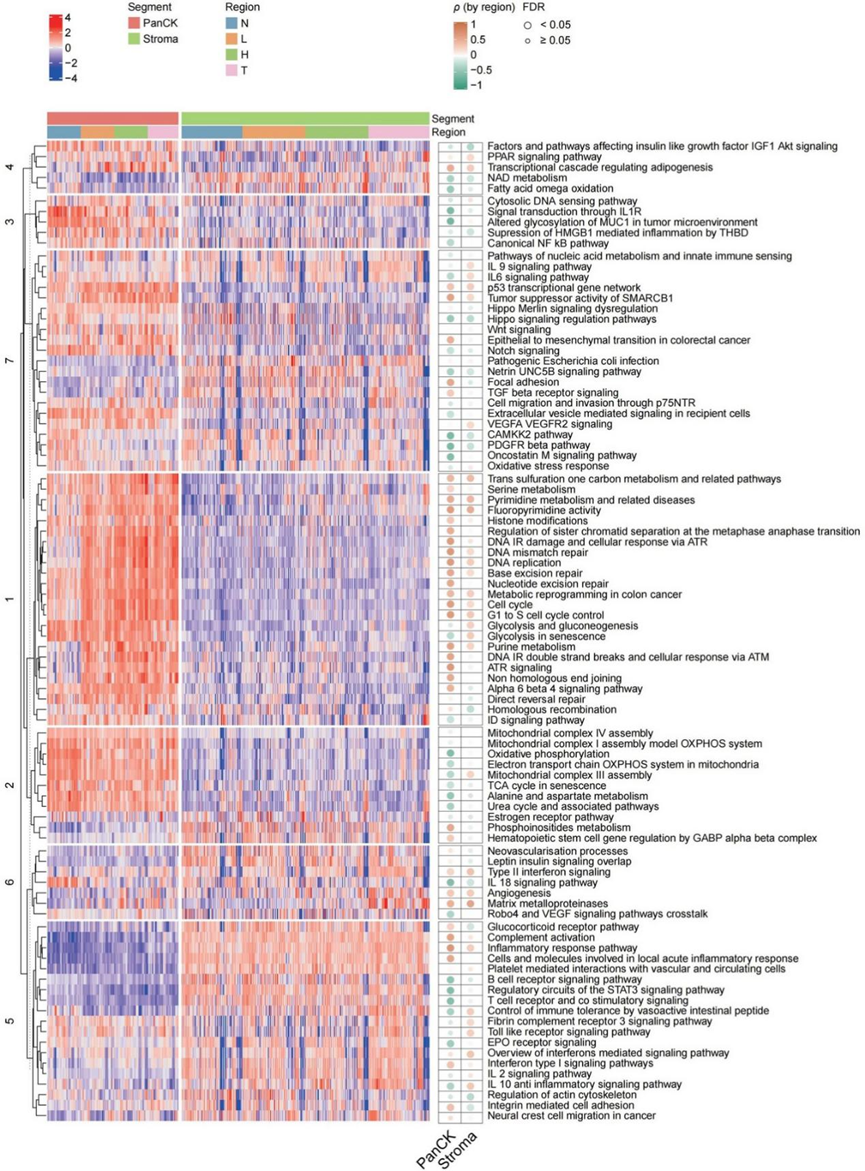
图2. 与上皮和基质区室中组织学进展相关的关键生物学通路。
02
ESCC 进展过程中的免疫相关改变
为了阐明免疫相关的改变,他们检测了 33 个与癌症免疫相关的功能性免疫调节基因的表达。大多数免疫调节基因表达来自基质片段。值得注意的是,基质细胞表达的抑制性免疫检查点基因(例如HAVCR2、CD276和SIRPA)在癌区域基质中的表达增加,这些上调的抑制性免疫检查点基因可能作为潜在的治疗靶点。
接下来,他们重新评估了 WikiPathways 的富集变化,特别是针对与免疫相关的基因集。值得注意的是,在恶性转化过程中,免疫相关特征发生了改变,反映了免疫微环境的变化(图 3 A)。在从正常粘膜向癌变的转变过程中,细胞因子相关(例如,干扰素概述、II 型干扰素、白细胞介素 (IL)-6 和 IL-10)和炎症反应通路在基质区中上调。与先天免疫相关的两条通路,包括“toll 样受体信号通路”和“纤维蛋白补体受体 3 信号通路”,在非免疫细胞基质段中持续上调。
受食管鳞状细胞癌发病过程中免疫相关基因和通路变化的影响,研究人员进一步评估了不同组织学区域之间肿瘤(免疫)微环境的改变。首先,使用 SpatialDecon 进行免疫细胞反卷积,以估计特定细胞亚群的相对丰度和比例。在正常组织转化为癌症的过程中,免疫细胞段中 CD4 + T 细胞、中性粒细胞和肥大细胞的相对比例降低(图 3B)。相反,在肿瘤发生过程中,免疫细胞区室中的巨噬细胞和调节性 T 细胞以及非免疫细胞区室中的成纤维细胞的相对比例增加(图 3B)。巨噬细胞促进转移性细胞的播散和建立,并在肿瘤的起始、进展和转移中发挥作用。在食管鳞状细胞癌进展过程中观察到促肿瘤 M2 巨噬细胞比例增加(图 3C)。 IHC 结果进一步表明,在从正常组织到 ESCC 的各个疾病阶段中,CD68(巨噬细胞标志物)和 CD163(M2 巨噬细胞标志物)的表达均有所增加(图3D-E)。总体而言,这些发现强烈表明,免疫抑制微环境的出现与肿瘤进展同时发生。
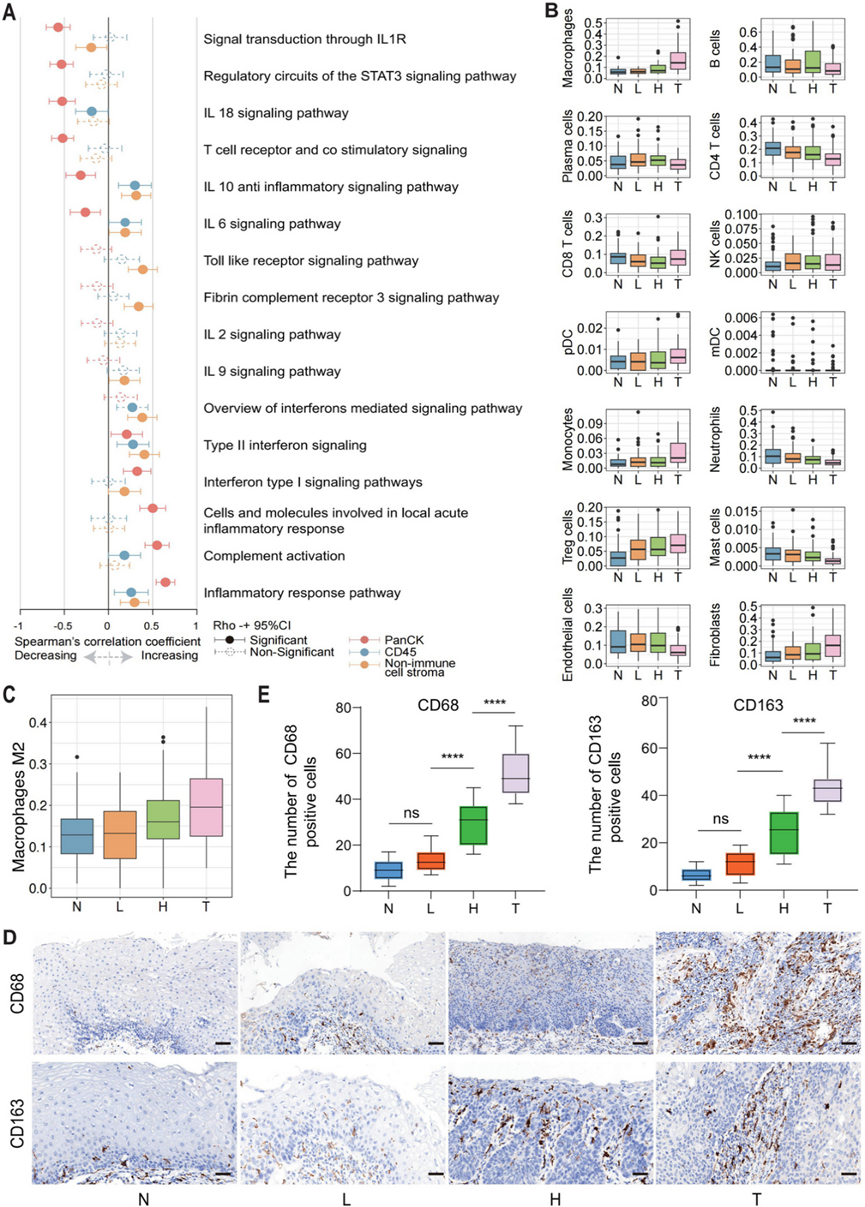
图3. 与 ESCC 组织学相关的免疫相关改变。
(A) Spearman's Rho 的森林图和相应的 95% CI,用于表示来自 WikiPathways 的免疫相关通路富集评分与作为序数变量的组织学之间的相关性。(B) 箱线图显示了由 SpatialDecon 计算的 CD45 和非免疫细胞基质节段中不同组织学中不同免疫和基质细胞群的比例。(C) 箱线图显示了由 CIBERSORT 计算的基质节段中不同组织学中 M2 巨噬细胞的比例。(D) 不同组织学中 CD68 和 CD163 的 IHC 染色载玻片的代表性图像。(E)在 20 个 pT1 ESCC 样本验证集中的四个病理阶段中通过 IHC 染色对 CD68 和 CD163 进行染色统计。
03
巨噬细胞亚群的表征以及巨噬细胞与肿瘤上皮细胞之间的相互作用
肿瘤的发生和进展可能受巨噬细胞表型的影响,不同的巨噬细胞亚型在促进肿瘤促进活动中发挥着关键作用。因此,分析了一个公开的单细胞转录组数据集 (GSE145370)。肿瘤组的总巨噬细胞比例明显高于正常组(图 4 A),这与DSP 反卷积结果一致(图 3 B)。鉴定出五个巨噬细胞亚聚类(图 4 B)。根据其高表达的特征基因和预测的功能,这些亚群可分为炎性细胞因子富集(Macro.0)、未表征(Macro.1)、干扰素引发(Macro.2)、脂质相关(Macro.3)和增殖(Macro.4)巨噬细胞。正常组和肿瘤组之间的巨噬细胞亚群组成比例差异很大(图 4 C)。值得注意的是,肿瘤组的 Macro.0 和 Macro.4 比例较高,而正常组的 Macro.1 比例较高。其余巨噬细胞亚群的比例在各组之间没有显著差异。
接下来,通过轨迹分析探索巨噬细胞的过渡状态。基于巨噬细胞基因表达动态,构建了伪时间发育树,显示出四个不同的分支点(图 4 D)。五个巨噬细胞亚聚类分散在发育树的各个分支上(图 4 E)。Macro.4 表现出最低的伪时间值并占据发育树的初始位置,表明其作为其他亚聚类的发育起源的作用。这与 Macro.4 的 GO 富集分析一致,将其标记为具有增殖特征的群体。Macro.1 和 Macro.2 位于相似的分支,而 Macro.0 和 Macro.3 表现出更广泛的分布。四个分支上变化最显著的基因聚类在一起。
全面了解肿瘤微环境(TME)内肿瘤上皮细胞和巨噬细胞之间的相互作用将有助于深入了解ESCC进展的潜在机制。最近的研究强调了肿瘤和免疫细胞之间的通讯在ESCC发展中的重要性。他们使用了另外两个公共ESCC 单细胞转录组分析(scRNA-seq)数据集,即GSE160269和GSE221561来研究正常和肿瘤组织中上皮细胞和巨噬细胞之间的信号网络。然而,由于巨噬细胞数量有限,无法对巨噬细胞群进行亚聚类。因此,阐明了上皮细胞和总巨噬细胞之间的信号网络。在上皮细胞和巨噬细胞之间观察到复杂的细胞间相互作用网络(图 4 F)。在肿瘤样本中专门鉴定了与上皮细胞和巨噬细胞之间相互作用相关的十条信号通路。与正常组织相比,在肿瘤组织中,七条信号通路在上皮细胞和巨噬细胞之间的通讯中表现出显著的参与。重要的是,据报道所有这些通路都与肿瘤发生有关。此外,使用 CosMx 空间分子成像 (SMI)技术对另外 4 个 pT1 ESCC 的 FFPE 样本进行了单细胞空间转录组学分析。值得注意的是,scRNA-seq 和 SMI 数据显示,配体-受体对巨噬细胞迁移抑制因子 (MIF)-(CD74 + CXCR4) 和 MIF-(CD74 + CD44) 表现出特别高的相互作用分数(图4 G-H)。
为了识别负责 MIF 信号通路和巨噬细胞之间串扰的上皮细胞亚群,将上皮细胞进一步细分为 6 个亚群 (Epi.0-Epi.5)(图4 I)。这些亚群的分布在肿瘤组和正常组之间有明显区别。具体而言,肿瘤 组中 Epi.0、Epi.2、Epi.3 和 Epi.5 的比例较高,而正常组中 Epi.1 和 Epi.4 的比例较高。MIF 信号通路显示巨噬细胞和每个上皮亚群之间存在强大的相互作用(图 4 J)。上皮细胞亚群高度表达 MIF,MIF 是一种炎性细胞因子,参与多种癌症类型的肿瘤发生。CD74 通过与 MIF 相互作用促进肿瘤细胞增殖。因此,抑制 MIF-CD74 轴有望阻止肿瘤发生,并可作为治疗 ESCC 的可行治疗策略。
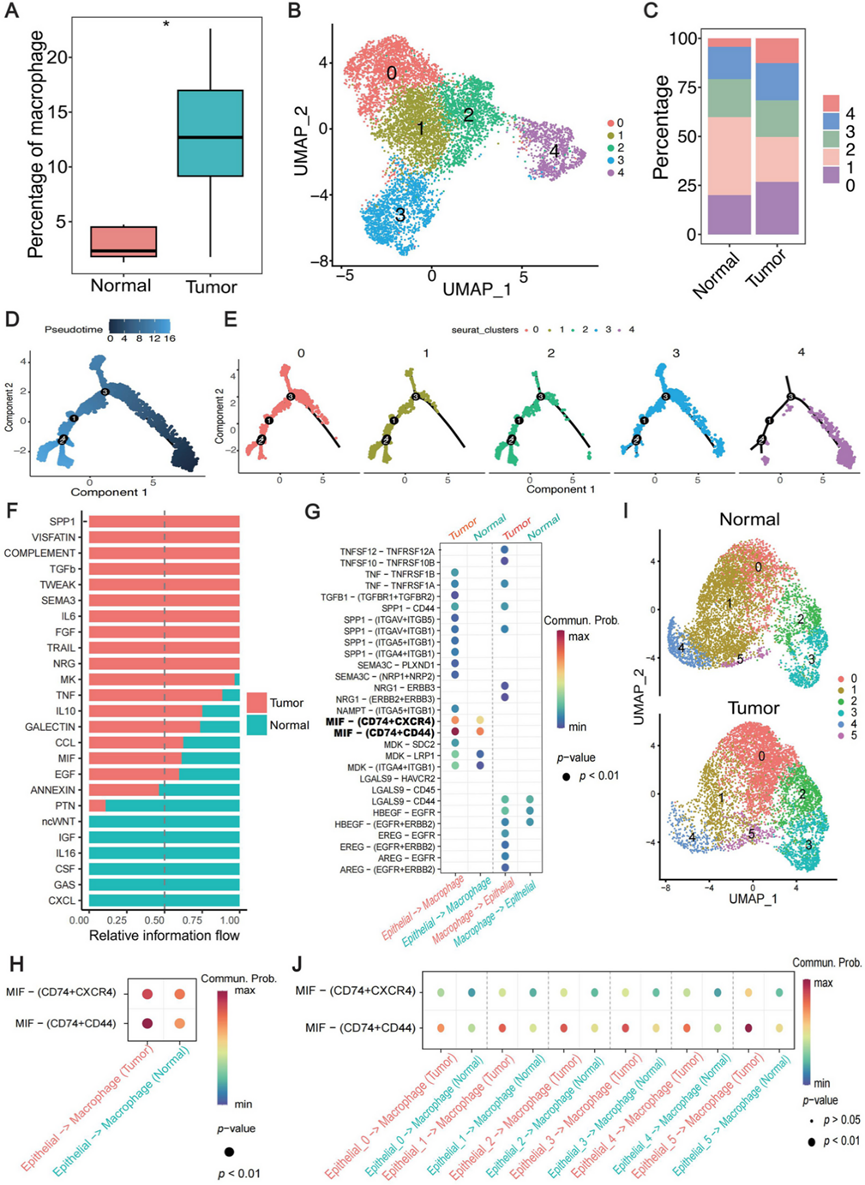
图4. 巨噬细胞亚型的表征以及巨噬细胞与肿瘤上皮细胞之间的相互作用。
(A) 肿瘤和正常组织中的巨噬细胞总数。(B) 巨噬细胞亚聚类的 UMAP 可视化。(C) 正常/肿瘤样本中已识别的巨噬细胞亚聚类的百分比。(D) 按伪时间值对巨噬细胞亚群的轨迹顺序。(E) 按聚类划分的巨噬细胞亚群在发育树上的分布。(F) 正常和肿瘤样本之间显著差异表达的配体-受体信号通路。(G) 气泡图显示上皮细胞和巨噬细胞之间选定的配体-受体相互作用。(H) 气泡图显示使用 SMI 数据的上皮细胞和巨噬细胞之间的 MIF-(CD74 + CXCR4) 和 MIF-(CD74 + CD44) 相互作用。(I) 上皮细胞亚聚类的 UMAP 可视化。(J) 气泡图显示上皮细胞亚聚类和巨噬细胞之间的 MIF-(CD74 + CXCR4) 和 MIF-(CD74 + CD44) 相互作用。
04
识别与 ESCC 逐步进展相关的潜在生物标志物
为了阐明从正常组织到癌症的逐步进展相关的基因表达变化,他们分析了不同组织学类型的区域之间的差异基因表达。在上皮区域内,正常组织与低度异型增生区域之间以及低度异型增生与高度异型增生区域之间的比较分别产生了 364 个和 89 个 DEG(图 5 A)。在基质区中,正常组织与低度异型增生之间以及低度异型增生与高度异型增生之间仅观察到微小差异(图 5 B-C)。值得注意的是,CXC 基序趋化因子配体 1 ( CXCL1 ) 和CCL18表达在低度发育不良的基质中增加(图 5 C),表明早期炎症过程与肿瘤发生增强有关。在肿瘤区域,上皮和基质区室中观察到基因表达的显著差异(图 5 A-C)。总体而言,这些发现支持了以下观点:ESCC 起始与(前)恶性上皮细胞和邻近基质细胞的转录变化有关。
特定基因在不同组织学的相邻区域之间表现出明显的表达改变,从而成为早期 ESCC 检测的潜在指标。为了说明这一点,选择了 8 个在不同区域之间表达存在明显差异的基因(图 5D-E),每个基因都与肿瘤进展具有重要意义。ALCAM、PPL、SGK1、SLC1A5、TFRC和TPM4与 ESCC 肿瘤发生有关。ESCC 标本在上皮区室中的SLC1A5表达高于相应的相邻正常组织,而在基质区室中没有观察到这种差异(图 5D)。潜在的新型生物标志物DTX3L在上皮段的表达和BST2在基质段的表达均表现出显著的上调(图 5 D-E)。SMI 数据进一步证实,上皮细胞中的DTX3L表达和基质细胞中的BST2表达随 ESCC 进展而增加。为了确定这些新型生物标志物的基因表达变化是否与蛋白质水平的变化相关,进行了 免疫组织化学(IHC)染色。在样本中验证了 ESCC 逐步进展过程中上皮段中DTX3L和基质段中 BST2的上调(图5 F-G)。
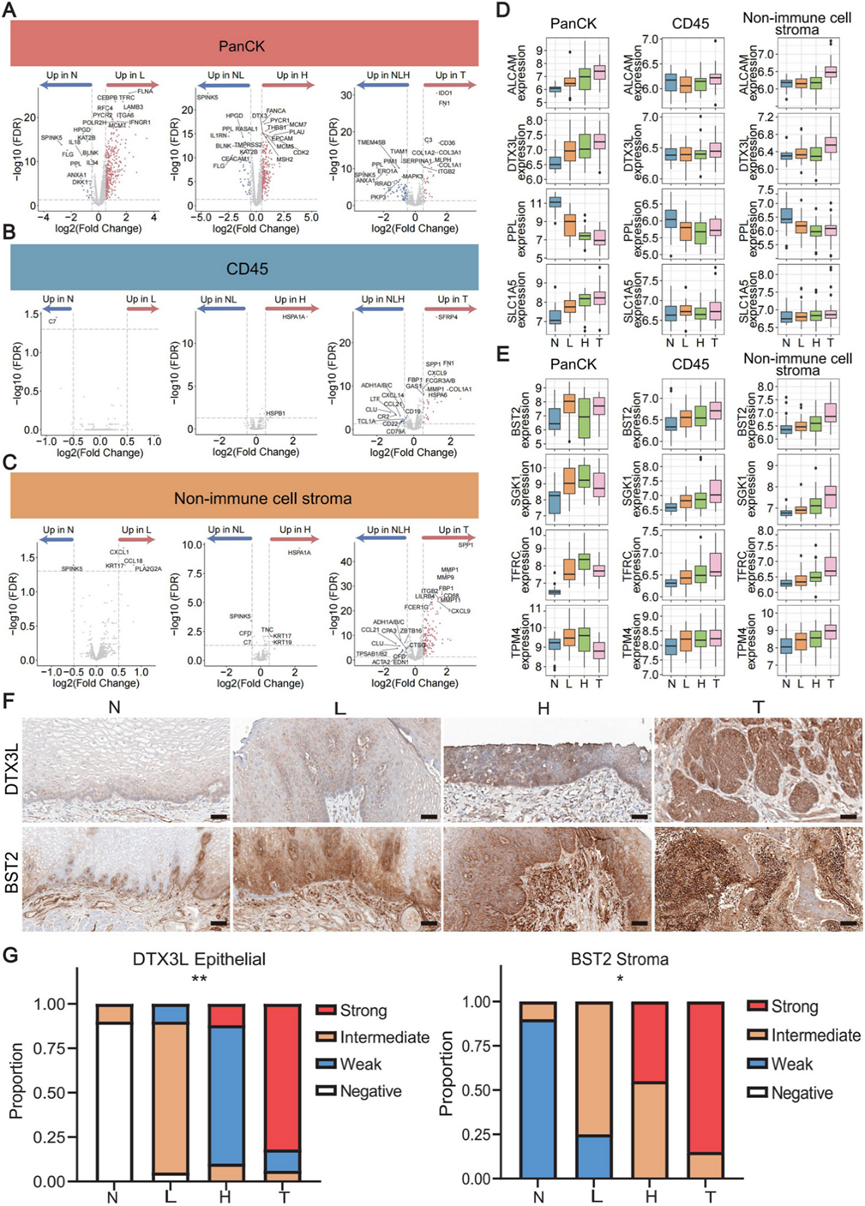
图5. 在空间不同区域内识别与 ESCC 逐步进展相关的 DEG。
(A-C) 火山图显示逐步比较中不同组织学之间的 DEG。(D) 在上皮中检测到的四种 DEG 的 log2 转换的归一化基因表达的箱线图以及免疫细胞和非免疫细胞基质节段中相应的基因表达。(E) 在免疫细胞或非免疫细胞节段中鉴定的四种DEG的箱线图以及上皮中相应的基因表达。(F) 在具有不同组织学(正常、低度发育不良、高度发育不良和肿瘤)的区域中对 DTX3L 和 BST2 进行 IHC 检测的代表性图像。(G) 20 个 pT1 ESCC 样本的验证集中 DTX3L 和 BST2 的蛋白质丰度。堆积条形图反映了每个评分类别中样本的比例。
05
DTX3L 和 BST2 特性
DTX3L,也称为 B 淋巴瘤和 BAL 相关蛋白,在神经胶质瘤、黑色素瘤和胰腺癌的肿瘤进展中发挥作用。骨髓基质细胞抗原 2(BST2,也称为 HM1.24/CD317)与乳腺癌、结直肠癌和胰腺内分泌肿瘤的肿瘤进展和转移有关。他们结合了 TCGA 的数据研究了它们在多种癌症类型中的表达。DTX3L 和 BST2广泛表达,并且在各种癌症类型的肿瘤组织中显著增加。GEO 数据集 (GSE213565)表明DTX3L和BST2在 ESCC 组织中的表达显著高于正常组织。TCGA 数据集表明DTX3L和BST2 的表达与 ESCC 的性别或 TNM 分期无显著相关性。GO分析显示,在DTX3-high和BST2-high ESCC中富集的通路分别是受体分解代谢过程的调节和干扰素反应。
BST2在结直肠癌的肿瘤进展和 M2 肿瘤相关巨噬细胞 (TAM) 极化中起着至关重要的作用。因此,他们探索了 BST2 在 ESCC 中是否具有类似的生物学功能。BST2 高表达的 ESCC 患者的免疫评分较高(图 6 A)。xCell 结果显示,BST2高表达组的免疫 细胞浸润比BST2 低表达组更明显(图 6 B)。总和 M2 极化巨噬细胞在BST2高表达组中显著富集。此外,DSP 数据的分析显示,免疫细胞和基质区室与总和 M2 巨噬细胞中的 BST2表达呈正相关(图6 C-D)。代表性 IHC 图像显示,BST2高表达往往与 M2 巨噬细胞(CD163 阳性)浸润增加有关(图 6 E-F)。值得注意的是,scRNA-seq 数据显示,总巨噬细胞、Macro.1 和 Macro.2在肿瘤组织中的BST2表达显著高于正常组织(图 6 G-H)。干扰素引发的巨噬细胞 (Macro.2) 类似于最近发现的免疫抑制巨噬细胞亚型,该亚型通过色氨酸降解和免疫抑制 Treg 募集发挥免疫抑制作用。总体而言,BST2可能调节 ESCC 微环境中 TAM 的浸润和状态。
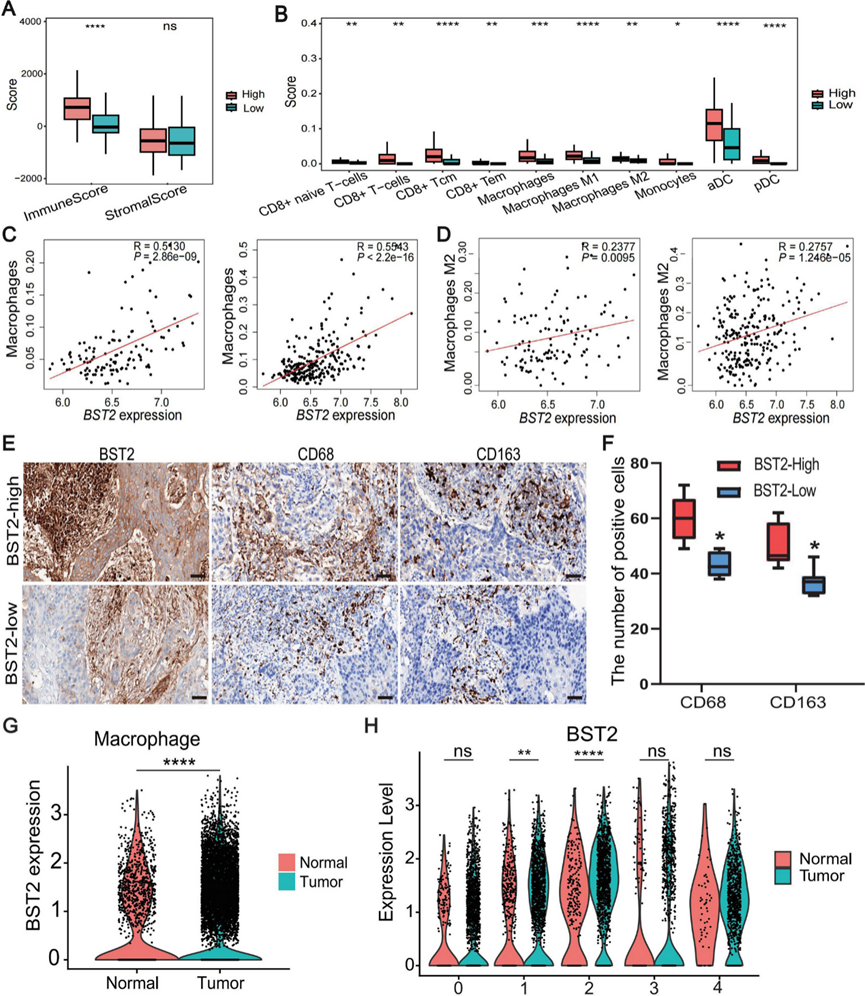
图6. BST2与 ESCC 中 TAM 浸润之间的关联。
(A) TCGA 队列中免疫和基质评分与BST2表达之间的关联。(B) TCGA队列中BST2高表达组和低表达组之间的免疫细胞浸润的 xCell 分析。(C-D) 使用 DSP 数据对基质段中BST2表达与总巨噬细胞和 M2 巨噬细胞比例之间的相关性进行分析。(E) BST2、CD68 和 CD163(M2 巨噬细胞标志物)的代表性 IHC 染色图像。(F) IHC 染色的定量分析。(G-H) 小提琴图显示通过分析scRNA-seq数据集确定的正常/肿瘤样本的巨噬细胞和巨噬细胞亚聚类中BST2表达的分布。
06
确定 DTX3L 和 BST2 在加速 ESCC 进展中的作用
功能研究可以深入了解基因影响癌症进展的分子机制。为了评估DTX3L对 ESCC 进展的影响,他们构建了DTX3L敲低细胞系(Eca-109 和 TE-1),分别使用 shRNA 和 siRNA 技术评估DTX3L对 ESCC 的影响。Transwell 和伤口愈合试验表明,DTX3L敲低显著抑制了 ESCC 细胞迁移(图 7 A-B)。此外,DTX3L敲低抑制了 Eca-109 和 TE-1 细胞增殖,这通过克隆形成以及 CCK-8 和 EdU 测定(图 7 C-D) 确定。为了探索DTX3L在体内的生物学作用,分别将Dtx3l敲低和对照 AKR 细胞接种到 C57BL/6 小鼠中。观察到dtx3l敲低后肿瘤体积显著减小(图 7 E-F)。此外,他们利用 IHC 研究了Dtx3l表达与增殖(由 Ki-67 检测)以及巨噬细胞浸润(由 F4/80 和 CD206 检测)之间的关联。结果显示Dtx3l敲低组中增殖减少,同时浸润的巨噬细胞减少,特别是 M2 巨噬细胞(图 7 G-H)。
为了评估BST2对巨噬细胞极化的影响,在 THP-1 衍生的巨噬细胞中敲低BST2 ,或用抗 BST2 处理 THP-1 衍生的巨噬细胞。如预期的那样, BST2敲低或抗 BST2 处理的巨噬细胞中的 M2 标志物表达明显低于对照组(图 7 I)。流式细胞分析进一步支持了这些结果,结果显示 CD163 +细胞数量减少(图 7 J)。考虑到巨噬细胞的表型转变调节癌细胞的增殖、迁移和侵袭能力,他们研究了BST2敲低或抗 BST2 处理巨噬细胞对 ESCC 进展的影响。将从BST2敲低或用抗 BST2 处理的THP-1 衍生巨噬细胞中收集的条件培养基 (CM)添加到 Eca-109 或 TE-1 细胞培养物中,并评估 Eca-109 或 TE-1 细胞的增殖和迁移能力。用BST2敲低或抗 BST2 处理的巨噬细胞的 CM 培养的 ESCC 细胞表现出迁移抑制(图 7 K-L)和增殖抑制(图 7 M-N)。此外,与 Eca-109 和DTX3L敲低的 TE-1 细胞的 CM 共培养的 THP-1 细胞促进了 M2 巨噬细胞极化(图 7 O-P)。
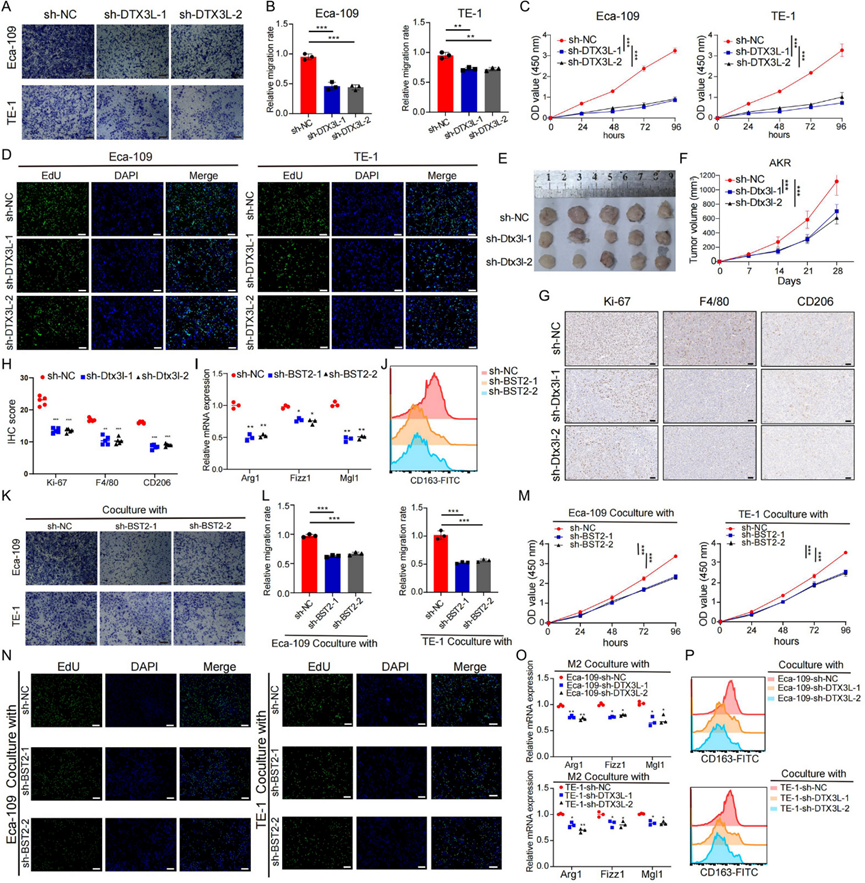
图7. 使用 shRNA 系统在体外和体内识别候选基因在ESCC 进展和 M2 巨噬细胞极化中的作用。
(A) 通过Transwell 测定评估DTX3L敲低的 Eca-109 或 TE-1 细胞的迁移。(B) 通过伤口愈合测定评估DTX3L敲低的 Eca-109 或 TE-1 细胞的迁移。(C) DTX3L 敲低的 Eca-109 或 TE-1 细胞的 CCK-8 测定。(D) 通过 EdU 掺入测定确定 DTX3L敲低的Eca -109 或TE-1细胞的增殖。(E) 小鼠 28 天安乐死后的肿瘤图片。(F) C57BL 小鼠的肿瘤体积。(G) 代表性 IHC 图像显示检测到 ki-67、F4/80 和 CD206。(H) 通过IHC 染色对 ki-67、F4/80 和 CD206 进行统计分析。(I) BST2敲低的 THP-1 衍生巨噬细胞中巨噬细胞标志物的相对 mRNA 表达。(J) 流式细胞分析。(K) 通过Transwell分析评估 Eca-109 和 TE-1 细胞的迁移能力。(L) 通过伤口愈合分析评估DTX3L敲低的 Eca-109 或 TE-1 细胞的迁移。(M) 通过 CCK-8 检测与BST2敲低的 THP-1 衍生的巨噬细胞的CM共培养的 Eca-109 和 TE-1 细胞的增殖。(N) 通过 EdU 分析检测 Eca-109 和 TE-1 细胞的增殖。(O) 与 DTX3L 敲低的 Eca-109 和 TE- 1细胞的 CM 共培养的 THP-1 衍生的巨噬细胞中巨噬细胞标志物(Arg1、Fizz1和Mgl1)的相对mRNA表达。(P)流式细胞分析。
+ + + + + + + + + + +
结 论
本项研究分析了决定 ESCC 进展的空间转录重编程和动态细胞信号通路。巨噬细胞从正常组织通过发育不良向癌组织浸润增加。使用 scRNA-seq 数据集表征巨噬细胞亚型。scRNA-seq 和 SMI 数据的细胞间通讯分析表明,迁移抑制因子 (MIF)-CD74 轴可能表现出巨噬细胞和上皮细胞之间的促肿瘤相互作用。DSP、SMI 和 IHC 数据表明,随着 ESCC 进展,上皮细胞中的DTX3L表达和基质细胞中的BST2表达逐渐增加。功能研究表明,DTX3L或BST2敲低可抑制 ESCC 增殖和迁移,并降低肿瘤相关巨噬细胞的 M2 极化。空间分析全面表征了从正常组织到 ESCC 的分子和免疫学特征,为深入了解该疾病的肿瘤发生和进展提供了指导,并有助于预防 ESCC。
+ + + + +



 English
English


