文献解读|Science(44.7):人类胶质母细胞瘤中不同的髓系抑制细胞群
✦ +
+
论文ID
原名:Distinct myeloid-derived suppressor cell populations in human glioblastoma
译名:人类胶质母细胞瘤中不同的髓系抑制细胞群
期刊:Science
影响因子:44.7
发表时间:2025.01.17
DOI号:10.1126/science.abm5214
背 景
针对 T 细胞检查点 CTLA-4、PD-1/L1 以及最近的 LAG3的检查点阻断免疫疗法已经改变了多种实体瘤的治疗标准。然而,这些基于免疫的疗法对神经胶质瘤的益处迄今为止令人失望。异柠檬酸脱氢酶野生型 (IDH-WT) 神经胶质母细胞瘤是最致命的成人型弥漫性神经胶质瘤,是免疫学上“冷肿瘤”的典型例子,其肿瘤浸润淋巴细胞相对较少,这极大地限制了 T 细胞靶向疗法的有效性。已在神经胶质母细胞瘤中证实存在真正的新抗原特异性 T 细胞。综上所述,这些发现表明,神经胶质母细胞瘤肿瘤微环境 (TME) 中的其他细胞和信号可以抑制肿瘤特异性 T 细胞的功能。肿瘤浸润性髓系细胞是 TME 的重要组成部分,占胶质母细胞瘤中肿瘤浸润性免疫细胞的 70% 以上。然而,人们对胶质瘤相关髓系细胞 (GAM) 的确切组成和表型、它们在塑造和与胶质母细胞瘤 TME 其他成分相互作用中的作用以及它们作为治疗干预靶点的适用性了解甚少。
实验设计

结 果
01
胶质瘤中髓系细胞的多样性和独特性
为了表征胶质瘤和健康对照患者中 GAM 的多样性,研究团队对来自 21 例切除的 IDH-WT 胶质母细胞瘤、6 例 IDH 突变和 1p/19q 编码缺失的 2 级少突胶质细胞瘤、1 例 IDH 突变的 2 级星形细胞瘤、3 例 IDH 突变的 3 级星形细胞瘤、2 例 IDH 突变的 4 级星形细胞瘤和 5 例非肿瘤性脑组织样本的新鲜分离的荧光激活细胞分选 (FACS) 纯化的 CD45+CD3- 免疫细胞进行了单细胞转录组分析(scRNA-seq)(图 1A)。共有 240183 个 CD45+CD3- 免疫细胞通过了质量控制并纳入分析。对所有分析的肿瘤和非肿瘤脑组织样本的 CD45+CD3- 细胞的总组合转录组应用无偏聚类和批次效应校正算法,鉴定出 18 个免疫细胞聚类。使用典型标记基因识别主要细胞群;HLA-DR 表达低的髓系细胞是 MDSC 的特征(图 1B),特别关注髓系细胞,他们鉴定出 14 个髓系细胞聚类,包括 5 个小胶质细胞聚类和 9 个 BMDM 聚类(图 1C),利用每个聚类与其他髓系聚类的差异表达基因,他们将各个聚类注释为不同的细胞类型(图 1D-E)。单细胞分析表明,非肿瘤和肿瘤中枢神经系统区室中的小胶质细胞和 BMDM 群体组成多样而复杂,这大大扩展了神经胶质瘤中 M1 和 M2 肿瘤相关巨噬细胞的传统观点。

图1. 通过 scRNA-seq 对 GAM 进行分析揭示了多样化的景观。
(A) 显示了对神经胶质瘤中的肿瘤和免疫细胞进行 scRNA-seq 分析的实验设计示意图。(B-C)UMAP可视化。(D) Z分数标准化热图,显示每个聚类中变化最大的前 5 个差异表达基因。(E) 条形图显示小胶质细胞和 BMDM 聚类中选定的代表性基因的基因表达水平。
02
IDH-WT 胶质母细胞瘤中特有的独特 MDSC 群体
根据小鼠模型的数据,TME 中的特定髓系细胞群可影响肿瘤细胞的生长和表型以及抗肿瘤免疫力,他们首先研究了 GAM 细胞群的分布是否因肿瘤等级和分子状态而异。他们发现在更具侵袭性的肿瘤状态下,BMDM 的数量远远多于小胶质细胞,并且 BMDM 比例的增加与胶质瘤等级的增加相关(图 2A)。值得注意的是,他们发现 14 个髓系细胞群中只有 2 个是 IDH-WT 胶质母细胞瘤所特有的,而在 IDH 突变 2 级和 3 级胶质瘤中几乎不存在(图 2B),其中一个是缺乏谱系标志物表达的类似于早期 MDSC (E-MDSC) 的群体,另一个是 CD14 表达更强的单核细胞 MDSC (M-MDSC) 群体。将第三个髓系群体指定为 MAC2,具有 M1 和 M2 巨噬细胞的转录组特征,在 IDH-WT 胶质母细胞瘤中也高度富集,但是在 IDH 突变的低级别肿瘤中观察到少量。值得注意的是,当比较这些 MDSC 在具有不同分子特征的肿瘤中的存在时,与 IDH 突变的 4 级星形细胞瘤相比,这些细胞仅存在于 IDH-WT 胶质母细胞瘤中。这些细胞的存在在其他分子特征[即表皮生长因子受体 (EGFR) 扩增和突变状态或 O6-甲基鸟嘌呤-DNA 甲基转移酶 (MGMT) 甲基化状态] 中没有显著差异。
这三个群体的转录组分析表明,E-MDSC 优先表达编码代谢酶、应激诱导基因和金属硫蛋白的多个基因;M-MDSC 优先表达多个 S100A 家族基因和细胞迁移基因;MAC2 巨噬细胞群表达高水平的 MHC2、清道夫受体和组织损伤相关基因(图 2C)。IDH-WT 胶质母细胞瘤中没有其他髓系群体选择性存在。虽然MDSC 在抑制 T 细胞贫乏肿瘤中的天然抗肿瘤 T 细胞反应中的作用尚不清楚,但是,MDSC 功能的标准测试是在体外抑制 T 细胞增殖反应。通过 FACS 将胶质母细胞瘤浸润的 MDSC 分离成 M-MDSC(CD14+)、PMN-MDSC(CD15+)和 E-MDSC(CD14-、CD15- 和 CD16-)群体。将细胞示踪紫染料 (CTV) 标记的、抗 CD3/CD28 刺激的外周血单核细胞 (PBMC) 与每个肿瘤相关的 MDSC 亚群以不同的 MDSC:PBMC 比率独立共培养。他们发现所有三种 MDSC 亚群均能强烈抑制 T 细胞增殖(通过 CTV 稀释测定),其中 M-MDSC 在体外对 CD4 和 CD8 T 细胞增殖的抑制最强。这些结果证实,在单细胞分析中转录定义的 MDSC 表现出 MDSC 的典型功能特征。
为了推断 GAM 的分化轨迹和转录状态,他们生成了扩散图并对 BMDM 细胞进行了伪时间和 RNA 速度分析,特别关注 MDSC 和巨噬细胞群。他们发现三对胶质母细胞瘤特异性髓系群体之间存在发育联系(E-MDSC→M-MDSC、MAC1→MAC2、PMN→PMN-MDSC)。E-MDSC 是发育轨迹中最早的,并且有可能沿着与 M-MDSC 不同的发育轨迹发育(图 2D)。
接下来,为了鉴定从 E-MDSC 到 M-MDSC 的单细胞轨迹中动态变化的特定基因,他们使用伪时间分析来评估通过 RNA 速度分析矢量建立的个体分化轨迹的转录组特征(图 2E)。随着细胞在 E-MDSC 和 M-MDSC 状态之间转变,与细胞外基质成分和重塑(CD44、FLNA、VCAN和FN1)、免疫炎症(FCN1和S100蛋白)、趋化因子(CXCL2和CXCL3)和单核细胞清道夫受体(CD14、MARCO和CD163)相关的基因表达增加,这些基因通常与 M2 巨噬细胞有关。相反,与代谢途径相关的基因表达减少,包括糖酵解(HK2、ENO2和SCD)、抗氧化途径(HMOX1、MT1G和MT1H)和细胞应激反应(BNIP3和NUPR1)(图 2E)。在细胞从 E-MDSC 状态转变为 M-MDSC 状态的过程中,代谢和缺氧途径的下调表明这些细胞所处的 TME 微环境存在差异。

图2. IDH-WT 胶质母细胞瘤含有特定的 MDSC 群体,这些群体存在于一系列细胞状态中。
(A) 比较不同肿瘤等级和非肿瘤组织中 BMDM 和小胶质细胞占总髓系细胞的比例(百分比),结果显示随着肿瘤侵袭性的增加,BMDM 比例增加,小胶质细胞比例减少。(B) 箱线图显示与 IDH 突变型胶质瘤(包括 4 级 IDH 突变型星形细胞瘤)相比,IDH-WT 胶质母细胞瘤中 E-MDSC、M-MDSC 和 MAC2 细胞群的比例增加。(C) IDH-WT 胶质母细胞瘤中富集的三个 BMDM 亚群细胞之间的差异表达基因热图显示了不同的转录组谱,每列代表一个细胞。(D) IDH-WT 胶质母细胞瘤中 BMDM 聚类的 RNA 速度扩散图表明 BMDM 之间存在发育联系,E-MDSC 有可能转变为 M-MDSC。(E) 热图展示了沿 E-MDSC 到 M-MDSC 轨迹的基因表达模式,与免疫炎症和清道夫受体相关的基因表达增加,与代谢途径相关的基因表达减少。
03
IDH-WT 胶质母细胞瘤 MDSC 表现出强劲的分解代谢和合成代谢
鉴于细胞在不同髓系细胞状态之间转换时与代谢途径相关的基因的拟时间表达发生了重大变化,他们进行了基因集富集分析 (GSEA),以进一步表征代表 MDSC 群体功能状态的途径。与其他 BMDM 亚群相比,对 E-MDSC 和 M-MDSC 中差异表达基因的 GSEA 分析表明,最突出的诱导基因集以多种分解代谢和合成代谢途径为主,包括糖酵解、氧化磷酸化、脂肪酸代谢和哺乳动物雷帕霉素靶 (mTOR) 途径的富集(图 3A)。在两种 MDSC 群体中发现的最富集的基因集途径是碳水化合物和脂质代谢途径。除了糖酵解和脂肪酸代谢外,E-MDSC 还表现出其他碳水化合物代谢的上调,包括果糖和甘露糖、戊糖磷酸途径、核苷酸和氨基糖代谢以及氨基酸代谢。使用 SCENIC,一种根据其调节子的表达水平确定特定转录因子活化状态的程序,他们确定了 E-MDSC 特异性激活的调节代谢途径的转录因子,包括对葡萄糖、脂质和氨基酸代谢稳态至关重要的CREB 、ATF、PPAR和RXR转录因子家族(图 3B),进一步检测 E-MDSC 与 M-MDSC 中的程序,E-MDSC 似乎对这些转录因子的激活程度更高(图 3B),并显示出编码参与糖酵解的关键酶的基因表达显著增加:己糖激酶-2 (HK2) 和 3-磷酸甘油醛脱氢酶 (GAPDH)。该细胞群还显示出葡萄糖转运蛋白 1 (SLC2A1) 的表达增加,这使得葡萄糖可以作为糖酵解的底物流入细胞。这些广泛的合成代谢和分解代谢转录程序高度表明存在活跃的增殖群体。事实上,E-MDSC 和 M-MDSC 代表了由MKI67等基因定义的增殖髓样聚类的主要成分。循环髓样细胞的亚聚类表明 E-MDSC 和 M-MDSC 占循环细胞的近一半(图 3C)。
为了在蛋白质水平上验证胶质母细胞瘤相关 MDSC 的主要代谢程序,他们对另外 10 个 IDH-WT 胶质母细胞瘤肿瘤样本进行了 21 色多参数流式细胞分析。使用针对各种髓系相关分子的抗体以及代谢酶和标志物的组合,他们确定了两个不同的 HLA-DR−CD33+ 细胞群,它们重现了从 scRNA-seq 分析中确定的 MDSC 亚群(图 3D)。具体来说,可以辨别出一个 MDSC 群体,它重现了 HK2 和 GLUT1 的高表达,类似于通过 scRNA-seq 鉴定的 E-MDSC 群体。他们还鉴定出另一个单独的 MDSC 群体,它具有更高的 CD14 和 CD206 表达和更低的 GLUT1 表达,类似于通过 scRNA-seq 鉴定的 M-MDSC 群体。虽然两个 MDSC 群体都表现出葡萄糖代谢的上调,但与 M-MDSC 相比,E-MDSC 表现出更高的 GLUT1 表达。他们假设 M-MDSC 可能使用不同的葡萄糖转运蛋白。基因表达分析发现它们显示出更高的 GLUT3 表达,而 E-MDSC 显示出更高的 GLUT1 和 GLUT5 表达。流式细胞结果还表明,与 HLA-DR+ 巨噬细胞相比,这些细胞中电压依赖性阴离子选择性通道 1 (VDAC1)、线粒体输入受体亚基 TOM20 同源物 (TOMM20) 和磷酸化 S6 核糖体蛋白 (pS6) 的表达增加,它们分别是氧化磷酸化和 mTOR 途径的一部分。总之,这些蛋白质组学研究验证了单细胞转录组分析,表明 MDSC 中多种代谢途径显著上调。他们进一步对来自相同胶质母细胞瘤患者的匹配 PBMC 进行了流式细胞分析,这些患者的肿瘤重现了 scRNA-seq 分析的蛋白质验证。这些分析表明,HK2+ MDSC 仅存在于肿瘤浸润性髓系细胞中,而不是外周血中,这些细胞会因缺乏营养的 TME 而改变其代谢途径(图 3E)。总之,这些发现表明,胶质母细胞瘤 MDSC 经过高度编程,可以吸收和代谢 TME 中有限的营养物质,以满足高能量需求以及通过合成代谢途径快速细胞扩增。这些上调的代谢程序是肿瘤细胞本身的特征,但此前尚未在 TME 中的 MDSC 中发现。
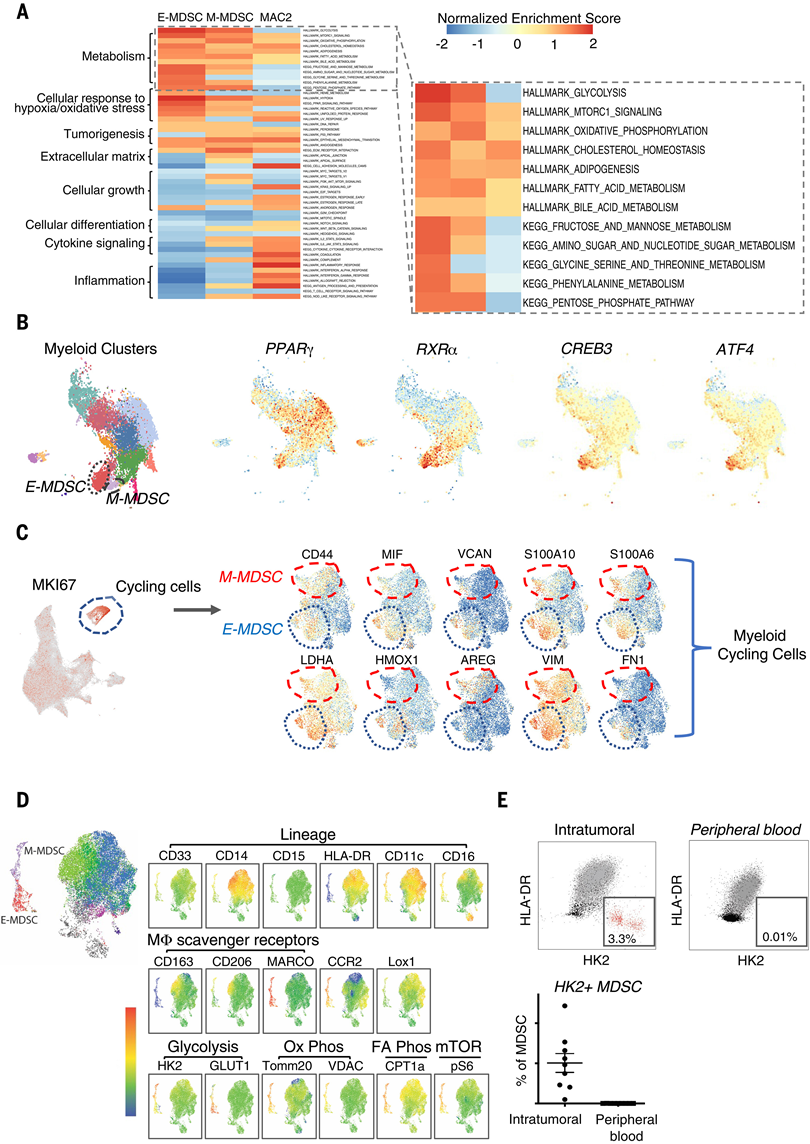
图3. 胶质母细胞瘤特异性MDSC表现出不同的代谢途径。
(A) E-MDSC、M-MDSC 和 MAC2 细胞群中 Hallmark 和 KEGG GSEA 富集通路的热图。(B) UMAP 图显示 MDSC 中调节碳水化合物、脂肪酸和氨基酸代谢的转录因子的激活增加。(C) UMAP 图显示具有高表达循环基因 (MKI67) 的髓系细胞群(左)。循环髓系细胞的亚聚类表明 E-MDSC 和 M-MDSC 占循环细胞的近一半。亚聚类循环细胞的 UMAP 图显示大量细胞表现出在 E-MDSC 和 M-MDSC 细胞中特有的基因的高表达(右)。(D) 多色流式细胞分析的 t 分布随机邻域嵌入 (t-SNE) 图。(E)与 PBMC相比,TME 中存在在各种代谢途径中特征蛋白高表达的 HK2+ MDSC。
04
具有干细胞样和间充质程序的 E-MDSC 与胶质瘤细胞之间的潜在配体-受体相互作用和空间共定位
为了确定髓系细胞和肿瘤细胞之间的潜在相互作用,他们接下来对 CD45- 细胞群进行了无监督聚类分析,通过根据基因在基因组各个位置的表达强度推断拷贝数变异 (CNV),将细胞分为恶性和非恶性细胞类型(inferCNV)。他们在均匀流形近似和投影 (UMAP) 分析中使用与先前研究一致的元程序定义了十个肿瘤细胞聚类(图 4A)。接下来,他们评估了不同胶质瘤亚型中肿瘤细胞群的存在情况,发现肿瘤群 T3 和 T4 在 IDH-WT 胶质母细胞瘤中高度选择性表达,而在 IDH 突变型胶质母细胞瘤中几乎不存在。与在 MDSC 中观察到的情况类似,这些特定的肿瘤细胞群也在 IDH-WT 胶质母细胞瘤中富集(图 4B)。
为了确定胶质母细胞瘤 TME 中髓系细胞和肿瘤细胞之间的潜在相互作用,他们对患者样本中各种转录确定的肿瘤和免疫细胞亚群的比例进行了成对 Spearman 相关性分析。值得注意的是,在所有样本和 IDH-WT 胶质母细胞瘤中,E-MDSC 细胞的频率与仅一个肿瘤聚类 T4 的存在呈显著正相关(图 4C)。T4 肿瘤群的转录组分析显示与血管生成 (VEGFA)、神经元发育 (MALAT1)、缺氧反应 (ERO1A) 和糖酵解 (PGK1) 相关的基因表达增加。相应地,在 GSEA 分析中,T4 肿瘤聚类显示肿瘤发生途径上调,包括 VEGF 信号传导、整合素、糖酵解和缺氧途径。这些途径此前已证明在胶质瘤细胞中上调并驱动干性。
基于调节子的转录因子活性分析表明,该 T4 肿瘤细胞群上调了先前在具有干细胞样特征的细胞中描述的转录因子的活性,这些转录因子在将分化的 IDH-WT 胶质母细胞瘤细胞重编程为能够自我更新和肿瘤增殖的干细胞样细胞中起关键作用,包括 HES1、SOX9 和 KLF4。T4 细胞群还表现出 ARID3A、GLI3、GATA6 和 XBP1 程序的激活,这些程序在胶质瘤中描述较少,但与诱导干细胞促进通路(如 Hedgehog 信号通路)以及维持其他系统性癌症中癌细胞的干细胞性有关(图 4D)。胶质瘤干细胞 (GSC) 是否是唯一可再生的肿瘤细胞亚群,并单向产生其他肿瘤亚群,尚不清楚,但它们是胶质瘤肿瘤细胞的一个关键亚群,负责肿瘤进展、侵袭和对放化疗的抵抗。随着研究人类胶质瘤技术的进步,传统上主要在小鼠模型和体外系统中讨论的 GSC 模型也发生了变化。最近在人类胶质瘤中进行的 scRNA 测序工作为胶质母细胞瘤的细胞状态提供了额外的粒度,其中多种细胞状态能够促进肿瘤生长。他们对肿瘤细胞聚类的 RNA 速度分析表明,肿瘤聚类 T4 具有转变为聚类 T3 的潜力,而聚类 T3 又具有转变为其他肿瘤聚类的潜力,表明 T4 聚类具有类干细胞作用。
鉴于 MDSC 和 T4 肿瘤细胞群共同上调了与低氧和营养受限环境中高能量需求相关的代谢途径(例如糖酵解、血管生成和缺氧途径),他们假设这些细胞可能在肿瘤区域地理上共定位,需要增强这些途径的活性以支持营养和氧气限制下的细胞生长和能量消耗。为了进一步评估这些群体的潜在共定位,他们对来自本研究队列的两名代表性 IDH-WT 胶质母细胞瘤患者的空间基因表达进行了分析,这些基因表达分布在肿瘤的不同组织学区域,包括坏死、假栅栏区域(pseudopalisading region)和远处肿瘤区域。每个样本由 Visium 空间转录组学平台分析的 5 微米组织切片组成。空间转录组特征的降维和聚类确定了具有差异基因表达的聚类,类似于通过 scRNA-seq 分析确定的聚类 E-MDSC 和 T4 细胞群。这些明确定位到肿瘤的假栅栏区域。胶质母细胞瘤的假栅栏区域是围绕坏死灶的细胞增多区是 IDH-WT 胶质母细胞瘤的一个显著病理特征(图 4E)。该区域的特点是缺氧微环境和微血管增生。假栅栏状坏死和微血管增生的存在是胶质瘤预后不良的重要预测因素,而缺氧环境是驱动肿瘤细胞存活和干细胞形成的原因。虽然传统上认为这些区域主要由肿瘤细胞组成,但结果表明 MDSC 对假栅栏状区域的细胞结构做出了重大贡献。使用稳健细胞类型分解 (RCTD),他们对 scRNA-seq 数据中定义的 E-MDSC 和 T4 的空间定位进行了分析,发现 E-MDSC 和 T4 几乎完全共定位到 IDH-WT 胶质母细胞瘤的假栅栏区域,并且可能性很高,而 M-MDSC 的共定位程度较低,它们与 T4 肿瘤亚群相邻而不是共定位(图 4F)。为了进一步量化 E-MDSC 和 T4 相对于其他细胞群在假栅栏区域中的定位,他们根据与坏死的距离将区域划分为 5 个区域,并计算每个区域中存在特定细胞聚类的概率。他们发现 E-MDSC 和 T4 存在的概率在区域 1(最靠近坏死区)中最高,随着远离坏死区,概率相应降低。相比之下,对于其他细胞群,例如 T3,随着远离坏死区,概率会增加(图 4G)。

图4. E-MDSC 与具有间充质和干细胞样程序的胶质母细胞瘤特异性肿瘤细胞共定位至肿瘤的假栅栏区域(pseudopalisading region)。
(A) 肿瘤细胞表达谱的 UMAP 投影显示 10 个肿瘤细胞聚类,每个聚类都用颜色代码标注出来。(B) 箱线图显示与 2 级 IDH 突变和 1p/19q 编码删除少突胶质细胞瘤以及 2、3 和 4 级 IDH 突变星形细胞瘤相比,IDH-WT 胶质母细胞瘤中 T3 和 T4 肿瘤聚类的表达显著增加。(C) 散点图突出显示了 IDH-WT 胶质母细胞瘤患者中 E-MDSC 和 T4 频率之间的 Spearman 相关性。(D) UMAP 图显示促进癌症干性的转录因子的激活分数,这些转录因子在胶质瘤干细胞样肿瘤聚类 T4 中优先激活。(E) IDH-WT 胶质母细胞瘤样本的代表性 H&E 病理切片显示了以高细胞细胞(箭头)为特征的假栅栏区域,该区域围绕着坏死的中心区域(红星)。(F) 在 H&E 病理切片上叠加的两名代表性患者的坏死(灰色)、假栅栏(黄色)和其余远处肿瘤(蓝色)区域的斑点水平标记(左)。(G) 将距坏死部位的距离分为 5 个区域 (R1 至 R5),并将每个点内的 E-MDSC、T4 和 T3 细胞群的比例绘制为距坏死部位距离的函数。
05
相互作用分析表明 E-MDSC 与间充质胶质瘤干细胞样细胞之间存在共生关系
E-MDSC 与具有干细胞样间充质特征的胶质瘤细胞在 IDH-WT 胶质母细胞瘤的假栅栏区域中共定位,这表明这些细胞之间的短距离通讯可能会增强肿瘤的侵袭性和进展,包括来自膜配体、细胞因子、趋化因子以及生长和分化因子的信号。因此,他们检测了 E-MDSC 和 T4 肿瘤细胞之间选择性增加的同源配体-受体相互作用,以确定这些细胞之间的假定通讯模式。他们使用已建立的经过生物学验证的配体-受体对数据集来对细胞聚类之间的相互作用进行评分。他们发现 E-MDSC 和 T4 肿瘤细胞之间的配体-受体对相互作用数量明显较高(图 5A)。
多种预测的受体-配体相互作用表明肿瘤细胞 (T4) 在 E-MDSC 的募集和增殖中起着积极作用。结果表明,通过几种配体-受体对,从 T4 到 E-MDSC 的趋化因子-趋化因子受体信号传导增加:CCL8-CCR1、CXCL1-CXCR1、CCL5-CCR1、CXCL8-CXCR1和CCL4-CCR5。其中一些相互作用已证明参与了各种鼠类癌症模型(包括神经胶质瘤)中 MDSC 向炎症部位和 TME 的募集。除了这些趋化因子之外,白细胞介素 6 (IL-6)–白细胞介素 6R (IL-6R) 相互作用进一步增强了 MDSC 的积累以及这些细胞中编码各种免疫抑制功能的基因的诱导。肿瘤聚类 T4 还表现出巨噬细胞集落刺激因子 1 ( CSF1 )(一种主要的髓系生长因子)表达增加,同时E-MDSC 上CSF1R表达较高。
相反,他们发现 E-MDSC 与肿瘤细胞之间存在强烈的配体-受体相互作用,这些相互作用具有驱动肿瘤增殖、存活和侵袭的间充质和干细胞样程序。细胞外基质成分多功能蛋白聚糖 (VCAN) 在 E-MDSC 上发生强烈诱导,而其相应的受体 CD44 在 T4 中发生诱导。E-MDSC 还显示出多种生长因子受体激酶配体的上调。特别是,他们发现了一种以前未知的FGF11-FGFR1相互作用,它可以通过激活 Ras/MAPK、PI3K/AKT 和磷脂酶 (PLC)/蛋白激酶 C (PKC) 信号级联来促进肿瘤细胞增殖和存活。据报道 FGFR1 是一种潜在的 IDH-WT 胶质母细胞瘤生长因子受体,但本研究的数据表明 E-MDSC 产生的 FGF11 可能是其在胶质母细胞瘤中的主要配体。此外,E-MDSC 与 T4 肿瘤细胞上的受体(与肿瘤侵袭、血管生成和胶质瘤细胞迁移有关)的推断相互作用增强,包括整合素亚基 α5 ( FN1-ITGA5 ) 和血管内皮生长因子 B (VEGFB-FLT1)(图 5A)。肿瘤细胞的转录因子分析表明,与生长因子和血管生成途径相关的转录因子的激活增加,包括 T4 亚群中的 c-Jun、c-Myc 和 ATF。E-MDSC 产生的生长因子可能与 T4 肿瘤细胞上的生长因子受体结合,随后激活促肿瘤基因程序(图 5A),他们接下来从已建立的关键生长因子受体(EGFR 和 FGFR1)的基因集中生成信号通路评分,这些受体在配体-受体相互作用分析确定的 T4 肿瘤细胞群中表现出上调。然后将这些信号评分与 T4 细胞群中每个细胞的相应生长因子受体的表达水平相关联。他们发现生长因子受体的表达水平与每个细胞中生长因子通路的相关信号评分之间存在很强的相关性(图 5B)。
他们进一步利用空间转录组数据评估了通过 E-MDSC 和 T4 之间的单细胞聚类相互作用映射确定的一些配体-受体相互作用,并发现在假栅栏区域中代表性配体-受体对的基因表达共同富集,尤其是 FGF11 和 FGFR1(图 5C)。挖掘 Cancer Genome Atlas (TCGA) 数据集,他们发现 E-MDSC 基因特征与肿瘤 T4 群体基因特征表现出很强的相关性。总之,E-MDSC 和 T4 在 IDH-WT 胶质母细胞瘤的拟栅栏区域中的共定位,以及配体-受体相互作用分析,支持 E-MDSC 和 T4 细胞之间的共生关系模型,其中肿瘤促进 E-MDSC 的积累和增殖,而 E-MDSC 的积累支持肿瘤的生长和侵袭。
鉴于 IDH-WT 胶质母细胞瘤与 IDH 突变 4 级星形细胞瘤相比,MDSC 的募集具有特异性,他们推测 IDH1 或 IDH2 (IDH1/2) 突变状态在机制上与 MDSC 募集相关。已知突变 IDH1/2 会产生并导致致癌代谢物 2-羟基戊二酸 (2-HG) 的积累,这可以抑制介导 DNA 去甲基化途径的十-十一易位 (TET) 酶的活性。因此,IDH 突变胶质瘤与高甲基化表型有关。他们推测 IDH 突变胶质瘤可能含有与 MDSC 激活和募集相关的假定细胞因子和趋化因子的高甲基化和沉默。为了验证这一假设,他们分析了低级别和高级别 TCGA 队列(TCGA 2016)的转录组和甲基化数据,与 IDH 突变体相比,IDH-WT 胶质母细胞瘤确实表现出甲基化评分降低,而趋化因子和细胞因子(如 CCL5、CXCL8 和 IL-6)的表达相应增加(图 5D)。当分析仅限于高级别胶质瘤的甲基化数据(TCGA 2013,基于数据库时的先前分类)时,他们发现与IDH-WT胶质母细胞瘤相比,IDH突变型4级星形细胞瘤中这些基因的甲基化趋势增加。他们进一步发现其中一些趋化因子和细胞因子的基因表达在空间水平上富集到假栅栏区域(图5E)。为了确定这些特定的 MDSC 和 T4 肿瘤细胞群的存在是否会导致胶质母细胞瘤患者的生存差异,他们检测了 MDSC 和 T4 肿瘤细胞相关基因在大量 TCGA 基因表达中的表达的临床后果。在分析合并的低级别胶质瘤和高级别胶质瘤 TCGA 队列时,高 E-MDSC 和 M-MDSC 表达样本几乎完全是 IDH-WT 胶质母细胞瘤,而低表达样本含有大量 IDH 突变型肿瘤,这与 scRNA-seq 结果相符,即这些细胞群是 IDH-WT 胶质母细胞瘤所特有的。他们进一步将 TCGA 样本细分为 IDH-WT 胶质母细胞瘤,仅在 IDH-WT 胶质母细胞瘤内进行的生存分析表明,与 E-MDSC 基因表达特征较低的患者相比,具有高 E-MDSC 基因表达特征的胶质母细胞瘤患者的总体生存期明显较短,且与 MGMT 甲基化状态无关(图 5F)。同样,M-MDSC 和 T4 基因表达特征也对 IDH-WT 胶质母细胞瘤患者的生存率进行了分层。这表明这些细胞的存在是 IDH-WT 胶质母细胞瘤的独立预后指标。为了确定关键趋化因子的甲基化和表达与 E-MDSC 特征的存在之间的关联,他们根据 E-MDSC 基因特征的表达对合并的胶质瘤队列进行了聚类,发现 E-MDSC 表达低的患者上述趋化因子的表达和高甲基化降低。

图5. E-MDSC 和T4 干细胞样细胞表现出潜在的共生关系,突出表现为MDSC 募集和肿瘤促进。
(A) 预测 IDH-WT 胶质母细胞瘤中 E-MDSC 和肿瘤细胞 T4 群体之间的配体-受体相互作用。(B) T4 肿瘤细胞中生长因子表达与基因集信号评分的相关性分析。(C) 在假栅栏区域中富集的配体-受体对 FGF11 和 FGFR1 的标准化表达的点级图(左);与远处肿瘤相比,FGF11 和 FGFR1 相邻表达的相关性表明假栅栏区域内的共表达增加(右)。(D) 点图和相关图描绘了 IDH-WT 胶质母细胞瘤中甲基化评分降低和 MDSC 募集趋化因子表达增加。(E) 关键 MDSC 募集和激活趋化因子和细胞因子的标准化表达显示局部表达到假栅栏区域。(F) Kaplan-Meier 曲线说明 E-MDSC 表达特征分层 IDH-WT 胶质母细胞瘤患者的生存率。
+ + + + + + + + + + +
结 论
本研究对 33 例胶质瘤的免疫细胞和肿瘤细胞进行了scRNA-seq,在IDH-WT胶质母细胞瘤中发现了两种不同的髓系抑制细胞 (MDSC) 群:代谢和缺氧途径上调的早期祖细胞 MDSC (E-MDSC) 群和单核细胞 MDSC (M-MDSC) 群。空间转录组学表明,E-MDSC 在地理上与假栅栏区域中的代谢干细胞样肿瘤细胞共定位。配体受体分析揭示了这些细胞之间的串扰,其中胶质瘤干细胞样细胞产生吸引 E-MDSC 的趋化因子,而 E-MDSC 又产生肿瘤细胞的生长因子。这种相互作用在 IDH 突变型胶质瘤中不存在,与 MDSC 吸引趋化因子的高甲基化和基因表达受抑制有关。本研究阐明了可能促进胶质母细胞瘤进展和介导肿瘤免疫抑制的特定 MDSC。
+ + + + +



 English
English


